ĆWICZENIA LABORATORYJNE Z FIZYKI
S P R A W O Z D A N I E
Temat: Pomiar wilgotności powietrza za pomocą psychrometru.
Wyznaczanie stosunku ciepła właściwego gazu przy stałym ciśnieniu do molowego ciepła właściwego przy stałej objętości (Cp / Cv).
para nr 8, ćwiczenie nr 18/27
Towaroznawstwo
Grupa 14
Wilgotnością bezwzględną powietrza nazywamy masę pary wodnej zawartej w 1 m3 powietrza. Jej wymiarem jest ![]()
. Wilgotnością względną powietrza nazywamy stosunek masy pary wodnej m1 zawartej w pewnej objętości powietrza do tej masy pary wodnej m2, którą miałaby para wodna nasycona w tej objętości powietrza, w danej temperaturze:
![]()
Masa pary m w danej objętości zależy od gęstości ρ(m = ρυ), a gęstość jest wprost proporcjonalna do ciśnienia p, możemy więc napisać: m = a , gdzie a - współczynnik proporcjonalności, oraz
![]()
![]()
gdzie: p1 - prężność pary wodnej zawartej w powietrzu w pewnej temperaturze, p2 - prężność pary wodnej nasyconej w tej temperaturze.
Wilgotność względną wyrażamy zwykle w %.
![]()
Ciepło. Pierwsza zasada termodynamiki w swej najprostszej (szczególnej) postaci ma zapis:
![]()
gdzie:
ΔU - zmiana energii wewnętrznej
W - praca
Q - ciepło
Zmianę energii wewnętrznej ΔU układu można osiągnąć dwoma sposobami:
a) za pośrednictwem pracy,
b) za pośrednictwem ciepła.
Załóżmy, że praca i ciepło są dodatnie, czyli wzbogacają układ w energię, tzn. że ΔU>0, co najczęściej objawia się wzrostem temperatury lub zmianą fazy układu. Układ zyskał energię, jednak praca nie jest energią. Idąc zatem śladami matematycznego porządku, musimy stwierdzić, że drugi składnik sumy w równaniu ![]()
, czyli Q, musi być składnikiem tego samego rodzaju co W, a więc też nie jest energią. Stwierdzamy zatem, że praca i ciepło są jedynie sposobami - formami przekazywania energii. Obie formy mają swoją miarę, a obie miary wspólną jednostkę - dżul. Energia przenoszona obydwoma sposobami jest mierzalna, np. termoergometrem oraz kalorymetrycznie.
Ilość energii przekazanej za pośrednictwem pracy powinniśmy nazywać nie pracą, lecz energetyczną równowartością pracy, a ilość energii przekazanej za pośrednictwem ciepła powinniśmy nazywać nie ciepłem, lecz ilością ciepła. Wartość zmiany energii wewnętrznej oznaczamy przez ΔU. Dżul jest jednostką nie samych form, lecz odpowiednich wartości przekazywanej energii. Od dziesiątków lat przywykliśmy ilość ciepła nazywać po prostu ciepłem, toteż nawyku tego nie będziemy uważali za błędny, pod warunkiem jednak, że potrafimy oba pojęcia odróżnić. Przekazywanie energii w formie ciepła wiąże się z różnicą temperatur między dwoma układami lub między dwoma miejscami tego samego układu. Przez ciepło będziemy rozumieli ilość ciepła, a to oznacza ilość (wartość) energii przepływającej w wyniku istnienia różnicy temperatur. W tym sensie ciepło bywa też nazywane energią cieplną lub termiczną. Z zasadniczych względów lepiej tych określeń unikać.
Temperatura. Mechaniczne oddziaływanie dwóch ciał na siebie umownie nazwano siłą. Jeśli to oddziaływanie jest duże mówimy, że siła ma dużą wartość. Miarą oddziaływania, czyli siły, są skutki tego oddziaływania (statyczne lub dynamiczne). Podobną umową jest temperatura. Pojęcie temperatury wprowadzono w celu określenia stanu chaotycznego ruchu cząsteczek danego ciała, a dokładnie - w celu określenia energii kinetycznej związanej z chaotycznym ruchem cząsteczek. Temperatura nie określa wartości energii ruchu cząsteczek, ale jest wielkością, która do tej energii jest wprost proporcjonalna. Jej jednostką nie jest dżul, ale kelwin (K) lub stopień Celsjusza (˚C).
Wzór na energię kinetyczną cząsteczek można zapisać następująco:
![]()
Jest to wzór Boltzmana dla gazu doskonałego, którego wyprowadzenie łatwo znaleźć w podręcznikach fizyki, gdzie:
![]()
- średnia energia kinetyczna cząsteczek danego układu, przeliczona na jedną cząsteczkę tego układu,
k - stała Boltzmana,
![]()
R - stała gazowa,
N - liczba Avogadra,
T - temp. mierzona w skali bezwzględnej (Kelwina)
Przedstawiony zapis jest wprawdzie praktyczny, gdyż łatwiej jest mierzyć temperaturę niż wartość energii ruchu cząsteczek ciała, w rzeczywistości jednak to nie energia zależy od temperatury, lecz odwrotnie - temperatura jest funkcją energii. Wzrost temperatury ma związek ze wzrostem energii lub wzrost temperatury oznacza wzrost energii.
Energia kinetyczna całego układu jest sumą energii kinetycznych wszystkich cząsteczek tego układu. Średnia energia kinetyczna każdej cząsteczki danego układu w stanie stacjonarnym jest taka sama, dlatego suma tych energii może być podana jako krotność wyrażenia ![]()
![]()
gdzie:
n - liczba cząsteczek
Dla dowolnej liczby stopni swobody (i) piszemy:
![]()
stąd ![]()
T nie zależy od n, gdyż E jest wprost proporcjonalna do n, czyli w danych warunkach:
![]()
Energia wewnętrzna i ilość ciepła. Przez energię wewnętrzną układu rozumiemy sumę wszystkich rodzajów energii zawartych w układzie. Są to energie wewnątrzatomowe i wewnątrzcząsteczkowe, energie potencjalne wynikające z oddziaływań międzycząsteczkowych oraz energie kinetyczne ruchu postępowego, drgającego i obrotowego cząsteczek. Temperatura wiąże się tylko z energią kinetyczną.
Przez „ilość ciepła” lub „ciepło” rozumiemy tę część energii wewnętrznej, która jest przekazywana (mówimy „przepływa”) między dwoma ciałami lub dwoma miejscami tego samego ciała, między którymi istnieje różnica temperatur. Zgodnie z określeniem temperatury przekazywana jest w ten sposób energia kinetyczna.
Parametry termodynamiczne określające stan gazu to: ciśnienie p, temperatura T w skali bezwzględnej i objętość V. Dla gazu doskonałego, którego cząsteczki mają trzy stopnie swobody, ciśnienie p wyraża się wzorem:
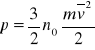
gdzie:
n0 - liczba cząsteczek gazu w jednostce objętości,
m - masa jednej cząsteczki,
v - średnia prędkość cząsteczek.
Wzór ten nazywa się podstawowym równaniem teorii kinetyczno-molekularnej.
Równaniem stanu gazu doskonałego jest równanie Clapeyrona, które wyraża związek między trzema parametrami stanu gazu (p, V, T).
![]()
gdzie:
Vμ - obj. jednego mola gazu,
R - stała gazowa ![]()
,
T - temperatura w skali bezwzględnej.
Procesy adiabatyczne. Procesy adiabatyczne są to takie przemiany gazowe, które zachodzą bez wymiany ciepła z otoczeniem. Pierwsza zasada termodynamiki przyjmuje postać:
![]()
gdzie:
ΔU - wzrost lub ubytek energii wewnętrznej, zależnie od znaku W.
Energia wewnętrzna 1 mola gazu doskonałego jako funkcja temperatury ma następującą postać:
![]()
gdzie:
Cv - molowe ciepło właściwe gazu przy stałej objętości.
Przyrost energii wewnętrznej na skutek zmiany temperatury oblicza się przez zróżniczkowanie względem temperatury wyrażenia
![]()
Praca, jaką wykonuje gaz przy adiabatycznym zwiększeniu objętości o dowolnie małą wartość dV, równa się:
![]()
Biorąc powyższe pod uwagę, dla dowolnie małych zmian energii wewnętrznej dU, I zasadę termodynamiki dla procesów adiabatycznych można zapisać w postaci:
![]()
Wartość ciśnienia, jakie wywiera gaz na ścianki naczynia, wynika z równania Clapeyrona
![]()
Przekształcając, otrzymamy:
![]()
Całkując powyższe równanie w granicach zmian objętości i temperatury
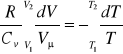
otrzymuje się równanie Poissona:
![]()
lub ![]()
gdzie:
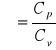
Cp - molowe ciepło właściwe przy stałym ciśnieniu gazu.
OBLICZENIA I POMIARY:
Pomiar wilgotności powietrza za pomocą psychrometru.
Pomiar nr |
t1 |
t2 |
p2 |
p |
p1 |
b |
W |
|
˚C |
˚C |
Nm-2 |
Nm-2 |
Nm-2 |
Pa |
% |
I |
25,6 |
15,4 |
3360,493 |
1730,234 |
1261,1513 |
99975 |
37,53 |
II |
25,4 |
15,6 |
3167,208 |
1748,896 |
1298,2087 |
99975 |
40,99 |
III |
25,4 |
15,4 |
3167,208 |
1730,234 |
1270,349 |
99975 |
40,11 |
Prężność pary wodnej p1: p1 = p - k (t1 - t2) b
Wilgotność powietrza: ![]()
k = 0,0046
I) p1 = 1730,234 - 0,00046(25,6 - 15,4) · 99975 = 1261,1513
II) p1 = 1748,896 - 0,00046(25,4 - 15,6) · 99975 = 1298,2087
III) p1 = 1730,234 - 0,00046(25,4 - 15,4) · 99975 = 1270,349
Obliczenie wartości niepewności:
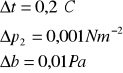
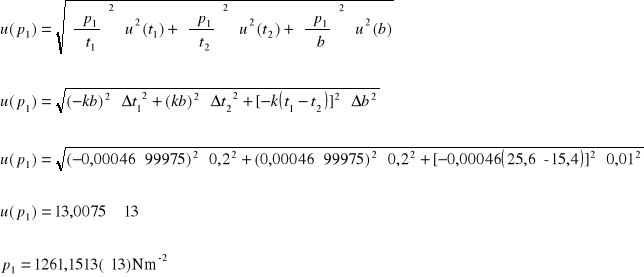
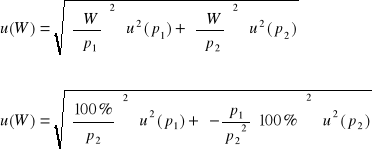

Wyznaczanie stosunku ciepła właściwego gazu przy stałym ciśnieniu do molowego ciepła właściwego przy stałej objętości (Cp / Cv).
Nr pomiaru |
t |
h1 |
h2 |
h1 - h2 |
|
|
˚C |
m |
m |
m |
|
I |
24 |
0,332 |
0,086 |
0,246 |
1,3495 |
II |
24 |
0,314 |
0,074 |
0,24 |
1,3083 |
III |
24 |
0,302 |
0,069 |
0,233 |
1,2961 |
IV |
24 |
0,314 |
0,074 |
0,24 |
1,3083 |
V |
24 |
0,332 |
0,086 |
0,246 |
1,3495 |
VI |
24 |
0,321 |
0,072 |
0,249 |
1,2891 |
VII |
24 |
0,346 |
0,079 |
0,267 |
1,296 |
VIII |
24 |
0,317 |
0,073 |
0,244 |
1,2991 |
IX |
24 |
0,324 |
0,079 |
0,245 |
1,3224 |
X |
24 |
0,324 |
0,075 |
0,249 |
1,3012 |
średnia: 1,3119 |
|||||
![]()
Obliczenie wartości niepewności:
![]()
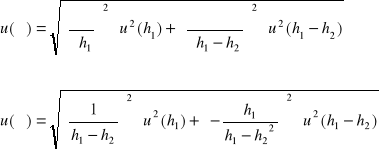

Obliczenie wartości niepewności metodą typu A:
Wartość średnia ![]()
(![]()
): 1,3119
|
|
|
1,3495 |
0,03755 |
0,001410003 |
1,3083 |
-0,00365 |
0,0000133225 |
1,2961 |
-0,01585 |
0,000251222 |
1,3083 |
-0,00365 |
0,0000133225 |
1,3495 |
0,03755 |
0,001410003 |
1,2891 |
-0,02285 |
0,000522123 |
1,296 |
-0,01595 |
0,000254402 |
1,2991 |
-0,01285 |
0,000165123 |
1,3224 |
0,01045 |
0,000109203 |
1,3012 |
-0,01075 |
0,000115563 |
![]()
0,004264285
Odchylenie standardowe wyników pomiaru: 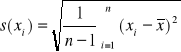
![]()
Odchylenie standardowe: ![]()
Niepewność standardowa u(x) wyniku ![]()
(odchylenie standardowe średniej wyników pomiaru) oblicza się ze wzoru:
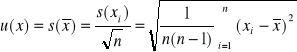
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Wykład 18, fizyka, wyklady
18, Fizyka, ćw 18
18 fizyka laborki, Budownictwo UTP, semestr 1 i 2, UTP, Materiały budowlane
(18 fizyka jadrowa 2010 [tryb zgodności])
18. Energia potencjalna, Fizyka - Lekcje
Fizyka K2 5,12,18 id 176846
Ćwiczenie nr 18, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicz
18 - rezonans, Studia, Semestr 1, Fizyka, Sprawozdania
SPR F 18, Transport i Logistyka (AM) 1 (semestr I), Fizyka, fiza laborki (rozwiązania), Laborki, Lab
KARTY POMIAROWE FIZYKA KARTA POMIAROWA 18
18 rezonans, Studia, Semestr 1, Fizyka, Sprawozdania
Fizyka 18
Sprawozdanie ćw 18, Bioinżynieria Produkcji żywności, Fizyka
FIZYKA-sprawozdania, 18,27
więcej podobnych podstron