Wody powierzchniowe dzieli się na klasy czystości (do celów pitnych tylko wody I klasy [o 0 - 0,6% a nawet 2,7%]). W przypadku wód podziemnych brak podziału na klasy.
Układ technologiczny jest to zespół następujących po sobie procesów.
Wody powierzchniowe są najwyżej średnio twarde. Wody podziemne mogą być bardzo twarde. Zasadowość wody miękkiej poniżej 1 mval/dm3.
CO2 w wodzie to suma CO2 związanego i wolnego.
Przewodnictwo wody jest to miara zasolenia.
Związki azotowe (azot organiczny i nieorganiczny)
W wyniku rozkładu substancji organicznych nie zależnie czy przebiegają w procesach tlenowych czy beztlenowych powstaje zawsze azot amonowy. Proces ten nazywamy procesem amonifikacji:
C10H19O3N + 12,5 O2 → 9CO2 + 7H2O + NH4HCO3 - tlenowo
→ CO2 + CH4 + NH4HCO3 - beztlenowo
Denitryfikacja jest to redukcja azotu azotanowego do azotu gazowego:
NO3- → NO2- → NO → NOH → N2
Azot organiczny w wodach powierzchniowych występuje tylko w tedy gdy wody te są zanieczyszczone fekaliami.
WSKAŹNIKI ZANIECZYSZCZEŃ ORGANICZNYCH.
Wody podziemne mogą zawierać węgiel (z humusu). Wody powierzchniowe mają więcej humusu z żyznej gleby.
Utlenialność, BZT5, ChZT, OWO
W wodach powierzchniowych mogą być również metale a także mikroorganizmy przydatne i chorobotwórcze. Wody podziemne są raczej pewne na brak mikroorganizmów.
OCZYSZ WÓD POWIERZ.
Trzeba usunąć zawiesiny, koloidy (mętność, barwa), bakterie.
UKŁAD TECHNOLOGICZNY.
- usuwanie zawiesin i mikroorganizmów (sedymentacja, mikrosita, rzadziej flotacja)
CaO - gdy woda jest bardzo miękka to zwiększamy zasadowość ługami.
- korekta zasadowości (zazwy zwiększanie)
- koagulacja - proces usuwania przede wszystkim koloidów organicznych i nieorganicznych, a więc zmniejszenie barwy, mętności, poziomu zanieczyszczeń organicznych oraz częściowo mikroorganizmów poza tym w procesie koagulacji usuwane są również zawiesiny obecne w wodzie i w nieznacznym stopniu substancje rozpuszczone.
- chemiczne wiązanie agresywnego CO2. W wyniku stosowania koagulantów powstają kwasy, które reagują z zasadowością i w wyniku tych reakcji powstaje CO2 agresywny, który powoduje korozyjność wody.
- sedymentacja - jest to usunięcie z wody zawiesin po koagulacyjnych (łatwo opadających - sedymentujących w ciągu 2 godzin)
- filtracja zwykle pośpieszna i są z tąd odprowadzane popłuczyny gdyż filtry są płukane
- ozonowanie - powinno być wówczas jeśli kolejnym procesem jest filtracja przez złoża zasiedlone mikroorganizmami (8) najczęściej są to złoża sorpcyjne, a więc węgiel aktywny.
Sorpcja - usuwanie zanieczyszczeń organicznych rozpuszczonych
Ozonowanie powoduje przejście związków niebiodegradowalnych w biodegradowalne. Występują popłuczyny z płukanych kolumn
- dezynfekcja - musi być w układzie oczyszczania wody powierzchniowej
- gospodarka osadami i popłuczynami - zawsze oddziela się osad od wody. Woda osadowa może być odprowadzana do kanalizacji lub do wód powierzchniowych gdy mamy na to zgodę. Wodę osadową wykorzystuje się ponownie tam gdzie występują braki w wodę.
PROCES KOAGULACJI.
Stosuje się do usuwania koloidów. W wodach mogą być koloidy dodatnie i ujemne, tzn takie które maja dodatni lub ujemny potencjał ၺ (dzeta) potencjał elektrokinetyczny (decyduje o tym, że koloid w wodzie wisi). Potencjał jest bardzo małą wielkością. Rozróżnia się koloidy hydrofobowe - wodno wstrętne decydujące głównie o mętności wody i koloidy hydrofilowe - wodno lubne. Koloidy zwykle organiczne decydują o intensywności barwy, zdecydowanie trudniejsze do usunięcia niż koloidy hydrofobowe.
Koagulacja polega na zmniejszeniu przede wszystkim stopnia dyspersji (rozproszenia) układu koloidalnego. Koagulacja chemicznie polega na obniżeniu potencjału dzeta. Koagulantami są zwykle sole glinu i żelaza. W wodach naturalnych koloidy mają zazwyczaj znak (-).
Rodzaje koagulantów.
![]()
- siarczan glinu pH 5,5 - 7,5
![]()
-siarczan żelazowypH 5 - 7 i 9 - 9,6
![]()
- siarczan żelazow
pH 9 - 11
![]()
- chlorek żelazowy pH 5 - 7 i > 8,5
![]()
- siarczan żelazowy chlorowany pH 5 - 7 i 9 - 9,6
Występują również koagulanty glinowe i żelazowe wstępnie schydrolizowane.
Dodany do wody koagulant najpierw dysocjuje:
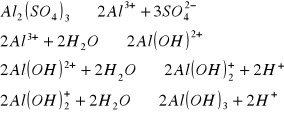
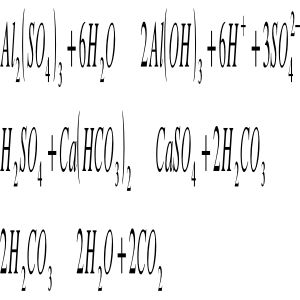
Wiązanie CO2
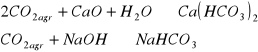
Po koagulacji następuje flokulacja polegająca na zbieraniu się kłaczków w większe aglomeracje.
Koagulanty glinowe nie powodują barwnych zabarwień wody. Substancjami wspomagającymi koagulację mogą być polielektrolity. Również substancją wspomagającą jest węgiel aktywny, który jest sorbentem, pomaga usuwać substancje organiczne. Koagulacja może być przeprowadzana w wersji objętościowej w komorach szybkiego mieszania ( na czas 1 - 2 minut miesza się wodę z koagulantem) i w komorach wolnego mieszania (komora flokulacji od 15 - 30 minut). Koagulacja kontaktowa realizowana jest w osadniku kontaktowym lub w złożu filtracyjnym, w tedy taki filtr nazywa się kontaktowym. Gdy jest koagulacja kontaktowa w układzie to nie ma komór wolnego mieszania.
SEDYMENTACJA - to opadanie cząstek stałych pod własnym ciężarem. Sedymentują te których gęstość jest większa od gęstości wody. Proces sedymentacji może być wykorzystany dla wód podziemnych i powierzchniowych. Skuteczność sedymentacji zależy od wielkości cząstek, stężenia zawiesin, czasu sedymentacji, od prędkości przepływu wody w osadniku. Wyróżnia się opadanie zawiesin swobodne - wówczas gdy zawiesiny opadają własnym torem nie oddziaływują na siebie, oraz opadanie skupione - wówczas zawiesiny na siebie
oddziaływują i w wyniku zderzeń powstają aglomeraty szybciej sedymentujące. Ma miejsce w przypadku opadania zawiesin pokoagulacyjnych.Opadanie swobodne - działa siła ciężkości, gdy:
![]()
![]()
W przypadku opadania laminarnego: ![]()
.
Wzór na prędkość sedym w ruchu laminarnym.
Równanie Stokesa:
![]()
Urządzeniami są osadniki w zależności od kierunku przepływu wody w osadniku dzieli się na osadniki o przepływie:
Pionowym, poziomym, pionowo - poziomym, oraz osadniki kontaktowe (realizowana jest koagulacja).
Prędkość przepływu w poziomym od 3 - 12 mm/s, prędkość opadania 0,35 - 0,6 mm/s (z koagulacją), 012 - 0,16 (bez koagulacji)
FILTRACJA- następuje usunięcie pozostałych w wodzie zawiesin
Materiał filtracyjny:
Piasek, antracyt, drobno mielony granit
porowatość od 40 - 60 %
Średnica miarodajna d10 - stanowi 10% masy próbki, średnica ziarna wraz z mniejszymi ziarnami
Współczynnik równomierności
![]()
Jeżeli filtracja jest na węglu aktywnym to następuje filtracja i jednocześnie adsorbcja polegająca na zatrzymaniu rozpuszczonych związków organicznych na węglu aktywnym.
Filtracja dzieli się na: powolna - to taka przy której prędkość filtracji wynosi od 01 - 0,3 m/h pośpieszna - to taka przy której prędkość filtracji wynosi od 5 - 15 m/h Filtry ze złożem: jedno i wielowarst. grawitacyjne, które mogą być otwarte lub zamknięte ciśnieniowe, zamknięte. Dopuszczalne straty ciśnienia: powolne 0,9 - 1,5 mH2O
pośpieszne grawitacyjne 3 mH2O
pośpieszne ciśnieniowe 5 mH2O i nieraz więcej. Filtry powolne czyści się mechanicznie a filtry pośpieszne są płukane. Długość cyklu filtracji dla filtrów pośpiesznych nie krótsza niż 8 godz.
Filtry powolne - różnią się od pośpiesznych, że w warunkach tak małej prędkości w warstwie powierzchniowej rozwijają się mikroorganizmy, które powodują biochemiczny rozkład biodegradowalnych substancji organicznych. W związku z tym podczas filtracji powolnej oprócz zjawisk fizycznych (cedzenie) zachodzących w filtracji pośpiesznej mają miejsce procesy biochemiczne. Cykl filtracji zależy od jakości wody dopływającej, okres od 1 miesiąca nawet do roku.
Filtry pośpieszne - wykorzystywane zarówno w oczyszczaniu wody powierzchniowej i podziemnej. Wykorzystuje się filtrację pośpieszną w usuwaniu żelaza i manganu. Służą do przeprowadzania koagulacji kontaktowej. Dzielą się na:
grawitacyjne
ciśnieniowe
Filtry grawitacyjne - jednowarstwowe (tylko piasek) wówczas prędkość filtracji może wynosić od 5 - 7m/h. Gdy są filtry wielowarstwowe to ta prędkość może wynosić do 10m/h. Filtry pośpieszne grawitacyjne mogą być stosowane w oczyszczaniu wody powierzchniowej i podziemnej. Są eksploatowane ze stałą prędkością, a więc na rurociągu filtratu zamontowany jest regulator prędkości. Filtry grawitacyjne mają powierzchnię od 12 - 100 m2. powinny być urządzeniami prostokątnymi.
Filtry ciśnieniowe - mogą być stosowane zarówno do wód powierzchniowych i podziemnych. Prędkość filtracji w zakresie 7,5 - 10 m/h. Pracują pod stałym ciśnieniem, podczas pracy zmienia się prędkość, brak regulatorów prędkości. Znajdują się w zbiornikach zamkniętych. Dopuszcza się w nich większą stratę ciśnienia. Zwyczajowo stosowane są do oczyszczania wód podziemnych. W zależności czy są pionowe czy poziome to mogą być jedno lub wielowarstwowe. Normowane są średnice dennic. W filtrach ciśnieniowych pionowych można stosować złoża wielowarstwowe. W filtrach ciśnieniowych poziomych tylko złoża jednowarstwowe. Do płukania filtrów służą drenaże. Wyróżnia się drenaże nisko i wysoko oporowe. Niskooporowe daje małe straty przepływu gdy woda przez nie przepływa. Drenaż wysokooporowy rurowy montuje się w warstwie podtrzymującej. Zawsze po węglu aktywnym musi być dezynfekcja.
OCZYSZCZANIE WÓD PODZIEMNYCH
Charakteryzują się w miarę ustabilizowanym składem. Nie zawierają tlenu, natomiast zawierają inne gazy głównie CO2, H2S rzadziej metan. Wody podziemne mają podwyższone stężenie żelaza i manganu. Zawierają znacznie więcej substancji rozpuszczonych niż wody powierzchniowe. Jest bardziej zasolona. Powinna być pewna pod względem bakteriologicznym. W wodach podziemnych pojawiają się częściej związki azotu: NH3 i NH4.
Główne problemy to:
usuwanie CO2
musi być odżelaziana i odmanganiana
musi być poddana dezynfekcji
Rzadziej istnieje potrzeba usuwania związków organicznych oraz związków azotowych. W Polsce nie stosuje się procesów zmiękczania wody. Żelazo w wodach podziemnych może występować w połączeniach nieorganicznych: Fe(HCO3)2, FeSO4, FeCl2. Część może występować w połączeniach ze związkami organicznymi. Mangan występuje w połączeniach nieorganicznych: Mn(HCO2), Mn(SO4), MnCl2. w zależności w jakich połączeniach występuje żelazo są również układy oczyszczania.
Podstawowy układ
żelazo w połączeniach organicznych:
Odkwaszanie jest to usuwanie nadmiernego CO2 metodą fizyczną przez napowietrzanie. Jeżeli nie usunięto do końca to stosuje się chemiczne wiązanie reszty CO2. W wyniku odkwaszania metodą fizyczną uzyskuje się nie tylko usunięcie CO2 ale także napowietrzenie wody. Częściowo uzyskuje się efekt odżelaziania. Jeżeli jest żelazo to kolejnym etapem jest sedymentacja, gdzie sedymentuje żelazo. Na filtrach przebiega głównie odmanganianie na złożu wpracowanym do usuwania manganu. Usunięty zostanie mangan oraz resztki żelaza. Chemiczne utlenianie potrzebne jest gdy w wodzie sa substancje przeszkadzające np.: NH4, żelazo. Najlepszym jest KMnO4. wydziela się dużo MnO2.
Wiele wód podziemnych wymaga usuwania azotu. Gdy jest podwyższona barwa i utlenialność to wiemy, że występuje żelazo i trzeba wprowadzić sedymentację.
Urządzenia do odkwaszania wody.
Odkwaszanie wody jest to pozbywanie się CO2agr z wody. Może być przeprowadzany metodami fizycznymi i chemicznymi. Przy czym jest zasada, że najpierw stosuje się metody fizyczne, a resztę nie usuniętego CO2agr wiąże się metodą chemiczną.
Metody fizyczne to nic innego jak napowietrzanie wody. Rodzaj urządzeń do napowietrzania zależy od zasadowości wody. Im większa jest zasadowość M tym mniej sprawne mogą być stosowane urządzenia. Jeżeli zasadowość wody jest większa od 5 val/m3 to stosuje się napowietrzanie w urządzeniach ciśnieniowych, natomiast gdy zasadowość jest mniejsza od 5 val/m3 to urządzenia otwarte. Jeżeli zasadowość:
4 - 5 można zastos wytryski sitowe
3 - 4 stosuje się dysze rozbryzgowe
2 - 3 stosuje się tzw złoża ociekowe (pułkowe, bezpułkowe)
< 2 trzeba poza napowietrzaniem stosować chemiczne wiązanie CO2agr
Gdy fizycznie nie został usunięty CO2agr stosujemy metody chemiczne:
wapno i mleko lub woda wapienna
2CO2 + CaO + H2O → Ca(HCO3)2
węglan sodu (5% roztwór wodny)
Na2CO3 + CO2 → NaHCO3
wodorotlenek sodu (5-10% wodny roztwór)
NaOH + CO2 → NaHCO3
Inną metodą jest stosowanie filtracji przez złoża alkalizujące:
grys marmurowy
CaCO3 + CO2 + H2O → Ca(HCO3)2
dofiltr (prażony dolomit)
MgO ∗ CaCO3 + 3CO2 + 2H2O → Ca(HCO3)2 + Mg(HCO3)2
Po tych procesach stosuje się proces sedymentacji. Gdy w wodzie jest żelazo w połączeniach nieorganicznych to po napowietrzaniu stosuje się osadnik, w którym żelazo się sedymentuje.
ODŻELAZIANIE I ODMANGA
Odżelazianie polega na utlenieniu Fe2+ fo Fe3+ i wytrąceniu go w postaci trudno rozpuszczalnego w wodzie Fe(OH)3↓.
Odmanganianie polega na utlenieniu Mn2+ fo Mn4+ i wytrąceniu go w postaci MnO(OH)2↓ (MnO2).
Im wyższe jest pH tym lepsze efekty uzyskuje się w usuwaniu żelaza i manganu.
Pierwszą fazą, która musi przebiegać podczas odżelaziania jest hydroliza:
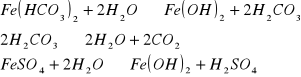
Drugą fazą jest utlenianie tlenem (napowietrzanie)
![]()
Kolejną fazą jest flokulacja:
![]()
Gdy w układzie nie ma napowietrzania to dodaje się do wody utleniacze chemiczne: O3, Cl2, ClO2, KMnO4.
Jeżeli w wodzie podniesiona jest zasadowość i występują związki organiczne to dawkuje się KMnO4 ponieważ nie tylko zapewnia utlenienie żelaza, ale również powstaje MnO2 wspomagający proces odmanganiania. KMnO4 powinien być dodawany do wody przed złożem filtracyjnym, aby wytrącający się MnO2 został zatrzymany w złożu filtracyjnym i zapewnił impregnację tego złoża. Jeżeli do utleniania stosuje się pozostałe utleniacze, to miejsce ich dawkowania zależy od stężenia żelaza w wodzie. Jeżeli stężenie Fe jest większe od 10 g/m3 to między miejscem dawkowania utleniaczy a filtrami powinna być sedymentacja. Aby uzyskać efekty odmanganiania, a więc utlenianie manganu tlenem, trzeba by zapewnić pH = 9 - 10. Można uzyskać odmanganianie na złożu filtracyjnym zawierającym MnO2 i uzyskuje się odmanganianie nawet przy pH naturalnym pod warunkiem, że w wodzie będzie tlen. Złoża te nazywają się złożami wpracowanymi.
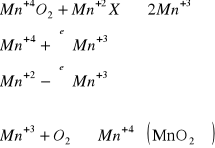
Odmanganianie idzie słabo gdy w wodzie jest amoniak, siarczyny, siarczki. Można w tedy pomóc dodając utleniacz chemiczny przed złożem filtracyjnym.
DEZYNFEKCJA, utlenianie
Celem dezynfekcji jest zniszczenie organizmów patogennych w wodzie wprowadzonej do sieci oraz zapobieżenie wtórnemu skażeniu bakteriologicznemu wody w sieci wodociągowej.
Proces dezynfekcji może być prowadzony metodami:
fizycznymi
pasteryzacja wody
gotowanie wody
ultra dźwięki
promienie UV (dodatkowo chemiczny czynnik dezynfekujący)
chemicznymi - polega na dawkowaniu do wody silnych utleniaczy mających działanie biobójcze. Do powszechnie stosowanych reagentów należy:
chlor dawkowany w formie gazowej, wody chlorowej lub roztworu podchlorynu sodu
dwutlenek chloru
chloraminy
ozon
Dobry dezynfektant powinien być trwały, skuteczny i nie powinien mieć skutków ubocznych.
Zdolność dezynfekcyjna:
ozon > dwutlenek chloru > chlor wolny > chloraminy
Stabilność i czas działania:
hloraminy > dwutlenek chloru > chlor wolny > ozon
Ozon - tworzy w wyniku reakcji ze związkami organicznymi uboczne skutki dezynfekcji i należą do nich: aldehydy, ketony, kwasy halooctowe.
Dwutlenek chloru czysty (bez chloru wolnego) - nie tworzy ze związkami organicznymi chlorowanych związków organicznych (ChZO = UPD). Ubocznymi skutkami są: chlorynu (ClO2-) i chlorany (ClO3-). Chloryny stwierdzono, że mogą powodować zmiany we krwi.
Chlor wolny - może być dawkowany jako:
chlor gazowy (duże zakłady i duże zanieczyszczenie)
wody chlorowej
podchloryn sodu (NaOCl)
Cl2 +H2O → 2HOCl (chlor wolny) + 2H+
Chlor wolny ma dużą siłę dezynfekującą, ale jest nietrwały i w wyniku dysocjacji powstaje:
HOCl → H++ OCl-
Cl2
Σ(HOCl + OCl +Cl2) → chlor wolny
Chlor wolny tworzy największą ilość ubocznych produktów dezynfekcji, są to: chlorowane związki organiczne. Powstają związki: Trichalometany (THM) → 100 μg/dm3
Chloroform ![]()
Bromodichlorometan ![]()
Dibromochlorometan ![]()
Bromoform (tribromoetan) ![]()
Przed stosowaniem chloru powinny być usunięte związki organiczne.
Chloraminy powstają w wodzie, gdy wodę chlorujemy, a w wodzie był obecny amoniak.
Reakcje powstawania:
NH4++HOCl = NH2Cl + H2O + H+ monochloramina
NH2Cl + HOCl = NH2Cl + H2O dichloramina
NH2Cl +HOCl = NCl3 + H2O trójchlorek azotu (bardzo źle jak powstaje)
NCl3 - ma tak okrutny zapach, że w zakładzie nie można wytrzymać. Powstaje przy pH około 4.
Chloraminy nie tworzą ubocznych skutków, ale są słabo biobójcze.
Dawka będzie zależeć od:
rodzaju dezynfektanta
zanieczyszczenia wody
od czasu kontaktu wody z dezynfektantem
od rodzaju niszczonych mikroorganizmów
Gdy jest rozległa sieć stosuje się często dezynfekcję strefową.
1
Wyszukiwarka
Podobne podstrony:
ściąga pyt 1, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
sciaga z pytan , Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
ściąga pyt4, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
Sprawko2, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
Sprawko3, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
Sprawko5, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
oczyszczanie wody pytania egz, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
Sprawko1, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
WYKLAD, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
Sprawko2, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
sciaga z chemii, Inżynieria środowiska, inż, Semestr IV, Chemia sanitarna
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
pHmetr-instrukcja obsługi, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
3z3, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wykłady, opracow
WYKŁAD 3. Reakcje chemiczne, Inżynieria środowiska, inż, Semestr I, Chemia ogólna
więcej podobnych podstron