Wydział: IMiC |
1.Anna Wójcik 2.Katarzyna Torba |
ROK II |
Grupa: 11 |
Zespól: B |
Chemia Fizyczna
|
Temat: Ogniwa chemiczne. |
Numer ćwiczenia 2 |
||
Cel ćwiczenia
Celem ćwiczenia jest zmierzenie siły elektromotorycznej (SEM) ogniw Daniella o różnych stężeniach roztworów oraz wyznaczenie iloczynu rozpuszczalności trudnorozpuszczalnej soli srebra AgCl na podstawie pomiarów SEM ogniwa miedziowo-srebrowego podczas miareczkowania roztworu AgNO3 roztworem soli KCl.
Wprowadzenie:
Reakcje elektrodowe uszeregowane według rosnących wartości odpowiadających im potencjałów normalnych noszą nazwę szeregu napięciowego metali
Szereg napięciowy metali
Elektroda |
Reakcja elektrodowa |
Potencjał standardowy |
K/K+ |
K <=> K+ + e |
- 2,92 |
Ca/Ca2+ |
Ca <=> Ca2+ + 2e |
- 2,84 |
Na, Na+ |
Na <=> Na+ + e |
- 2,71 |
Mg/Mg2+ |
Mg <=> Mg2+ +2e |
- 2,37 |
Al/Al3+ |
Al <=> Al3++ 3e |
- 1,66 |
Zn/Zn2+ |
Zn <=> Zn2+ + 2e |
- 0,76 |
H2/H+ |
H2 <=> 2H+ + 2e |
- 0,00 |
Cu/Cu2+ |
Cu2+ + 2e <=> Cu |
+ 0,345 |
Ag/Ag+ |
Ag+ + e <=> Ag |
+ 0,800 |
Przedstawiona tabela ma swoje praktyczne znaczenie, a mianowicie wartość potencjału standardowego jest miarą zdolności utleniająco-redukujących pary utleniacz-reduktor. Znając położenie pierwiastka w szeregu napięciowym można przewidzieć, który z nich jest bardziej aktywny chemicznie, tzn. które:
mogą wypierać wodór z rozcieńczonych roztworów kwasów,
są odporne na działanie rozcieńczonych roztworów kwasów,
mogą wypierać srebro z rozcieńczonego AgNO3.
Na przykład w ogniwie (-)Me(s)|Mez+||H+(aq)|H2(g)|Pt(+) wodór może być wypierany z rozcieńczonych kwasów przez metale o potencjałach standardowych niższych niż potencjał standardowy elektrody wodorowej. Metalami tymi są; K, Ca, Na, Zn, itd. W czasie pracy tak zbudowanego ogniwa na lewym półogniwie będzie przebiegał proces utlenienia metalu Me, natomiast na prawym - proces redukcji kationów H+. Wypadkowa reakcja zachodząca w ogniwie ma przebieg następujący.
Me(s) + z H+(aq) --> Mez+ + z/2 H2(g)
Na podstawie potencjałów normalnych elektrod można określić znaki elektrod i obliczyć wartość SEM ogniwa. Na podstawie potencjałów normalnych łatwo jest przewidzieć, że w ogniwie zbudowanym z elektrod miedzianej i cynkowej, zanurzonych w roztworach swych dwuwartościowych jonów o jednakowych stężeniach molowych, elektrodą dodatnią jest elektroda miedziana, a elektrodą ujemną - elektroda cynkowa. Normalna SEM tego ogniwa wyniesie:
DEo = 0,345 V - (-0,763) = 1,108 V
SEM ogniwa zbudowanego z dwóch metali jest tym większa im dalej od siebie są one położone w szeregu napięciowym.
Wyznaczanie iloczynu rozpuszczalności AgCl
W doświadczeniu wykorzystujemy zależność SEM od aktywności jonów w roztworze, służy ona do pomiarów aktywności ewentualnie stężenia jonów, wyznaczania współczynników aktywności, miareczkowania potencjometrycznego i wyznaczania iloczynu rozpuszczalności soli trudno rozpuszczalnych. W zestawionym przez nas ogniwie miedziowo-srebrowym o schemacie:
(-) Cu | CuSO4 | NH4 NO3 | AgNO3 | Ag (+)
wykorzystując równanie Nernsta wiemy że:
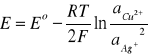
Podczas miareczkowania roztworu AgNO3 roztworem KCl wprowadzamy stopniowo jony Cl - , których obecność spowoduje zmniejszenie ilości jonów Ag+. Spowodowane jest to wytrącaniem się trudnorozpuszczalnej soli AgCl. W punkcie równoważnikowym zauważalna jest znaczna zmiana wartości SEM. Wykorzystując tę wartość łatwo obliczamy aktywność (stężenie) jonów Ag+ pochodzących z rozpuszczania AgCl , a zatem także iloczyn rozpuszczalności danej soli. Dalsze dodawanie Cl− będzie powodowało obniżenie aktywności jonów Ag+ zgodnie z zależnością:
![]()
i doprowadzi do zmiany znaku SEM ogniwa.
Ogniwo Daniella
Przebieg doświadczenia:
Zbudowałyśmy określone przez instrukcje ogniwa. Jako pierwsze wykonałyśmy ogniwo Daniella o schemacie:
(-) Zn|ZnSO4 |KCl|CuSO4 |Cu (+)
Ogniwo napełniałyśmy kolejno roztworami ZnSO4 i CuSO4 o stężeniach 0,1 M; 0,5 M i 1 M. Rolę klucza elektrolitycznego spełniał nasycony roztwór KCl. Zanurzając elektrody cynkową i miedziową w odpowiednich ramionach U-rurki i podłączając je przewodami do woltomierza dokonałyśmy pomiarów SEM dla każdego stężenia roztworów.
Wyniki doświadczenia:
Dla ogniwa Zn|ZnSO4 |KCl|CuSO4 |Cu o kolejnych stężeniach roztworów 0,1M; 0,5M i 1M dokonałyśmy pięciokrotnego pomiaru SEM i otrzymałyśmy następujące wyniki:
Lp. |
Siła elektromotoryczna ogniwa Edośw[V] |
||
|
C1=0,1M |
C2=0,5M |
C3=1M |
1. |
1,069 |
1,052 |
1,079 |
2. |
1,070 |
1,053 |
1,081 |
3. |
1,069 |
1,054 |
1,083 |
4. |
1,070 |
1,060 |
1,084 |
5. |
1,070 |
1,065 |
1,085 |
Eśr |
1,070 |
1,057 |
1,082 |
Wartość teoretyczną SEM dla ogniwa otrzymujemy z następującego wzoru:
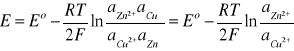
gdzie:
R- uniwersalna stała gazowa - R = 8,314 [J mol-1 K-1]
T- temperatura T = 295 [K]
F- stała Faradaya F = 96500 [C]
E0- standardowa siła elektromotoryczna ogniwa
Standardowa siła elektromotoryczna E0 dla ogniwa cynkowo-miedziowego wyliczana jest według konwencji sztokholmskiej, gdzie standardowe potencjały redox dla półogniw wynoszą:
Elektroda |
Reakcja elektrodowa |
Eo [V] |
cynk |
Zn2+ + 2e- = Zn0 |
-0,7611 |
miedź |
Cu2+ + 2e- = Cu0 |
+0,339 |
Wiedząc że:
aZn2+= cZn2+* fZn2+
aCu2+= cCu2+* fCu2+
c, f- stężenie i współczynnik aktywności odpowiednich jonów
c [M] |
fCu2+ |
fZn2+ |
0,1 |
0,210 |
0,206 |
0,5 |
0,104 |
0,102 |
1,0 |
0,063 |
0,062 |
Stężenia roztworów [M] |
Rodzaj ogniwa |
E teor [V] |
Edośw [V] |
Potencjał dyfuzyjny Eteor -Edośw |
0,1 |
Zn/ZnSO4 /KCl/CuSO4 /Cu |
1,100 |
1,070 |
0,030 |
0,5 |
Zn/ZnSO4 /KCl/CuSO4 /Cu |
1,100 |
1,057 |
0,043 |
1,0 |
Zn/ZnSO4 /KCl/CuSO4 /Cu |
1,100 |
1,082 |
0,018 |
Po dokonaniu obliczeń otrzymałyśmy następujące wyniki zawarte w poniżej tabeli:
Ogniwo miedziowo - srebrowe
Przebieg doświadczenia:
Zestawiłyśmy ogniwo miedziowo-srebrowe w następujący sposób: jedną ze zlewek napełniłyśmy do połowy 1 M roztworem CuSO4,do drugiej zaś wlałyśmy 50ml 0,01 M roztworu AgNO3. Kontakt między roztworami zapewniłyśmy za pomocą klucza elektrolitycznego NH4NO3. Po zanurzeniu w naczyńkach odpowiednich elektrod zmierzyłyśmy SEM badanego ogniwa woltomierzem cyfrowym o wysokiej oporności wewnętrznej. Pomiar powtórzyłyśmy pięciokrotnie otrzymując następujące wyniki:
SEM1=0,353
SEM2=0,361
SEM3=0,361
SEM4=0,361
SEM5=0,362
SEMśr=0,360
Postępując w identyczny sposób zmierzyłyśmy SEM badanego ogniwa w trakcie miareczkowania roztworu AgNO3 (w półogniwie srebrowym) roztworem KCl.
Stężenie KCl [M] |
Objętość KCl [ml] |
E [V] |
ΔE/ΔVKCl |
0,1 |
0,0 |
0,360 |
0,008 |
0,1 |
2,5 |
0,340 |
0,049 |
0,1 |
4,4 |
0,260 |
0,590 |
0,1 |
4,6 |
0,142 |
0,185 |
0,1 |
4,8 |
0,105 |
0,075 |
0,1 |
5,0 |
0,090 |
0,040 |
0,1 |
5,2 |
0,082 |
0,030 |
0,1 |
5,4 |
0,076 |
0,020 |
0,1 |
5,6 |
0,072 |
0,025 |
0,1 |
5,8 |
0,067 |
0,015 |
0,1 |
6,0 |
0,064 |
0,015 |
0,1 |
6,2 |
0,061 |
0,010 |
0,1 |
6,4 |
0,059 |
0,015 |
0,1 |
6,6 |
0,056 |
0,010 |
0,1 |
6,8 |
0,054 |
0,010 |
0,1 |
7,0 |
0,052 |
0,006 |
0,1 |
7,5 |
0,049 |
0,004 |
0,1 |
15,0 |
0,023 |
0,001 |
0,1 |
50,0 |
-0,002 |
0,001 |
1 |
10 |
-0,025 |
- |
Zależność E = f(V) obrazuje nam krzywa miareczkowania roztworu AgNO3 roztworem 0,1 M roztworem KCl.
Punkt przegięcia wykresu E = f(VKCl) pokrywa się z maksimum pierwszej pochodnej tej funkcji, widocznym na wykresie ΔE/ΔVKCl = f (VKCl).
Punkt przegięcia wykresu funkcji E = f(VKCl) odpowiada punktowi równoważnikowemu miareczkowania, w którym aktywność jonów Ag+ i Cl - jest sobie równa. Zatem przekształcając równanie Nernsta otrzymujemy zależność:
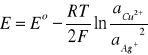
Chcąc obliczyć iloczyn rozpuszczalności trudnorozpuszczalnej soli AgCl wydzielającej się podczas wprowadzania do roztworu AgNO3 jonów Cl - z równania Nernsta wyliczamy aktywność jonów Ag+.
gdzie: E=0,260 [V] -odczyt z wykresu
E0=0,460 [V]
R- uniwersalna stała gazowa - R = 8,314 [J mol-1 K-1]
T- temperatura T = 295 [K]
F- stała Faradaya F = 96500 [C]
a Cu=0,21
Z czego wynika że:
Szukany przez nas iloczyn rozpuszczalności soli AgCl jest zatem równy:
![]()
Wnioski
Otrzymane przez nas wartości SEM dla ogniwa cynkowo-miedziowego są zbliżone do wartości teoretycznych obliczonych z równania Nernsta, a potencjał dyfuzyjny jest bardzo niski. Świadczy to o dość dokładnych pomiarach oraz poprawnie przeprowadzonym doświadczeniu.
W ogniwie miedziowo-srebrowym iloczyn rozpuszczalności AgCl otrzymany przez nas w ćwiczeniu wynosi LAgCl =3,935 * 10-10, a zatem pLAgCl = 9,4 podczas gdy wartość tablicowa pLAgCl = 9,8. Różnica ta wynikać może z niedokładnego miareczkowania roztworu AgNO3, czyli ewentualnego przesunięcia punktu równoważnikowego.
Wyszukiwarka
Podobne podstrony:
Ogniwagal.wzor, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
ogniwa chemiczne, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Chemia a ochrona środowiska - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Katalizatory - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
wielkości molowe-odp na pytania, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga z chemii (Na, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga na zaliczenie laboratorium u mgr. Pacławskiego, Chemia Fizyczna, chemia fizyczna- laborki roz
Grupy główne i podgrupy układu okresowego pierwiastków, Chemia Fizyczna, chemia fizyczna- laborki ro
Ściąga do metali z hutnictwa i nie tylko, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Wodorotlenosole, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Napięcie powierzchniowe1, Chemia Fizyczna, chemia fizyczna- laborki rozne, NAPIĘCIE POWIERZCHNIOWE
elektrolity, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga z chemii (C, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Liczby przenoszenia, Chemia Fizyczna, chemia fizyczna- laborki rozne, Liczby przenoszenia
okładka-sb lab 15, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
oddana, Chemia Fizyczna, chemia fizyczna- laborki rozne, pH
!!!!!!!!destylacja, Chemia Fizyczna, chemia fizyczna- laborki rozne, destylacja
więcej podobnych podstron