POLITECHNIKA ŚLĄSKA
Wydział Górnictwa i Geologii
ANALIZA WIDMOWA.
Ćwiczenia laboratoryjne z fizyki.
Grupa , sekcja
1.
2.
Gliwice dnia 26 X 2007r.
1. Wprowadzenie.
Analizę widmową możemy zdefiniować jako określanie ilościowe i jakościowe składu chemicznego ciał na podstawie widm ich promieniowania (widzialnego, nadfioletowego lub podczerwonego). Rozszczepienie widma na poszczególne linie widmowe następuje w pryzmacie, dzięki zjawisku dyspersji. Zjawisko to polega na zmianie współczynnika załamania w zależności od długości fali (im mniejsza długość fali, tym większy kąt załamania).
Ze względu na pochodzenie widma dzielimy na:
emisyjne
absorpcyjne
luminescencyjne
Ze względu na powstały obraz widma dzielimy na:
liniowe
pasmowe
ciągłe
Emisyjne widmo liniowe dają pobudzone do świecenia gazy i pary metali. Powstawanie widma związane jest ze wzbudzaniem elektronów pojedynczych atomów. Wzbudzony elektron (termicznie, elektrycznie) przechodzi ze stanu stacjonarnego do stanu wyższego, a wracając wypromieniowuje energię w postaci kwantu (fotonu):
![]()
Długości poszczególnych linii widmowych są charakterystyczne dla rodzaju substancji. Czułość takiej analizy jest wysoka, gdyż nawet śladowe domieszki mogą być zauważone. Z natężenia linii można wnioskować o ilości danego pierwiastka w związku chemicznym. Linie widmowe powinny mieć szerokość zerową, jednak z powodu takich zjawisk jak efekt Dopplera, oddziaływania międzycząsteczkowego oraz skończonego czasu życia elektronu podczas wzbudzenia ich szerokość jest większa. Charakterystyczne są serie widmowe dla wodoru. W zakresie światła widzialnego długość fali określa wzór Balmera:
![]()
Wzór ten można otrzymać bezpośrednio ze wzoru Rydberga:
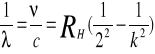
Widmo emitowane przez cząsteczki ma postać pasm złożonych z poszczególnych linii. W każdym paśmie przy brzegach linie tworzą tzw. głowicę pasma. W przypadku pobudzenia do świecenia ciał stałych, cieczy lub gazów pod wysokim ciśnieniem otrzymamy ciągłe widmo emisyjne. Jeśli na drodze światła o ciągłym rozkładzie widmowym ustawimy warstwę gazu lub pary o temperaturze niższej niż temperatura źródła, to na tle widma ciągłego zaobserwuje się czarne linie odpowiadające liniom widma emisyjnego. Zgodnie z zasadą Kirchhoffa, linie absorpcyjne zajmują to samo miejsce, co odpowiadające im linie emisyjne danej substancji. Najbardziej znanym widmem absorpcyjnym jest widmo światła słonecznego.
Do analizy widmowej stosuje się spektrografy pryzmatyczne, siatkowe i interferencyjne. Działanie spektrografu pryzmatycznego oparte jest na zjawisku dyspersji, polegającym na zależności prędkości światła od długości fali. Dyspersję kątową określa wzór:
Dyspersja kątowa określa rozbieżność dwóch wiązek różniących się długością fal o jednostkę.
Do obserwacji widma służą spektroskopy. Wymagają każdorazowego cechowania. Ocena fotometryczna linii widmowych jest czasochłonna i zwykle poprzestajemy na określeniu położeń linii widmowych.
2. Przebieg ćwiczenia.
Włączamy zasilacz spektrofotometru oraz lampę rtęciową, ustawiając ją na osi przyrządu.
Dokonujemy regulacji spektrofotometru (ostrość, intensywność, zbieżność wiązek).
Kręcąc pokrętłem sterującym z prawej strony przyrządu znajdujemy kolejne linie widmowe i notujemy ich położenie w tabeli. W celu jednakowych pomiarów linie ustawiamy na brzegu (z lewej lub prawej strony) wyróżnionej ramki pola widzenia.
Podobne pomiary wykonujemy z rurkami Pluckera wypełnionymi badanymi gazami.
Rysujemy krzywą dyspersji.
Z wykresu określamy długość linii widmowych badanego gazu i za pomocą tablic linii spektralnych identyfikujemy go.
3. Opracowanie wyników.
Substancja: RTĘĆ.
SKALA |
BARWA |
INTENSYWNOŚĆ |
DŁUGOŚĆ FALI [nm] |
|
|
|
|
TABLICOWA |
Z WYKRESU |
75 |
Czerwona |
Słaba |
641,9 |
641,9 |
104 |
Żółta |
Jasna |
579,0 |
579,0 |
115 |
Zielona |
Bardzo jasna |
546,1 |
546,1 |
144 |
Błękit cyjanowy |
Słaba |
497,4 |
497,4 |
180 |
Fioletowa |
Jasna |
435,7 |
435,7 |
Substancja: NEON.
SKALA |
BARWA |
INTENSYWNOŚĆ |
DŁUGOŚĆ FALI [nm] |
|
|
|
|
TABLICOWA |
Z WYKRESU |
84 |
Czerwona |
Bardzo jasna |
640,2 |
640,2 |
90 |
Pomarańczowa |
Jasna |
626,6 |
626,6 |
96 |
Pomarańczowo żółta |
Bardzo jasna |
597,6 |
597,6 |
99 |
Żółta |
Bardzo jasna |
576,4 |
576,4 |
115 |
Zielona |
Jasna |
534,1 |
534,1 |
153 |
Fioletowa |
Słaba |
363,4 |
363,4 |
Substancja: KRYPTON.
SKALA |
BARWA |
INTENSYWNOŚĆ |
TABLICOWA DŁUGOŚĆ FALI [nm] |
|
|
|
|
82 |
Czerwona |
Jasna |
642,0 |
100 |
Pomarańczowo żółta |
Jasna |
587,1 |
110 |
Zielona |
Jasna |
557,0 |
Substancja: WODÓR.
SKALA |
BARWA |
INTENSYWNOŚĆ |
TABLICOWA DŁUGOŚĆ FALI [nm] |
82 |
Czerwona |
Jasna |
687,0 |
143 |
Niebieska |
Jasna |
486,1 |
181 |
Fioletowa |
Jasna |
434,0 |
Substancja: NIEZNANA.
SKALA |
BARWA |
INTENSYWNOŚĆ |
DŁUGOŚĆ FALI [nm] Z WYKRESU |
81 |
Czerwona |
Słaba |
655 |
101 |
Żółta |
Bardzo jasna |
583 |
135 |
Zielona |
Jasna |
510 |
153 |
Niebieska |
Słaba |
463 |
170 |
Fioletowa |
Jasna |
424 |
4. Wyniki ćwiczenia.
Na podstawie wykresu stwierdziłyśmy, że bada substancja to HEL.
5. Wnioski.
Celem wyżej przedstawionego przez nas ćwiczenia, było przeprowadzenie analizy widmowej pięciu gazów, jakimi były: rtęć, neon, krypton, wodór oraz gaz nieznany, który miałyśmy zidentyfikować.
Po dokonaniu przez nas pomiarów barw, ich intensywności oraz odczytu na skali poszczególnych linii widmowych, sporządziłyśmy dla dwóch znanych gazów (rtęci oraz neonu) krzywą dyspersji, która posłużyła nam do określenia długości linii widmowych nieznanej substancji, a co za tym idzie - zidentyfikowania jej. Po tak przeprowadzonej analizie doszłyśmy do wniosku, iż piątą badaną przez nas substancją był hel, co postaramy się teraz udowodnić.
Jak wynika z tabeli przedstawionej poniżej, w której zestawiłyśmy porównanie naszych wartości długości linii widmowych odczytanych z wykresu krzywej dyspersji z wartościami z tablic linii spektralnych dla helu, łatwo możemy zauważyć, że są one do siebie zbliżone w pewnych zakresach. W porównaniu z niektórymi wartościami nasze wyniki różnią się trochę. Jest to związane z błędami jakich dokonaliśmy. Przede wszystkim do błędów tych możemy zaliczyć źle odczytaną barwę, intensywność linii widmowych, jak również źle dobrane wartości tablicowe długości linii widmowych dla rtęci i neonu oraz wartości wykresowych dla helu. Doskonale widać to zarówno na wykresie, jak i w tabelach. Do błędów przyczyniła się również niedokładność samego spektrofometru oraz panujące w laboratorium warunki. Pomimo tego wynik naszej analizy wydaje się nam poprawny oraz zgodny z rzeczywistością.
Poniżej przedstawiamy tabelę linii spektralnych helu, którą kierowałyśmy się przy odczytywaniu długości linii widmowych naszej badanej substancji oraz jej identyfikacji.
Substancja: HEL.
SKALA |
BARWA |
INTENSYWNOŚĆ |
DŁUGOŚĆ FALI [nm] Z WYKRESU |
DŁUGOŚĆ FALI TABLICOWA |
81 |
Czerwona |
Słaba |
655 |
656,0 |
101 |
Żółta |
Bardzo jasna |
583 |
587,6 |
135 |
Zielona |
Jasna |
510 |
504,8 |
153 |
Niebieska |
Słaba |
463 |
468,6 |
170 |
Fioletowa |
Jasna |
424 |
439,0 |
1
Wyszukiwarka
Podobne podstrony:
widmowa, GiG sem I - III
Projekt betonu sekcja 1, GiG sem I - III
Pomiar mocy i energii w ukladach jednofazowych, GiG sem I - III
Promienie beta(1), GiG sem I - III
projekt muru oporowego, AGH Kier. GiG rok III Sem. V, ge
ZAGADNIENIA - analiza instrumentalna, Studia, I o, rok III, sem V, Analiza instrumentalna [egz]
Zarys Geomechaniki wykład, AGH Kier. GiG rok III Sem. V, Zarys geomechaniki
matematyczna analiza metody ryzyka zał.1, Zarządzanie, Sem III, FINANSE PRZEDSIĘBIORSTW
analiza od beaty, studia, sem III, analiza
Symulacyjna analiza widmowa czwórników pasywnych, UTP Bydgoszcz Elektrotechnika, III semestr, teoria
chemia egzamin odp2, AGH Kier. GiG rok II Sem. III
TT Sem III 14 03
więcej podobnych podstron