Faza - jest to jednorodna część układu pod względem chemicznym jak i krystalograficznym, oddzielona od pozostałych części granicą rozdziału faz (między fazową(
Układ - układem nazywamy zbór faz. Jeśli fazy znajdują się w równowadze termodynamicznej, mówimy o układzie równowagi. Istnieją układy jednoskładnikowe - pojedyncze, dwuskładnikowe - podwójne, itd.
Składniki - składnikami układu nazywamy substancje proste (np. pierwiastki) lub złożone (np. związki) nie ulegające przemianom, z których składają się fazy układu.
Równowaga fazowa - następuje wówczas, gdy w określonych warunkach termodynamicznych stosunki ilościowe między fazami układu, tj. skład fazowy, pozostają stałe.
Równowaga termodynamiczna - jest pojęciem wykorzystywanym do określania stanu układu. Kryterium równowagi termodynamicznej jest energia swobodna, która w warunkach równowagi osiąga wartość minimalną.
Potencjał chemiczny - jest to pochodna energii swobodnej względem stężenia (wyrażona w molach)
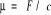
lub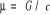
Reguła faz (Gibasa) - określa liczbę stopni swobody S układu, tzn, liczbę zew i wew czynników, które można zmienić nie powodując zmiany liczby faz w układzie.
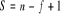
(gdy S=0 mówimy że ukł jest niezmienny i wtedy zmiana jakiegokolwiek czynnika zew lub wew powoduje zmianę liczby faz. Gdy S=1 układ jest jednoimienny i wówczas można zmienić jeden czynnik (np. temp.) przy utrzymaniu tej samej liczby faz.Solidus - linia na wykresie równowagi fazowej oznaczająca koniec krzepnięcia stopów wartości temperatury, poniżej których stopy w całym zakresie stężeń występują w stanie stałym.
Likwidus - linia przedstawiająca na wykresie równowagi wartości temperatury, początek krzepnięcia stopów o różnych stężeniach, powyżej których stopy w całym zakresie stężeń są ciekłe. Dla układów dwuskładnikowych jest linią, dla trójskładnikowych - powierzchnią.
Roztwór to nie rozdzielająca się w długich okresach czasu mieszanina dwóch lub więcej związków chemicznych. Skład roztworów określa się przez podanie stężenia składników. W roztworach zwykle jeden ze związków chemicznych jest nazywany rozpuszczalnikiem, a drugi substancją rozpuszczaną.
Mieszanina - układ dwóch lub więcej pierwiastków lub związków chemicznych zmieszanych ze sobą w dowolnym stosunku i wykazujących swoje indywidualne właściwości. Wyróżnia się dwa rodzaje mieszanin: a)mieszaniny jednorodne, czyli roztwory np. stopy metali (brąz), benzyna, solanka, cukier w wodzie, powietrze, roztwory wodne soków, ocet. Wzrokowe określenie składu mieszaniny jednorodnej jest zazwyczaj niemożliwe; b)mieszaniny niejednorodne, np. opiłki żelaza zmieszane z cukrem, piasek z wodą, zaprawa murarska, opiłki żelaza w wodzie, kawa mielona z wodą, groch z fasolą. Składniki mieszanin niejednorodnych można często określić bez pomocy aparatury analitycznej.
Prawo dźwigni. Za pomocą reguły można określić ilość oraz skład chemiczny dwóch faz.
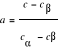
,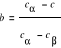
rs - ilość fazy stałej, rc - ilość fazy ciekłej, r- ogólna ilość stopu, ab, bc, ac - odcinki wyznaczone przez linie ty, likwidus oraz solidus.Wykresy. 1. o zupełnej rozpuszczalności w stanie ciekłym i stały. 2. o ograniczonej rozpuszczalności w stanie ciekłym i stałym z eutektyką 3. o ograniczonej rozpuszczalności w stanie ciekłym i stałym z perytetyką.
Wyszukiwarka
Podobne podstrony:
cw 3 mini, Studia, ZiIP, Semestr I, PNOM, Ćwiczenia
ćw 1 mini, Studia, ZiIP, Semestr I, PNOM, Ćwiczenia
ćw 4 mini, Studia, ZiIP, Semestr I, PNOM, Ćwiczenia
ćw 6 układ Fe-C składniki strukturalne mini, Studia, ZiIP, Semestr I, PNOM, Ćwiczenia
cw 5, Studia, ZiIP, Semestr I, PNOM, Ćwiczenia
ćw 1, Studia, ZiIP, Semestr I, PNOM, Ćwiczenia
ćw 6 układ Fe-C składniki strukturalne, Studia, ZiIP, Semestr I, PNOM, Ćwiczenia
Materiały ceramiczne ćw.1 mini, Studia, ZiIP, SEMESTR III, Materiały Ceramiczne (MC)
Lista obecnosci i ocen ZiIP gr.III, Studia, ZiIP, Semestr I, PNOM, Ćwiczenia
PNOM odp zestaw 1 mini, Studia, ZiIP, Semestr I, PNOM
PNOM odp zestaw 3 mini, Studia, ZiIP, Semestr I, PNOM
Materiały ceramiczne ćw.1 mini, Studia, ZiIP, SEMESTR III, Materiały Ceramiczne (MC)
cwiczenia rozpiska, Studia, ZiIP, Semestr I, PNOM
Fir ćw 2, Studia, ZiIP, SEMESTR V, FiR, Ćwiczenia FiR
Materiały kolokwium mini, Studia, ZiIP, Semestr I, METALURGIA
Obróbka cieplna mini, Studia, ZiIP, SEMESTR II, Materiały metalowe
ZDMI wyk 1 mini, Studia, ZiIP, SEMESTR V, ZDMI
Pnom sciaga gr 1, Studia, ZiIP, Semestr I, PNOM
Pytania gr B mini, Studia, ZiIP, Semestr I, METALURGIA
więcej podobnych podstron