Jak dzielą się układy termodynamiczne z punktu widzenia wymiany materii?
Układy termodynamiczne z punktu widzenia wymiany materii dzielą się na otwarte, zamknięte i izolowane.
Układ termodynamicznie otwarty wymienia z otoczeniem materię zarówno na sposób masy jak i energii.
Układ izolowany - nie wymienia materii z otoczeniem (ani na sposób masy ani na sposób energii). Układ zamknięty - wymienia z otoczeniem energię (na sposób ciepła, pracy lub kwantów promieniowania) ale nie wymienia masy. Układ zamknięty może być:
-zamknięty adiabatycznie - nie wymienia energii na sposób ciepła (układ jest izolowany termicznie), ale może wymieniać energię na skutek wykonania pracy (np. Ruch tłoka)
-zamknięty diatermicznie - wymienia energię na sposób ciepła jak i na sposób pracy.
2. Jakie znasz termodynamiczne funkcje stanu? Podaj podstawowe zależności pomiędzy tymi
funkcjami stanu.
Stanem układu nazywamy jego sytuację opisaną zestawem zmiennych zwanych parametrami stanu.
Znane mi termodynamiczne funkcje stanu to:
-Energia wewnętrzna U
λ Entalpia H
- Energia swobodna F
λ Entalpia swobodna G
λ Entropia S
podstawowe zależności między nimi to:
H = U + pV
F = U - TS
G = H - TS
G = F + pV
Wymień właściwości funkcji stanu.
¬ wartość liczbowa funkcji stanu dla danego stanu jest
funkcją parametrów określających ten stan
¬ mają określoną wartość liczbową dla danego stanu
(niezależną od drogi na jakiej ten stan osiągnięto)
¬ zmiana wartości funkcji stanu zależy tylko od stanu
końcowego (B) i początkowego (A): Df = fB - fA
¬różniczka funkcji stanu f = f(x,y) jest różniczką zupełną: df=(df/dx)ydx + (df/dy)xdy
Podaj treść zasad termodynamiki.
Zerowa zasada termodynamiki. Jeżeli układy A i B są w stanie równowagi termicznej z układem C, to są one również w stanie równowagi termicznej względem siebie.
I zasada termodynamiki. Energia całkowita układu, a więc jego energia wewnętrzna, zmienia się na skutek wymiany ciepła lub pracy z otoczeniem: U = Q + W
II zasada termodynamiki. Jeżeli układ zmienia swój stan w dowolnymprocesie elementarnym, podczas którego wymienia z otoczeniem w temperaturze T ciepło Qel, to zmiana entropii układu w każdym,nieskończenie małym etapie tego procesu spełnia warunek: ![]()
III zasada termodynamiki. W temperaturze zera bezwzględnego entropia każdej substancji czystej w stanie kryształu doskonałego jest równa zeru.
Wyprowadź zależność na efekt cieplny przemiany prowadzonej w stałej objętości. (izochoryczna)
Zgodnie z I zasadą termodynamiki ΔU=Q+W
Jeżeli wymiana energii na sposób pracy jest realizowana wyłącznie na drodze zmiany objętości w przemianie kwazystatycznej, to I zasadę termodynamiki można zapisać jako: U = Q - p·V
W przemianie izochorycznej V = const, a więc DV=0 (dV=0) otrzymujemy: DU = Q
Wyprowadź zależność na efekt cieplny przemiany prowadzonej pod stałym ciśnieniem.
Do opisu przemian izobarycznych (p=const) wygodna jest entalpia H ≡ U+pV
Różniczkując H otrzymujemy: dH=dU+pdV+Vdp
Z I zasady termodynamiki (tylko praca objetościowa): dU=Qel+Wobj=Qel-pdV
Łącząc te zależności mamy: dH=Qel-pdV+pdV+Vdp=Qel+Vdp
Wobec p=const: dp=0 (przemiana elementarna) dH=Qel
Dp=0 (przemiana skończona) DH=Q
Jak brzmi prawo Hessa i jakie jest jego zastosowanie?
Jeżeli układ ulegający przemianie może wymieniać z otoczeniemenergię wyłącznie poprzez wymianę ciepła i ewentualnie poprzez wykonanie pracy objętościowej, to ilość energii wymienionej przez przekazywanie ciepła (efekt cieplny przemiany - DU lub DH) , zależy tylko od stanu początkowego i końcowego układu, a nie zależy od drogi przemiany (tzn. liczby i rodzaju etapów pośrednich na tej drodze), pod warunkiem, że wszystkie etapy zachodzą pod stałym ciśnieniem lub w stałej objętości.
Zastosowanie prawa Hessa: do obliczania efektów energetycznych reakcji chemicznej przebiegającej w różnych temperaturach (należy znać zależność ciepła tworzenia związku chemicznego od temperatury).
Podaj podstawowe prawa termochemii pomocne w wyznaczaniu efektów cieplnych reakcji.
Prawo Hessa
Jeżeli układ ulegający przemianie może wymieniać z otoczeniem energię wyłącznie poprzez wymianę ciepła i ewentualnie poprzez wykonanie pracy objętościowej, to ilość energii wymienionej przez przekazywanie ciepła (efekt cieplny przemiany - DU lub DH) , zależy tylko od stanu początkowego i końcowego układu, a nie zależy od drogi przemiany (tzn. liczby i rodzaju etapów pośrednich na tej drodze), pod warunkiem, że wszystkie etapy zachodzą pod stałym ciśnieniem lub w stałej objętości.
Prawo Lavoisiera i Laplace'a
Efekt cieplny reakcji przebiegającej w danym kierunku jest równy efektowi cieplnemu reakcji odwrotnej z przeciwnym znakiem.
Prawo Kirchhoffa
Znając efekt cieplny reakcji w jednej temperaturze i znając pojemność cieplną reagentów reakcji można obliczyć efekt cieplny tej reakcji w innej temperaturze.
ΔHⷪ (T2)= ΔHⷪ (T1)+∑nicp,prodi(T2-T1)-∑nicp,subi(T2-T1);
ΔUⷪ (T2)= ΔUⷪ (T1)+∑nicV,prodi(T2-T1)-∑nicV,subi(T2-T1).
Jakie znasz sposoby wyznaczania efektów cieplnych reakcji?
Efekty cieplne przemian fizycznych i reakcji chemicznych można wyliczyć korzystając z poznanych praw, na podstawie znanych efektów innych przemian lub reakcji. Konieczne jest jednak także
eksperymentalne wyznaczanie ciepeł reakcji.
¬ Bezpośredni pomiar efektów cieplnych procesów umożliwia metoda kalorymetryczna. Do pomiaru kalorymetrycznego nadają się szczególnie reakcje przebiegające szybko i praktycznie do końca.
¬ Gdy reakcja przebiega do osiągnięcia stanu równowagi, w którym w podobnych ilościach pozostają zarówno substraty jaki i produkty reakcji, a także łatwo można określić stałą równowagi, to efekt cieplny można wyliczyć wyznaczając stałe równowagi reakcji w dwu różnych temperaturach.
¬ Jeżeli reakcja może być przeprowadzona w taki sposób, że efekt energetyczny przejawi się w postaci pracy elektrycznej ogniwa, to ciepło reakcji można obliczyć mierząc siłę elektromotoryczną (SEM) takiego ogniwa w różnych temperaturach.
¬ Ciepła pewnych reakcji, np. reakcji dysocjacji cząsteczek dwuatomowych można wyznaczyć również metodami spektroskopowymi.
Podaj i objaśnij równanie izobary van't Hoffa.
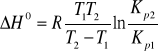
Podaj i objaśnij równanie stanu gazu doskonałego.
Stan gazu określają trzy parametry: temperatura, ciśnienie i objętość. Zależność między nimi nazywamy równaniem stanu gazu.
pV=nRT
gdzie: p-ciśnienie, V-objętość, n-liczba moli gazu, T-temperatura bezwzględna: T[K]=t[°C]+273,15K;R-uniwersalna stała gazowa: R=NAk, gdzie: NA- stała Avogadra (liczba Avogadra), k-stała Boltzmanna, R=8,314 J/(mol·K).
Często stosowanym punktem odniesienia do obliczeń są warunki normalne zdefiniowane przez IUPAC (tzw. STP):
p=1,013.105 Pa=1atm, T=273,15K=O°C. Objętość 1mola gazu o właściwościach gazu doskonałego w warunkach normalnych wynosi odpowiednio 22,7 dm3 lub 22,4 dm3
Co to jest punkt krytyczny substancji?
Tkr to temperatura, w której zanika różnica między cieczą a parą. Powyżej tej temperatury gazu nie można skroplić. Ciśnienie potrzebne do skroplenia gazu w Tkr nosi nazwę ciśnienia krytycznego pkr, a objętość 1 mola, jaką zajmuje gaz w tych warunkach nosi nazwę objętości krytycznej Vkr.
Izoterma dla Tkr, zwana izotermą krytyczną (linia zielona) ma tylko punkt przegięcia. Po przekształceniu równania van der Waalsa dla 1 mola substancji do postaci: pV= (Rt)/(V-b) - (a/V^)
i zastosowaniu warunku o zerowaniu się pierwszej i drugiej pochodnej w punkcie przegięcia można wyznaczyć parametry punktu krytycznego:
wykł3 slajd 3
Jakie znasz równania stanu gazu rzeczywistego?
![]()
![]()
to korekta ciśnieniowa, zwana ciśnieniem wewnętrznym gazu, uwzględnia wzajemne przyciąganie cząsteczek, które powoduje, że cząsteczki są hamowane przez siły przyciągania i rzadziej uderzają o ścianki naczynia.
nb - poprawka objętościowa (n-liczba moli, b- stała oznaczająca rzeczywistą objętość zajmowaną przez cząsteczki w 1 molu gazu).
Żaden gaz rzeczywisty nie spełnia wszystkich warunków stawianych gazowi doskonałemu. Tylko w odpowiednio wysokich temperaturach oraz w stanie dość dużego rozrzedzenia, właściwości gazów rzeczywistych zbliżają się do właściwości gazu doskonałego.
Opisz zjawisko załamania promienia światła na granicy faz.
Faza "1" jest optycznie rzadsza od fazy "2", c1 > c2, kąt padania a > kąt załamania b.
Faza "1" jest optycznie gęstsza od fazy "2", c1 < c2, kąt padania a < kąt załamania b.
Wzór Snelliusa: n2,1= (sinἀ/sinB)=c1/c2
n2,1 - współczynnik załamania światła, α - kąt padania, β - kąt załamania, c1 - prędkość światła w fazie "1", c2 - prędkość światła w fazie "2".
15. Co to jest i od czego zależy współczynnik załamania światła?
Współczynnik załamania światła (oznaczany literą n) jest wielkością opisującą załamanie światła przy przejściu z jednego ośrodka do drugiego. Liczbowo współczynnik załamania wyraża się poprzez stosunek prędkości światła v1 w jednym ośrodku do prędkości v2 drugim ośrodku, n21=v1/v2. Jeśli jednym z ośrodków jest próżnia, to współczynnik załamania n nosi nazwę bezwzględnego n=c/v, gdzie c to prędkość światła w próżni. Poniższa tabela przedstawia bezwzględne współczynniki załamania światła dla długości fali 589 nm.
¬Rozchodzenie się fal elektromagnetycznych w danej fazie zależy od jej budowy. Faza zbudowana z atomów lub cząsteczek i należących do nich, poruszających się elektronów oddziałuje swoim polem elektromagnetycznym na przechodzące przez jej wnętrze fale elektromagnetyczne zmieniając szybkość rozchodzenia się fal.
¬Wpływ fazy na szybkość rozchodzenia się fal elektromagnetycznych najłatwiej można zaobserwować na powierzchni pomiędzy dwiema fazami, gdy fala elektromagnetyczna przechodzi przez tę powierzchnię. Promienie świetlne, padając pod pewnym kątem na powierzchnię granicy faz pomiędzy dwiema przezroczystymi fazami o różnych gęstościach optycznych, ulegają częściowo odbiciu a częściowo załamaniu.
Co to jest refrakcja molowa i jakie ma właściwości?
Refrakcja molowa oznacza objętość jaką zajmują cząsteczki w 1 molu substancji.
Refrakcja molowa jest wielkością stałą i charakterystyczną dla danego związku chemicznego. Nie zależy od temperatury i od ciśnienia, zależy natomiast od długości fali świetlnej, dla której jest wyznaczana.
równanie Lorentza-Lorentza:![]()
![]()
gdzie: n - współczynnik załamania światła danej substancji, M - masa molowa, d - gęstość
Refrakcja molowa substancji chemicznej jest wielkością addytywną, to znaczy jest sumą refrakcji molowych atomów i grup atomów oraz wiązań występujących w cząsteczce danego związku, czyli:
R = ∑niRi
Refrakcja molowa jest także wielkością konstytutywną. Oznacza to, że zależy od sposobu powiązania wszystkich atomów w cząsteczce.
Używa się jej w celu potwierdzenia tożsamości badanego związku.
Jakie znasz wielkości koligatywne roztworów?
Należą do nich:
efekt ebulioskopowy - podwyższenie temperatury wrzenia i związane z nim obniżenie prężności pary nad roztworem (względem czystego rozpuszczalnika). Wykorzystane w ebuliometrii.
efekt krioskopowy - obniżenie temperatury krzepnięcia roztworów.
Definicja: Wielkości koligatywne to wielkości, które zależą tylko od liczby cząsteczek substancji rozpuszczonej w roztworze (od stężenia), a nie zależą od ich rodzaju. Założenia:
Substancja rozpuszczona jest nielotna, tj. faza parowa zawiera czysty rozpuszczalnik.
Substancja rozpuszczona jest nierozpuszczalna w fazie stałej, tj. faza stała jest czystym składnikiem.
Wielkości koligatywne służą do opisu roztworów bardzo rozcieńczonych, które z dobrym przybliżeniem możemy traktować jako doskonałe (brak oddziaływań międzycząsteczkowych).
Wielkości koligatywne można stosować do określania czystości substancji.
Na czym polega osmoza?
Kolejną wielkością koligatywną jest ciśnienie osmotyczne.
Osmoza to zjawisko związane z istnieniem błon półprzepuszczalnych (przepuszczalnych dla jednego składnika roztworu, nieprzepuszczalnych dla innych).
Osmoza polega na wyrównywaniu stężenia rozpuszczalnika po obu stronach błony.
Cząsteczki rozpuszczalnika wędrują z roztworu o większej jego zawartości-niższym stężeniu rozpuszczonych substancji (roztwór hipotoniczny) do roztworu o wyższym stężeniu substancji, a niższym rozpuszczalnika (roztwór hipertoniczny). W stanie równowagi zawartość rozpuszczalnika wyrównuje się - roztwory stają się izotoniczne.
19. Jak brzmi prawo podziału Nernsta?
Jeżeli do układu zawierającego dwie fazy ciekłe (praktycznie nie mieszające się ze sobą) wprowadzimy trzeci składnik (rozpuszczający się w obu cieczach), to w stanie równowagi, stosunek stężeń wprowadzonej substancji w tych fazach jest wielkością stałą w danej temperaturze, niezależną od ilości wprowadzonej substancji:
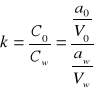
k - stężeniowy współczynnik podziału substancji,
co - stężenie molowe substancji w pierwszym rozpuszczalniku (organicznym),
cw - stężenie molowe substancji w drugim rozpuszczalniku (najczęściej wodnym).
20. Jakie czynniki wpływają na odchylenia od prawa podziału Nernsta?
Prawo podziału Nernsta w podanej postaci jest spełnione ściśle tylko w przypadku roztworów rozcieńczonych. Na jego odchylenia wpływa Dysocjacja lub asocjacja rozpuszczonych cząsteczek
21. Krótko scharakteryzuj metodę ekstrakcji.
Ekstrakcja to usuwanie rozpuszczonej substancji z rozpuszczalnika ciekłego przez wytrząsanie roztworu z innym rozpuszczalnikiem.
rozpuszczalniki nie mogą się rozpuszczać jeden w drugim
ogranicza się ilość rozpuszczalnika do minimum
szuka się rozpuszczalnika o dużej wartości współczynnika podziału
często stosuje się bardziej efektywną ekstrakcję wielokrotną mniejszymi porcjami rozpuszczalnika
22. Co to jest adsorpcja, adsorbent i adsorbat?
Adsorpcją, nazywamy zjawisko polegające na gromadzeniu się jakiejś substancji na powierzchni ciała stałego lub cieczy.
Substancja gromadząca się na powierzchni to adsorbat. Substancja na której gromadzi się adsorbat to adsorbent.
23. Wyprowadź zależność określającą znak ciepła adsorpcji.
Ciepło adsorpcji charakteryzuje powinowactwo danego rodzaju adsorbentu do określonego adsorbatu. Proces adsorpcji przebiega zawsze samorzutnie, więc w warunkach izotermiczno-izobarycznych spełniona jest zależność:
G ≤ 0
Ponieważ entropia (miara nieuporządkowania) uporządkowanej warstwy adsorpcyjnej jest mniejsza niż entropia gazu czy substancji w głębi roztworu, to zmiana entropii w procesie adsorpcji spełnia nierówność:
S ≤ 0
Z definicji:
G = H - TS
Przekształcając ten wzór możemy obliczyć wartość zmiany entalpii podczas samorzutnej przemiany:
H = G + TS , a wobec G ≤ 0 i S ≤ 0
H ≤ 0
24. Porównaj adsorpcje fizyczna i chemiczną.
W procesie adsorpcji fizycznej pomiędzy adsorbatem i adsorbentem zachodzą oddziaływania van der Wasala (w wyniku sił dyspersyjnych lub oddziaływań dipolowych). Mogą powstawać warstwy wielocząsteczkowe (adsorpcja wielowarstwowa). Adsorpcja fizyczna jest procesem odwracalnym.
W procesie adsorpcji chemicznej (chemisorpcji) cząsteczki lub atomy łączą się z powierzchnią tworząc wiązania chemiczne (najczęściej kowalencyjne, a czasem jonowe). Do przebiegu tego zjawiska konieczne jest doprowadzenie odpowiedniej energii, zwanej energią aktywacji, która zapoczątkowałaby powstanie wiązania. Adsorpcja chemiczna jest procesem nieodwracalnym a jej szybkość rośnie wraz ze wzrostem temperatury, przy czym wartość tej szybkości jest znacznie mniejsza w porównaniu z adsorpcją fizyczną. Powstające w toku chemisorpcji warstwy adsorpcyjne są jednocząsteczkowe. Entalpia chemisorpcji jest o rząd wielkości wyższa od entalpii fizysorpcji i wynosi ok. 200 kJ/mol.
25. Podaj i objaśnij wzór pozwalający obliczyć adsorpcję substancji z roztworu ciekłego.
![]()
a-adsorpcja rzeczywista
x-ilość moli adsorbatu na powierzchni
adsorbentu
m-masa adsorbentu
V-objętość roztworu
co, cr-stężenie adsorbatu w roztworze przed adsorpcją i po adsorpcji
Vw-objętość właściwa warstwy powierzchniowej adsorbentu (iloczyn powierzchni właściwej adsorbentu i grubości warstwy adsorpcyjnej.
26. Zdefiniuj i podaj wzór na powierzchnie właściwą adsorbentu.
Powierzchnia właściwa adsorbentu Sa to wielkość powierzchni zewnętrznej tego adsorbentu przypadająca na jednostkę masy tej substancji:
![]()
Tak zdefiniowana powierzchnia właściwa wyrażana jest w m2/g lub m2/kg.
27. Podaj jakie znasz izotermy adsorpcji i określ do jakiego rodzaju adsorpcji się je stosuje.
Izoterma Freundlicha- stosuje się do opisu adsorpcji fizycznej gazów i składników roztworów ciekłych.
Izoterma Langmuira- dobrze opisuje przypadki chemisorpcji,natomiast w przypadku adsorpcji fizycznej na ogół zawodzi.
Izoterma BET (Brunauer, Emmet i Teller)- adsorpcja fizyczna
28. Zdefiniuj szybkość reakcji.
Szybkość reakcji określa szybkość zanikania substratów lub powstawania produktów.
29. Wymień czynniki wpływające na szybkość reakcji i krótko scharakteryzuj ich wpływ.
Najważniejszymi czynnikami decydującymi o szybkości reakcji
chemicznej są:
rodzaj i stężenie reagujących substancji lub ciśnienie gazów (jeżeli
reakcja przebiega w fazie gazowej)
stopień rozdrobnienia reagentów.
temperatura
obecność katalizatorów
30. Zdefiniuj pojęcie rzędowości i cząsteczkowości reakcji.
Rzędowość- sumą wykładników potęg do jakich podniesione są stężenia substancji w równaniu kinetycznym
Cząsteczkowość (molekularność) reakcji- Liczba cząsteczek (także atomów, rodników lub jonów) biorących udział w reakcji elementarnej (prostej)
31. Zdefiniuj podstawowe typy reakcji złożonych i podaj ich przykłady.
reakcje równoległe,
np. nitrowanie fenolu
następcze ,
np.: CH4 + H2O -> CO + 3 H2
CO + H2O -> CO2 + H2
odwracalne , np. dysocjacja słabego kwasu
RCOOH ⇌ RCOO- + H+
sprzężone - A + B -> M
A + C -> N
np. FeSO4(B) utlenia się pod wpływem H2O2(A) w obecności jak i
nieobecności HI(C), ale HI tylko w obecności FeSO4(B), jako induktora
łańcuchowe , np. polimeryzacja łańcuchowa
32. Wyprowadź wzór na zmiany stężenia w reakcji I-rzędu i czas połowicznego przereagowania.
![]()
czyli ![]()
Całkując równanie w granicach czasu od to=0 do t i odpowiadających im stężeń otrzymujemy:
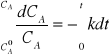
czyli ![]()
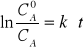
lub![]()
czas połowicznego przereagowania:
Korzystając ze wzoru opisującego zmiany stężenia można obliczyć czas t potrzebny do zmniejszenia stężenia substancji A z cA o do cA: 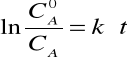
-> 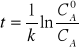
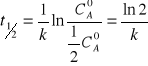
33. Wyprowadź wzór na zmiany stężenia w reakcji II-rzędu i czas połowicznego przereagowania.
![]()
czyli ![]()
Całkując równanie w granicach czasu od to=0 do t i odpowiadających im stężeń otrzymujemy:
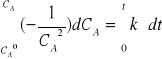
czyli ![]()
Czas t potrzebny do zmniejszenia stężenia substancji A z cAo do cA: ![]()
Czas połowicznej przemiany: ![]()
34. Podaj wyprowadzony na podstawie teorii zderzeń aktywnych wzór określający zależność stałej szybkości reakcji od temperatury.
![]()
lub ![]()
35. Jak teoria stanu przejściowego tłumaczy zmiany stanu energii reagentów podczas reakcji?
Teoria stanu przejściowego przyjmuje , że podczas zderzenia cząsteczek substratów wytwarza się zespół atomów zwany kompleksem aktywnym (przejściowym), obdarzony energią zwiększoną o energię aktywacji. Kompleks aktywny jest nietrwały i rozpadając się może utworzyć cząsteczki produktów lub z powrotem cząsteczki substratów.
36. Jaki jest wpływ katalizatorów na szybkość reakcji? Jak to tłumaczy teoria stanu przejściowego?
Utworzenia przejściowego połączenia katalizatora z substratami - połączenia, które następnie rozpada się na produkty i zregenerowany katalizator. Obniżenie poziomu energetycznego
kompleksu przejściowego oznacza obniżenie energii aktywacji. Działanie katalizatora sprowadza się do obniżenia energii aktywacji katalizowanej reakcji, a więc do zwiększenia wartości stałej szybkości reakcji
H = U + pV
F = U - TS
G = H - TS
G = F + pV
Izobara van't Hoffa
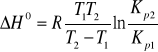
Równanie gazu rzeczywistego:
![]()
![]()
to korekta ciśnieniowa, zwana ciśnieniem wewnętrznym gazu, uwzględnia wzajemne przyciąganie cząsteczek, które powoduje, że cząsteczki są hamowane przez siły przyciągania i rzadziej uderzają o ścianki naczynia.
nb - poprawka objętościowa (n-liczba moli, b- stała oznaczająca rzeczywistą objętość zajmowaną przez cząsteczki w 1 molu gazu).
równanie Lorentza-Lorentza:
![]()
![]()
Zmiany ST. Reakcji I rzędu:
![]()
wyprowadzony na podstawie teorii zderzeń aktywnych wzór określający zależność stałej szybkości reakcji od temperatur:
![]()
lub ![]()
Wyszukiwarka
Podobne podstrony:
chemia fizycznaMiBM 1, Studia, Mibm, semestr II, Chemia Fizyczna, !chemia fiz
sprawozdanie chemia michał, Budownictwo UZ semestr I , II, Chemia budowlana, Sprawozdania od Seweryn
14.10, Studia Biotechnologia, Semestr 7 - II stopnia - mikrobiologia molekularna, Metagenomika
Egz2003IIsemS, chemia w nauce i gospodarce Uł, Semestr II, Egzamin sem II chem
Pytania z PCR 2, Studia Biotechnologia, Semestr 7 - II stopnia - mikrobiologia molekularna, Metody P
chemia cześć 1, PG Budownictwo, Semestr II, Chemia
Chemia 2 koło, PG Budownictwo, Semestr II, Chemia
Zasady projektowania starterow, Studia Biotechnologia, Semestr 7 - II stopnia - mikrobiologia moleku
botanika ćw 2 wszystkie pojęcia, Biotechnologia, Semestr II, botanika
chemia-kolos2, IŚ PW semestr II, chemia, kolokwium
Jak si, chemia w nauce i gospodarce Uł, Semestr II, fizyka wykłady
Dla wektorów z miejscem polilinkerowym, Studia Biotechnologia, Semestr 7 - II stopnia - mikrobiologi
CHEMIA OGÓLNA egzamin, Biotechnologia, Semestr 1, Chemia ogólna, Egzamin
CHEMIA FIZYCZNA, Studia, Mibm, semestr II, Chemia Fizyczna, Chemia fizyczna
Egz2007IIsem, chemia w nauce i gospodarce Uł, Semestr II, Egzamin sem II chem
Program kursu ch.og.-cw wer. II, Biotechnologia, SEMESTR 1, Chemia ogólna
chemia fiz spr połączone, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od ol
chemia fizyczna ps, Studia, Mibm, semestr II, Chemia Fizyczna, !chemia fiz
więcej podobnych podstron