Nr ćwicz.: 10 i 11 |
Data: 20.04.2011 |
Imię i nazwisko:
|
Wydział: Technologia chemiczna Kierunek: Technologia Chemiczna |
Semestr: II |
Prowadzący: Dr inż. Bogdan Wyrwas |
Przygotowanie: |
Wykonanie: |
Ocena: |
|
Temat: Reakcje utleniania i redukcji
Wstęp teoretyczny:
Utleniacz to pierwiastek lub związek chemiczny, będący w analizowanej reakcji redoks akceptorem (przyjmującym) elektronów. Utleniacze w reakcjach zmniejszają swój stopień utlenienia i jednocześnie powodują jego wzrost w pozostałych produktach reakcji.
Reduktor to pierwiastek lub związek chemiczny będący w analizowanej reakcji redoks donorem (dostarczycielem) elektronów. Reduktory w reakcjach zwiększają swój stopień utlenienia i jednocześnie powodują jego zmniejszenie w pozostałych produktach reakcji.
Utlenianie to reakcja chemiczna, w której jakiś atom (lub ich grupa) przechodzi z niższego na wyższy stopień utlenienia (oddaje elektrony).
Np.:
CH3CH2OH + O2 → CH3COOH + H2O
(C przechodzi z -I do +III, a tlen z 0 do -II).
Redukcja to proces, w trakcie którego atom lub ich grupa przechodzi z wyższego na niższy stopień utlenienia.
Np.:
Fe2O3 + 3CO → 2Fe + 3CO2
(Fe przechodzi z +III do 0, a C z +II do +I)
Szereg napięciowy metali to zestawienie pierwiastków chemicznych o własnościach metalicznych, według ich potencjału standardowego E0. Punktem odniesienia dla tego zestawienia jest elektroda wodorowa, której potencjał standardowy przyjmuje się umownie za zero.
Praktyczne znaczenie szeregu napięciowego metali wynika z faktu, że metal bardziej aktywny wypiera (poza niektórymi wyjątkami) metal mniej aktywny z roztworu jego soli, zaś dobrą miarą aktywności chemicznej metali jest ich potencjał standardowy.
Szereg ważniejszych metali uporządkowany w kierunku wzrostu potencjału i zarazem spadku aktywności do tworzenia kationów:
Li K Na Ca Mg Al Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Ag Hg Pt Au
Równanie Nernsta to podstawowa zależność elektrochemiczna wyrażająca równowagowy potencjał elektrody (E) względem jej potencjału standardowego (E0) i stężenia substancji biorących udział w procesie elektrodowym.
Równanie ogólne ma następująca postać:
lub dla temperatury 298 K i rozcieńczonych roztworów, przy założeniu, że współczynnik aktywności jonów jest równy 1, równanie przyjmuje postać:
gdzie:
[red] - stężenie molowe formy zredukowanej
[ox] - stężenie molowe formy utlenionej
Stopniem utlenienia pierwiastka nazywamy, wchodzącego w skład określonej substancji nazywamy liczbę dodatnich lub ujemnych ładunków elementarnych, które przypisalibyśmy atomom tego pierwiastka, gdyby cząsteczki tej substancji miały budowę jonową. Ze stopniem utlenienia są związane pewne reguły:
Suma stopni utlenienia wszystkich atomów wchodzących w skład cząsteczki obojętnej wynosi zero, natomiast wchodzących w skład jonu jest równa wartościowości jonu.
Pierwiastki w stanie wolnym mają przypisany stopień utlenienia 0.
Fluor we wszystkich swych połączeniach występuje na -1 stopniu utlenienia.
Tlen w większości swych połączeń występuje na -2 stopniu utlenienia. Wyjątek stanowią nadtlenki np. MgO2, gdzie jest na -1 stopniu utlenienia. W ponadtlenkach tlen występuje na -1/2 stopniu utlenienia np. w Na2O. W OF2 tlen z kolei występuje na +2 stopniu utlenienia.
Wodór przyjmuje w swych związkach +1 stopień utlenienia. Wyjątek stanowią wodorki litowców i berylowców, gdzie stopień utlenienia wodoru jest równy -1.
Stopień utlenienia podaje się jako liczbę arabską ze znakiem + lub - umieszczoną za nazwą lub symbolem pierwiastka. Czasem też oznaczenia stopnia utlenienia umieszcza się nad symbolami chemicznymi.
Moc utleniacza i reduktora:
Najsilniejsze działanie utleniające wykazują jony metali o najwyższych potencjałach normalnych: Au+, Au3+, Pt2+itd.
Najsilniejszymi środkami redukującymi są metale położone na początku szeregu napięciowego, wykazujące najbardziej ujemne potencjały normalne: Li, Rb, K, Cs, Ba itd.
Ważniejsze utleniacze: nadmanganian potasu, nadsiarczan amonowy, dwuchromian i chromian potasowy lub sodowy, nadtlenek wodoru, podchloryn sodowy, bram, jod, chloramina T, nadjodan potasowy.
Potencjał normalny-jest to potencjał występujący na granicy faz metal-roztwór, w którym aktywność jonów wynosi 1 ,a temp.298 K. Przyjęto , że potencjał normalny elektrody wodorowej jest równy 0, a przy tym założeniu można określić potencjał każdego układu w stosunku do elektrody wodorowej.
* W wielu reakcjach redoks biorą udział jony H+ i OH-, np.:
Reakcje te można przedstawić wzorami ogólnymi:
Po zastosowaniu wzoru Nernsta i przyjęciu, że w warunkach analitycznych
, otrzymujemy:
Gdy reakcja redoks przebiega z udziałem jonów wodorowych, zmniejszenie pH, czyli zwiększenie kwasowości środowiska, zwiększa potencjał utleniający układu.
Dla drugiego równania:
W przypadku reakcji redoks, w których biorą udział jony OH-, potencjał redoks układu wzrasta w miarę wzrostu pH, układ jest zatem silniejszym utleniaczem w środowiskach bardziej alkalicznych.
Potencjałem standardowym nazywamy potencjał układu, w którym wszystkie substraty i produkt reakcji połówkowej mają aktywność równą jedności. Jest to wielkość termodynamiczna, które nie charakteryzuje układu istniejącego w określonym środowisku. Na wielkość tego potencjału wpływają kwasowość roztworu i czynniki kompleksujące.
Formalny (rzeczywisty) potencjał redoks określa potencjał układu, w którym stosunek analitycznych stężeń substratów i produktów reakcji połówkowej jest równy 1.00, a stężenia molowe innych składników roztworu są wyraźnie określone. Tylko na podstawie formalnych potencjałów redoks można przewidywać przebieg reakcji redoks w określonych roztworach.
Amfoterami redoks nazywamy substancje, które w zależności od środowiska mogą zachowywać się jak utleniacze, lub jak reduktory (np. MnO2, MnO42-, Br2, H2O2), np.:
Poliutleniaczami nazywamy substancje, które mogą ulegać wielokrotnej redukcji (np. MnO4-- MnO42-- MnO2-Mn2+).
Obserwacje i reakcje:
Utlenianie i redukcja część I
1.1
Redukcja przez metale (cementacja)
blaszka miedziowa
Cu + Hg2+→Cu2+ + Hg powstaje czarny osad
reduktor Cu0 → Cu2+ + 2e
utleniacz Hg2+ - 2e→Hg0
2Cu + Hg22+ → 2Cu2+ + 2Hg powstaje srebrny osad
reduktor Cu0 - 2e→ Cu2+
utleniacz Hg22+ + 4e→2Hg0
Cu + 2Ag+ →Cu2+ + 2Ag powstaje brązowy osad
reduktor Cu0 - 2e →Cu2+
utleniacz Ag + e →Ag0 /∙2
Cu + Cu2+ - reakcja nie zachodzi
Cu + Zn2+ - reakcja nie zachodzi
-Cu + Bi3+ - reakcja nie zachodzi
blaszka cynowa
Sn + Hg2+ → Sn2++ Hg powstaje czarny osad
Sn0 → Sn2+ + 2e
Hg2+ + 2e → Hg0
2Sn + Hg22+ → 2Sn2+ + 2Hg powstaje biały osad
Sn0 → Sn2+ + 2e
Hg22+ + 4e → 2Hg
Sn + 2Ag+ → Sn2+ + 2Ag postaje różowy osad
Sn0 → Sn2+ + 2e
Ag+ + e → Ag0 /∙2
Sn + Cu2+ → Sn2+ + Cu bez zmian
Sn0 → Sn2+ + 2e
Cu2+ + 2e → Cu0
Sn + Zn2+ - reakcja nie zachodzi
3Sn + 2Bi3+ → 3Sn2+ + 2Bi powstał jasnoróżowy osad
Sn0 - 2e → Sn2+ / ∙3
Bi3+ + 3e → Bi0 / ∙2
blaszka glinowa
2Al + 3Hg2+ →2Al3+ + 3Hg powstaje czarny osad
Al0 - 3e → Al3+ / ∙3
Hg2+ + 2e → Hg0 / ∙2
2Al + 3Hg2+ → 2Al3+ + 6Hg powstaje srebrny osad
Al0 → Al3+ + 3e / ∙2
Hg22+ + 2e → 2Hg / ∙3
2Al +3 Zn2+ → nie zachodzi
Al + 3Ag+ → Al3+ + 3Ag powstaje brązowy osad
Al0 - 3e → Al3+
Ag+ + e → Ag0 / ∙
Al + Cu2+ → 2Al3+ + 3Cu powstaje różowy osad
Al0 → Al3+ + 3e / ∙2
Cu2+ + 2e → Cu0 / ∙3
Al + Bi3+ → Al3+ + Bi brak zmian
Al0 → Al3+ + 3e
Bi3+ + 3e- → Bi0
Własności utleniające jonów wodorowych
1.2.1
Fe + 2HCl → 2FeCl2 + H2 reakcja zachodzi gwałtownie po podgrzaniu, barwa żółta roztworu
Fe0→ Fe2+ + 2e
2H+ + 2e- → H20
2Al + 6HCl → 2AlCl3 + 3H2 reakcja zachodzi wolno, po podgrzaniu- gwałtownie, srebrzysta barwa roztworu
Al0 → Al3+ + 3e / ∙2
H+ + 2e → H20 / ∙3
Mg + 2HCl → MgCl2 + H2 szybki przebieg reakcji, nie wymaga podgrzania
Mg0 - 2e → Mg2+
2H+ + 2e → H20
Zn + HCl → ZnCl2 + H2 reakcja zachodzi, nie wymaga podgrzania
Zn0 → Zn2+ + 2e
2H+ + 2e → H20
1.2.2
2Fe + 6NaOH + 6H2O → 2Na3[Fe(OH)6] + 3H2 reakcja zachodzi po podgrzaniu
Fe0 → Fe3+ + 3e / ∙2
2H+ + 2e → H20/ ∙3
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 reakcja zachodzi, nie wymaga podgrzania, a po podgrzaniu zachodzi szybciej i roztwór mętnieje
Al0 → Al3+ + 3e / ∙2
2H+ + 2e → H20/ ∙3
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + 3H2 reakcja zachodzi po podgrzaniu
Zn0 → Zn2+ + 2e
2H+ + 2e → H20
Mg + NaOH → reakcja nie zachodzi
1.3 Moc utleniaczy i reduktorów-przewidywanie reakcji redoks
1.3.1
Ciemnożółty roztwór odbarwia się - reakcja zachodzi
SO32- I2 + H2O→2 I- + SO42- + 2H+
S4+ → S6+ + 2e
I2 + 2e → 2 I-
1.3.2
Reakcja zachodzi, po dodaniu skrobi roztwór zabarwia się na fioletowo, co świadczy że w roztworze znajduje się jod.
2NaNO2 + 4HCl + 2KI → 2NO + I2 + 2NaCl + 2KCl + 2H2O
N3+ + e → N2+ / ∙2
2I- → I20 + 2e
1.4. Wpływ temperatury na kierunek reakcji redoks
1.4.1.
Roztwór odbarwia się, co świadczy o redukcji manganu
3H2SO4 + 2KMnO4 + 5C2O4(NH4) 2 → 2MnSO4 + K2SO4 + 10NH3 + 8H2O + 10CO2
10CIII -10e- → 10 CIV
2MnVII +10e- → 2MnII
1.4.3
Powstaje żółto-pomarańczowy roztwór, po dodaniu soli Pb2+ wytrąca się pomarańczowy, kłaczkowaty osad.
3H2O2 + 2Cr3+ → 2CrO4- + 6H2O
2O- + 2e → 2O-2 /∙3
Cr3+ - 3e → Cr+6 /∙2
Pb2+ +CrO42- →PbCrO4
1.4.4
Powstaje brązowy roztwór i opada osad ciemnobrunatny
5PbO2 + 4H+ + 2Mn2+ → 2MnO4- + 5Pb2+ + 2H2O
Mn+2 -5e → Mn+7 /∙2
Pb+4 +2e → Pb+2 /∙5
Utlenianie i redukcja część II
Zmiany pH podczas reakcji redoks.
1.1.1
oranż metylowy zmienia barwę z czerwonej na żółtą, co świadczy o zmianie odczynu z kwaśnego na obojętny:
6S2O32- + IO3- + 6H+ → 3S4O62- + I- + 3H2O
IV +6e → I-
3S2O32- -6e → S4O62-
Zachodzi reakcja utleniania jonów tiosiarczanowych jonami jodanowymi.
1.1.2
papierek uniwersalny zabarwia się na czerwono, co świadczy o kwaśnym odczynie roztworu
SO32- + I20 + H2O → 2HI + SO42-
S4+ -2e → S6+
I20 +2e → 2I-
Przewidywanie kierunku reakcji w zależności od pH
1.2.1
Po zmieszaniu nadtlenku wodoru, kwasu siarkowego i roztworu jodu obserwujemy pojawienie się brązowej barwy, wytrąca się czarny osad. Po zalkalizowaniu roztworu za pomocą 2M NH3aq roztwór jaśnieje i robi się pomarańczowy.
1.2.2
1) Roztwór jest bezbarwny:
2) Roztwór ma zieloną barwę:
3) Roztwór przybiera barwę żółtawą, pojawia się brązowy osad:
1.2.3
Barwa roztworu jest na początku rdzawa, po dodaniu skrobi roztwór przybiera barwę ciemnozieloną, co świadczy o wydzielaniu się jodu.
2I- + 2H+ + IO3- → I20 + IO2 + H2O
2I- - 2e → I20
I5+ + 2e → I3+
1.3 Dysproporcjonowanie pod wpływem pH
1.3.1
Roztwór ma początkowo barwę pomarańczową, która przechodzi po zmieszaniu roztworów w zieloną aż do bezbarwnej.
1.4 Wpływ pH na utlenianie chlorków
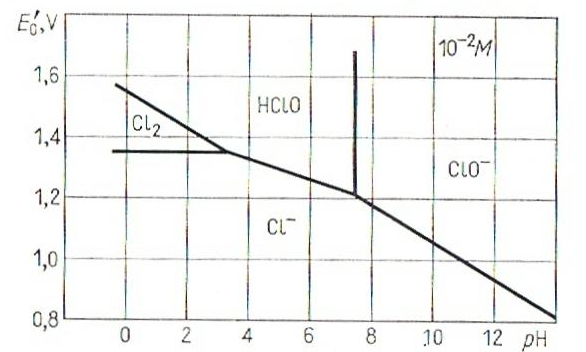
1.4.1
Następuje odbarwienie roztworu, papierek jodoskrobiowy zabarwia się na fioletowo, co świadczy o wydzielaniu się Cl2.
2MnO4- + 16H+ + 10Cl- → 5Cl20 + 2Mn2+ + 8H2O
2MnVII + 10e → 2Mn2+ + 8H2O
10Cl- → 5Cl20 + 10e
1.4.2
Papierek jodoskrobiowy zmienia barwę pod wpływem wydzielającego się Cl2. Powstaje ciemnobrązowy roztwór i wytrąca się czarny osad.
2Cl- + PbO2 + 2H+ → PbO + Cl2 + H2O
PbIV + 2e → PbII
2Cl- → Cl20 +2e
1.4.3
Obecność chloru potwierdzona papierkiem jodoskrobiowym
MnO2 + 2Cl- + 4H+ →Mn2+ + Cl2 + 2H2O
MnIV+2e → MnII
2Cl-→ Cl20 + 2e
L.p. |
utleniacz |
E utleniacza w środowisku |
obecność chloru w parach nad probówką |
||
|
|
Obojętnym |
Kwaśnym |
obojętne |
kwaśne |
1. |
KMnO4 |
+0.60 |
+1.70 |
nie |
tak |
2. |
PbO2 |
+1.45 |
+1.69 |
tak |
tak |
3. |
MnO2 |
+0,98 |
+1.23 |
nie |
tak |
Wnioski:
Na podstawie przeprowadzonych doświadczeń można stwierdzić, ze reakcje zaszły tylko tam, gdzie potencjał jonu utleniającego był większy od potencjału metalu. Metale o mniejszym potencjale normalnym wypierają wodór z kwasów. Wzrost temperatury przyśpiesza przebieg reakcji
Przebieg reakcji utleniania- redukcji uzależniony jest od odpowiedniego stężenia jonów OH- lub H+. Jony te także biorą udział w reakcji, przez co zmienia się ich stężenie w roztworze. W danym pH roztworu możemy przewidzieć jakie powstaną produkty np.: jony
redukują się w zależności od środowiska: w kwasowym do jonów Mn2+, w obojętnym do MnO2, a w zasadowym do
. W niektórych przypadkach reakcja nie zachodzi, co jest spowodowane zbyt małą różnicą między potencjałami utleniacza i reduktora, lub utleniacz ma niższy potencjał niż reduktor, przez co nie jest w stanie go utlenić. Możliwe są też reakcje dysproporcjonowania, w których dany związek ulega jednocześnie utlenieniu i redukcji, np.: jod I2 utlenia się do
jednocześnie redukując się do
.
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 5 - Reakcje utleniania i redukcji, Studia, Chemia
Ćw. 13 - rozdział przez ekstrakcję - sprawko, Chemia ogólna i nieorganiczna
Ćw. 12 - rozdział przez strącania - sprawko, Chemia ogólna i nieorganiczna
CHEM OG, cw 4, REAKCJE UTLENIANIA I REDUKCJI
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
instrukcja - REAKCJE UTLENIANIA I REDUKCJI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, l
Wyklad 4. Reakcje utleniajaco-redukcyjne, pwr biotechnologia(I stopień), I semestr, Chemia ogó
Walkowiak, Chemia ogólna, Reakcje utleniająco redukcyjne
Wykład 4. Reakcje utleniajaco-redukcyjne, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
W15S-Reakcje utlenienia-redukcji, chemia, szkolka
Chemia - Reakcje utleniania i redukcji, Reakcje utleniania i redukcji to są reakcje, w których pierw
W15 reakcje utlenienia redukcji
5 Reakcje utleniania i redukcji Reakcje w roztworach
06 Sprawozdanie z reakcji utleniania i redukcji Naprawiony
cw 10 11 S E Ch
3.Reakcje utleniania i redukcji, Notatki AWF, Biochemia
3.Reakcje utleniania i redukcji, Zad
więcej podobnych podstron