Zestaw 51.
Liazy - udział w metabolizmie.
Liazy - czwarta klasa enzymów odwracalnie lub nieodwracalnie katalizujących odszczepienie grup bez udziału wody, najczęściej tworząc wiązanie podwójne albo strukturę cykliczną. Różnią się od innych enzymów tym, że potrzebują jednego substratu, a w reakcji odwrotnej dwóch. Dzielą się na podklasy:
Liazy C-C:
- karboksy-liazy: Koenzymami dekarboksylaz są najczęściej: fosfopirydoksal, difosfotiamina, kwas liponowy, koenzym A, FAD, NAD+: dekarboksylaza pirogronianowa, dekarboksylaza L-aminokwasów aromatycznych (dekarb. DOPA)
- aldehydo-liazy: aldolaza
- liazy ketokwasów: liaza HMG-CoA
Liazy C-O:
- hydro-liazy: hydrataza fumarowa, hydrataza akonitanowa, anhydraza węglanowa, hydrataza enoilo-CoA, syntaza porfobilinogenu, syntaza uroporfobilinogenu III
Liazy C-N
Liazy C-S
Liazy C-X (halogenek)
Liazy P-O: cyklaza adenylanowa, cyklaza guanylowa
dekarboksylaza pirogronianowa - rozszczepia pirogronian na aldehyd octowy i CO2. Koenzymem jest pirofosforan tiaminy. Jest to pierwsza reakcja fermentacji alkoholowej.
dekarboksylaza DOPA - katalizuje dekarboksylację DOPA do dopaminy.
aldolaza - enzym cytozolowy katalizujący rozszczepienie fruktozo-1,6-bisfosforanu do fosfodihydroksyacetonu i aldehydu 3-fosfoglicerynowego. Substrat jest w formie łańcuchowej. Enzym składa się z 4 podjednostek. Występuje kilka jego rodzajów (najczęściej aldolaza A).
liaza 3-hydroksy-3-metyloglutaryloCoA - enzym występujący w wątrobie. Bierze udział w ketogenezie, rozszczepia HMG-CoA na acetooctan i acetylo-CoA.
akonitaza (hydrataza akonitanowa) - enzym cyklu Krebsa katalizujący izomeryzację cytrynianu do izocytrynianu poprzez pośredni związek cis-akonitan. Przemiana zachodzi w 2 etapach: najpierw jest dehydratacja (do cis-akonitanu), następnie rehydratacja. Enzym zawiera jon Fe2+ w formie białka żelazo-siarkowego.
fumaraza (hydrataza fumarowa) - enzym cyklu Krebsa, katalizujący uwodnienie fumaranu do L-jabłczanu.
anhydraza węglanowa (dehydrataza węglanowa) - katalizuje reakcję:
CO2 + H2O <------> H2CO3
reakcja zachodzi w prawo w tkankach, a w lewo w płucach i nefronach. Anhydraza jest metaloenzymem (w centrum katalitycznym znajduje się cynk).
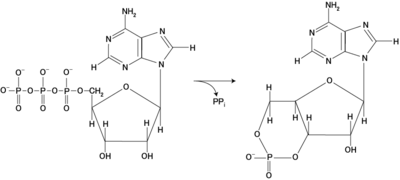
cyklaza adenylanowa - katalizuje konwersję ATP do 3',5'-cyklicznego AMP, wtórnego przekaźnika.
Regulacja glukoneogenezy.
Regulacji podlegają zasadniczo enzymy: karboksylaza pirogronianowa, karboksykinaza fosfoenolopirogronianowa, fruktozo-1,6-bisfosfataza. Może zachodzić wg trzech mechanizów: zmiany szybkości syntezy enzymów, kowalencyjnej modyfikacji enzymu przez odwracalną fosforylację i efekty allosteryczne.
Enzymy glukoneogenezy wykazują dużą aktywność przy braku glukozy. Glikokortykosteroidy, hormon adrenokortykotropowy (ACTH), hormon wzrostu (GH), hormony tarczycy, adrenalina i glukagon wzmagający wydzielanie cAMP pobudzają te enzymy, insulina przeciwdziała temu wpływowi. Przeciwstawna jest regulacja glikolizy, aby nie zachodziły tzw. cykle daremne, w wyniku których zużywane byłoby ATP. Indukcja i represja głównych enzymów następuje w ciągu kilku godzin.
Karboksylaza pirogronianowa wymaga obecności acetylo-CoA jako aktywatora allosterycznego. Acetylo-CoA powoduje zmianę IV-rzędowej struktury białka, zmniejszając Km dla wodorowęglanu (substratu). Jest także hamowana przez duże stężenie ADP.
Karboksykinaza fosfoenolopirogronianowa jest hamowana przez duże stężenie ADP.
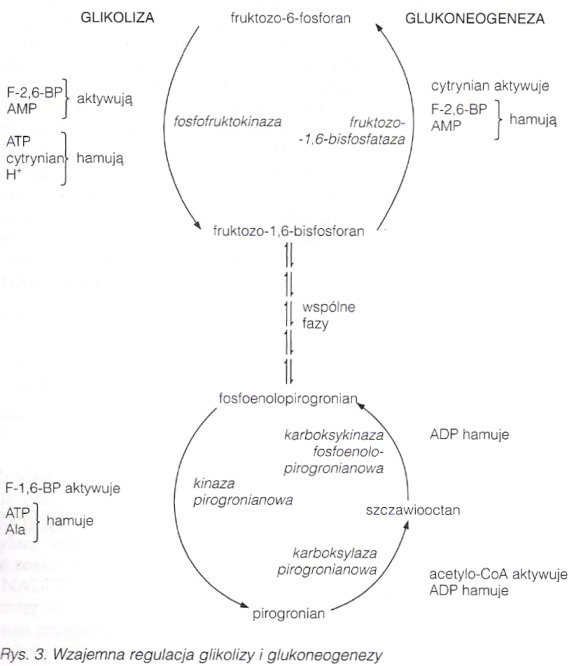
Inhibitorem fruktozo-1,6-bisfosfatazy jest fruktozo-2,6-bisfosforan. Powoduje on zwiększenie wartości Km tego enzymu dla fruktozo-1,6-fosforanu. Fruktozo-2,6-bisfosforan powstaje przez fosforylację fruktozo-6-fosforanu działaniem fosfofruktokinazy-2. Ten enzym ma także właściwość fruktozo-2,6-bisfosfatazy. Jest on kontrolowany allosterycznie przez fruktozo-6-fosforan. Po posiłku, gdy jest dużo glukozy, występuje podwyższone stężenie fruktozo-6-fosforanu - to powoduje aktywność kinazy, a zahamowanie fosfatazy (nie zachodzi wówczas glukoneogeneza). Kontrola przez fosforylację występuje w przypadku niedoboru glukozy, gdy glukagon pobudza wytwarzanie cAMP, co aktywuje kinazę białek zależną od cAMP - ta fosforyluje fosfofruktokinazę-2 (inaktywując ją), a aktywuje fruktozo-2,6-bisfosfatazę. Jeszcze raz - w warunkach niedoboru glukozy, glukoneogeneza jest pobudzana przez zmniejszenie stężenia fruktozo-2,6-bisfosforanu, który inaktywuje fosfofruktokinazę-1 (enzym glikolizy) oraz znosi hamowanie fruktozo-1,6-bisfosfatazy. Enzym jest także hamowany przez duże stężenie AMP, a aktywowany przez duże stężenie cytrynianu.
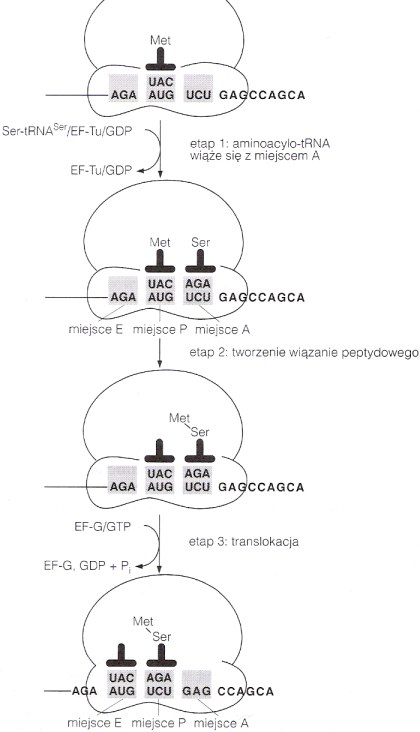
Rola tRNA w biosyntezie łańcuchów polipeptydowych.
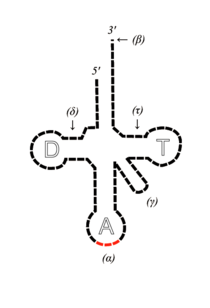
tRNA - transferowy RNA, złożony z około 75 nukleotydów, wytwarzany przez jądrową obróbkę cząsteczki prekursorowej. Komórka posiada przynajmniej 20 różnych tRNA, różnią się nukleotydami w antykodonie i tym, że wiążą się ze specyficznym dla siebie aminokwasem, co wymaga również obecności przynajmniej 20 enzymów, tzw. syntetaz aminoacylo-tRNA. Dzięki nim aminokwas ulega aktywacji i przeniesieniu na tRNA: w pierwszym etapie reakcji aa reaguje z enzymem i z ATP, uwalnia się PPi i tworzy się kompleks aminoacylo-AMP-enzym, kompleks ów rozpoznaje następnie swoisty tRNA i przenosi resztę aminoacylową na koniec 3`-hydroksylowej adenozyny ramienia akceptorowego o końcowej sekwencji CCA (5`->3`) - tworzy się wysokoenergetyczne wiązanie estrowe. Ramię DHU (ma dihydrourydynę) - decyduje o tym jaki rodzaj aa może być przyłączony do danego tRNA (rozpoznaje je odpowiednia syntetaza). Ramię TψC (sekwencja T-pseudourydyna-C) przytwierdza tRNA do rybosomu. Region antykodonowy składa się z 7 nukleotydów (3`-dowolna zmodyfikowana Puryna - XYZ - Pirymidyna - Pirymidyna-5`) i jest rozpoznawany przez 3-literowy kodon mRNA Kierunek odczytu antykodonu jest 3`->5`, podczas gdy kod genetyczny czytany jest 5`->3` co oznacza, że kodon mRNA i pętla antykodonu są przeciwrównoległe pod względem komplementarności. Ze względu na degenerację kodu genetycznego, niektóre kodony kodują ten sam aa. Hipoteza tolerancji mówi o tym, że degeneracja dotyczy głównie trzeciego nukleotydu i jego parowanie z antykodonem jest mało precyzyjne.
Pierwszym kodonem ulegającym translacji jest AUG kodujący metioninę, jednakże występują dwa różne rodzaje tRNA dostarczające metioniny: inicjatorowy tRNA - tRNAfMet (dostarcza N-formylometioniny) oraz tRNAmMet dla wewnętrznych kodonów AUG.
tRNA wiąże się w trzech miejscach z rybosomem: miejsce A - tu w trakcie elongacji wiąże się nowo wchodzący aminoacylo-tRNA, miejsce P - tu zostaje związany tRNA z przyłączonym rosnącym łańcuchem polipeptydowym oraz miejsce E - rejon wiązania tRNA, który wykonał już swoją funkcję i będzie uwolniony z rybosomu.
fMet-tRNAfMet wchodzi w skład kompleksu preinicjacyjnego po czym kolejne czynniki inicjacyjne katalizują ostateczne powstanie kompleksu inicjującego, w którym tenże pierwszy aminoacylo-tRNA znajduje się od razu w miejscu P (pozostałe aminoacylo-tRNA łączą się w miejscu A). Elongacja obejmuje wiązanie aminoacylo-tRNA, utworzenie wiązania peptydowego i translokację. Nowy aminoacylo-tRNA przyłączany jest w miejsce A. Peptydylotransferaza katalizuje przeniesienie aminokwasu z miejsca P na aminokwas w miejscu A. Następnie translokaza katalizuje translokację deacylowanego tRNA z miejsca P do E, peptydylo-tRNA z miejsca A na miejsce P a rybosom przesuwa się wzdłuż mRNA o kolejne trzy nukleotydy. Deacylowany tRNA uwalnia się z miejsca E zanim wejdzie nowy aminoacylo-tRNA w miejsce A. Itd aż do kodonu „stop” (UAG, UAA lub UGA), który świadczy o zakończeniu procesu translacji. Odpowiednie czynniki uwalniające zmuszają peptydylotransferazę do przerzucenia reszty peptydylowej na cząsteczkę wody. Polipeptyd, mRNA i wolne tRNA opuszczają rybosom, który potem dysocjuje na podjednostki.
Zatem zadaniem tRNA jest przyłączenie wolnego, określonego aminokwasu w cytoplazmie, jego transport do rybosomu, rozpoznanie konkretnego kodonu i włączanie aminokwasu w nowo rosnący łańcuch polipeptydowy.
2
Wyszukiwarka
Podobne podstrony:
Zestaw 54 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 50 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 52 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 53 Hanka Cywińska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracow
Zestaw 88 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
ZESTAW 5 Ania Piecuch, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowani
zestaw 97 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
zestaw 1 Ania Piecuch, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowani
zestaw 96 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 94 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 90 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 91 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
ZESTAW 47 Kasia Gawęda, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowan
Zestaw 89 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
Zestaw 93 Przemek Pepliński, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
zestaw 87 Kasia Goszczyńska, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opra
ZESTAW 39 Kasia Gaweda, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowan
Zestaw 2 Ania Piecuch, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowani
ZESTAW 40 Kasia Gaweda, materiały farmacja, Materiały 3 rok, Od Ani, biochemia, biochemia, opracowan
więcej podobnych podstron