UKŁADY RÓWNOWAGI FAZOWEJ
Pojęcia podstawowe
Przebieg przemian zachodzących podczas analizy termicznej czystych metali jest prosty. W określonych temperaturach krytycznych następują tylko zmiany stanu skupienia lub przemiany alotropowe w stanie stałym, czemu odpowiadają na krzywych chłodzenia czy też nagrzewania przystanki temperatur.
Inaczej jest w przypadku stopów. Przemiany zachodzące w tego rodzaju układach wieloskładnikowych są bardziej złożone i przedstawia się je graficznie na wykresach układów równowagi fazowej, zwanych krótko układami równowagi. Ilustrują one całokształt przemian zachodzących w stopach zarówno w stanie ciekłym, jak i w stanie stałym, w zależności od temperatury i składu chemicznego. Można za ich pomocą ustalić, jakie przemiany zachodzą w stopach o określonym składzie chemicznym podczas nagrzewania czy też chłodzenia i jaką strukturę otrzymuje się w wyniku tych przemian. Ponadto z wykresów układów równowagi fazowej można odczytać, z jakich faz składa się stop o określonym składzie w określonej temperaturze oraz ustalić ich liczbę. Układy te dlatego zwane są układami równowagi, ponieważ przedstawiają trwałe stany stopów, odpowiadające w danych warunkach najmniejszemu zapasowi energii swobodnej układu, a w praktyce otrzymywane przez bardzo wolne nagrzewanie czy też chłodzenie. Pomocą przy konstrukcji wykresów układów równowagi oraz sprawdzianem prawidłowego ich wykonania jest reguła faz Gibbsa, dająca jakościową charakterystykę układów wielofazowych w stanie równowagi. Na podstawie reguły faz można przewidzieć, czy przemiany zachodzą w stałej temperaturze, czy też w zakresie temperatur, oraz ile faz może równocześnie występować w stanie równowagi.
Podstawowymi pojęciami, którymi operuje się przy omawianiu układów równowagi, a które już były używane bez podania ich właściwego znaczenia, są: układ, faza, składnik i stopnie swobody. Wyodrębnioną z otoczenia grupę ciał, będącą przedmiotem badania, nazywamy układem; będzie więc układem np. stop metaliczny, w którym badamy przemiany zachodzące przy nagrzewaniu czy też chłodzeniu. Faza jest jednorodną częścią układu o jednakowych właściwościach fizycznych i jednakowym składzie chemicznym, oddzielona powierzchnią rozdziału od pozostałych części układu. Stop dwu metali nie rozpuszczających się w sobie w stanie stałym, np. żelaza i ołowiu, będzie się składał po zakrzepnięciu z dwu faz: kryształów ołowiu i żelaza. Natomiast stop dwu metali rozpuszczających się nieograniczenie w stanie ciekłym po stopieniu stanowi tylko jedną fazę, tj. ciekły roztwór tych metali. Wszystkie cząstki tej samej substancji, tworzące zawiesinę, uważa się za jedną fazę, pomimo że są oddzielone od siebie powierzchniami rozdziału, gdyż nie różnią się między sobą właściwościami. Składnikami nazywamy substancje proste lub złożone, z których w odpowiednich warunkach mogą powstać wszystkie fazy danego układu. Składnikami mogą być pierwiastki albo związki chemiczne. Niemożliwa jest przemiana jednego składnika w drugi, natomiast poszczególne składniki mogą przechodzić z jednej fazy do drugiej. Związki chemiczne można uważać za składniki jedynie wtedy, gdy nie rozpadają się w rozpatrywanym zakresie temperatur. Jest rzeczą istotną wyraźne rozróżnienie pojęcia składnika i fazy (np. czysty metal w temperaturze topnienia jest układem jednoskładnikowym, lecz składa się z dwu faz, tj. kryształów i cieczy). Brąz jest stopem złożonym z dwu składników: z miedzi i cyny, a po stopieniu składa się z jednej fazy ciekłego roztworu obu tych składników.
Stan układu zależy od temperatury i ciśnienia oraz składu chemicznego poszczególnych faz, przy czym wielkości te są zmienne. Liczbą stopni swobody układu nazywamy tę liczbę zmiennych czynników niezależnych, które można zmieniać dowolnie, niezależnie od siebie, bez spowodowania zmiany liczby faz układu. Chemicznie jednorodny gaz doskonały ma trzy zmienne: ciśnienie, temperaturę i objętość. Tylko dwie jednak z nich mogą zmieniać się niezależnie, ponieważ równanie stanu gazu doskonałego wiąże je z trzecią zmienną (np. przy określonym ciśnieniu i w określonej temperaturze określona jest objętość gazu). Układ więc, jakim jest gaz doskonały, ma dwie zmienne niezależne, czyli dwa stopnie swobody. W przypadku układu jednoskładnikowego, złożonego z dwu faz (np. woda i para wodna), stan układu zależy od dwu zmiennych, ciśnienia i temperatury. Tylko jedna z tych zmiennych może się zmieniać niezależnie, np. woda może znajdować się w równowadze z parą wodną o określonym ciśnieniu tylko w określonej temperaturze. Układ ma więc jedną zmienną niezależną, tj. jeden stopień swobody. Współistnienie trzech faz w układzie jednoskładnikowym, np. wody, lodu i pary, jest możliwe tylko przy określonym ciśnieniu i w określonej temperaturze. Układ jest więc niezmienny i nie ma żadnego stopnia swobody. W układach wieloskładnikowych przybywają nowe zmienne — stężenia składników w poszczególnych fazach.
Reguła faz
Reguła faz podaje liczbową zależność pomiędzy liczbą składników n, liczbą faz współistniejących ze sobą w stanie równowagi / oraz liczbą stopni swobody s. Została ona wyprowadzona przez J. W. Gibbsa w 1876 r.
Przy wyprowadzeniu reguły faz można się posłużyć analogią do układu równań algebraicznych, w którym liczba zmiennych niezależnych jest równa różnicy między liczbą wszystkich zmiennych występujących w równaniach a liczbą wiążących je równań. Te zmienne niezależne mogą być odpowiednikiem stopni swobody układu, a ogólna liczba zmiennych odpowiada liczbie wszystkich zmiennych czynników wpływających na stan całego układu. Czynnikami tymi są temperatura i ciśnienie, jednakowe we wszystkich częściach układu, oraz stężenia składników w każdej fazie.
Załóżmy, że układ składa się z n składników tworzących w stanie równowagi f faz, przy czym wszystkie składniki wchodzą w skład każdej fazy układu. W tym przypadku w każdej fazie mamy n zmiennych określających jej skład chemiczny. Oznaczamy symbolami x\, x'2, x'3, ..., x'n stężenia wszystkich n składników w fazie pierwszej (indeks u góry przy x oznacza fazę pierwszą). Podobnie oznaczyć można stężenie składników w fazie drugiej, trzeciej itd., aż do fazy f. Zestawienie zmiennych charakteryzujących skład poszczególnych faz jest następujące:
|
|
|
... , |
|
— |
faza 1, |
|
|
|
|
|
|
|
|
|
|
... , |
|
— |
faza 2, |
· · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · |
||||||
|
|
|
... , |
|
— |
faza |
|
|
|
|
|
|
|
|
|
|
... , |
|
— |
faza |
Zgodnie z przyjętymi oznaczeniami w szeregach poziomych mamy podane składy poszczególnych faz, od fazy pierwszej aż do fazy /, a w szeregach pionowych stężenie poszczególnych składników we wszystkich fazach układu, a więc np. pierwszy szereg pionowy reprezentuje składnik pierwszy, a ostatni szereg pionowy reprezentuje n-ty składnik. Ogólna więc liczba zmiennych układu, włączając w to dwie zmienne czynników zewnętrznych, tj. ciśnienie i temperaturę, wynosi:
![]()
.
Określimy teraz liczbę równań łączących te zmienne. Jeżeli literą M' oznaczymy masę fazy pierwszej, a masy wchodzących w jej skład składników symbolami ![]()
, ![]()
, ![]()
, ... ![]()
, to
![]()
lub
![]()
Lewa część równania przedstawia stężenie poszczególnych składników układu w pierwszej fazie, gdyż
![]()
wobec czego można napisać
![]()
Podobne równanie można również napisać dla pozostałych faz układu. Jeśli więc w rozpatrywanym układzie współistnieje ze sobą w stanie równowagi f faz, to można utworzyć f analogicznych równań. Ze względu na to, że wszystkie fazy danego układu znajdują się w stanie równowagi, stosunek stężenia każdego składnika w dwu fazach jest wielkością stałą, np.
![]()
Na podstawie tego warunku dla każdego składnika wchodzącego w skład f faz można napisać ![]()
analogicznych równań, co dla układu o n składnikach daje liczbę równań:
![]()
więc liczba wszystkich równań wiążących zmienne układu będzie wynosić:
![]()
Wszystkie ![]()
zmienne układu związane są ![]()
liczbą równań.
Liczbę zmiennych niezależnych, tj. liczbę stopni swobody układu, otrzymujemy odejmując od liczby zmiennych liczbę wiążących je równań. Liczba stopni swobody układu wynosi więc
![]()
stąd
![]()
.
Ta ostatnia zależność jest matematycznym ujęciem reguły faz. Przy rozważaniu układów metalicznych zakładamy ciśnienie stałe; wpływ małych zresztą zmian ciśnienia na przebieg przemian fazowych w metalach jest nieznaczny. Z tego względu ogólna liczba zmiennych zmniejszy się o jeden i reguła faz przybierze w tym przypadku postać:
![]()
Z podanego wzoru wynika, że dla układu niezmiennego ![]()
![]()
.
W tym przypadku żaden z czynników wpływających na stan układu nie może ulec zmianie bez naruszenia liczby faz układu.
Rozpatrzmy zastosowanie reguły faz do układu jednoskładnikowego, jakim jest czysty metal. W przypadku gdy czysty metal znajduje się w stanie ciekłym czy też w stanie stałym, układ składa się tylko z jednej fazy (f = 1) i liczba stopni swobody układu wynosi 1. Istotnie, w zakresie powyżej czy też poniżej temperatury topnienia można temperaturę układu zmieniać, a będzie się on składał z jednej tylko fazy, tj. ciekłego lub zakrzepniętego metalu. W momencie krystalizacji współistnieją ze sobą dwie fazy, tj. kryształy i ciecz (f = 2). Układ jest wówczas niezmienny i nie ma żadnego stopnia swobody (s = 0). Oznacza to, że w układzie jednoskładnikowym dwie fazy mogą istnieć w równowadze tylko w ściśle określonej temperaturze i nie może się ona zmieniać, gdyż jedna z faz zniknie. Wówczas układ mieć będzie znowu jeden stopień swobody.
Konstrukcja wykresu układu równowagi stopów dwuskładnikowych
Układ równowagi stopów dwuskładnikowych zwanych stopami podwójnymi może być przedstawiony wykreślnie na płaszczyźnie, jak to przedstawia rys. 6.1. Na poziomym odcinku AB odczytuje się skład chemiczny stopu, wyrażony w procentach wagowych. Punkty końcowe A i B odpowiadają 100%-owym zawartościom składników A i B w stopie, tj. punkt A oznacza czysty składnik A, a punkt B czysty składnik B. Każdemu punktowi w obrębie odcinka A B odpowiada stop obu tych składników o określonym składzie chemicznym. Zawartość procentowa składnika A wzrasta od punktu B w lewo, tj. od 0% składnika A w punkcie B do 100% w punkcie A, jak to zaznaczono strzałką na rys. 6.1. Podobnie zawartość procentowa składnika B wzrasta w prawo od 0% w punkcie A do 100% w punkcie B, co również zaznaczono strzałką. Skład chemiczny w punkcie x wynosi więc Ax% składnika B oraz Bx% składnika A. Sumaryczna zawartość tych składników musi wynosić oczywiście 100%. Z tego względu wystarczy, aby skala procentowa odpowiadała tylko zawartości jednego ze składników stopu, w tym przypadku zawartość składnika B. Zawartość drugiego składnika, tj. A, odczytuje się jako dopełnienie do 100%. W rzeczywistych układach zamiast hipotetycznych składników A oraz B występują metale wchodzące w skład stopu. Temperaturę odczytuje się na osi rzędnych.
Rys. 6.1. Zasada konstrukcji wykresu układu równowagi fazowej stopów dwuskładnikowych
Każdemu punktowi na wykresie odpowiada stop o określonym składzie chemicznym, znajdujący się w określonej temperaturze. Dla odczytania składu chemicznego stopu trzeba go zrzutować pionowo na podstawę wykresu, tj. na odcinek AB. Stop określony punktem M na rys. 6.1 zawiera 60% składnika A oraz 40% składnika B i znajduje się w temperaturze t1. Stop o składzie punktu W jest czystym metalem B, znajdującym się w temperaturze t2. Wszystkie stopy leżące na jednej linii pionowej mają oczywiście ten sam skład chemiczny, a wszystkie stopy leżące na tej samej linii poziomej znajdują się w tej samej temperaturze. W następnych punktach będą rozważone różne rodzaje podstawowych układów równowagi, których charakter zależy od sposobu wzajemnego oddziaływania obu składników stopu. Są to układy hipotetyczne, które w rzeczywistości (poza pewnymi wyjątkami) nie występują. Występujące w praktyce układy równowagi są z reguły bardziej złożone. Dopiero dokładne poznanie tych podstawowych układów pozwoli na prawidłową analizę układów rzeczywistych.
Nieograniczona rozpuszczalność w stanie stałym (roztwory stałe ciągłe)
Metale, których wzajemna rozpuszczalność zarówno w stanie ciekłym jak i stałym jest nieograniczona, tworzą po stopieniu jednorodny roztwór ciekły, a w stanie stałym jednorodne kryształy roztworu stałego.
W celu sporządzenia wykresu układu równowagi fazowej trzeba przeprowadzić analizę termiczną szeregu stopów o różnym stosunku wagowym obu metali, polegającą na wykreśleniu krzywych chłodzenia czy też nagrzewania. Im więcej stopów zostanie przebadanych, tym dokładniej ustalić można przebieg poszczególnych linii wykresu. Weźmy np. miedź i nikiel oraz kilka stopów tych metali o odpowiednio wzrastającej zawartości miedzi, a mianowicie:
stop I |
— |
75% Ni i 25% Cu, |
stop II |
— |
50% Ni i 50% Cu, |
stop III |
— |
25% Ni i 75% Cu. |
Uzyskane na drodze analizy termicznej krzywe chłodzenia zarówno dla obu czystych metali, jak i dla ich stopów pokazano na rys. 6.2. Na krzywych chłodzenia czystych składników, tj. niklu i miedzi, występują tylko przystanki w temperaturach 1455°C (1-1') oraz 1083°C (8-8'), odpowiadające krzepnięciu tych metali. Stopy Ni-Cu krzepną natomiast nie w stałej temperaturze, lecz w pewnym zakresie temperatur, czemu na krzywych chłodzenia odpowiadają dwa punkty załamania z wybrzuszeniem pomiędzy nimi. Pierwszy punkt oznacza początek krzepnięcia, drugi zaś zakończenie krzepnięcia. Wybrzuszenie powstaje w wyniku wydzielania się utajonego ciepła krzepnięcia. Z porównania przebiegu krzywych widać, że im większa jest w stopie zawartość metalu niżej topliwego, tj. miedzi, tym zakres temperatur krzepnięcia stopów jest niższy.
Rys. 6.2. Układ równowagi Ni-Cu z krzywymi chłodzenia
W celu narysowania na podstawie tych krzywych chłodzenia wykresu równowagi Ni-Cu należy na wykresie dwuskładnikowym wykreślić linie pionowe odpowiadające składom poszczególnych stopów i nanieść na nie uzyskane temperatury krytyczne, jak to przedstawiono na rys. 6.2. Tak więc na liniach pionowych oznaczających czyste metale nanosi się punkty 7 i 8, odpowiadające temperaturom ich krzepnięcia. Na linii pionowej stopu I nanosi się punkty 2 i 3 jako temperatury początku i końca krzepnięcia tego stopu; dla stopu II nanosi się punkty 4 i 5 i podobnie dla stopu III punkty 6 i 7. Łącząc liniami ciągłymi naniesione punkty, otrzymamy wykres układu równowagi stopów Ni-Cu. Krzywa 1-2-4-6-8, odpowiadająca początkowi krzepnięcia stopów nazywa się linią likwidus, a krzywa 1-3-5-7-8, oznaczająca zakończenie krzepnięcia, nazywa się linią solidus. Przez wykreślenie tych linii wykres rozpadł się na trzy pola. W polu powyżej linii likwidus występuje ciekły roztwór miedzi i niklu. Pomiędzy liniami likwidus i solidus współistnieją ze sobą dwie fazy, tj. roztwór ciekły i roztwór stały. Poniżej linii solidus występują tylko kryształy roztworu stałego.
Na rysunku 6.3 przedstawiono hipotetyczny układ równowagi dwu metali A-B, tworzących roztwór stały ciągły wraz z krzywą chłodzenia dla stopu I. Przy chłodzeniu tego stopu do temperatury punktu l stygnie tylko jednorodny ciekły roztwór i żadne przemiany w tym czasie nie zachodzą. Po osiągnięciu temperatury, w której pionowa reprezentująca stop przecina linię likwidus (punkt 1), z ciekłego roztworu zaczną się wydzielać kryształy roztworu stałego ![]()
, czemu na krzywej chłodzenia odpowiada punkt przegięcia. Skład chemiczny pierwszego wydzielonego kryształu otrzymamy kreśląc na wykresie równowagi z punktu 7 poziomą aż do przecięcia się z linią solidus w punkcie 2 i rzutując ten punkt na podstawę układu. W miarę obniżania temperatury, z cieczy, której skład chemiczny zmienia się wzdłuż linii likwidus, wydzielają się w dalszym ciągu kryształy roztworu stałego o zmieniającym się składzie chemicznym wzdłuż linii solidus w zakresie 2-3. Koniec krzepnięcia następuje w temperaturze, w której pionowa reprezentująca stop przecina linię solidus (w punkcie 3), czemu na krzywej chłodzenia odpowiada drugi punkt przegięcia. Skład chemiczny ostatniej kropli cieczy otrzymamy kreśląc z punktu 3 poziomą aż do przecięcia z linią likwidus (punkt 4). Przy dalszym chłodzeniu żadne przemiany już nie zachodzą. Jak wynika z układu równowagi, wydzielające się na początku krzepnięcia kryształy są bogatsze w składnik trudniej topliwy (metal B), niż wynosi średni skład stopu, wobec czego koncentracja składnika niżej topliwego (metal A) w ciekłym roztworze musi wzrastać. Zakładamy przy tym, że przebieg chłodzenia jest bardzo powolny i skład chemiczny wszystkich wydzielonych kryształów, jak i pozostałej cieczy, wyrównuje się w drodze dyfuzji, tak że poszczególne punkty linii solidus czy też likwidus wskazują skład chemiczny wszystkich wydzielonych kryształów lub pozostałej cieczy.
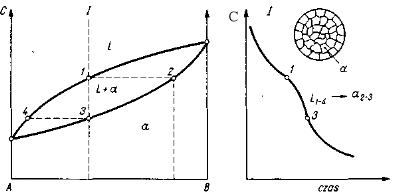
Rys. 6.3. Roztwory stałe ciągłe
W czasie krzepnięcia roztworów stałych ciągłych w każdej temperaturze istnieją w równowadze dwie fazy: roztwór ciekły i stały obu metali tworzących stop. Zgodnie z regułą faz układ ma podczas krzepnięcia jeden stopień swobody:
![]()
W określonej temperaturze występują w równowadze dwie fazy o określonym składzie chemicznym. Zmiana temperatury pociąga za sobą zmianę składu chemicznego obu faz. Z wykresu układu równowagi można odczytać, jakie są fazy, jaki mają skład chemiczny oraz jaki jest ich ilościowy stosunek. W tym celu należy wykreślić na wykresie w odpowiedniej temperaturze izotermę do przecięcia się z najbliższymi liniami wykresu. Tak na przykład linia pozioma wykreślona w temperaturze t1 na wykresie układu równowagi podanym na rys. 6.4, przetnie linię likwidus w punkcie 1oraz solidus w punkcie 2. Rzutując oba te punkty na podstawę wykresu, otrzymamy skład chemiczny fazy ciekłej (punkt 1') oraz kryształów (punkt 2').
Rys. 6.4. Zastosowanie reguły dźwigni
Z wykreślonej prostej można ponadto odczytać ilościowy stosunek faz pozostających w danej temperaturze w równowadze, opierając się na regule dźwigni. Niech w układzie dwu metali A i B istnieje stop, którego temperaturę i skład chemiczny określa punkt 3, składający się z dwu faz: M oraz N o składach 1' oraz 2' w ilościach wagowych p oraz q. Skład chemiczny poszczególnych faz i średni skład stopu można odczytać z wykresu podanego na rys. 6.4, a mianowicie zawartość składnika B w całym stopie wynosi x, w fazie M wynosi x1; a w fazie N wynosi x2. Można założyć, że suma ilości wagowych tych faz jest równa jedności, tj.
![]()
(1)
Wówczas średnia zawartość składnika B w stopie może być wyrażona równaniem
![]()
(2)
Rozwiązując układ równań (1) oraz (2), znajdziemy
![]()
skąd
![]()
Wartości p oraz q podano, gdy ciężar stopu był równy jedności. W przypadku gdy ciężar stopu wynosi Q, wartości p oraz q należy odpowiednio pomnożyć. Dla określenia procentowej ilości faz stopu mogą służyć następujące zależności:
![]()
.
Na podstawie podanych wzorów można określić ilości faz wchodzących w skład stopu w określonej temperaturze:
ilość roztworu stałego o składzie chemicznym 2' w % równa się ![]()
ilość roztworu ciekłego o składzie chemicznym 1' w % równa się ![]()
.
Ażeby więc określić ilościowy stosunek faz w stopie w punkcie 3, prowadzi się przez ten punkt poziomą do przecięcia z liniami likwidus i solidus (punkty 1 oraz 2). Długości odcinków tej linii, znajdujących się pomiędzy punktem określającym stan stopu a punktami określającymi skład chemiczny faz, są odwrotnie proporcjonalne do ilości tych faz. Opisany sposób określania ilości faz odnosi się również do wszystkich innych rodzajów układów podwójnych, a z uwagi na pewne analogie do rozważań z mechaniki nosi on w literaturze nazwę reguły dźwigni.
Całkowity brak rozpuszczalności w stanie stałym (eutektyka)
Przykładem pary metali, które zupełnie nie rozpuszczają się w sobie w stanie stałym ani też nie tworzą związków chemicznych, a w stanie ciekłym rozpuszczają się wzajemnie nieograniczenie, jest bizmut i kadm. Praktycznie biorąc metale te również i w stanie stałym rozpuszczają się w pewnym stopniu, jednak ta rozpuszczalność jest tak nieznaczna, że można ją pominąć.
Podobnie jak poprzednio, dla ustalenia układu równowagi należy przeprowadzić analizę termiczną zarówno obu czystych metali, jak też pewnej liczby ich stopów, np.:
stop I |
— |
90% Bi i 10% Cd, |
stop II |
— |
70% Bi i 30% Cd, |
stop III |
— |
60% Bi i 40% Cd, |
stop IV |
— |
50% Bi i 50% Cd, |
stopa V |
— |
30% Bi i 70% Cd |
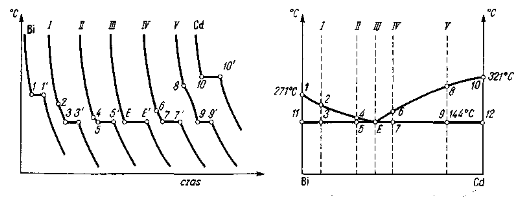
Rys. 6.5. Układ równowagi stopów Bi-Cd z krzywymi chłodzenia
Uzyskane krzywe chłodzenia przedstawia rys. 6.5. Dla bizmutu i kadmu występują na nich przystanki temperatur w 271°C (1-1') oraz w 321°C (10-10'), odpowiadające krzepnięciu tych metali. Również stop III krzepnie w stałej temperaturze 144°C (E-E') i kształt krzywej chłodzenia jest analogiczny jak dla czystych składników. Wszystkie inne stopy krzepną w pewnym zakresie temperatur. Na krzywej chłodzenia tych stopów obserwuje się punkt przegięcia, występujący dla każdego stopu w innej temperaturze (punkty 2, 4, 6, 8), oraz, przystanek leżący dla wszystkich stopów w stałej temperaturze. Wydzielenie pierwszych kryształów następuje w chwili pojawienia się punktu przegięcia; koniec krzepnięcia zachodzi natomiast w stałej temperaturze. Poziomy odcinek na krzywej chłodzenia trwa tak długo, aż cały stop nie ulegnie zakrzepnięciu. Długość odcinka poziomego jest różna i zależy od składu chemicznego stopu. Na podstawie analizy termicznej uzyskano następujące temperatury krytyczne dla poszczególnych stopów:
stop |
temperatura punktu przegięcia °C |
temperatura przystanku °C |
I |
250 |
144 |
II |
170 |
144 |
III |
— |
144 |
IV |
190 |
144 |
V |
255 |
144 |
Nanosząc uzyskane temperatury krytyczne na linie pionowe reprezentujące poszczególne stopy w układzie Bi-Cd i łącząc je liniami ciągłymi, otrzymuje się dwie linie: 1-2-4-E oraz E-6-8-10, przecinające się w punkcie E. Linia łącząca punkty 3-5-E-7-9 jest prostą, gdyż wszystkie odcinki poziome odpowiadają tej samej temperaturze 144°C. Linia 1-E-10 jest linią likwidus, a linia 1-11-E-12-10 jest linią solidus. Powyżej linii likwidus występuje jednorodny ciekły roztwór, a poniżej linii solidus występuje mieszania kryształów bizmutu i kadmu.
Rozpatrzmy przebieg krzepnięcia poszczególnych stopów zaczynając od stopu III. Zgodnie z przebiegiem krzywej ostygania (rys. 6.5), do temperatury punktu E żadne zmiany nie zachodzą i stygnie jednorodny, ciekły roztwór Bi-Cd. W temperaturze 144°C z tej jednorodnej cieczy o składzie punktu E wydzielają się kryształy obu metali, tj. bizmutu i kadmu. Stosując regułę faz otrzymamy:
![]()
Liczba stopni swobody wynosi zero. Układ jest więc niezmienny i krzepnięcie zachodzić będzie w stałej temperaturze, co się w rzeczywistości obserwuje. Przystanek na krzywej chłodzenia trwa tak długo, aż cała ciecz nie ulegnie zakrzepnięciu i przy dalszym obniżeniu temperatury w badanym stopie żadne zmiany już nie zachodzą. Powstająca mieszanina kryształów ma budowę drobnoziarnistą, o charakterystycznym zazwyczaj wyglądzie pod mikroskopem. Taką drobnoziarnistą mieszaninę kryształów różnych metali, wydzielającą się z ciekłego roztworu o określonym składzie chemicznym w stałej temperaturze, nazywamy mieszaniną eutektyczną lub krótko eutektyką. Punkt E określający skład ciekłego roztworu, z którego powstała eutektyką, nazywa się punktem eutektycznym, a pozioma linia przechodząca przez punkt E, odpowiadająca temperaturze krzepnięcia eutektyki, czyli temperaturze eutektycznej, nazywa się linią eutektyczną (linia 11-E-12). Stop zaś o składzie odpowiadającym ściśle punktowi E, w rozpatrywanym układzie stop o zawartości 60% Bi oraz 40% Cd, nazywa się stopem eutektycznym. Stopy o składach na lewo od punktu E, tj. pomiędzy punktami 11-E, nazywamy stopami podeutektycznymi, a stopy o składach leżących pomiędzy punktami E-12 — nadeutek-tycznymi. Końce linii eutektycznej, w omawianym przypadku punkty 11 i 12, wskazują skład chemiczny kryształów wchodzących w skład eutektyki. Wynika stąd, że w analizowanym przypadku eutektyką złożona jest z kryształów czystych metali: bizmutu (punkt 11) i kadmu (punkt 12).
Stopy podeutektyczne Bi-Cd leżące na lewo od punktu E krzepną w ten sposób, że z jednorodnej cieczy wydzielają się początkowo kryształy bizmutu i skład cieczy zmienia się wzdłuż linii likwidus aż do punktu E. Dopiero wtedy reszta cieczy krzepnie w stałej temperaturze jako mieszanina eutektyczna kryształów bizmutu i kadmu. Struktura takiego stopu będzie się składać z pierwotnie wydzielonych, stosunkowo dużych kryształów bizmutu na tle drobnoziarnistej eutektyki Bi-Cd.
Stopy nadeutektyczne krzepną podobnie, z tym że początkowo wydzielają się kryształy kadmu; po zakrzepnięciu stopy te zbudowane będą z kryształów kadmu na tle eutektyki Bi-Cd. Jak z porównania przebiegu krzywych chłodzenia podanych na rys. 6.5 wynika, im stop (zarówno podeutektyczny jak i nadeutektyczny) swym składem chemicznym jest bardziej zbliżony do składu punktu eutektycznego, tym niższa jest temperatura początku jego krzepnięcia, a przystanek odpowiadający krzepnięciu eutektyki jest dłuższy i tym mniej w jego strukturze będzie pierwotnie wydzielonych kryształów bizmutu czy też kadmu, a więcej eutektyki. W zakresie między linią likwidus a solidus układ ma jeden stopień swobody:
![]()
W określonej temperaturze występują w stanie równowagi dwie fazy o określonym składzie chemicznym i odwrotnie — fazy o określonym składzie chemicznym występują w równowadze tylko w określonej temperaturze. W ogólnym przypadku wykres równowagi dwu metali A i B, które w stanie stałym tworzą mieszaninę eutektyczna, przedstawiono na rys. 6.6. Linie wykresu odpowiadają następującym przemianom: 1-E — likwidus — początek wydzielania się kryształów metalu A, E-3 — likwidus — początek wydzielania się kryształów metalu B, 1-2-E-4-3 — solidus, 2-E-4 — linia eutektyczna.
Rys. 6.6. Eutektyka
W poszczególnych polach wykresu występują następujące fazy lub składniki strukturalne:
I — jednorodny ciekły roztwór metali A-B,
II — kryształy metalu A oraz ciekły roztwór A-B,
III — kryształy B oraz ciekły roztwór A-B.
Poniżej linii eutektycznej występują dwie fazy, tj. kryształy A i B. Biorąc jednak pod uwagę, że kryształy te występują w strukturze stopów albo oddzielnie, albo też jako eutektyka, przy opisie pól można uwzględnić składniki strukturalne i wówczas w polach poniżej linii eutektycznej występują:
IV — kryształy A oraz eutektyka (A + B),
V — kryształy B oraz eutektyka (A + B).
Przy chłodzeniu stopu o składzie określonym linią pionową I (rys. 6.6) do temperatury odpowiadającej położeniu punktu 5 nie zachodzą żadne przemiany (stygnie tylko roztwór ciekły). W temperaturze punktu 5, w której linia pionowa reprezentująca skład stopu przecina linię likwidus, zaczynają się wydzielać pierwsze kryształy. Skład kryształów otrzymamy, kreśląc z punktu 5 izotermę do przecięcia z linią solidus; jest to punkt 6, co wskazuje, że wydzielające się kryształy będą czystym metalem A. W miarę chłodzenia z cieczy o składzie chemicznym zmieniającym się od punktu 5 do punktu eutektycznego wydzielają się w dalszym ciągu kryształy metalu A. Na podstawie reguły dźwigni można w każdej temperaturze ustalić skład chemiczny występujących faz, jak też i ich wzajemny ilościowy stosunek, kreśląc w danej temperaturze linię poziomą do przecięcia się z liniami likwidus i solidus. Tak na przykład na rys. 6.6 pokazano, że w skład stopu w temperaturze tx wchodzą dwie fazy: ciecz o składzie punktu 9 oraz kryształy o składzie punktu 7 (tj. kryształy metalu A). Wzajemny stosunek ilościowy tych faz określony jest zależnością:
![]()
Przy osiągnięciu temperatury eutektycznej stop będzie się składał z kryształów A oraz cieczy eutektycznej. W stałej temperaturze następuje obecnie krzepnięcie eutektyki, przy czym przystanek na krzywej chłodzenia trwać będzie tak długo, aż cała ciecz nie ulegnie zakrzepnięciu. Otrzymamy więc po zakrzepnięciu kryształy A na tle drobnoziarnistej eutektyki (A + B). Przy dalszym chłodzeniu żadne przemiany już nie zachodzą. Dla pewnego uproszczenia punkty na układzie równowagi i krzywych chłodzenia zostały identycznie oznakowane, np. punkt 5 znajduje się zarówno na układzie równowagi, jak i na krzywej chłodzenia (rys. 6.6). Ma to na celu podkreślenie, że chodzi tu o tę samą temperaturę. Nie są to natomiast identyczne punkty, gdyż leżą w innych układach współrzędnych (wykres równowagi: w układzie temperatura-skład chemiczny, krzywa chłodzenia: w układzie tempera tura-czas).
Analizować można również przebieg przy nagrzewaniu. Przemiany zachodzą wówczas w odwrotnej kolejności, tj. na początku topi się w stałej temperaturze eutektyka, a dopiero następnie przy wzrastającej temperaturze rozpuszczają się stopniowo w cieczy pozostałe kryształy metalu A lub B.
Ograniczona rozpuszczalność w stanie stałym z przemianą eutektyczną
Układ równowagi fazowej dwu metali A i B, które całkowicie rozpuszczają się wzajemnie w stanie ciekłym, a tylko ograniczenie w stanie stałym, tworząc eutektykę, przedstawiono na rys. 6.7. Oprócz ciekłego roztworu występują wówczas dwie fazy: kryształy roztworu stałego składnika B w składniku A (oznaczone jako kryształy α) oraz kryształy roztworu stałego składnika A w składniku B (oznaczone jako kryształy β). Pionowa linia 2-3 określa graniczną rozpuszczalność składnika B w składniku A, a linia pionowa 5-6 określa graniczną rozpuszczalność składnika A w składniku B. Kryształy α po osiągnięciu składu chemicznego danego punktem 3, a kryształy β — punktem 6, stają się roztworami nasyconymi.
Rys. 6.7. Eutektyka z ograniczoną rozpuszczalnością składników w stanie stałym
Omawiany układ jest jak gdyby połączeniem obu poprzednio poznanych wykresów. Stopy o składach pomiędzy punktami A-3 oraz 6-B krzepną podobnie jak roztwory stałe ciągłe i w stanie stałym zbudowane są z jednorodnych kryształów roztworu α lub β. Tak na przykład krzepnięcie stopu I według rys. 6.7 rozpoczyna się w temperaturze punktu 7 i polega na wydzielaniu się z cieczy, o składzie chemicznym zmieniającym się wzdłuż linii likwidus od punktu 7 do punktu 10, kryształów roztworu stałego β o składzie chemicznym zmieniającym się wzdłuż linii solidus od punktu 8 do punktu 9, aż do całkowitego wyczerpania cieczy.
Środkowa część układu, obejmująca stopy o koncentracji pomiędzy punktami 3 i 6, jest zupełnie podobna do poprzednio omówionego przypadku eutektyki, z tą jednak różnicą, że przy krzepnięciu początkowo wydzielać się będą kryształy roztworu stałego α lub β, w zależności od tego, czy będą to stopy podeutektyczne czy nadeutektyczne. Ponadto linia eutektyczna 2-E-5 nie sięga do pionowych odpowiadających czystym składnikom, jak to było przy całkowitym braku rozpuszczalności w stanie stałym, lecz kończy się w punktach 2 oraz 5, odpowiadających nasyconym roztworom α2 i β2 (eutektyka jest więc w tym przypadku mieszaniną obu nasyconych roztworów stałych α i β). Dla przykładu zostanie omówiony przebieg przemian przy chłodzeniu stopu podeutektycznego II według rys. 6.7. Stop taki zaczyna krzepnąć w temperaturze punktu 11. Z cieczy o zmieniającym się składzie chemicznym 11-E wydzielają się kryształy a o zmieniającym się składzie chemicznym 12-2. Po osiągnięciu temperatury eutektycznej stop składa się z cieczy eutektycznej (LE) oraz kryształów (α2). Zgodnie z regułą dźwigni ilościowy stosunek tych faz wynosi
![]()
W temperaturze eutektycznej z cieczy wydzielają się równocześnie kryształy α2 i β5, tworząc mieszaninę eutektyczną. Po zakrzepnięciu stop będzie się składał z pierwotnie wydzielonych kryształów α2 na tle eutektyki. Przy dalszym ostyganiu żadne zmiany w strukturze stopu już nie zachodzą. Składniki fazowe lub strukturalne, występujące w poszczególnych polach układu, podano na rys. 6.7.
Ograniczona rozpuszczalność w stanie stałym z przemianą perytektyczną
Inny rodzaj układu równowagi fazowej dwu metali tworzących w stanie stałym roztwory graniczne przedstawiono na rys. 6.8. W tym przypadku przy krzepnięciu zachodzi przemiana perytektyczna polegająca na tym, że ciecz (L4) reaguje z uprzednio wydzielonymi kryształami (α2), w wyniku czego powstaje nowy rodzaj kryształów (β3):
![]()
.
Rys. 6.8. Perytektyka z ograniczoną rozpuszczalnością składników w stanie stałym
Ze względu na to, że w czasie reakcji perytektycznej występują równocześnie trzy fazy, układ jest niezmienny:
![]()
Przemiana ta zachodzi w stałej temperaturze, której na wykresie układu równowagi odpowiada linia pozioma (2-3-4). Jak wynika z układu, do linii pionowych odpowiadających czystym składnikom A i B przylegają pola, w których występują jednorodne roztwory stałe na osnowie tych metali, tj. roztwory α lub β. Linia pionowa 2-5 określa graniczną rozpuszczalność składnika B w składniku A, a linia pionowa 3-6 określa graniczną rozpuszczalność składnika A w składniku B. Linią likwidus jest linia 1-4-7, a linią solidus linia 1-2-3-7. Stopy o składzie na lewo od punktu 5 i na prawo od punktu 4 krzepną jak roztwory stałe i nie ma tu żadnej różnicy w stosunku do poprzednio omówionych przypadków.
Przy chłodzeniu stopów o składzie pomiędzy punktami 5-6 (np. stop I) początkowo wydzielają się z cieczy o zmieniającym się składzie chemicznym 9-4 kryształy roztworu stałego α o zmieniającym się składzie chemicznym 10-2. Po osiągnięciu temperatury perytektycznej otrzymamy kryształy roztworu stałego α2 oraz ciekły roztwór L4 w ilościowym stosunku:
![]()
Rys. 6.9. Schemat powstawania mieszaniny perytektycznej
W stałej temperaturze zachodzi reakcja perytektyczna, która trwa aż do całkowitego wyczerpania się cieczy L4. Schemat przebiegu reakcji perytektycznej przedstawiono na rys. 6.9. Zaczyna się ona na powierzchni kryształów α2. Atomy metalu B z cieczy, stykając się z atomami metalu A kryształów α, tworzą nowe kryształy β. Dalszy proces rozrastania się kryształów β zachodzi dzięki obustronnej dyfuzji atomów metalu B z cieczy poprzez kryształ β w kierunku kryształów α i atomów metalu A z wnętrza kryształów
α w kierunku cieczy L, w wyniku czego warstwa kryształów β staje się coraz grubsza kosztem otaczającej je cieczy L i zanikających kryształów α. Przemiana ta trwa aż do całkowitego zaniku cieczy. W przypadku omawianego stopu I w ten sposób otrzymuje się mieszaninę perytektyczna kryształów α2 + β3 (wokół resztek kryształów α2 powstały kryształy β3, jak to pokazano na rys. 6.8). Ilościowy stosunek kryształów α2 i β3 przedstawia się następująco:
![]()
W stopach o składzie pomiędzy punktami 3-4 początek krzepnięcia przy chłodzeniu jest podobny; np. przy chłodzeniu stopu II z cieczy o zmieniającym się składzie chemicznym 11-4 wydzielają się kryształy roztworu α o składzie 12-2. Po osiągnięciu temperatury perytektycznej występują podobnie jak w stopie I kryształy α2 i ciecz L4, jednak w tym przypadku mamy nadmiar fazy ciekłej w stosunku do ilości niezbędnej do tworzenia kryształów β. W tym przypadku ilościowy stosunek fazy ciekłej do fazy stałej jest następujący:
![]()
.
Dlatego też reakcja perytektyczna kończy się wyczerpaniem kryształów roztworu stałego α2. W wyniku reakcji perytektycznej otrzymujemy kryształy β3 i pozostałą resztę cieczy L4. Przy dalszym chłodzeniu stopu II z cieczy o zmieniającym się składzie chemicznym 4-14 wydzielają się kryształy roztworu β o zmieniającym się składzie chemicznym 3-15, aż do całkowitego wyczerpania się cieczy. Stop po zakrzepnięciu będzie zbudowany z jednorodnych kryształów β. Krzywe chłodzenia dla obu stopów podano również na rys. 6.8. Przy nagrzewaniu przebieg reakcji perytektycznej jest odwrotny, tj.
Ograniczona zmienna rozpuszczalność w stanie stałym
W poprzednio omawianych przypadkach układów z eutektyką i perytektyką linie ograniczające pola roztworów stałych były pionowe, co wskazywało, że maksymalna wzajemna rozpuszczalność składników była stała, niezależnie od temperatury. Najczęściej jednak rozpuszczalność ta maleje z obniżeniem temperatury i wówczas układ równowagi fazowej może przybrać postać podaną na rys. 6.10. Linią likwidus jest linia 1-E-3, a linią solidus jest linia 1-2-E-4-3. Linia 2-5 odpowiada granicznej rozpuszczalności składnika B w składniku A (w roztworze a), a linia 4-6 określa graniczną rozpuszczalność składnika A w składniku B (roztwór β). Jak z tego wynika, wzajemna rozpuszczalność obu tych składników maleje z obniżeniem temperatury, np. maksymalna rozpuszczalność składnika B w A w temperaturze eutektycznej wynosi A-2', a w temperaturze otoczenia tylko A-5, podobnie jest i z roztworem β. W polu A-1-2-5-A występują kryształy roztworu α, a w polu B-3-4-6-B kryształy roztworu β; pomiędzy liniami 2-5 i 4-6 występują dwie fazy, tj. kryształy nasyconych roztworów α oraz β. W związku ze zmniejszającą się rozpuszczalnością metalu B w metalu A, przy chłodzeniu z nasyconych kryształów roztworu α, o zmieniającym się składzie chemicznym wzdłuż linii 2-5, wydzielać się będą kryształy bogate w składnik B, tj. kryształy β o zmieniającym się składzie chemicznym wzdłuż linii 4-6. Analogicznie z nasyconych kryształów roztworu β o zmieniającym się składzie chemicznym wzdłuż linii 4-6 wydzielają się przy chłodzeniu kryształy α o zmieniającym się składzie 2-5. Tego rodzaju wydzielenia z kryształów roztworu stałego w odróżnieniu od kryształów pierwotnych zwą się kryształami wtórnymi i oznacza się je zwykle jako α" lub β". Tak na przykład stop I (rys. 6.10) krzepnie w ten sposób, że z cieczy o składzie 7-10 wydzielają się kryształy roztworu α o zmieniającym się składzie 8-9. W punkcie 9 krystalizacja kończy się i przy dalszym chłodzeniu aż do punktu 11 żadne przemiany w zakrzepłym stopie nie zachodzą. Dopiero po przekroczeniu linii granicznej rozpuszczalności w punkcie 11, z kryształów roztworu a o zmieniającym się składzie 11-5 wydzielają się wtórne kryształy β" o zmieniającym się składzie 12-6. Ilościowy stosunek kryształów α i β określa reguła dźwigni, np. w temperaturze tx występują kryształy α13 i β15 w ilościowym stosunku:
![]()
Po osiągnięciu temperatury otoczenia stop będzie zbudowany z kryształów α5 i β''6 .
Rys. 6.10. Ograniczona zmienna rozpuszczalność w stanie stałym (eutektyką)
Odmiennie przebiegają przemiany przy chłodzeniu stopu II, należącego do stopów podeutektycznych. Krzepnięcie tego stopu rozpoczyna się w punkcie 16 (z cieczy L16-E wydzielają się kryształy a o składzie 17-2). Po osiągnięciu temperatury eutektycznej stop będzie się składał z cieczy eutektycznej (LE) oraz kryształów roztworu stałego α2 (obecnie w stałej temperaturze krzepnie eutektyka), z cieczy wydzielają się równocześnie kryształy α2 i β4
![]()
co zachodzi aż do całkowitego wyczerpania się cieczy. Struktura stopu po jego zakrzepnięciu składać się będzie z pierwotnych kryształów α2 na tle eutektyki (α2 + β4). Przy dalszym chłodzeniu zakrzepniętego stopu z kryształów α2-5 wydzielają się kryształy wtórne β''4-6 i w temperaturze otoczenia zarówno kryształy pierwotne α, jak też i kryształy α wchodzące w skład eutektyki będą miały skład odpowiadający punktowi 5. Proces wydzielania się faz wtórnych ze składników eutektyki można pominąć. Łączą się one bowiem z odpowiednią fazą eutektyki i nie widać ich pod mikroskopem, tak że uwzględnia się jedynie wydzielenia wtórne z kryształów pierwotnych. Stop II jest więc w temperaturach otoczenia zbudowany z kryształów pierwotnych α5, wtórnych kryształów β''6 oraz eutektyki (α5 + β6). Pomimo różnorodności tych składników strukturalnych, ogólnie biorąc, stop składa się z dwu faz, tj. kryształów nasyconych roztworów α i β. Analogicznie przebiegają przemiany w stopach nadeutektycznych. Na rysunku 6.10 zaznaczono, jakie składniki strukturalne lub fazowe występują w poszczególnych polach układu. Na rysunku tym podano ponadto przebieg krzywych chłodzenia obu tych stopów I oraz II. Zmienna rozpuszczalność może występować także w przypadku perytektyki, jak to przedstawiono na rys. 6.11. Rzadszym przypadkiem jest wzrost rozpuszczalności z obniżeniem temperatury, jak to występuje na układzie równowagi, przedstawionym na rys. 6.12. Linia 2-3 wskazuje na wzrost rozpuszczalności metalu B w metalu A, w związku z czym przy chłodzeniu kryształy metalu B rozpuszczają się w roztworze α i ich ilość w strukturze zakrzepniętego stopu maleje. W przypadku chłodzenia, stopy o składzie 2-3, które po zakrzepnięciu składają się z dwu faz: kryształów α i β, po przekroczeniu linii 2-3 zbudowane są już tylko z jednorodnego roztworu α.
|
|
|
Rys. 6.11. Ograniczona zmienna rozpuszczalność w stanie stałym (perytektyka)
|
|
Rys. 6.12. Wzrost rozpuszczalności w stanie stałym przy obniżaniu temperatury |
Układy równowagi ze związkiem chemicznym
Ponieważ skład chemiczny związków chemicznych jest stały, są one na wykresie układu równowagi reprezentowane linią pionową, przechodzącą przez punkt osi od-ciętych, określających odpowiedni stosunek składników związku, jak to przedstawiono na rys. 6.13 (widoczna linia pionowa na wykresie A-B odpowiada związkowi chemicznemu Z o wzorze stechiometrycznym AmBn). Metale A i B, których układ równowagi przedstawiono na rys. 6.13, tworzą trwały związek chemiczny, tj. taki, który można nagrzać bez jego rozkładu aż do temperatury topnienia. Topnienie (czy też krzepnięcie) związku chemicznego zachodzi w stałej temperaturze, której na linii likwidus odpowiada maksimum (punkt 3). Jest to zgodne z regułą faz, gdyż czysty związek chemiczny jako układ jednoskładnikowy (n = l) ma liczbę stopni swobody w temperaturze topnienia równą zeru, zgodnie z równaniem:
![]()
.
Rys. 6.13. Związek chemiczny
Krzywa chłodzenia stopu o składzie odpowiadającym związkowi chemicznemu będzie miała jeden przystanek w temperaturze krzepnięcia. Linia pionowa, reprezentująca związek chemiczny, dzieli wykres równowagi fazowej na dwie jak gdyby niezależne od siebie części, które można rozpatrywać oddzielnie. Na rysunku 6.13 można więc wyróżnić dwa układy składowe:
1) układ: A-AmBn (Z),
2) układ: Am-Bn (Z),
Układy te są proste i odpowiadają omówionemu poprzednio przypadkowi eutektyki. W układzie pierwszym występuje eutektyka E1 złożona z kryształów składnika A oraz związku AmBn. W zależności od składu chemicznego stopy z tego układu krzepną z początkowym wydzielaniem się kryształów A (stopy podeutektyczne) lub kryształów związku AmBn (stopy nadeutektyczne), po czym w stałej temperaturze krzepnie reszta cieczy, tworząc mieszaninę eutektyczną. W układzie drugim występuje również eutektyka E2, złożona z kryształów związku AmBn i metalu B. Krzepnięcie stopów w tej części układu rozpoczyna się wydzieleniem związku chemicznego AmBn lub składnika B, po czym reszta cieczy krzepnie, dając mieszaninę eutektyczną. Składniki strukturalne i fazowe występujące w poszczególnych polach tego rodzaju układu pokazano na rys. 6.13. Na tym też rysunku podano przykładowo krzywą chłodzenia dla stopu I, z zaznaczeniem zachodzących przemian. Mogą również występować nietrwałe związki chemiczne i układ z tego rodzaju fazą przedstawiono na rys. 6.14. Jak z niego wynika, utworzony ze składników stopu związek chemiczny AmBn jest nietrwały, gdyż przy nagrzewaniu przed osiągnięciem temperatury topnienia ulega on rozpadowi na ciecz o składzie punktu 4 oraz kryształy metalu A. Podczas chłodzenia natomiast zachodzi w stałej temperaturze reakcja perytektyczna:
![]()
.
Przebieg przemian przy chłodzeniu stopu I zaznaczono na krzywej chłodzenia (rys. 6.14).
Rys. 6.14. Nietrwały związek chemiczny
Z cieczy o zmieniającym się składzie chemicznym wzdłuż likwidus 5-4 wydzielają się kryształy składnika A. W temperaturze 2-3-4 następuje reakcja pomiędzy cieczą a kryształami A, w wyniku czego powstaje nietrwały związek chemiczny AmBn (reakcja ta trwa aż do całkowitego wyczerpania składnika A), przy dalszym chłodzeniu z cieczy o zmieniającym się składzie 4-E wydzielają się kryształy związku AmBn, po czym w temperaturze eutektycznej z reszty cieczy o składzie punktu E wydziela się mieszanina eutektyczna AmBn-B. W tym przypadku na krzywej chłodzenia będą występować dwa przystanki. W przypadku układów podanych na rys. 6.13 oraz 6.14 metale A i B wzajemnie się nie rozpuszczają.
Układy równowagi z fazami międzymetalicznymi
Rysunki 6.15 oraz 6.16 przedstawiają układy równowagi fazowej z fazą międzymetaliczną γ; może ona zawierać nadmiar atomów metalu A lub metalu B, na skutek czego skład chemiczny fazy γ jest w pewnym zakresie koncentracji zmienny. Metal A i metal B wzajemnie się rozpuszczają, na skutek czego w obu układach występują roztwory stałe α oraz β. Rysunek 6.15 przedstawia układ równowagi, gdzie występują roztwory stałe oraz faza międzymetaliczna γ, którą można uważać za roztwór stały metalu A lub metalu B w związku AmBn; faza ta jest trwała aż do temperatury jej topnienia. Układ równowagi z fazą międzymetaliczną nietrwałą przedstawiono na rys. 6.16. Składniki strukturalne lub fazowe występujące w poszczególnych polach układu zostały na obu rysunkach oznaczone. Przebieg przemian zachodzących w tych układach można opisać na podstawie znajomości układów ze związkami chemicznymi oraz wykresów z ograniczoną rozpuszczalnością w stanie stałym, tworzących eutektykę lub perytektykę.
Rys. 6.15. Faza międzymetaliczna
Rys. 6.16. Nietrwała faza międzymetaliczna
Ograniczona rozpuszczalność w stanie ciekłym
We wszystkich rozpatrzonych wyżej układach równowagi metale w stanie ciekłym rozpuszczały się wzajemnie całkowicie, tj. powyżej linii likwidus występował jednorodny ciekły roztwór. Istnieją także pary takich metali, jak np. ołów-miedź, których wzajemna rozpuszczalność w stanie ciekłym jest ograniczona, na ogół wzrastająca z podwyższeniem temperatury.
Układ z ograniczoną rozpuszczalnością w stanie ciekłym przedstawiono na rys. 6.17. W wysokich temperaturach występuje jednorodny ciekły roztwór, jednakże w miarę chłodzenia, po przekroczeniu linii nasycenia (linia kreskowana na rys. 6.17) następuje jego rozpad na dwa nasycone ciekłe roztwory, jeden bogaty w metal A, drugi zaś bogaty w metal B, których skład chemiczny przy chłodzeniu czy też nagrzewaniu zmienia się wzdłuż linii nasycenia. W polu ograniczonym więc linią nasycenia i odpowiednim odcinkiem linii likwidus 2-3 występują dwa nasycone ciekłe roztwory. Ze względu na to, że mają one różną gęstość, przy dostatecznie wolnym chłodzeniu mogą się wytworzyć dwie oddzielne warstwy cieczy; zjawisko to w niektórych stopach technicznych jest szkodliwe, gdyż powoduje powstanie segregacji. Z tego względu np. brązy ołowiowe, stosowane jako materiał łożyskowy, poddaje się po zalaniu form szybkiemu chłodzeniu, co pozwala uniknąć zjawiska segregacji i uzyskać równomierne rozmieszczenie drobnych kryształów ołowiu na tle osnowy miedzi.
Rys. 6.17. Układ równowagi stopów podwójnych składników o ograniczonej rozpuszczalności w stanie ciekłym wraz z krzywą chłodzenia
Przy chłodzeniu stopu (rys. 6.17) aż do punktu 7 stygnie jednorodny roztwór ciekły, po czym z tego roztworu o zmieniającym się składzie chemicznym 7-2 wydziela się drugi nasycony roztwór ciekły o zmieniającym się składzie 8-3. Po osiągnięciu temperatury tm stop będzie się składał z dwu roztworów ciekłych L2 oraz L3. W tej temperaturze następuje rozpad cieczy L2 w myśl reakcji:
![]()
Tego rodzaju reakcja, w czasie której jedna faza ciekła rozpada się na drugą fazę ciekłą oraz kryształy, nazywa się reakcją monotektyczną. Ze względu na to, że w czasie przebiegu tej reakcji występują równocześnie trzy fazy, liczba stopni swobody układu jest równa zeru:
![]()
,
i reakcja ta zachodzi w stałej temperaturze. Z chwilą gdy ciecz L2 wyczerpie się, przy dalszym chłodzeniu z cieczy o zmiennym składzie chemicznym 3-E wydzielają się kryształy metalu A, po czym w temperaturze eutektycznej krzepnie reszta cieczy jako mieszanina eutektyczna (A + B).
Znane są również pary metali całkowicie wzajemnie nie rozpuszczające się w stanie ciekłym, jak np. żelazo-ołów.
Przemiany w stanie stałym
Omówione układy równowagi fazowej dotyczyły metali nie mających odmian alo-tropowych. Dlatego też, z wyjątkiem zmiennej rozpuszczalności w stanie stałym, dotyczyły one przemian związanych z krystalizacją pierwotną. Jeśli jednak przynajmniej jeden ze składników stopu jest polimorficzny, to w zakrzepniętym stopie przebiegać będą jeszcze procesy krystalizacji wtórnej. Na wykresach równowagi fazowej pojawiają się wówczas poniżej linii solidus dodatkowe linie odpowiadające tym przemianom.
Jeżeli składnik A ma dwie odmiany alotropowe (Aα i Aβ), przy czym trwała w niższych temperaturach odmiana Aα i składnik B tworzą roztwory stałe ciągłe, to wykres układu równowagi fazowej ma postać przedstawioną schematycznie na rys. 6.18 a. Linia 1-2-3 jest linią przemiany perytektycznej, w której wyniku przy chłodzeniu z kryształów roztworu β1 i cieczy L3 powstają kryształy roztworu stałego α2. W polu 1-2-5 współistnieją w stanie równowagi oba roztwory stałe α i β, przy czym skład roztworu a zmienia się wzdłuż linii 2-5, a skład chemiczny roztworu β wzdłuż linii 1-5. W przypadku gdy trwała w wyższych temperaturach odmiana alotropowa Aβ tworzy ze składnikiem B roztwór stały ciągły, wykres równowagi fazowej ma postać podaną na rys. 6.18 b. Jest rzeczą widoczną, że w polu 1-2-3 występują w równowadze oba roztwory α oraz β.
Rys. 6.18. Przemiany w stanic stałym
Na rys. 6.18 c przedstawiono układ równowagi fazowej dwu składników, z których każdy ma dwie odmiany alotropowe, przy czym zarówno trwałe w niższych temperaturach odmiany Aα i Bα jak też trwałe w wyższych temperaturach odmiany Aβ i Bβ rozpuszczają się wzajemnie nieograniczenie. Wykres równowagi przypomina wówczas podwójny wykres roztworów stałych ciągłych, z tym tylko, że linie 1-2 dotyczą krystalizacji pierwotnej, a linie 3-4 krystalizacji wtórnej. Jeżeli natomiast tylko wysokotemperaturowe odmiany alotropowe (Aβ i Bβ) tworzą roztwór stały ciągły γ, natomiast wzajemna rozpuszczalność niskotemperaturowych odmian alotropowych (Aα i Bα) jest ograniczona, to układ ma postać podaną na rys. 6.18 d. W części dolnej układ równowagi podobny jest do poprzednio omówionej eutektyki, z tym jednak, że fazą wyjściową jest roztwór stały γ (a nie ciecz), który na linii 1-E-2 ulega rozpadowi na mieszaninę kryształów a i jS. Tego rodzaju przemianę zachodzącą w stanie stałym nazywamy przemianą eutektoidalną, a otrzymaną mieszaninę kryształów eutektoidem. Podobnie jak w przypadku eutektoidu, w stanie stałym może zachodzić przemiana podobna do przemiany perytektycznej, zwie się ona wówczas przemianą perytektoidalną.
Rys. 6.19. Faza międzymetaliczna
Fazy międzymetaliczne mogą również powstawać w stanie stałym, co przedstawia układ równowagi podany na rys. 6.19. Przy chłodzeniu z roztworu stałego α powstaje faza międzymetaliczna σ. Można ją uważać za roztwór na osnowie związku międzymetalicznego AmBn Podobne tworzenie faz międzymetalicznych spotykamy w wielu układach, jak Fe-Cr, Fe-V i innych.
Właściwości stopów dwuskładnikowych
Właściwości stopów zależą głównie od ich budowy wewnętrznej, tj. struktury, a nieznacznie tylko od właściwości tworzących je składników. Właściwości stopów jednofazowych o strukturze jednorodnej związane są z ich składem chemicznym i wielkością ziarn. Natomiast właściwości stopów o strukturze niejednorodnej, wielofazowej, zależą od rodzaju i udziału każdej z faz, sposobu ich występowania i rozmieszczenia oraz od wielkości ziarna. Z tych względów występują określone zależności pomiędzy rodzajem układu równowagi z właściwościami stopów. Widać to szczególnie wyraźnie na przykładzie takich właściwości fizycznych jak przewodnictwo elektryczne i cieplne, rozszerzalność cieplna, gęstość; właściwości te praktycznie nie zależą od wielkości ziarna, postaci występowania i rozmieszczenia poszczególnych faz. Związek pomiędzy tymi właściwościami stopu a rodzajem układu równowagi przedstawiono na rys. 6.20. W górnej części rysunku podano cztery zasadnicze rodzaje układów równowagi fazowej, a w części dolnej przedstawiono zmianę właściwości stopów w zależności od ich składu chemicznego dla poszczególnych układów. Widać, że dla stopów tworzących mieszaninę składników (rys. 6.20 a) zmiana właściwości stopów ma charakter prostoliniowy. Właściwości roztworów stałych ciągłych zmieniają się ze zmianą składu chemicznego stopu według zależności krzywoliniowej (rys. 6.20 b), przy czym gwałtowna zmiana właściwości następuje już przy niewielkich ilościach rozpuszczonego składnika. Tego rodzaju zależność wykazuje zwłaszcza przewodnictwo elektryczne (co ma duże znaczenie praktyczne). Obecność niewielkich nawet ilości domieszek występujących w postaci roztworu stałego silnie zmniejsza przewodnictwo elektryczne i np. miedź o dużej czystości (99,999% Cu) ma przewodność elektryczną właściwą 59,77 MS/m, podczas gdy miedź o czystości 99,95% Cu ma przewodność elektryczną właściwą obniżoną do około 56 MS/m. Ten szkodliwy wpływ rozpuszczonych domieszek na przewodnictwo elektryczne tłumaczy się tym, że obecność obcych atomów w sieci metalu rozpuszczalnika powoduje odkształcenia jego sieci krystalicznej, co z kolei utrudnia przepływ elektronów. Rozpad roztworu stałego i wydzielenie składnika rozpuszczonego w postaci odrębnej fazy będzie powodować wzrost przewodnictwa elektrycznego. Zjawisko to określa się nazwą prawa Kurnakowa. W przypadku tworzenia się roztworów stałych o ograniczonej rozpuszczalności, właściwości stopów zmieniają się w zakresach odpowiadających stopom jednofazowym według zależności krzywoliniowej, a w zakresach dwufazowych według zależności prostoliniowej, jak to przedstawiono na rys. 6.20c (punkty skrajne odcinka prostej odpowiadają właściwościom roztworów nasyconych, tworzących mieszaninę). Jeżeli natomiast w danym układzie występują fazy międzymetaliczne, to na wykresie zależności właściwości stopów od ich składu chemicznego pojawia się maksimum lub minimum określające właściwości danej fazy (rys. 6.20 d). Tego rodzaju punkty odpowiadające występowaniu faz międzymetalicznych noszą nazwę punktów szczególnych lub osobliwych. Większość jednak właściwości stopów, a zwłaszcza właściwości mechaniczne i technologiczne, zależy nie tylko od rodzaju faz i ich liczby, lecz także od postaci ich występowania, sposobu rozmieszczenia, wielkości ziarna; stąd też podane zależności mogą mieć jedynie charakter orientacyjny. Dotyczy to zwłaszcza stopów o składzie eutektycznym lub eutektoidalnym, które mając bardzo drobnoziarnistą budowę, wykazują niekiedy najlepsze właściwości mechaniczne, takie jak wytrzymałość na rozciąganie czy też twardość.
Rys. 6.20. Związek pomiędzy rodzajem układu a właściwościami stopów
Układy równowagi fazowej stopów trójskładnikowych
Oprócz stopów dwuskładnikowych szerokie zastosowanie w technice znajdują stopy wieloskładnikowe (jak np. stopy żelaza, miedzi, aluminium) złożone z trzech, czterech, czy też nawet większej liczby składników. Z tego względu zachodzi konieczność poznania również układów równowagi fazowej stopów trójskładnikowych (budowa modeli układów równowagi stopów o jeszcze większej liczbie składników jest bardzo złożona i pomimo dużego praktycznego znaczenia są one do tej chwili mało zbadane).
Rys. 6.21. Zasada określania składu chemicznego stopów potrójnych w trójkącie równobocznym
W przypadku układów dwuskładnikowych występowały dwie zmienne niezależne, tj. temperatura układu oraz zawartość jednego ze składników, co umożliwiało przedstawienie ich na płaszczyźnie. W układzie trójskładnikowym dochodzi jeszcze jedna zmienna niezależna, tj. stężenie drugiego ze składników (składnik trzeci stanowi dopełnienie do 100% stopu: A + B + C = 100%). Z tego względu układ taki, będący zależnością trzech zmiennych, można przedstawić w postaci modelu przestrzennego. Podstawę modelu stanowić będzie płaszczyzna pozioma, na której nanosi się odpowiednio skład chemiczny stopów, wyrażony w procentach, na osi zaś pionowej zaznacza się temperatury przemian. Najczęściej za podstawę układu przyjmuje się trójkąt równoboczny, na którym najłatwiej odczytać można skład chemiczny stopów. Trójkąt taki nazywa się trójkątem składów lub trójkątem koncentracji i jest przedstawiony na rys. 6.21. Wierzchołki trójkąta odpowiadają czystym składnikom, np. A, B, C, rozpatrywanego układu potrójnego. Bokom tegoż trójkąta odpowiadają właściwe układy podwójne A-B, B-C oraz C-A. Wszystkie stopy potrójne tych składników mieszczą się wewnątrz trójkąta ABC, tj. każdemu punktowi wewnątrz trójkąta odpowiada stop trójskładnikowy o określonym składzie chemicznym. Odczytanie składu stopów opiera się na zasadzie, że jeżeli przez dowolny punkt M, leżący wewnątrz trójkąta równobocznego, przeprowadzimy równoległe do jego boków, to suma otrzymanych na tych bokach odcinków (a, b, c) jest stała i równa długości boku trójkąta (rys. 6.21):
a + b + c = AB = BC =CA
Przy założeniu, że długość boku trójkąta stanowi 100% stopu, zawartość poszczególnych składników w trójskładnikowym stopie o składzie danym punktem M jest następująca:
![]()
—zawartość składnika A,
![]()
—zawartość składnika B, ad
![]()
—zawartość składnika C AB
Aby więc określić skład procentowy potrójnego stopu, należy przez punkt M reprezentujący stop przeprowadzić równoległe do poszczególnych boków trójkąta, zgodnie z rys. 6.21 i wówczas:
— równoległa do boku BC odcina na boku AC odcinek A'C, proporcjonalny do zawartości składnika A w stopie;
— równoległa do boku AC odcina na boku AB odcinek AB', proporcjonalny do zawartości składnika B w stopie;
— równoległa do boku AB odcina na boku BC odcinek BC', proporcjonalny do zawartości składnika C w stopie.
Rys. 6.22. Trójkąt składów
Linie równoległe do poszczególnych boków trójkąta odpowiadają stopom o stałej zawartości jednego ze składników; tak np. linia M-N na rys. 6.22 równoległa do boku AC trójkąta składów odpowiada stopom o stałej zawartości składnika B. Stopy, których skład chemiczny leży na siecznej przechodzącej przez jeden z wierzchołków trójkąta składów, mają stały stosunek składników reprezentowanych przez wierzchołki trójkąta, leżące po obu stronach od tej siecznej, tak np. stopy, których skład chemiczny leży na siecznej BE, mają stały stosunek koncentracji składników A do C. W praktyce dla ułatwienia odczytywania składu stopów, pole trójkąta dzieli się równoległymi do boków, otrzymując skalę w postaci sieci trójkątnej, jak to przedstawiono na rys. 6.23.
Rys. 6.23. Trójkąt składów
Zawartość składników stopu odczytuje się na odpowiednich bokach trójkąta zgodnie z zaznaczonymi strzałkami; np. stop N zawiera: 20% A, 20% B i 60% C. Przykładowo rozpatrzymy dwa proste przypadki układów potrójnych, a mianowicie roztwory stałe ciągłe oraz eutektykę potrójną. Trójskładnikowy układ równowagi fazowej o całkowitej wzajemnej rozpuszczalności wszystkich trzech składników zarówno w stanie ciekłym, jak i w stanie stałym jest przedstawiony w perspektywie na rys. 6.24.
Rys. 6.24. Układ równowagi stopów potrójnych o nieograniczonej rozpuszczalności składników
Jest to graniastosłup o podstawie trójkąta, którego krawędzie odpowiadają czystym składom A, B, C, a ściany boczne — układom podwójnym A-B, B-C, C-A. Górna wypukła powierzchnia przechodząca przez temperatury topnienia wszystkich trzech składników jest powierzchnią likwidus i odpowiada temperaturom początku krzepnięcia stopów potrójnych, oraz jest ona ograniczona liniami likwidus odpowiednich układów podwójnych. Dolna powierzchnia wklęsła, przechodząca również przez temperatury topnienia składników stopu i ograniczona liniami solidus na układach podwójnych, jest powierzchnią solidus określającą temperatury końca krzepnięcia stopów potrójnych. Stop o składzie np. punktu N będzie krzepł w zakresie temperatur od t1 do t2 (rys. 6.24), które to temperatury odpowiadają punktom przebicia powierzchni likwidus lub solidus przez prostopadłą biegnącą z punktu N. Krzywa chłodzenia, zupełnie podobnie jak i w układach podwójnych, wykazywać będzie w tym zakresie temperatur wybrzuszenie odpowiadające krystalizacji roztworu stałego.
Rys. 6.25. Przekroje izotermiczne w układzie równowagi stopów trójskładnikowych
Ponieważ modele układów potrójnych mają charakter przestrzenny, co ogranicza praktyczne zastosowanie, istnieje tendencja do przedstawiania ich na płaszczyźnie; można tego dokonać stosując rzuty izoterm likwidus i solidus na podstawę układu. Jeżeli powierzchnię likwidus oraz powierzchnię solidus danego układu przetniemy płaszczyzną poziomą, jak to pokazano na rys. 6.25, to przetnie ona powierzchnię likwidus wzdłuż krzywej a1-b1, a powierzchnię solidus wzdłuż krzywej c1-d1. Krzywe te, odpowiadające określonej temperaturze, noszą właśnie nazwę izoterm, przy czym krzywa al-b1 leżąca na powierzchni likwidus nosi nazwę izotermy likwidusu, a krzywa c1-d1 leżąca na powierzchni solidus — izotermy solidusu. Izotermy te można następnie rzutować na płaszczyznę podstawy. Otrzymane w ten sposób rzuty izoterm likwidusu (a-b) oraz solidusu (c-d) umożliwiają określenie temperatur krzepnięcia stopów. W tym celu przecina się model układu równowagi szeregiem płaszczyzn izotermicznych, a otrzymane izotermy rzutuje się w sposób wyżej podany na płaszczyznę podstawy (rys. 6.26). Rzuty izoterm likwidusu podaje rys. 6.26 a, a rzuty izoterm solidusu rys. 6.26 b. Wykresy te mogą zastąpić model przestrzenny, gdyż umożliwiają odczytanie temperatury początku i końca krzepnięcia (lub topnienia) stopów z dokładnością zależną od gęstości izoterm; np. stop o składzie punktu M zacznie krzepnąć w temperaturze około !030°C, ponieważ leży pomiędzy izotermami likwidusu dla 1000°C i 1050°C, a kończy krzepnąć w temperaturze około 880°C, ponieważ leży pomiędzy izotermami solidusu dla 850°C i 900°C.
Rys. 6.26. Rzuty izoterm likwidusu i solidusu w układzie potrójnym
Gdy składniki całkowicie nie rozpuszczają się w stanie stałym, tworząc eutektykę potrójną, model układu równowagi ma wygląd przedstawiony na rys. 6.27.
Rys. 6.27. Eutektyka potrójna
Ma on również kształt graniastosłupa o podstawie trójkątnej; krawędzie odpowiadają czystym składnikom A, B, C, a ściany boczne stanowią odpowiednie układy podwójne A-B, B-C, A-C, przy czym w tym przypadku każdy z nich przedstawia prosty przypadek podwójnej eutektyki. Widać to wyraźnie na rozwiniętym modelu układu po dokonaniu kładu ścian bocznych na płaszczyznę podstawy, jak to przedstawiono na rys. 6.28. Na rysunku 6.27 z punktów l, 2, i 3 odpowiadających temperaturom topnienia poszczególnych składników, wybiegają wzdłuż linii E31E1, E12E2 oraz E23E3 powierzchnie górne, będące powierzchniami likwidus. Wzdłuż powierzchni tych zachodzi przy krzepnięciu wydzielanie się z cieczy kryształów czystych składników A, B lub C, zależnie z której krawędzi dana powierzchnia wybiega. Powierzchnie te przecinają się wzdłuż linii odpowiadających wydzielaniu się eutektyk podwójnych, a mianowicie wzdłuż linii E1E wydziela się eutektyka (A + B), wzdłuż linii E2E — eutektyka (B + C), a wzdłuż linii E3E — eutektyka (A + C). Wszystkie te trzy linie eutektyk podwójnych przecinają się w punkcie E, w którym z cieczy o składzie tego punktu powstaje eutektyka potrójna (A + B + C). Układ jest wówczas niezmienny i krzepnięcie eutektyki potrójnej zachodzi w stałej temperaturze t' zgodnie z regułą faz:
![]()
Przez punkt E przebiega pozioma płaszczyzna, będąca solidusem, odpowiadająca zakończeniu krzepnięcia. Krzepnięcie wszystkich stopów takiego układu kończy się wytworzeniem eutektyki potrójnej, analogicznie jak w podanym układzie dwuskładnikowym krzepnięcie kończy się wytworzeniem w stałej temperaturze eutektyki podwójnej.
Rys. 6.28. Płaska projekcja układu równowagi składników tworzących eutektykę potrójną
Jakie składniki strukturalne występują w zakrzepniętych stopach, można odczytać z rozwiniętego układu podanego na rys. 6.28. W tym celu na podstawę wykresu naniesiono rzuty linii eutektyk podwójnych E'1E', E'2E', E'3E' łącznie z punktem rzutu eutektyki potrójnej E' oraz połączono jeszcze punkt E' z wierzchołkami trójkąta składów. Trójkąt ten rozpadł się na sześć obszarów, w których zakrzepnięte stopy będą miały różną strukturę. Rozpatrzmy krzepnięcie stopu w obszarze E'1BE'. Podczas krzepnięcia stopu o składzie punktu O początkowo będą się wydzielały kryształy czystego metalu B. Ponieważ wówczas stosunek stężenia pozostałych składników stopu (A : C) będzie wielkością stałą, skład cieczy będzie się zmieniał wzdłuż siecznej przechodzącej przez punkt B na odcinku Ob, dopóki nie osiągnie ona linii eutektyki podwójnej, w tym przypadku linii E'1E', wówczas z cieczy zacznie się wydzielać eutektyka podwójna (A + B), a skład cieczy będzie się zmieniał wzdłuż tej linii, aż do osiągnięcia punktu E', w której to temperaturze krzepnie eutektyka potrójna. Przebieg krzywej chłodzenia wraz z podaniem przemian pokazano na rys. 6.29.
Rys. 6.29. Krzywa chłodzenia stopu składników tworzących eutektykę potrójną
Stop O po zakrzepnięciu będzie się składał z kryształów metalu B, eutektyki podwójnej (A + B) oraz eutektyki potrójnej (A + B + C). W podobny sposób krzepną wszystkie stopy tego układu, z wyjątkiem tych, których składy leżą na liniach eutektyk podwójnych; w stopach takich krzepnie od razu eutektyka podwójna, bez uprzedniego wydzielania się kryształów jednego ze składników stopu. Składniki strukturalne stopów w poszczególnych obszarach trójkąta składów przedstawiono na rys. 6.30.
Rys. 6.30. Struktury stopów składników tworzących eutektykę potrójną
1
25
Wyszukiwarka
Podobne podstrony:
Rozdział 17, S. Rudnik - materiałoznawstwo
Rozdział 04, S. Rudnik - materiałoznawstwo
Rozdział 05, S. Rudnik - materiałoznawstwo
Rozdział 12, S. Rudnik - materiałoznawstwo
Rozdział 14, S. Rudnik - materiałoznawstwo
Rozdział 19, S. Rudnik - materiałoznawstwo
Rozdział 09, S. Rudnik - materiałoznawstwo
Rozdział 18, S. Rudnik - materiałoznawstwo
Rozdział 10, S. Rudnik - materiałoznawstwo
Rozdział 03, S. Rudnik - materiałoznawstwo
Rozdział 11, S. Rudnik - materiałoznawstwo
Rozdział 02, S. Rudnik - materiałoznawstwo
15.02.06-Anemia-materiały do wykładu, studia, 4 rok, farmakologia, materiały, C21W15-niedokrwistosci
rozdzial02-06, PONAD 12 000 podręczniki
06 Dobieranie materiałów konstrukcyjnych
07 Rozdziaę 06
06 Rozpoznawanie materiałów i elementów konstrukcyjnych
Ir-1 (R-1) 091-102 Rozdział 06
06 Dobieranie materialow wykonc Nieznany (2)
więcej podobnych podstron