I AD
Laboratorium z fizyki
Ćw. Nr 23
Sprawdzanie praw elektrolizy Faraday'a
Maciuła Grzegorz
L2
I AD
Laboratorium z fizyki
Ćw. Nr 23
Sprawdzanie praw elektrolizy Faraday'a
Kubit Rafał
L2
I. Teoria
Pierwsze prawo Faraday'a - masa substancji wydzielonej na elektrodzie jest wprost proporcjonalna do natężenia prądu płynącego przez elektrolit i do czasu trwania elektrolizy.
m = k I t
gdzie:
k - równoważnik elektrochemiczny
[k] = kg/A s
Równoważnik ten jest charakterystyczny dla danej substancji i określa nam masę substancji wydzielonej na elektrodzie, przy przepływie prądu elektrycznego o natężeniu 1 ampera (A) w czasie 1 sekundy (s).
Osadzanie się substancji wchodzących w skład elektrolitu na elektrodach pozwoliło na wykorzystanie tego procesu w galwanizacji, czyli pokrywaniu różnych materiałów powłokami metalowymi oraz w przemyśle elektrochemicznym do uzyskiwania czystych metali.
W wyniku elektrolizy możemy otrzymywać gazy, np.: O2 i H2.
Z pierwszego prawa elektrolizy wynika, że masa wydzielona na elektrodzie jest proporcjonalna do ładunku, który przepłynął przez elektrolit.
m = k q
Podczas elektrolizy na elektrodzie odkładają się jony przenoszące ładunki elektryczne, stąd masa wydzielana na elektrodzie będzie proporcjonalna do masy jonu (mj) oraz ilości jonów (n) przyłączonych do elektrody:
m = mj n
Jeżeli całkowity ładunek oddany przez jon oznaczymy (q), a ładunek jonu (we), to liczba odłożonych jonów n, wyrażona będzie wzorem:
n = q/w e
e - ładunek elektronu
w - wartościowość
m = (mj q)/(w e)
Masę jednego jonu każdej substancji możemy obliczyć dzieląc masę molową (u) przez liczbę awogadra (Na), która wynosi 6.022 x 1023 [1/mol]. stąd masa jednego jonu:.
mj = u/Na
m = (u q)/(Na we)
Ze wzoru wynika, że masa jest proporcjonalna do ładunku, stąd równoważnik elektrochemiczny:
k = u/(Na w e)
Z powyższego wzoru widzimy, że cztery wielkości charakteryzują daną substancję. Masa molowa, liczba awogadra, ładunek elektronu i wartościowość. Dwie wielkości są stałe: Na i e. Stąd wpływ maja u i w.
Iloczyn dwóch stałych wielkości Na i e został nazwany stałą Faradaya (F).
F = Na e
[F] = c/mol
k = u/(w F)
Powyższy wzór wyraża nam drugie prawo elektrolizy Faraday'a
Drugie prawo Faraday'a - równoważnik elektrochemiczny jest wprost proporcjonalny do masy molowej tej substancji, a odwrotnie proporcjonalny do iloczynu stałej Faraday'a i wartościowości.
Elektroliza - proces rozkładu związków chemicznych i separacji produktów tego rozkładu pod wpływem przepuszczania przez nie prądu elektrycznego, co wywołuje wędrówkę jonów do pary nie reagujących z układem elektrod.
Elektroliza zachodzi w układach, w których już przed przyłożeniem do elektrod napięcia występowały wolne jony, a zatem w elektrolitach. Związek chemiczny może stać się elektrolitem na skutek dysocjacji elektrolitycznej wywołanej przez rozpuszczalnik, na skutek domieszkowania jonami lub odpowiednio wysokiej temperatury.
Proces elektrolizy polega na wędrówce jonów do obojętnych chemicznie elektrod, zanurzonych w elektrolicie, po przyłożeniu do nich odpowiedniego napięcia prądu elektrycznego. W elektrolizie elektroda naładowana ujemnie jest nazywana katodą, a elektroda naładowana dodatnio anodą. Każda z elektrod przyciąga do siebie przeciwnie naładowane jony. Do katody dążą więc dodatnio naładowane kationy a do anody ujemnie naładowane aniony. Po dotarciu do elektrod jony przekazują im swój ładunek na skutek czego zamieniają się w obojętne elektrycznie związki chemiczne lub pierwiastki. Powstające w ten sposób substancje zwykle albo osadzają się na elektrodach lub wydzielają się z układu w postaci gazu. Proces elektrolizy wymaga stałego dostarczania energii elektrycznej.
II. Wykonanie ćwiczenia
Komplet urządzeń do wykonania ćwiczenia stanowią: szklane naczynie na elektrolit, elektrody miedziane, zasilacz, amperomierz, miernik do pomiaru czasu, waga laboratoryjna.
Połączyć obwód według schematu przedstawionego na rysunku
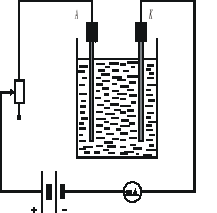
Schemat obwodu pomiarowego
Sprawdzić poprawność obwodu elektrycznego zamykając obwód na krótki czas. Jednocześnie wyregulować natężenie prądu w obwodzie tak, by gęstość prądu nie przekraczała
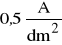
(j = I/S jest gęstością prądu). Natężenie prądu wyznaczyć w odniesieniu do zanurzonej w elektrolicie powierzchni elektrody).
Wyjąć katodę, osuszyć, oczyścić starannie papierem ściernym, przepłukać wodą. Wyznaczyć masę
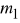
katody korzystając z wagi analitycznej.Umieścić ponownie katodę w elektrolicie, włączyć prąd uruchamiając jednocześnie zegar. Utrzymywać stałą wartość natężenia prądu przez czas
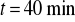
.Po upływie tego czasu przerwać dopływ prądu. Opłukać katodę wodą, osuszyć i wyznaczyć masę
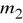
katody.
III. Tabela pomiarowa
I |
|
t |
|
M |
k |
|
F |
|
[ ] |
[ ] |
[ ] |
[ ] |
[ ] |
[ ] |
[ ] |
[ ] |
[ ] |
|
|
|
|
|
|
|
|
|
Wyszukiwarka
Podobne podstrony:
ćw 1 obliczenia, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
Wstęp teoretyczny ćw 44, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium
Sprawozdanie z ćw. 44, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium s
spr.23, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, Fizyka Da
ćw 22xx - Cechowanie termopary, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, labor
sprawozdanie ćw 4, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare
cw.44załamanie światła, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium
ćw 1, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, 1b, czyjeś
koncowe40, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, 44, Ćw
Wyznaczanie stałej siatki dyfrakcyjnej, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDANIA DU
SiS strona tytulowa spr, Prz inf 2013, I Semestr Informatyka, Fizyka, Wykłady-Fizyka, Sygnały i Syst
Tabela pomiarowa, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare
tabele 1B+, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, 1b
Ćwiczenie nr 44 prawie dobre ale juz teraz lux, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA
spr5, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, bartochowsk
obliczenia ćw23, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
więcej podobnych podstron