|
INSTYTUT INŻYNIERII ŚRODOWISKA UNIWERSYTET ZIELONOGORSKI
|
|
|
CHEMIA OGÓLNA LABORATORIUM
|
|
I ROK INŻYNIERIA ŚRODOWISKA STUDIA DZIENNE GRUPA 18 A
|
23.02.2003. |
|
ELEKTROLITY
TEMAT II
AUTORZY OPRACOWANIA
KATARZYNA KOZERSKA
|
||
Część teoretyczna.
Dysocjacja elektrolityczna to rozpad cząsteczek zawierających wiązanie jonowe lub kowalencyjne spolaryzowane na jony pod wpływem polarnego rozpuszczalnika, najczęściej wody. Mechanizm dysocjacji polega na otoczeniu polarnej (dipolowej) cząsteczki związku AB przez kilka cząsteczek wody, które również są polarne i rozrywają wiązanie A - B. Substancje, które ulegają dysocjacji nazywa się elektrolitami, a te które jej nie ulegają nieelektrolitami.
Nieelektrolity to substancje, które nie ulegają rozpadowi na jony. Nie przewodzą one prądu elektrycznego. Należą do nich przede wszystkim związki organiczne (z nielicznymi wyjątkami, jak kwasy karboksylowe i ich sole) oraz tlenki i wodorki nie reagujące z wodą.
Elektrolity to substancje ulegające rozpadowi na jony pod wpływem wody i innych rozpuszczalników polarnych. Ich wodne lub stopione roztwory przewodzą prąd elektryczny. Są nimi kwasy tlenowe, wodorki kwasowe (wodorki fluorowców i tlenowców) zasady i sole.
Elektrolity dzielimy na:
mocne - takie, które po rozpuszczeniu w wodzie są całkowicie zdysocjowane na jony ;należą do nich: wszystkie rozcieńczone sole, kwasy: HCl(aq), HBr(aq), HI(aq), H2SO4 (tylko na pierwszym stopniu dysocjacji), HNO3, HClO4 i wodorotlenki berylowców i litowców [z wyjątkiem Be(OH)2 i Mg(OH)2]
AB → A+ + B-
np. HCl → H+ + Cl-
słabe - takie, których cząsteczki nie ulegają całkowitej dysocjacji
AB ↔ A+ + B-
dużo mało
np. HF ↔ H+ + F-
dużo mało
Miarą mocy elektrolitów jest wielkość zwana stopniem dysocjacji(α). Jest to stosunek liczby cząstek zdysocjowanych Nz do liczby cząstek wprowadzonych do roztworu Nw :
![]()
Stosunek ten może być również wyrażony w procentach:
![]()
![]()
Stopień dysocjacji zależy od rodzaju elektrolitu, stężenia roztworu - maleje ze wzrostem stężenia, temperatury - nieznacznie rośnie ze wzrostem temperatury, obecności innych substancji w roztworze. Jeżeli substancja dysocjuje stopniowo to:
α1 > α2 > α3 > α4 ...
Dla słabych elektrolitów nie stosuje się stopnia, lecz stałą dysocjacji. Stała dysocjacji jest to stosunek iloczynu stężeń jonów do cząstek niezdysocjowanych:
![]()
![]()
Stałą dysocjacji słabego kwasu oznaczamy symbolem Ka, natomiast słabej zasady - Kb.
Ujemny logarytm dziesiętny z odpowiedniej wartości stałej dysocjacji słabego kwasu to pKa, a słabej zasady to pKb.
pKa = - log Ka
pKb = - log Kb
Wartość stałej dysocjacji zależy od rodzaju elektrolitu i temperatury, natomiast nie zależy od stężenia roztworu - jest wielkością charakterystyczna dla danego elektrolitu.
Dla elektrolitów bardzo rozcieńczonych zależność między stopniem, a stałą dysocjacji można zapisać:
dla elektrolitów słabych α < 5 %
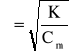
czyli
K = Cm · α2
dla elektrolitów mocniejszych
![]()
Te zależności to prawo rozcieńczalności Ostwalda.
Liczba wytworzonych podczas dysocjacji ładunków dodatnich jest równa liczbie wytwarzanych równocześnie ładunków ujemnych. Elektrolit AB (A - kation, B - anion) rozpada się zawsze na jeden kation i jeden anion, lecz ich ładunki są uzależnione od rodzaju elektrolitu:
AB → A+ + B- (np. HNO3 → H+ + NO3-)
AB → A2+ + B2- (np. CuSO4 → Cu2+ + SO42-)
AB → A3+ + B3- (np. AlPO4 → Al3+ + PO43-)
Elektrolity typu AB (dysocjujące na jeden kation i jeden anion) są nazywane elektrolitami binarnymi lub dwujonowymi (bez względu na wartość ładunku).
Elektrolity niebinarne (AB2, AB3, A2B3 itp.) rozpadają się w wodzie dając różne liczby kationów i anionów:
AB2 → A2+ + 2 B- [np. Ca(OH)2 → Ca2+ + 2 OH-]
AB2 → A4+ + 2 B2- [np. Pb(SO4)2 → Pb4+ + 2 SO42-]
AB3 → A3+ + 3 B- [np. AlCl3 → Al3+ + 3 Cl-]
A2B3 → 2 A3+ + 3 B2- [np. Fe2S3 → 2 Fe3+ + 3 S2-]
Słabe elektrolity niebinarne dysocjują w kilku etapach. W pierwszym etapie następuje odszczepienie jednego jonu (dysocjacja pierwszego stopnia), np.:
H2CO3 ↔ H+ + HCO3- K ≈ 5 · 10-7
Część wytworzonych jonów wodorowęglanowych HCO3- ulega dalszemu rozpadowi (dysocjacja drugiego stopnia):
HCO3- ↔ H+ + CO32- K ≈ 5 · 10-11
Dysocjacja w drugim etapie zachodzi w dużo mniejszym etapie niż w pierwszym.
W roztworze wytwarza się stan równowagi chemicznej między nie zdysocjowanymi cząsteczkami a jonami:
AB ↔ A+ + B-
cząsteczki nie jony wytworzone
zdysocjowane z cząsteczek
zdysocjowanych
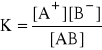
K - stała dysocjacji (stała równowagi)
Równowaga taka jest to równowaga dynamiczna, podlegająca prawu równowagi chemicznej. Jej dynamiczny charakter polega na tym, że w jednostce czasu na jony rozpada się tyle samo cząsteczek, ile równocześnie tworzy się w wyniku łączenia się jonów. Stężenie cząsteczek i jonów pozostaje jednak stałe.
Jeżeli w stanie równowagi liczba cząsteczek nie zdysocjowanych znacznie przewyższa liczbę cząstek zdysocjowanych, czyli równowaga jest przesunięta w lewo, elektrolit określa się jako słaby (nieznacznie zdysocjowany), a równanie dysocjacji wygląda następująco:
AB ↔ A+ + B-
W sytuacji gdy w roztworze są jony, a nie ma cząsteczek, mówi się o elektrolicie mocnym (całkowicie zdysocjowanym). Równanie chemiczne wygląda wtedy tak:
AB → A+ + B-
W roztworze kwasu stała równowagi wyraża się wzorem:
![]()
![]()
np. ![]()
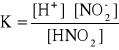
W roztworze wodorotlenku stała równowagi wyraża się wzorem:
![]()
![]()
np. ![]()
![]()
Oznacza to, że kwasy dysocjują z odszczepieniem jonów wodorowych H+, natomiast wodorotlenki odszczepiają anion wodorotlenowy OH-.
Współczynnik aktywności elektrolitu to stosunek aktywności jonu do stężenia tego jonu w roztworze.
Jest wielkością niemianowaną, która wyraża zmniejszenie aktywności jonu w stosunku do jego aktywności w roztworze doskonałym, spowodowane wzajemnym oddziaływaniem cząstek w roztworach rzeczywistych.
Współczynnik aktywności zależy od stężenia (bardziej dla elektrolitów aniżeli nieelektrolitów) - dla roztworów nieskończenie rozcieńczonych równa się on jedności. Doświadczalnie można wyznaczyć tzw. średnie współczynniki aktywności związane z aktywnością całego elektrolitu, dla poszczególnych jonów pomiar taki jest niemożliwy (roztwór).
Iloczyn jonowy wody (Kw) to iloczyn stężeń jonów wodorowych i wodorotlenowych.
![]()
Dzięki stałej wartości iloczynu [H+][OH-] można określać odczyn roztworu.
[OH-] = [H+] = 10-7 - roztwór obojętny
[H+] > 10-7 - roztwór kwaśny
[H+] < 10-7 - roztwór zasadowy
Ponieważ określanie stężeń jonów często wymaga stosowania wykładnika potęgowego wprowadzono dogodny system operowania ujemnym logarytmem stężenia jonów H+ i OH-.
Ujemny logarytm dziesiętny ze stężenia jonów wodorowych nosi nazwę pH roztworu (wykładnik wodorowy).
pH = - log [H+]
zatem:
[H+] = 10-pH
Natomiast ujemny logarytm dziesiętny ze stężenia jonów wodorotlenowych to pOH:
pOH = - log [OH-]
Zależność pomiędzy stężeniami jonów wodorowych i wodorotlenowych wyrażona za pomocą wykładników potęgi przybiera postać:
pH + pOH = 14
W roztworze obojętnym pH = pOH = 7, w roztworze kwaśnym pH < 7, natomiast w roztworze zasadowym pH > 7.
Wskaźniki pH (indykatory) to związki, które mają właściwość zmiany barwy w zależności od pH roztworu, są one słabymi kwasami lub zasadami organicznymi, których jony mają inne zabarwienie niż cząsteczki niezdysocjowane.
Dysocjacja wskaźnika o charakterze kwasu lub zasady przebiega według równania:
HInd ↔ H+ + Ind-
IndOH ↔ Ind+ + OH-
gdzie:
HInd, IndOH - cząsteczka niezdysocjowana
Ind- - anion wskaźnika
Ind+ - kation wskaźnika
Indykatory (wskaźniki pH) służą do orientacyjnego badania odczynu roztworu. Po wprowadzeniu wskaźnika do roztworu wodnego następuje jego częściowa dysocjacja i wytwarza się stan równowagi chemicznej:
H-R ↔ H+ + R-
czerwony bezbarwny żółty
Indykatory mogą być stosowane samodzielnie lub z obojętnym barwnikiem, wzmagającym intensywność ich koloru (wskaźniki mieszane). na zabarwienie wskaźników ma także wpływ temperatura oraz obecność w roztworze soli obojętnych, rozpuszczalników organicznych lub cząstek koloidalnych.
W zależności od rodzaju miareczkowania wyróżnia się wskaźniki:
alkacymeryczne - słabe kwasy lub zasady organiczne, tworzące z wodą sprzężoną parę kwas-zasada, przy czym postać kwasowa ma inne zabarwienie niż postać zasadowa. Do wskaźników alkacymerycznych należą m.in. oranż metylowy, czerwień metylowa, błękit tymolowy, fenoloftaleina.
kompleksometryczne - substancje organiczne, tworzące barwne kompleksy z oznaczanym metalem. Należą do nich m.in. czerń eriochromowa T, mureksyd, fiolet pirokatechinowy.
redoks - substancje organiczne, tworzące sprzężone układy redoks, przy czym postać utleniona wskaźników ma inna barwę niż postać zredukowana. Przykładami tych wskaźników są: safranina T, błękit metylenowy, ferroina (fenantrolina).
Do najczęściej stosowanych indykatorów należą:
fenoloftaleina - w roztworach zasadowych ma kolor malinowy, natomiast w roztworach kwaśnych jest bezbarwna.
oranż metylowy - w roztworach zasadowych ma kolor żółty, natomiast w roztworach kwaśnych zmienia barwę na czerwoną.
błękit bromotymolowy - zmienia barwę z zielonej na niebieska w zakresie pH 3,2 - 4,4.
papierek wskaźnikowy - pasek bibuły (lub obojętnego chemicznie polimeru) nasycony roztworem wskaźnika. Papierek wskaźnikowy w zetknięciu z roztworem przyjmuje barwę wskazującą na obecność danej substancji lub pozwalającą określić stężenie tej substancji - dzięki dołączonej skali barw.
Najczęściej używane papierki wskaźnikowe to: papierek lakumusowy, służący do wykrywania odczynu roztworu (w roztworach zasadowych ma kolor niebieski, w roztworach kwaśnych - czerwony), uniwersalny (do wyznaczania pH roztworu), jodoskrobiowy (do wykrywania utleniaczy w roztworze), ołowiowy (do wykrywania H2S), palladowy (do wykrywania CO).
Część eksperymentalna.
Przebieg doświadczeń.
Przewodnictwo elektryczne roztworów.
W kolejnych roztworach: kwas solny (HCl), kwas octowy (CH3COOH), wodorotlenek sodu (NaOH), wodorotlenek amonu (NH4OH), woda destylowana zanurzano elektrody. Zanotowano, które roztwory przewodzą prąd elektryczny. Przed każdą próba dokładnie przemywano elektrody wodą destylowaną
Stopień dysocjacji zasady i soli.
Do zlewki nalano 20 cm3 25 % roztworu amoniaku (NH3), zbadano przewodzenie prądu. Następnie dodano 10 cm3 lodowatego kwasu octowego (CH3COOH), roztwór wymieszano, ostudzono i ponownie zbadano jego przewodzenie.
Indykatory - wskaźniki.
Zbadano barwę poszczególnych wskaźników (fenoloftaleina, oranż metylowy, czerwień metylowa, papierek lakumusowy) w roztworach kwasu solnego (HCl), wodorotlenku sodu (NaOH) i wodzie destylowanej.
Równowaga w roztworze słabego kwasu.
Do probówki nalano 5 cm3 wody destylowanej, dodano 1 kroplę lodowatego kwasu octowego (CH3COOH) i 2 krople oranżu metylowego. Podzielono roztwory na dwie części. Do jednej dodano kilka kryształków octanu sodu (CH3COONa). Następnie porównano barwy roztworów.
Równowaga w roztworze słabej zasady.
Do probówki nalano 5 cm3 wody destylowanej, dodano 1 kroplę wodorotlenku amonu (NH4OH) i 2 krople fenoloftaleiny. Podzielono roztwory na dwie części. Do jednej dodano kilka kryształków chlorku amonu (NH4Cl). Następnie porównano barwy roztworów.
Wyniki pomiarów.
Przewodnictwo elektryczne roztworów.
Przewodnictwo elektryczne badano za pomocą konduktometru oraz urządzenia składającego się z dwóch elektrod, żarówki i źródła prądu.
Elektrody zanurzono w:
0,1 M roztworze kwasu solnego (HCl)
żarówka świeciła dość mocno (mocniej niż przy NaOH)
0,1 M roztworze kwasu octowego (CH3COOH)
żarówka nie świeciła się
0,1 M roztworze wodorotlenku sodu
żarówka świeciła słabo
0,1 M roztworze wodorotlenku amonu (NH4OH)
żarówka nie świeciła się
wodzie destylowanej
żarówka nie świeciła się
Stopień dysocjacji zasady i soli.
Do zlewki nalano 20 cm3 25 % roztworu amoniaku (NH4OH), zbadano przewodzenie prądu - żarówka ni świeciła się. Następnie dodano 10 cm3 lodowatego kwasu octowego (CH3COOH), roztwór ogrzał się - zaszła reakcja silnie egzotermiczna. Po ostudzeniu ponownie zbadano jego przewodzenie - żarówka świeciła się bardzo mocno.
NH4OH ↔ NH4+ + OH-
dużo mało
NH4OH + CH3COOH → CH3COONH4 + H2O
CH3COONH3 ↔ CH3COO- + NH4+
mało dużo
Indykatory - wskaźniki.
Zbadano barwę poszczególnych wskaźników (fenoloftaleina, oranż metylowy, czerwień metylowa, papierek lakumusowy) w roztworach kwasu solnego (HCl), wodorotlenku sodu (NaOH) i wodzie destylowanej.
Wskaźnik |
Kwas solny (HCl) |
Wodorotlenek sodu (NaOH) |
Woda destylowana |
oranż metylowy |
czerwony |
żółty |
jasny pomarańczowy |
fenoloftaleina |
bezbarwny |
malinowy |
mleczno-biały |
czerwień metylowa |
malinowy |
ciemny żółty |
jasny czerwony |
papierek lakumusowy |
ciemny czerwony (pH = 1) |
niebieski (pH = 10) |
bezbarwny |
Równowaga w roztworze słabego kwasu.
Do probówki nalano 5 cm3 wody destylowanej, dodano 1 kroplę lodowatego kwasu octowego (CH3COOH) i 2 krople oranżu metylowego. Podzielono roztwory na dwie części. Do jednej dodano kilka kryształków octanu sodu (CH3COONa). Następnie porównano barwy roztworów.
CH3COOH ↔ CH3COO- + H+ kolor czerwony (odczyn kwaśny)
dużo mało
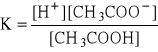
Po dodaniu do roztworu kryształków octanu sodu (CH3COONa), roztwór zmienił swój kolor na żółto-pomarańczowy - zmiana odczynu z kwaśnego na zasadowy.
CH3COONa ↔ CH3COO- + Na+
mało dużo
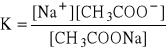
H2O + CH3COOH + CH3COONa → 2 CH3COO+ + 2 H+ + Na+ OH- kolor żółto-pomarańczowy (odczyn zasadowy)
NaOH ↔ Na+ + OH-
mało dużo
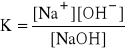
Równowaga w roztworze słabej zasady.
Do probówki nalano 5 cm3 wody destylowanej, dodano 1 kroplę wodorotlenku amonu (NH4OH) i 2 krople fenoloftaleiny. Podzielono roztwory na dwie części. Do jednej dodano kilka kryształków chlorku amonu (NH4Cl). Następnie porównano barwy roztworów.
NH4OH ↔ NH4+ + OH- kolor malinowy (odczyn zasadowy)
dużo mało
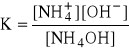
Po dodaniu do roztworu kryształków chlorku amonu, nastąpiło jego odbarwienie zmiana odczynu z zasadowego na kwaśny.
NH4Cl ↔ NH4+ + Cl-
mało dużo
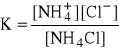
H2O + NH4OH + NH4Cl → 2 NH4+ + 2 OH- + H+ Cl- roztwór bezbarwny
(odczyn kwaśny)
Podsumowanie i wnioski.
Na podstawie przeprowadzonych doświadczeń można wyciągnąć następujące wnioski:
Przewodnictwo elektryczne roztworów.
kwas octowy i wodorotlenek amonu są słabymi elektrolitami, słabo przewodzą prąd elektryczny (NH4OH słabiej niż CH3COOH)
kwas solny i wodorotlenek sodu są mocnymi elektrolitami, dobrze przewodzą prąd elektryczny (HCl lepiej niż NaOH)
woda destylowana jest bardzo słabym elektrolitem, bardzo słabo przewodzi prąd elektryczny
Stopień dysocjacji zasady i soli.
Po włożeniu elektrod do 25 % roztworu amoniaku, żarówka nie zaświeciła się. Natomiast, gdy do roztworu dodano lodowatego kwasu octowego i ponownie włożono elektrody, żarówka świeciła się bardzo mocno. Oznacza to, że roztwór słabiej przewodzi prąd, a co za tym idzie jest słabiej zdysocjowany na jony (mniejszy stopień dysocjacji), niż sól (octan amonu).
αz < αs
αz - stopień dysocjacji zasady
αs - stopień dysocjacji soli
Indykatory - wskaźniki.
Wskaźniki zmieniają barwę w zależności od pH roztworu, a więc są one słabymi kwasami lub zasadami organicznymi, których jony mają inne zabarwienie niż cząsteczki niezdysocjowane.
Dysocjacja wskaźnika o charakterze kwasu lub zasady przebiega według równania:
HInd ↔ H+ + Ind-
IndOH ↔ Ind+ + OH-
gdzie:
HInd, IndOH - cząsteczka nie zdysocjowana
Ind- - anion wskaźnika
Ind+ - kation wskaźnika
Równowaga w roztworze słabego kwasu.
Po dodaniu kwasu octowego do wody destylowanej ulega on dysocjacji. Jednak jeżeli do tego roztworu dodamy octanu sodu, to nastąpi zmiana odczynu roztworu z kwaśnego na zasadowy. Oznacza to, że kwas octowy jest słabym kwasem (słabym elektrolitem), czyli w stanie równowagi liczba cząsteczek nie zdysocjowanych znacznie przewyższa liczbę cząstek zdysocjowanych - równowaga jest przesunięta w lewo.
CH3COOH ↔ CH3COO- + H+
mało dużo
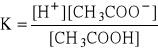
Równowaga w roztworze słabej zasady.
Po dodaniu wodorotlenku amonu do wody destylowanej ulega on dysocjacji. Jednak jeżeli do tego roztworu dodamy chlorku amonu, to nastąpi zmiana odczynu roztworu z zasadowego na kwaśny. Oznacza to, że wodorotlenek amonu jest słabą zasadą (słabym elektrolitem), czyli w stanie równowagi liczba cząsteczek nie zdysocjowanych znacznie przewyższa liczbę cząstek zdysocjowanych - równowaga jest przesunięta w lewo.
NH4OH ↔ NH4+ + OH-
dużo mało
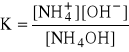
Wyszukiwarka
Podobne podstrony:
chemia nr 4-sik, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
SprawozdanieNr2Kevcio, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
sprawozdaniewapno2, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
Moje sprawozdanie chemia nr 3, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana,
cemm, Studia budownictwo pierwszy rok, Chemia budowlana, sprawozdania
Sprawozdanie z ćw nr6 chemia bud, Studia budownictwo pierwszy rok, Chemia budowlana, sprawozdania
SPRAWOZDANIE NR 2 CHEMIA BUDOWLANA SPOIWA WAPIENNE MAJ 2012, Studia budownictwo pierwszy rok, Chemia
Sprawozdanie z ćw nr1 - chemia bud, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z che
chemia nr3-sik, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
Moje sprawozdanie chemia nr 4, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana,
sprw. 2, Studia budownictwo pierwszy rok, Chemia budowlana, sprawozdania
sprw. 2, Studia budownictwo pierwszy rok, Chemia budowlana, sprawozdania
sprawozdanieNR1Daras, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
Chemia1-3, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
SprawozdanieNr2Daras, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
sprawozdanie cement, Studia budownictwo pierwszy rok, Chemia budowlana, sprawka z chemii
Spoiwa cementowe, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana, Na Egzamin
UNIWERSYTET ZIELONOGÓRSKI spr, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana,
więcej podobnych podstron