Wykład 4. 7.11.2008
CHEMIA*
Twardość wody ( zawartość soli wapnia i magnezu)
Przemijająca ( wodorowęglanowa )
Powstawanie twardości wody
CaCO3 + CO2 + H2O Ca (HCO3)2
Mg(OH)2 + 2CO2 Mg (HCO3)2
Usuwanie twardości wody przez gotowanie (100oC)
Ca (HCO3)2 CaCO3 + CO2 + H2O
Mg (HCO3)2 Mg(OH)2 + 2CO2
Stała ( siarczany, chlorki)
CaSO4 + NaCO3 CaCO3 + Na2SO4
Twardość ogólna ( stała + przemijająca)
Stopnie twardości wody.
1 twardości milimolowy - 20.04 mg Ca2- lub 12.16 mg Mg2- w 1 dm3 wody
1 niemiecki (1N) - 10 mg CaO lub 7.19 mg MgO w 1 dm3 wody
Koloidy - są to układy fizyczne niejednorodne składające się z fazy rozpraszającej i rozproszonej.
Faza rozproszona - 5 * 10-5 - 10-7cm
Ośrodek rozpraszający
Cząstki koloidowe |
GAZ |
CIECZ |
FAZA STAŁA |
GAZ |
_________ |
PIANA |
PIANA STAŁA |
CIECZ |
MGŁA |
EMULSJA |
STAŁA EMULSJA |
FAZA STAŁA |
DYM |
ZOL SUSPENSJA |
STAŁA SUSPENSJA |
Cząsteczki koloidu przenikają przez sączki z bibuły filtracyjnej podobnie jak cząsteczki rozpuszczalnika ale w przeciwieństwie do nich nie przenikają przez naturalne i sztuczne błony selektywnie przepuszczalne.
Metody otrzymywania koloidów.
metody dyspersyjne - rozdrobnienie w młynach koloidowych,
metody kondensacyjne ( hydroliza )
FeCl3 + HOH Fe(OH)3 + 3HCl
Właściwości koloidów:
dializa
błona selektywna
H2O przepuszczalna
krew krew oczyszczona
H2O
NaCl Ca(NH)2
efekt TYNDALA - ugięcie lub rozproszenie światła na cząsteczkach koloidu
koloidy dzielimy na:
liofilowe ( hydrofilowe ) lubiące rozpuszczalnik np. żelatyna
liofobowe ( hydrofobowe ) nie lubiące rozpuszczalnika np. koloidy metali
koagulacja i peptyzacja ( ruchy Browna )
KOAGULACJA
ZOL ŻEL
PEPTYZACJA
flotacja - wzbogacanie rud
Fe2O3 + C Fe + CO2
DYFUZJA I OSMOZA
Dyfuzja jest to zjawisko samorzutnego rozprzestrzeniania się cząsteczek gazów, cieczy czy substancji stałych wywołanych ich ruchem kinetyczno - molekularnym, prowadzi do wyrównania stężeń.
Najszybciej w gazach, wolniej w cieczach, najwolniej w ciałach stałych.
Przyspiesza ją temperatura i mieszanie.
Osmoza - jest to jednostronna dyfuzja rozpuszczalnika przez błonę selektywnie przepuszczalną (pół przepuszczalną ). Czynnik wywołujący to zjawisko nazywany jest ciśnieniem osmotycznym. Możemy je zmierzyć stosując komórkę osmotyczną lub obliczyć.
Ciśnienie osmotyczne substancji w roztworze przy danej objętości w stężeniu i temperaturze jest równe ciśnieniu jakie wywierałaby ta sama ilość substancji w stanie gazowym gdyby zajmowała w tej samej temperaturze taką objętość jak roztwór.
Komórka osmotyczna.
Ciśnienie osmotyczne.
Słupek cieczy tak długo będzie się podnosił do góry aż ciśnienie osmotyczne w komórce zostanie zrównoważone przez ciśnienie hydrostatyczne.
Ciśnienie osmotyczne.
Π = c * R * T ( dla nieelektrolitów)
Nie dysocjują
Π = i * c * R * T ( dla elektrolitów)
i= 1+(n - 1 ) * ∞
2+ 2-
Al2(SO4)3 2Al + 3SO4
i= 1 + ( 5 - 1 ) * 1 = 1 + 4 = 5
Plazmoliza - kurczenie
Turgor - nasycanie
Plazmoliza Krwinki Hemoliza
1/3 % NaCl 0,9% NaCl 0,6% NaCl
Nawóz Deszcz
Plazmoliza Rośliny Turgor
Dysocjacja elektrolityczna wg Areniusa.
Jest to rozpad cząsteczek elektrolitów na jony pod wpływem rozpuszczalnika.
Miarą mocy elektrolitu jest stopień dysocjacji alfa. Stosunek liczby moli cząstkowych z dysocjowanych do liczby moli cząstek rozpuszczonych.
Wartości od 0 - 100.
Stopień dysocjacji zależy od:
rodzaju elektrolitu ( typu wiązań )
rodzaju rozpuszczalnika ( polarności rozpuszczalnika )
stężenia ( stopień dysocjacji wzrasta z rozcieńczenie )
temperatury ( wzrasta z temperaturą ).
Częściej stosowaną miarą mocy elektrolitu jest stała dysocjacji, która nie zależy od stężenia.
CH3COOH H+ + CH3COO-
[H+] [ CH3C00-]
K = CH3COOH
Stała dysocjacji jest to stosunek iloczynu stężeń molowych produktu reakcji do stężenia molowego substratu.
Inne teorie dysocjacji.
Protonowa teoria kwasów i zasad Bronsteda - Lowry'ego.
Kwasy to protonodawcy a zasady to protonobiorcy ( akceptory protonów ).
Ten sam związek w zależności od rodzaju kwasu może być kwasem lub zasadą w teorii B - L.
HCl + H2O H30+ + Cl-
H20 + NH3 NH+ + OH-
H30+ + OH- H2O + H20
Woda może być protonodawcą lub protonobiorcą.
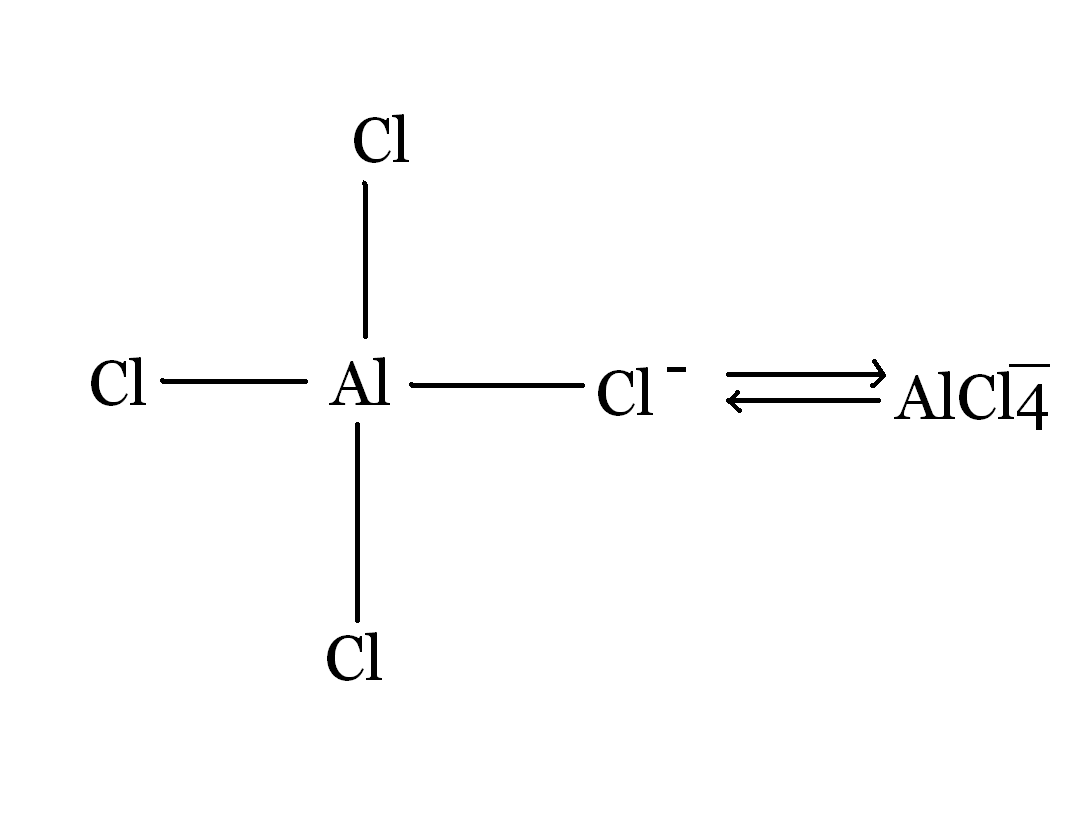
Elektronowa teoria kwasów i zasad Lewisa.
Teoria ta dotyczy związków a protonowych (nie mających protonów ), kwas to biorca pary elektronów, zasada dawca protonu.
BF3 + NH3 F3B + NH3
Iloczyn jonowy wody.
H20 + H20 H3O+ + OH-
H2O H+ + OH-
[H+][OH-]
K= [H2O] = 1,8 * 10-16
1000
[H20] = 18 * 55,4 [mol/dm3]
[H+] * [OH-] = K * 55,4 = 1,8*10-16 * 55,4 = 10-14 [mol/dm3]
[H+] * [OH-] = 10-14
[H+] = [OH-] = 10-7 odczyn obojętny
Duński uczony Syrensen wprowadził pojęcie wykładnika stężeń jonów wodorowych.
pH - wykładnik stężenia jonów wodorowych
pH = - log [H+]
pOH = - log [OH-]
pH + pOH = 14
pH = 7 obojętny
pH > 7 zasadowy
pH < 7 kwaśny
pH jest to ujemny logarytm dziesiętny liczby wyrażającej stężenie molowe kationów wodorowych H+.
Ponieważ pewne procesy wymagają określonego pH dlatego aby zapobiec zmianą pH stosuje się mieszaniny buforowe. Są to mieszaniny złożone z słabych kwasów lub słabych zasad z ich solami. Mieszaniny buforowe utrzymują stałe pH przy dodawaniu do nich niewielkich ilości kwasów, zasad lub wody.
Ile określa pojemność buforowa?
Pojemność buforowa to liczba moli kationów wodorowych H+ lub anionów wodorotlenowych OH- która dodana do jednego dm3 mieszaniny buforowej zmienia pH o 1.
Mieszaniny buforowe.
Bufor amonowy
NH3 * H2O zasada - protonobiorca
NH4Cl - sól tej zasady - protonodawca
Bufor octanowy
CH3COOH - kwas protonodawca
CH3COONa - zasada protonobiorca
Bufor fosforanowy
H2PO4- - protonodawca
HPO42- - protonobiorca
Bufor węglanowy
H2CO3 - protonodawca
NaHCO3 - protonobiorca
Działanie stabilizujące mieszanin buforowych.
Omów na przykładzie mieszaniny kwasów.
CH3COOH CH3COO- + H+
CH3COONa CH3COO- + Na+
CH3COO- + H+(H30+) CH3COOH
CH3COOH + OH- CH3COO- + H2O
NH3 * H2O NH4+ + OH-
NH4Cl NH4+ + Cl-
NH3 + H+(H3O+) NH4+ + H2O
NH4+ + OH+ NH3+ + H2O
NaHPO4 2Na+ + HPO42-
H2PO4+ + OH- HPO42- + H2O
HPO42- + H+ H2PO4-
Węglanowy
CO2 + H2O H2CO3 H+ + HCO3-
NaHCO3 Na+ + HCO3-
H2CO3 + OH- HCO3- + H2O
HCO3- + H+ H2CO3
HCO3- + H3O- H2CO3 + H2O
7
W4
Wyszukiwarka
Podobne podstrony:
Wykad 3 WD, Chemia
Wykad 2 WD, Chemia
Wykad 1 WD, Chemia
wykad 5 dWD, Chemia
Chemia fizyczna - wykad 5, OŚ, sem II 1 SOWiG, Chemia Fizyczna
Chemia kliniczna wykad VIII) 11
chemia kliniczna-wykad 2, BIO, Diagnostyka Laboratoryjna, chemia kliniczna, semestr V
Wykad 6, Chemia
Chemia Bionie wyk1
chemia powt
Wykład Chemia kwantowa 11
więcej podobnych podstron