INSTYTUT TECHNOLOGII NIEORGANICZNEJ I NAWOZÓW MINERALNYCH
WYDZIAŁ CHEMICZNY
POLITECHNIKA WROCŁAWSKA
KONTROLA JAKOŚCI SUROWCÓW I PRODUKTÓW
Ćwiczenie nr 1. Kontrola jakości wody
Spis treści: strona
Wprowadzenie 2
Podstawowe wskaźniki charakteryzujące jakość wód 2
Analiza wody do picia i na potrzeby gospodarcze 5
Analiza wody kotłowej i do celów energetycznych 5
Analiza ścieków 6
Sposób wykonania oznaczeń 6
Wrocław 2014
1. Wprowadzenie
Woda jest jednym z podstawowych elementów środowiska, w którym żyjemy. Pod względem chemicznym oznacza substancję o wzorze H2O. Jednak woda występująca w przyrodzie nie jest czystą chemicznie substancją, lecz wodnym roztworem różnych związków nieorganicznych i organicznych. Substancje rozpuszczone w wodzie pochodzą ze źródeł naturalnych lub są wprowadzone do wód w wyniku działalności człowieka (ścieki). Do najważniejszych przyczyn zanieczyszczeń wód należy zaliczyć rozwój przemysłu i rolnictwa oraz procesy demograficzne.
Przeciętną, przybliżoną zawartość kationów i anionów, występującą w największych ilościach w naturalnych wodach powierzchniowych, przedstawiono w tabeli 1.
Tabela 1.
Kationy |
Aniony |
||
Wzór chemiczny |
Stężenie, mg/dm3 |
Wzór chemiczny |
Stężenie, mg/dm3 |
Ca2+ |
70 |
HCO3- |
150 |
Mg2+ |
24 |
SO42- |
40 |
Na+ |
15 |
Cl- |
20 |
K+ |
10 |
NO3- |
3 |
Fe2+ i Mn2+ |
do 1 |
|
|
Oprócz rozpuszczonych soli, przedstawionych w tabeli 1, woda zawiera rozpuszczone gazy, takie jak CO2 i O2, a także zawiesiny, jak Fe(OH)3, MnO2 i SiO2.
Woda stanowi nie tylko ważny element naturalnego środowiska, lecz posiada bardzo istotne znaczenie gospodarcze, ze względu na jej szerokie zastosowanie w przemyśle, w gospodarce rolnej i leśnej, a także w gospodarstwach domowych.
Do celów przemysłowych i komunalnych używane są wody powierzchniowe i gruntowe. Tylko w niewielu przypadkach woda pobierana ze źródła nadaje się bezpośrednio do użycia - zwykle należy ją przed użyciem uzdatnić. Stosowane są różne metody oczyszczania wody. Zwykle najtrudniejsze do uzdatniania są wody zawierające znaczne ilości substancji organicznych.
W zależności od zastosowania, woda musi spełniać odpowiednie wymogi ujęte w normach. Szczególnie wysokie wymagania stawiane są wodzie stosowanej w energetyce. Jakość użytej wody decyduje często nie tylko o wskaźnikach ekonomicznych produkcji, ale wpływa również w istotny sposób na trwałość oraz niezawodność aparatów i urządzeń.
2. Podstawowe wskaźniki charakteryzujące jakość wód
Do podstawowych wskaźników charakteryzujących właściwości fizyczne wody należą:
temperatura, mętność (przezroczystość), barwa, smak, zapach oraz przewodnictwo elektryczne.
Skład chemiczny wód charakteryzuje znacznie więcej składników, do których należy zaliczyć:
suchą pozostałość, zawiesiny, wartość pH, zasadowość, kwasowość, twardość, utlenialność, zawartość rozpuszczonego ditlenku węgla i tlenu, BZT-5, ChZT, zawartość chlorków, siarczanów, związków azotowych, metali ciężkich i inne. W celu określenia przydatności wody do różnego rodzaju zastosowań lub określenia intensywności jej oddziaływania na różnego rodzaju urządzenia, wykonuje się analizy wody. Ilość i rodzaj oznaczeń są zależne od celu badań wody.
Jednym z podstawowych wskaźników jakości wody jest tzw. sucha pozostałość, tj. pozostałość po odparowaniu wody w temp. 105ºC, wyrażona w miligramach na dm3 wody. Daje ona wskazówki o ogólnej zawartości ciał stałych w wodzie (organicznych i nieorganicznych, rozpuszczonych oraz zawiesin, ulegających i nie ulegających rozkładowi podczas prażenia). Np. dla wód wodociągowych sucha pozostałość nie powinna przekraczać 500 mg/dm3, a dla wody używanej do przygotowywania betonów - 5000 mg/dm3.
Zawarte w wodzie domieszki (składniki naturalne) i zanieczyszczenia nadają wodzie inne właściwości, niż posiada czysty związek chemiczny H2O. W wyniku dysocjacji elektrolitycznej wody powstają jony H3O+ i OH-. W wodzie nie zawierającej domieszek stężenia tych jonów są sobie równe
i w temp. 22ºC wynoszą po 10-7 mol/dm3. Wartość pH takiej wody wynosi 7,0, a przewodność właściwa wynosi 4·10-8 S/cm. Wartość pH wód naturalnych jest zawarta najczęściej w granicach 6,5-8,5, a przewodność właściwa w granicach 3,3·10-4 - 1,3·10-3 S/cm. Różnice te są spowodowane przede wszystkim zawartością CO2 oraz soli kwasu węglowego w wodzie. Dzięki ich obecności wody naturalne wykazują zdolność zobojętniania mocnych kwasów (zasadowość) oraz mocnych zasad (kwasowość).
Rozróżnia się dwa rodzaje kwasowości (mineralna i węglanowa) oraz dwa rodzaje zasadowości wód (zasadowość F - oznaczana wobec fenoloftaleiny i M - oznaczana wobec metyloranżu). Zależności pomiędzy obecnością w wodzie różnych domieszek, a wartością pH oraz poszczególnymi rodzajami kwasowości i zasadowości, przedstawiono w tabeli 2. W tabeli tej podano również reakcje zachodzące przy oznaczaniu zasadowości i kwasowości.
Tabela 2. Wpływ domieszek na odczyn i właściwości wody
Wartość pH |
4,6 8,3 |
||
Rodzaj wskaźnika |
Metyloranż Fenoloftaleina |
||
Kolor roztworu |
różowożółty← | →żółty bezbarwny← | →czerwony |
||
Rodzaj zasadowości |
|
||
|
|
||
Domieszki powodujące zasadowość |
|
HCO3- |
CO32- CO32- + HCO3- CO32- + OH- OH- |
Reakcje podczas oznaczania zasadowości |
|
HCO3- + H+ = H2CO3 = H2O + CO2 |
OH- +H+ = H2O CO32- + H+ = HCO3- |
|
kwasowość ogólna |
||
|
|
||
Domieszki powodujące kwasowość |
silne kwasy miner. (HCl, H2SO4), hydrolizujące sole silnych kw. i słabych zasad (np. FeSO4) |
CO2, (H2CO3)*, |
|
Reakcje podczas oznaczania kwasowości |
H+ + OH- = H2O |
CO2 + OH- =HCO3- |
|
* H2CO3 stanowi nieznaczną część CO2 rozpuszczonego w wodzie.
Rys. 1. Charakterystyka ditlenku węgla występującego w wodach naturalnych.
Ditlenek węgla, wodorowęglany i węglany zawarte w wodach naturalnych, pochodzą z atmosfery, z procesów mineralizacji związków organicznych oraz z procesów rozpuszczania skał węglanowych.
Do określenia łącznej zawartości CO2 H2CO3, HCO3- i CO32- w wodzie używa się pojęcia ogólny ditlenek węgla. Schemat układu rodzajów ditlenku węgla w wodach naturalnych przedstawiono na rys. 1. Związany ditlenek węgla występuje w postaci jonów CO32- i HCO3-, natomiast wolny ditlenek węgla - w postaci H2CO3 (ok. 1%) i rozpuszczonego CO2 w wodzie (ok. 99%). Część wolnego ditlenku węgla, niezbędna do utrzymania w roztworze rozpuszczonego Ca(HCO3)2 nazywa się ditlenkiem węgla przynależnym (równowaga węglanowo - wapniowa), natomiast pozostała część ditlenku węgla wolnego to ditlenek węgla agresywny w stosunku do betonów i metali. Równowagę węglanowo - wapniową opisują równania (1) i (2):
Ca(HCO3)2 ↔CaCO3↓ + H2O +CO2↑ (1)
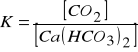
(2)
Z równania (2) wynika, że stężenie ditlenku węgla przynależnego jest wprost proporcjonalne
do stężenia jonów wodorowęglanowych. Ditlenek węgla agresywny (różnica między CO2 ogólnym
i przynależnym) jest zdolny do reakcji z CaCO3, będącym składnikiem betonu. Przebieg tej reakcji powoduje tzw. korozję węglanową betonu [reakcja (1) przebiega wtedy w lewą stronę].
Jednym z podstawowych wskaźników charakteryzujących wodę jest jej twardość. Twardość wody jest powodowana obecnością kationów wieloładunkowych, głównie wapnia i magnezu, które zdolne są do tworzenia kamienia kotłowego oraz trudnorozpuszczalnych soli kwasów tłuszczowych w reakcji z mydłami. W wodach naturalnych i pitnych dominują jony Ca2+ i Mg2+, natomiast inne kationy, takie jak Fe2+, Mn2+, Zn2+, Cu2+ powodujące twardość, występują w znacznie mniejszych ilościach. Rozróżnia się więc twardość wapniową, magnezową oraz twardość ogólną, będącą sumą twardości wywołanej przez wszystkie kationy wieloładunkowe.
Podczas ogrzewania wody zawarte w niej wodorowęglany rozkładają się wg równań reakcji:
Ca(HCO3)2 = CaCO3↓ + H2O + CO2↑ (3)
Mg(HCO3)2 = MgCO3↓ + H2O + CO2↑ (4)
MgCO3+ H2O = Mg(OH)2↓ + CO2↑ (5)
Powstający w wyniku tych reakcji węglan wapniowy i wodorotlenek magnezowy oraz mogący się tworzyć siarczan wapniowy (gips), osadzają się na ściankach urządzeń grzewczych, w wyniku czego tworzy się tzw. kamień kotłowy.
Oprócz wodorowęglanów, w wodach naturalnych w największych ilościach występują chlorki
i siarczany. Przedostają się one do wody wskutek wymywania ze skał osadowych, a także w wyniku utleniania siarczków metali ciężkich. Obecność siarczanu wapnia w wodach przemysłowych jest niepożądana, gdyż powoduje on powstawanie szczególnie twardego kamienia kotłowego. Ponadto obecność chlorków i siarczanów nadaje wodzie charakter agresywny wobec stali, a siarczany zawarte w wodzie gruntowej powodują korozję betonu i żelbetu.
Występująca w wodzie równocześnie wysoka zawartość chlorków, związków azotu i wysoka utlenialność, wskazują na zanieczyszczenie wody naturalnej substancjami pochodzenia zwierzęcego. Utlenialność wody jest to umowny wskaźnik, określający zdolność wody do pobierania tlenu z nadmanganianu potasowego w środowisku kwaśnym lub alkalicznym, we wrzącej łaźni wodnej w ciągu 30 minut. Redukcja nadmanganianu w tych warunkach zachodzi wskutek utleniania się zawartych w wodzie związków organicznych, niektórych łatwo utleniających się związków nieorganicznych (np. Cl- o stężeniu powyżej 300 mg/dm3, Fe2+, NO2-, H2S). Utlenialność daje więc tylko przybliżone pojęcie o zawartości związków organicznych i oznaczona w ten sposób ilość związków organicznych jest często znacznie niższa od rzeczywistej (wynosi zwykle 60-70%).
Podobnie jak utlenialność, zawartość tlenu w wodzie, a ściślej - procent nasycenia wody naturalnej tlenem, jest jednym z podstawowych wskaźników stopnia zanieczyszczenia wód powierzchniowych. Tlen rozpuszczony w wodach powierzchniowych pochodzi z atmosfery oraz niekiedy - z procesów fotosyntezy. Czyste wody powierzchniowe wykazują stopień nasycenia tlenem bliski 100%. W miarę wzrostu zanieczyszczenia wód substancjami organicznymi, stopień nasycenia spada, gdyż część tlenu jest zużywana w procesach biochemicznych, zachodzących w wodzie. Oznaczanie zawartości tlenu rozpuszczonego w wodzie wykonuje się celem określenia, czy istnieją warunki do samooczyszczania się wody naturalnej. Ponadto kontroluje się zawartość tlenu w wodzie kotłowej, gdyż tlen występujący wraz z agresywnym CO2 intensyfikuje procesy korozyjne urządzeń metalowych.
3. Analiza wody do picia i na potrzeby gospodarcze
Warunki, jakim musi odpowiadać woda używana do picia, przedstawiono w tabeli 3.
Tabela 3. Dopuszczalny skład wody do picia i na potrzeby gospodarcze.
Składnik |
Jednostki |
Dopuszczalna ilość |
Barwa Odczyn (pH) Mętność Substancje rozpuszczone Twardość (CaCO3) Chlorki Fluorki Siarczany Żelazo Mangan Ołów Arsen Miedź Cynk Rtęć Kadm Chrom (Cr6+) Nikiel Wolny chlor Ditlenek węgla agresywny Liczba kolonii bakterii na agarze po 24 godz. w temp. 37ºC, w 1 ml wody nie większa niż |
mg/dm3 - mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3 mg/dm3
|
20 6,5-8,5 5 800 500 300 1,5 200 0,5 0,1 0,05 0,05 1,0 5,0 0,001 0,005 0,01 0,03 0,3-0,5 0
20 |
Należy podkreślić, że duża część oznaczeń podanych w tabeli 3. powinna być wykonana bezpośrednio po pobraniu próbek, gdyż w czasie przechowywania próbek zachodzą różne procesy, w wyniku których zmienia się skład chemiczny wody i zmieniają się jej właściwości fizyczne. Przykładem takich zjawisk jest pojawiające się niekiedy zmętnienie, spowodowane natlenieniem wody i utratą ditlenku węgla, co prowadzi do wytrącania się CaCO3 lub Fe(OH)3 zgodnie z równaniami (1) i (6):
2Fe(HCO3)2 + H2O + 0,5O2 = 2 Fe(OH)3↓ + 4CO2↑ (6)
W programie zajęć przewidziano analizę próbek wody, wskazanych przez prowadzącego zajęcia. Należy wykonać następujące oznaczenia:
przybliżonej zawartości soli rozpuszczonych w wodzie metodą konduktometryczną,
kwasowości mineralnej i ogólnej
zasadowości F i M
zawartości wapnia i magnezu oraz twardości ogólnej
wolnego i agresywnego CO2.
4. Analiza wody kotłowej i do celów energetycznych
Zastosowanie wody w przemyśle jest bardzo różnorodne. Woda stanowi bowiem:
środowisko reakcji prowadzonych w roztworach wodnych
surowiec chemiczny
nośnik ciepła w procesach ogrzewania i chłodzenia
środek pomocniczy w różnych procesach technologicznych.
Stosowanie wody w energetyce jako nośnika ciepła jest powszechne. Wody naturalne w stanie surowym na ogół nie nadają się do zastosowania w energetyce. Ich zanieczyszczenia powodują tworzenie się kamienia kotłowego, zaburzenia w odparowaniu wody oraz korozję urządzeń. Przygotowanie wody naturalnej do zastosowania w energetyce wymaga zwykle przeprowadzenia wielu operacji, mających na celu usunięcie z niej pewnych zanieczyszczeń lub korektę jej właściwości, przy niewielkich zmianach składu. W celu usunięcia osadów i zawiesin wodę rzeczną przepuszcza się przez filtry piaskowo-żwirowe. Po filtracji uzyskuje się wodę surową, którą poddaje się dekarbonizacji, a następnie koagulacji, dodając wodorotlenek wapniowy i substancje, które hydrolizując, wytwarzają cząstki koloidalne o przeciwnych ładunkach elektrycznych, w stosunku do cząstek znajdujących się w wodzie. Cząstki koloidów (obecne w wodzie i wytworzone w wyniku wprowadzania koagulantów) łączą się w aglomeraty, które można oddzielić na filtrach. Między innymi zachodzą wtedy następujące reakcje:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + 2H2O (7)
FeSO4 + 2H2O = Fe(OH)2(koloid) + H2SO4 (8)
Al2(SO4)3 +6H2O = 2Al(OH)3 (koloid) +3H2SO4 (9)
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O. (10)
W wyniku powyższych procesów otrzymuje się wodę skoagulowaną i zdekarbonizowaną, którą dalej przerabia się na dwa sposoby, prowadząc zmiękczanie lub demineralizację. Zmiękczanie wody ma na celu usunięcie kationów wieloładunkowych (głównie wapnia i magnezu), które prowadzi się na wymieniaczach jonowych kationitowych, pracujących w cyklu sodowym:
![]()
(11)
Demineralizacja wody następuje kolejno w wymieniaczach kationitowych, pracujących w cyklu wodorowym i anionitowych, pracujących w cyklu wodorotlenowym. Zachodzą tu następujące procesy:
![]()
(12)
![]()
(13)
W wyniku przepuszczenia wody dodatkowo przez złoże węgla aktywnego następuje ponadto oczyszczenie wody z substancji organicznych.
5. Analiza ścieków
Analizy ścieków wykonuje się zwykle w celu:
kontroli ilości (ładunku) zanieczyszczeń odprowadzanych do odbiornika, ze względu na ochronę środowiska wodnego
opracowania założeń do projektu oczyszczalni
kontroli pracy istniejących urządzeń do oczyszczania ścieków.
Zależnie od założonego celu zmienia się zakres i metody analizy, przy czym dopasowuje się je do specyfiki ścieków. Ładunek zanieczyszczeń odprowadzany w ściekach oblicza się z iloczynu stężenia zanieczyszczeń i objętości przepływających ścieków. Miarą szybkości przemian zanieczyszczeń ulegających utlenianiu jest biologiczne zapotrzebowanie tlenu (BZT) oraz chemiczne zapotrzebowanie tlenu (ChZT). BZT określa ilość tlenu, potrzebną do biochemicznego utlenienia głównie związków organicznych w wodzie lub ściekach, w warunkach tlenowych w temp. 20ºC. ChZT określa ilość tlenu pobranego od utleniacza w reakcji chemicznego utleniania zanieczyszczeń, w ściśle określonych warunkach. W procesie biochemicznego utleniania zanieczyszczeń organicznych, zawierających azot, powstają w pierwszej fazie jony amonowe, które ulegają następnie utlenieniu kolejno do jonów azotanowych(III) i azotanowych(V). Na podstawie stężenia jonów azotanowych można wnioskować o efektywności procesu oczyszczania ścieków metodą osadu czynnego.
Typowa instalacja do oczyszczania ścieków obejmuje wstępne oczyszczanie mechaniczne (osadzanie), które bywa czasami połączone z oczyszczaniem chemicznym (neutralizacja, koagulacja). Wstępnie oczyszczone ścieki poddaje się ewentualnie oczyszczaniu biologicznemu (z użyciem osadu czynnego). Ścieki oczyszczone biologicznie odprowadza się na ogół do odbiornika, a osad poddaje się fermentacji.
6. Sposób wykonania oznaczeń
Oznaczanie przybliżonej zawartości soli rozpuszczonych w wodzie metodą konduktometryczną
Zasada oznaczania
Oznaczenie polega na wyznaczeniu przewodnictwa właściwego badanej wody w określonej temperaturze oraz określeniu na tej podstawie zawartości soli rozpuszczonych w wodzie.
Przyrządy i sprzęt: 1. konduktometr
zlewka (100cm3)
tryskawka
Wykonanie oznaczenia
Wykonać pomiar przewodnictwa właściwego badanej próbki zgodnie z instrukcją przyrządu.
Obliczanie wyników
Obliczyć wynik korzystając z zależności: C = 750 · κ , mg/dm3,
gdzie: κ - przewodnictwo właściwe próbki, mS/cm
C - stężenie soli rozpuszczonych w wodzie, mg/dm3.
6.2. Oznaczanie wartości pH
Przyrządy, sprzęt i odczynniki: 1. pHmetr
2. wzorce pH
3. zlewki
4. tryskawka
Wykonanie oznaczenia
Wykonać kalibrowanie pH-metru i pomiar pH badanej próbki zgodnie z instrukcją przyrządu.
6.3. Oznaczanie kwasowości mineralnej i węglanowej oraz zasadowości F i M
Oznaczanie polega na zobojętnieniu próbki wody roztworem 0,1 M NaOH lub 0,1 M HCl odpowiednio wobec metyloranżu i fenoloftaleiny.
Sprzęt i odczynniki
kolba stożkowa (200-300 cm3)
cylinder miarowy (100 cm3)
dwie biurety (25-50 cm3)
0,1 M roztwór wodny NaOH
0,1 M roztwór wodny HCl
0,1% roztwór alkoholowy fenoloftaleiny
0,1% roztwór wodny metyloranżu
Wykonanie oznaczenia kwasowości mineralnej i węglanowej
Do kolby stożkowej odmierzyć 100 cm3 wody i dodać 3 krople metyloranżu. Jeżeli woda zabarwi się na kolor czerwony, to posiada ona kwasowość mineralną. W celu oznaczenia kwasowości mineralnej miareczkuje się przygotowaną próbkę 0,1 M roztworem NaOH do zmiany barwy czerwonej na pomarańczową. Natomiast jeżeli woda po dodaniu metyloranżu zabarwi się na kolor żółty , wówczas nie posiada ona kwasowości mineralnej.
W celu oznaczenia kwasowości ogólnej należy odmierzyć 100 cm3 badanej wody do kolby stożkowej i dodać ok. 3 krople roztworu fenoloftaleiny. Jeżeli woda nie zabarwi się na kolor różowy, należy miareczkować 0,1 M roztworem NaOH do pojawienia się lekko różowego zabarwienia, utrzymującego się nie krócej niż 3 minuty.
Obliczanie wyników kwasowości mineralnej i węglanowej
Wyniki oznaczeń kwasowości mineralnej (Kmin) i ogólnej (Kog) oblicza się ze wzoru:
![]()
, mVal/dm3,
gdzie: a - objętość 0,1 M roztworu NaOH, zużyta do miareczkowania odpowiednio wobec metyloranżu,
i (b) - wobec fenoloftaleiny, cm3,
V - objętość próbki, cm3.
Wyniki oznaczania kwasowości węglanowej (Kwęglan.) oblicza się odejmując od kwasowości ogólnej (Kog) kwasowość mineralną (Kmin).
Wykonanie oznaczenia zasadowości F i M
Do kolby stożkowej odmierzyć 100 cm3 wody i dodać 4 krople roztworu fenoloftaleiny. Jeżeli woda zabarwi się na różowo lub czerwono, to posiada ona zasadowość F. W celu jej oznaczenia należy przygotowaną próbkę zmiareczkować 0,1 M HCl do zaniku różowego zabarwienia. Jeżeli woda po dodaniu fenoloftaleiny nie barwi się na kolor różowy, to nie posiada zasadowości F.
W celu oznaczenia zasadowości M należy dodać do próbki, w której oznaczono zasadowość F,
3 krople metyloranżu i miareczkować 0,1 M HCl do zmiany barwy z żółtej na pomarańczową. Jeżeli próbka wody po dodaniu metyloranżu zabarwia się na kolor różowy lub czerwony, to woda nie posiada zasadowości M.
Obliczanie wyników zasadowości F i M
Zasadowość F i M oblicza się ze wzoru:
![]()
, mVal/dm3,
gdzie: a - objętość 0,1 M roztworu HCl, zużytego do zmiareczkowania próbki wody wobec
fenoloftaleiny, cm3,
b - suma objętości 0,1 M roztworu HCl, zużytego do zmiareczkowania próbki wobec
fenoloftaleiny oraz wobec metyloranżu, cm3,
V - objętość próbki wody, cm3.
6.4. Oznaczanie wolnego CO2
Oznaczanie polega na zobojętnieniu próbki wody roztworem wodorotlenku sodowego wobec fenoloftaleiny.
Sprzęt i odczynniki - jak w punkcie 6.3.
Wykonanie oznaczenia - jak w oznaczaniu 6.3.
Obliczanie wyników
Zawartość wolnego CO2 podaje się w mg/dm3. Korzysta się z otrzymanej uprzednio wartości kwasowości węglanowej (Kwęglan.), a wynik oznaczania wolnego CO2 (XCO2) oblicza się ze wzoru:
XCO2 = Kwęglan.⋅ 44 , mg/dm3.
6.5. Oznaczanie twardości ogólnej w wodzie
Oznaczenia polegają na zmiareczkowaniu składników zawartych w próbce wody o odpowiednio skorygowanej wcześniej wartości pH za pomocą wersenianu sodowego wobec odpowiednich wskaźników.
Sprzęt i odczynniki
kolbki stożkowe (200-300 cm3),
cylinder miarowy (100 cm3),
cylinder miarowy (10 cm3),
biureta (25-50 cm3),
pipeta szklana (5 cm3),
roztwór wodny wersenianu sodowego 0,05 M,
roztwór HCl 0,1M,
roztwór NH3 25%,
czerń ET roztarta z NaCl w stosunku 1:100,
Wykonanie oznaczenia twardości ogólnej
Do 100 cm3 badanej wody dodać 3 krople metyloranżu, taką objętość 0,1 M roztworu HCl, jaką zużyto przy oznaczaniu zasadowości M, 1 cm3 roztworu amoniaku oraz szczyptę wskaźnika czerni ET
i natychmiast miareczkować roztworem wersenianu sodowego do zmiany barwy z czerwonej na zieloną.
Wyniki
Wartość twardości ogólnej (Twog) oblicza się wg wzoru:
![]()
, °twardości,
gdzie: a -ilość cm3 zużytego wersenianu sodowego
V - objętość próbki wody, cm3.
6.6. Oznaczanie utlenialności (ChZT) metodą nadmanganianową
Próbkę wody wygrzewa się we wrzącej łaźni wodnej z roztworem KMnO4.
Sprzęt i odczynniki
łaźnia wodna
kolby stożkowe (200-300 cm3)
cylinder miarowy (100 cm3)
pipety (10 cm3) - 2 szt.
Kwas siarkowy (1:3)
0,00625 M (0,0125 N) kwas szczawiowy
0,0025 M (0,0125 N) KMnO4.
Wykonanie oznaczenia
Do kolby stożkowej odmierzyć 100 cm3 wody, dodać 10 cm3 kwasu siarkowego (1:3) i 10 cm3 roztworu nadmanganianu. Roztwór wymieszać, wstawić do wrzącej łaźni wodnej i ogrzewać przez 30 minut. Po wyjęciu próbki z łaźni dodać natychmiast 10 cm3 kwasu szczawiowego i po odbarwieniu się roztworu miareczkować na gorąco roztworem KMnO4 do pojawienia się różowego zabarwienia, utrzymującego się przez kilka minut.
Wyniki
Utlenialność wody [ChZT] (X) obliczyć ze wzoru: ![]()
, mg O2/dm3,
gdzie: a - ilość cm3 roztworu KMnO4 zużyta na zmiareczkowanie badanej próbki wody
b- ilość cm3 roztworu KMnO4 zużyta na zmiareczkowanie próbki wody destylowanej
V - objętość próbki wody użyta do oznaczania, cm3.
6.7. Oznaczanie chlorków
Oznaczanie polega na miareczkowaniu jonów Cl- zawartych w próbce wody, roztworem AgNO3 wobec dwuchromianu potasowego jako wskaźnika.
Sprzęt i odczynniki
1. biureta (25-50 cm3) 4. 0,1 M roztwór AgNO3
2. cylinder miarowy (100 cm3) 5. 0,1 M roztwór NaOH
3. kolbki stożkowe (200-300 cm3) 6. 10% roztwór K2CrO4
Wykonanie oznaczenia
Przed wykonaniem oznaczenia należy sprawdzić wartość pH wody. Jeżeli pH < 6, to należy podwyższyć je do ok. pH = 8, za pomocą 0,1 M NaOH (najkorzystniej w ilości równoważnej oznaczonej kwasowości ogólnej). Następnie, do kolby stożkowej odmierzyć 100 cm3 badanej wody, dodać 1 cm3 roztworu K2CrO4 i miareczkować roztworem AgNO3 do pojawienia się trwałego zabarwienia żółto-brunatnego. Od ilości zużytego roztworu AgNO3 należy odjąć 0,3 cm3 tego roztworu, który jest konieczny do wytworzenia Ag2CrO4 w wodzie destylowanej.
Wyniki Zawartość jonów chlorkowych w wodzie (X) obliczyć wg wzoru:
![]()
, mg/dm3, gdzie:
a - objętość 0,1 M roztworu AgNO3, cm3
V - objętość próbki wody, cm3.
6.8. Oznaczanie siarczanów
Oznaczanie polega na miareczkowaniu jonów SO4-, zawartych w próbce wody za pomocą roztworu, zawierającego jony Ba2+, wobec nitrochromazonu jako wskaźnika.
Sprzęt i odczynniki
biureta (25-50 cm3)
cylinder miarowy (50 cm3)
kolbki stożkowe (200-300 cm3)
pipeta (10 cm3)
kwas solny (1:10)
0,02 M roztwór BaCl2
nitrochromazon - roztwór wodny
aceton lub metanol
Wykonanie oznaczenia
Do kolby stożkowej odmierzyć 50 cm3 badanej wody, dodać 4 cm3 HCl 1:10 - (roztwór po zakwaszeniu powinien mieć pH = 1,5-2,0), dodać 50 cm3 acetonu i 2-3 krople nitrochromazonu. Przygotowaną w ten sposób próbkę miareczkuje się roztworem BaCl2 do zmiany barwy fioletowej na niebieską.
Wyniki: Zawartość siarczanów (Y) oblicza się ze wzoru:
![]()
, mg SO42-/dm3, gdzie:
a - ilość cm3 zużytego 0,02 M roztworu BaCl2,
V - objętość próbki wody, cm3.
SPOSÓB WYKONANIA ĆWICZENIA
Grupy dwuosobowe otrzymują próbkę wody o objętości ok. 1 dm3 i wykonują następujące oznaczenia z niniejszej instrukcji:
6.1. Przybliżona zawartość soli rozpuszczonych metodą konduktometryczną
6.2. Wartość pH
6.3. Zasadowość M
6.4 Zawartość wolnego CO2
6.5. Twardość ogólna
6.6. Utlenialność (ChZT) metodą nadmanganianową
6.7. Zawartość chlorków
6.8. Zawartość siarczanów.
Następnie grupy te wykonują usuwanie twardości ogólnej wody za pomocą silnie kwaśnego kationitu w następujący sposób:
W zlewce o pojemności ok. 400 ml umieścić 220 ml badanej wody, dodać ok. 10 ml kationitu i mieszać bagietką przez 20 minut, do ustalenia się stanu równowagi. Po tym czasie zdekantować wodę znad kationitu i wykonać oznaczenia 6.3. (zasadowość M) i 6.5. (twardość ogólna).
Sporządzić sprawozdanie z wykonanego ćwiczenia i sformułować wnioski.
Instrukcję opracował dr inż. Izydor Drela
8
Ogólny ditlenek węgla
Wolny ditlenek
węgla
Związany ditlenek węgla
Agresywny ditlenek węgla
Przynależny ditlenek węgla
Półzwiązany w postaci HCO3- ditlenek węgla
Związany w postaci CO32- ditlenek węgla
Wyszukiwarka
Podobne podstrony:
spr cw 11, Technologia chemiczna, semestr 2, Fizyka, Laboratorium, laboratoria fizyka bincia
sprawozdanie1 cw.4, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Wyniki II CC-DI kolokwium grudz 2009, Technologia chemiczna, semestr 2, Zarządzanie jakością i pro
ćw 5, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 2(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 1, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
zarzadzanie, Uczelnia PWR Technologia Chemiczna, Semestr 6, Zarządzanie jakością, jakość, zarzadzani
Kolokwium poprawkowe trzecie i ostatnie dla III IMD luty 2009, Technologia chemiczna, semestr 2, Za
Kolokwium sesja poprawkowa dla III IMD24 luty 2009, Technologia chemiczna, semestr 2, Zarządzanie ja
ćw B Procesy utleniania-utlenianie ksylenów, Uczelnia PWR Technologia Chemiczna, Semestr 5, Technolo
sprawko z ćw 1, Uczelnia PWR Technologia Chemiczna, Semestr 3, Chemia techniczna organiczna
Opracowanie zagadnie systemy zarzadzania jakoscia, Uczelnia PWR Technologia Chemiczna, Semestr 6, Za
Kolokwium poprawkowe trzecie i ostatnie dla III IMD, Technologia chemiczna, semestr 2, Zarządzanie j
cw 1(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
zaliczenie I CC-DI ZJiPCh, Technologia chemiczna, semestr 2, Zarządzanie jakością i prod
spr cw 11, Technologia chemiczna, semestr 2, Fizyka, Laboratorium, laboratoria fizyka bincia
sprawozdanie1 cw.4, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
więcej podobnych podstron