LABORATORIUM Z BIOCHEMII
ćwiczenie nr 4
Temat: KWASY NUKLEINOWE
Wtorek 815-1200
Opiekun grupy :
Dr inż. A. Bujacz Marta Wujek
Aleksandra Kosiorek
Przemysław Woiński
Wstęp
Kwasy nukleinowe to wielocząsteczkowe polimery nukleotydów.
Wyróżniamy dwa kwasy: rybonukleinowe (RNA) oraz deoksyrybonukleinowe (DNA).
DNA ma postać podwójnej helisy. Zbudowany jest z dwóch łańcuchów nukleotydów, które biegną w przeciwnych kierunkach. Nukleotydy w DNA zawierają cukier deoksyrybozę i jedną z czterech zasad: adeninę(A), tyminę (T), cytozynę(C) oraz guaninę (G). Łańcuchy polinukleotydowe połączone są ze sobą wiązaniami wodorowymi między parami komplementarnych zasad (ilościowo: A = T i C ≡ G) i skręcone spiralnie.
RNA zbudowany jest zwykle z jednego łańcucha nukleotydów, ale w jego obrębie mogą występować odcinki podwójnej helisy, powstałe także dzięki wiązaniom wodorowym między parami komplementarnych zasad, z tym że zamiast tyminy występuje w RNA uracyl (U). Istnieje kilka rodzajów RNA, z których najważniejsze to: mRNA (informacyjny), tRNA (transportujący), rRNA (rybosomalny).
Kwasy nukleinowe odpowiadają za przechowywanie i przekazywanie informacji genetycznej zawartej w sekwencji nukleotydów.
Nukleotyd jest podstawową jednostką strukturalną kwasów nukleinowych.Zbudowany jest z trzech podstawowych składników:
> pentozy (cukier zbudowany z 5 atomów C) - D-ryboza lub 2-deoksy-D-ryboza
>zasady azotowej - purynowej lub pirymidynowej
> reszty kwasu fosforowego.
1.Cukier występujący w kwasach nukleinowych jest pentozą należącą do aldoz. Wśród aldo-pentoz istnieje szereg izomerów przestrzennych. Pentoza występująca w kwasach nukleinowych jest rybozą.
W RNA ryboza występuje w formie niezmienionej, natomiast w DNA składnikiem cukrowym jest ryboza pozbawiona atomu tlenu przy węglu drugim cząsteczki, czyli deoksyryboza. Przykłady przedstawiam poniżej:
2.Zasada azotowa to związek organiczny posiadający skomplikowaną budowę cykliczną, zawierający w swoim składzie atomy azotu. Wymienia się 5 rodzajów zasad azotowych występujących w kwasach nukleinowych.
Dzieli się je na 2 grupy:
zasady purynowe (pochodne heterocyklicznego związku puryny)
zasady pirymidynowe (pochodne heterocyklicznego związku pirymidyny)
Przeprowadzone doświadczenia
1.Rozpuszczalnosć kwasów nukleinowych.
Cel ćwiczenia:
Celem ćwiczenia było badanie rozpuszczalności kwasów nukleinowych.
Opis wykonywanych czynności:
a)Do probówki zawierającej 0,5 ml 0,1% roztworu DNA dodawaliśmy kroplami 1M kwasu solnego, aż do momentu wytrącenia się osadu. Następnie dodawaliśmy również kroplami roztwór NaOH, który rozpuścił wcześniej wytrącony osad. Próbę wykonaliśmy także dla 0,1% roztwory RNA.
b)Do probówki zawierającej 1ml 0,1% roztworu DNA dodaliśmy 2ml 96% etanolu. Próbę wykonaliśmy również dla 0,1% roztworu RNA.
Obserwacje:
a)Podczas doświadczenia w probówce wytworzył się biały osad, który rozpuścił się po zalkalizowaniu.
b)Podczas doświadczenia w probówce z DNA i RNA wytrącił się biały osad.
Wnioski:
a) DNA i RNA jako kwasy nukleinowe nie rozpuszczają się w kwasach o czym świadczy powstanie osadu po dodaniu do probówek kwasu solnego, natomiast rozpuszczają się w środowisku alkalicznym - o czym świadczy rozpuszczenie się osadu po dodaniu NaOH.
b) W próbie z etanolem powstanie białego osadu dowodzi, iż kwasy nukleinowe dobrze wytrącają się w obecności alkoholi.
2.Kwaśna hydroliza kwasów nukleinowych.
Cel ćwiczenia:
Celem ćwiczenia było uzyskanie hydrolizatów DNA i RNA, które służyły nam do dalszych doświadczeń.
Opis wykonywanych czynności:
Do probówki wlaliśmy 2,5 ml 1% roztworu DNA oraz 2,5 ml 10% H2SO4, a następnie ogrzewaliśmy mieszaninę we wrzącej łaźni wodnej przez godzinę. Doświadczenie wykonaliśmy także dla 1% roztworu RNA.
Wnioski: Kwasy nukleinowe: DNA i RNA pod wpływem ogrzewania z kwasem siarkowym (VI) ulegają hydrolizie do wolnych zasad purynowych i nukleotydów pirymidynowych.
Po godzinie ogrzewania mogliśmy wykonywać następujące doświadczenia.
2.1. Reakcja orcynolowa.
Cel ćwiczenia:
Celem ćwiczenia było wykrycie pentoz w hydrolizatach kwasowych.
Opis wykonywanych czynności:
Do probówki zawierającej 1ml hydrolizatu RNA dodaliśmy 1ml odczynnika orcynolowego (zawierającego orcynę, stężony HCl oraz FeCl3), a następnie ogrzewaliśmy przez 15 minut. Po upływie danego czasu ostudziliśmy mieszaninę i dodaliśmy 5 ml wody destylowanej.
Reakcje przeprowadziliśmy również dla hydrolizatu DNA, 0,1% roztworu DNA, 01,% roztworu RNA, 1% roztworu rybozy oraz 1% roztwory deoksyrybozy.
Obserwacje:
Po wykonaniu doświadczenia we wszystkich próbach powstały kompleksy o różnym odcieniu barwy zielonej.
Wnioski: Pentozy wolne (ryboza i deoksyryboza) oraz związane w nukleozydach (RNA i DNA) pod wpływem ogrzewania ze stężonym HCl przechodzą w furfural, który wraz z orcyną, katalizowany jonami Fe3+, tworzy trwały kompleks o zielonym zabarwieniu.
2.2.Reakcja Dischego.
Cel ćwiczenia:
Celem ćwiczenia było odróżnienie DNA od RNA.
Opis wykonywanych czynności:
Do probówki zawierającej 1 ml hydrolizatu RNA dodaliśmy 2 ml odczynnika difenyloaminowego , a następnie ogrzewaliśmy we wrzącej łaźni wodnej przez 10 minut.Reakcje przeprowadziliśmy również dla hydrolizatu DNA, 0,1% roztworu DNA, 0,1% roztworu RNA, 1% roztworu rybozy oraz 1% roztwory deoksyrybozy.
Obserwacje:
W probówce z roztworem DNA i roztworem deoksyrybozy pojawiła się niebieski osad. W przypadku roztworu RNA i rybozy zabarwienia nie było.
Wnioski: Deoksyryboza i DNA w którym jest ona związana uległo barwnej reakcji z difenyloaminą dając niebieskie zabarwienie co odróżnia ją od rybozy. Ta barwna reakcja jest konsekwencją powstania aldehydu hydroksylewulinowego z deoksyrybozy pod wpływem działania kwasu siarkowego i octowego (zawartych obok difenyloaminy w odczynniku difenyloaminowym).
2.3.Wykrywanie kwasu fosforowego.
Cel ćwiczenia:
Celem ćwiczenia było wykrycie kwasu fosforowego obecnego w kwasach nukleinowych.
Opis wykonywanych czynności:
Do probówki zawierającej 0,5 ml hydrolizatu DNA dodaliśmy 3 krople stężonego amoniaku w celu zobojętnienia. Następnie dodaliśmy 0,5 ml stężonego HNO3 i 2 ml molibdenianu amonowego. Mieszaninę ogrzewaliśmy do wrzenia. Próbę wykonaliśmy dodatkowo dla hydrolizatu RNA.
Obserwacje:
Po wykonaniu doświadczenia w probówkach z roztworem RNA i DNA wytrącił się żółty osad.
Wnioski: Wytrącił się żółty osad fosfomolibdenianu amonowego co świadczy o obecności fosforanów w badanej próbie.
3.Wykrywanie zasad purynowych.
Cel ćwiczenia:
Celem ćwiczenia było wykrycie zasad purynowych obecnych w kwasach nukleinowych, tworzących sole z metalami ciężkimi takimi jak Ag+, lub Cu+.
Opis wykonywanych czynności:
Do probówki zawierającej 1 ml hydrolizaty DNA dodaliśmy 6 kropli stężonego amoniaku i 3 ml azotanu srebra. Po wytraceniu osadu dodaliśmy amoniaku w celu rozpuszczenia.
Obserwacje:
Po wykonaniu doświadczenia powstał biały osad, który się nie rozpuszczał w amoniaku.
Wnioski: Zasady azotowe reagują z jonami Ag+ tworząc nierozpuszczalne w amoniaku sole srebrowe puryn co świadczy o ich obecności w DNA.
4.Oznaczanie zawartości zasad purynowych metodą spektrofotometryczną.
Cel ćwiczenia:
Celem ćwiczenia było oznaczenie zawartości zasad purynowych metodą spektrofotometryczną.
Opis wykonywanych czynności:
Do kolby odważyliśmy 5 g kostki bulionowej i dodaliśmy 75 ml wody. Mieszaninę gotowaliśmy we wrzącej łaźni wodnej przez 10 minut. Po przestudzeniu roztwór przesączyliśmy przez gazę młyńską do 100 mililitrowej kolby i dopełniliśmy wodą destylowaną do kreski. Po dokładnym wymieszaniu mieszaninę ponownie sączyliśmy , ale przez sączek bibułowy. Przed wykonaniem pomiaru badany roztwór rozcieńczyliśmy 20-krotnie 0,1M kwasem solnym. Następnie za pomocą spektrometru wykonaliśmy pomiar absorbancji dla adeniny przy 262 nm i 290 nm, a dla guaniny przy 249 nm i 290 nm.
Produkt |
ΔE262-290 |
ΔE249-290 |
adenina (μg/g) |
guanina (μg/g) |
1) Rosół warzywny Culineo |
0,108 |
0,129 |
0,48 |
1,13 |
2) Rosół wołowy Kucharek |
0,186 |
0,191 |
0,83 |
1,67 |
3) Rosół z kury Kucharek |
0,167 |
0,198 |
0,74 |
1,73 |
4) Rosół z kury Knorr |
0,179 |
0,156 |
0,80 |
1,37 |
5) Rosół wołowy Knorr |
0,075 |
0,100 |
0,33 |
0,88 |
6) Bulion cielęcy Knorr |
0,220 |
0,187 |
0,98 |
1,64 |
7) Rosół drobiowy Culineo |
0,234 |
0,267 |
1,04 |
2,34 |
8) Rosół drobiowy Winiary |
0,163 |
0,174 |
0,72 |
1,52 |
Obliczenia:
Dla adeniny:
ΔE262-290 = 0,234
10µg/ml - 0,900
x - 0,234
![]()
Dla guaniny:
ΔE249-292 = 0,267
10µg/ml - 0,457
x - 0,267
Wnioski:
Największą zawartość zasad purynowych (adeniny i guaniny) posiadają kostki rosołowe drobiowe Culineo, natomiast najmniejszą rosół wołowy Knorr.
Oznaczanie zawartości DNA metodą difenyloaminową.
Ekstrakcja kwasów nukleinowych.
10g tkanki zwierzęcej (wątroba),
1g mleczu z ryb,
homogenizowaliśmy z 50ml zimnego 10% kwasu trójchlorooctowego. Homogenat odwirowaliśmy. W osadzie pozostają białka, polisacharydy i kwasy nukleinowe. Superntant (ciecz nadosadowa) usunęliśmy, a do osadu dodaliśmy 30ml 0,6M roztworu kwasu nadchlorowego i ogrzewaliśmy mieszaninę w ciągu 15 minut w łaźni wodnej o temperaturze 90oC stale mieszając.. Po ostudzeniu odwirowaliśmy osad zawierający białko, a supernatant przenieśliśmy ilościowo do kolby miarowej o pojemności 50ml. Zawartość kolby uzupełniliśmy kwasem nadchlorowym do kreski i dokładnie wymieszaliśmy.
1ml ekstraktu kwasów nukleinowych i 1ml wody destylowanej (próba badana)
1ml wzorcowego DNA (o stężeniu 200µg/ml) i 1ml wody destylowanej (próba wzorcowa)
2ml wody destylowanej (próba odczynnikowa)
do każdej dodaliśmy po 4ml odczynnika difenyloaminowego. Wszystkie próby jednocześnie wstawiliśmy do wrzącej łaźni wodnej i inkubowaliśmy w ciągu 10 minut. Ochłodziliśmy próby i zmierzyliśmy absorbancję prób badanych i wzorcowej wobec próby odczynnikowej na spektrokolorymetrze przy długości fali 600nm.
Wzorcowa próba kwasu DNA
![]()
Wątroba:
odczytana absorbancja - 0,183 (wartość średnia z 0,169, 0,167, 0,212)

Śledź:
Odczytana absorbancja: 0,462 (średnia wyliczona z wartości 0,466, 0,458)
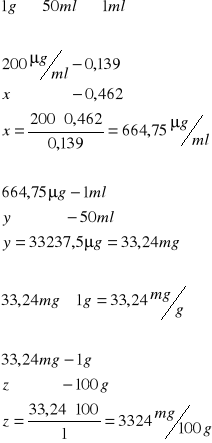
Wnioski: Zawartość zasad purynowych w śledziu jest dużo większa niż w wątrobie.
5'
Wyszukiwarka