Błona komórkowa
Błony komórkowe to struktury charakterystyczne dla wszystkich komórek. Są one zamkniętymi obszarami wokół cytoplazmy, zbudowanymi z lipidów i białek. Błonę komórkową charakteryzuje przepuszczalność uwarunkowana istnieniem kanałów i pomp dla jonów i substancji oraz występowaniem receptorów dla odbioru sygnałów. Istotą błon jest także wyodrębnienie odpowiednich obszarów wewnątrz komórki. Otaczają one wiele odrębnych struktur, takich jak mitochondria, lizosomy, aparat Golgiego. W zależności od pełnionej funkcji błony mają zróżnicowaną budowę. Model błony przedstawiono jako model płynnej mozaiki lipidów w postaci dwumolekularnej warstwy, w której znajdują się białka penetrujące. Wśród lipidów błonowych można wyróżnić:
fosfolipidy - związki tłuszczowe zawierające resztę fosforanową, dzielimy je na:
fosfoglicerydy składające się z glicerolu,do którego dołączone są dwie reszty kwasów tłuszczowych oraz reszta fosforanowa, a do niej alkohol
sfingomieliny, zawierające szkielet sfingozyny, reszty fosforanowej i choliny
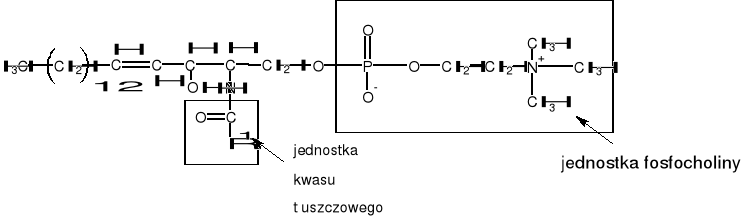
Rysunek 1. Sfingomielina
glikosfingolipidy - lipidy zawierające sfingozynę oraz fragment węglowodorowy, wyróżniamy:
cerebrozydy - sfingozyna zawierająca łańcuch kwasu tłuszczowego i cukru
globozydy - budowa podobna do cerebrozydu, jednak zamiast czystej reszty cukrowej występuje cząsteczka aminocukru
gangliozydy - budowa podobna do cerebrozytu, z tym że połączony nie z pojedynczą cząsteczką cukru, a z całym łańcuchem heksoz
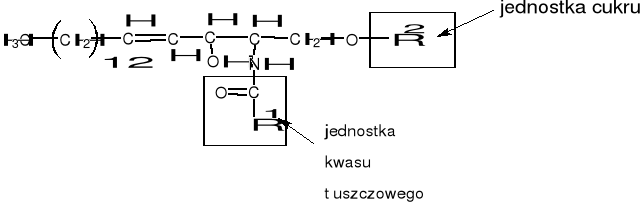
Rysunek 2. Cerebrozyd
sterole, głównie cholesterol
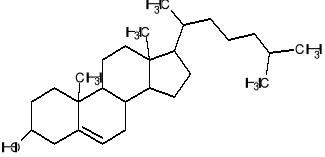
Rysunek 3. Cholesterol
Błony są niesymetrycznymi zamkniętymi strukturami warstwowymi, mającymi powierzchnie zewnętrzną i wewnętrzną. Asymetria związana jest z różnicą składu lipidów w tych warstwach. Składniki lipidowe błon są amfifilowe. Mają polarne „główki” i niepolarne „ogony”.
Rysunek 4. Schemat błony komórkowej
W wodzie tworzą postać stabilną termodynamicznie - micele. Hydrofobowe regiony są osłonięte od wody podczas, gdy hydrofilowa część znajduje się w wodzie. Utworzona warstwa jest nieprzepuszczalna dla większości rozpuszczonych w wodzie cząsteczek. W warstwy błony wbudowane są białka, które tworzą kanały dla ruchu jonów i małych cząsteczek, a także przenośniki większych molekuł. Fosfolipidy tworzą kanały, w których hydrofilowe rejony skierowane są na zewnątrz równocześnie połączone są przez hydrofobowe wnętrze dwuwarstwy. W skład białek wchodzą: enzymy, antygeny, białka transportujące i strukturalne oraz receptory.1,2
Transport przez błony.
Cząsteczki mogą swobodnie przedostawać się przez błony, dzięki rozpuszczaniu się w dwuwarstwie lipidowej.
Transport podzielić można na bierny i aktywny. Podział ten uwarunkowany jest kierunkiem transportu oraz niezbędnością energii chemicznej. Gdy transport nie wymaga nakładu energii i zachodzi zgodnie z gradientem stężeń substancji mówimy o transporcie biernym, natomiast transport zachodzący przeciwnie do gradientu stężeń i wykorzystujący energię nazywany jest transportem aktywnym.1
Transport bierny
Transport bierny - dyfuzja przez błony - zachodzi jako: dyfuzja prosta lub ułatwiona.
Dyfuzja prosta
Dyfuzja cząsteczek może odbywać się na zasadzie bezpośredniego przenikania substancji przez błonę oraz przez transport przez specjalne białka błonowe - kanały. Przez błony mogą dyfundować cząsteczki obojętne - woda, obojętne gazy oddechowe i związki lipofilowe. Cząsteczki naładowane - jony - nie mogą być transportowane w dowolnych miejscach hydrofobowej błony, przechodzą one przez specyficzne kanały.
Kanały działają na zasadzie transportu biernego, przepływ jonów odbywa się w kierunku zgodnym z ich gradientem. Przez kanały zazwyczaj przepływa tylko jeden rodzaj jonów , toteż często klasyfikuje się je na podstawie rodzaju transportowanych jonów. Kanały występują w różnych stanach konformacyjnych: otwartym, zamkniętym i gotowości. Początkowo kanał znajduje się w trybie gotowości do otwarcia - jony nie są przepuszczane. Następnie przechodzi w stan otwarty. W tym stanie jony mogą swobodnie przenikać przez błonę. Kanał otwarty jest przez określony czas, indywidualny dla danego kanału, następnie ulega zamknięciu. Stan zamknięty różni się od stanu gotowości brakiem wrażliwości na bodźce otwierające. Ostatnim etapem zamykającym cykl pracy kanału jest przejście ze stanu zamkniętego w stan gotowości. Czynnikami wpływającymi na otwarcie kanału są: bramkowe potencjały na błonie, bramkowane ligandem oraz bramkowane naprężeniem mechanicznym.
Przykładami kanałów jonowych mogą być: kanały bramkowane ligandem, kanały Na+ i K+ bramkowane napięciem na błonie.1
Dyfuzja ułatwiona
Ułatwiona dyfuzja to zjawisko, w którym cząsteczki samodzielnie nie mogą przenikać przez błonę. Zjawisko wykorzystuje białka transportujące i wykazuje swoistość dla jonów, węglowodorów i aminokwasów. Dyfuzja ta dotyczy cząsteczek rozpuszczonych, dyfundujących zgodnie z gradientem stężeń.
Mechanizm dyfuzji ułatwionej, przedstawia się następująco: białko transportujące występuje w dwóch konformacjach: w stanie większego i mniejszego stężenia substancji rozpuszczonej. W stanie wyższego stężenia cząsteczki zostają przyłączone do miejsc w białku. Transport zachodzi wtedy, gdy nastąpi zmiana konformacji, białko transportujące zostanie wystawione na stężenie mniejsze. Proces ten jest odwracalny, a przepływ zależy od gradientu stężenia. Szybkość dyfuzji uzależniona jest od: gradientu stężenia w poprzek błony, ilości białka transportującego, szybkości pomiędzy substancją rozpuszczoną, a białkiem oraz od szybkości zmiany konformacyjnej obu stanów.1,2
Rysunek 5. Transport przez błony: a) dyfuzja prosta b) dyfuzja ułatwiona
Można to przedstawić na przykładzie przenoszenia glukozy przez erytrocyt za pomocą przenośnika glukozy. Przenośnikiem glukozy jest integralne białko błonowe ułożone asymetrycznie względem błony. Osadzenie białka w membranie możliwe jest dzięki występowaniu 12 α helis tworzących centralny por, przez który przechodzi cząsteczka glukozy. Transport zachodzi w czasie konformacyjnej zmiany białka. Kierunek migracji glukozy zależy od jej stężenia po którejkolwiek stronie membrany, proces ten jest w pełni odwracalny.1,2
Transport aktywny
W transporcie aktywnym potrzebne jest dostarczenie energii. Spowodowane jest to przenoszeniem cząsteczek niezgodnie z gradientem stężeń. Źródłem energii może być: hydroliza ATP, ruch elektronów lub światło. Transport przebiega z udziałem białek transportowych, występujących w dwóch konformacjach. Białka te wykazują dużą swoistość względem jonów i węglowodanów. Cechy te sprawiają, że transport aktywny wykazuje podobieństwo do dyfuzji ułatwionej. Różnica wynika z kierunku transportu. Transport aktywny jest jednokierunkowy.1,2
Transport aktywny napędzany przez ATP
Energia wykorzystywana do transportu jonów pochodzi z hydrolizy ATP. Transport odbywa się przy pomocy pomp lub ATP-azy.
Rysunek 6. Transport aktywny napędzany ATP
Wyróżniamy dwa rodzaje pomp wykorzystujących hydrolizę ATP: ATP-azy typu P oraz białka ABC. Pompy ATP-azy typu P ulegają fosforylacji i mogą podlegać zmianom konformacyjnym. ATP oraz substancje przenoszone, np. jony, wiązane są w wyjściowym stanie konformacyjnym pompy. ATP ulega rozszczepieniu, równowaga zostaje przesunięta, przez fosforylację do drugiego stanu konformacyjnego pompy. Pozwala to na odłączeniu przenoszonej cząsteczki, poprzez wyeksponowanie miejsca wiązania po drugiej stronie błony. W drugim stanie konformacyjnym, ze względu na niższe powinowactwo pompy do jonu, jon ulegają dysocjacji. Jon zostaje uwolniony, a pompa powraca do pierwotnego stanu konformacyjnego.
Do pomp ATP-azy typu P należą m. in.:
Na+/K+ - ATP-aza, która posiada miejsca wiążące trzy składniki Na+, K+, Mg2+,
Ca2+ - ATP-aza, której praca polega na transporcie jonów wapniowych do wnętrza erytrocytów,
H+ - ATP-aza, w przypadku której następuje hydroliza ATP oraz transport protonów.
Białka ABC są złożonymi pompami z kasetą wiążącą ATP. Każda zawiera cztery strefy: dwie przenikające przez membranę i dwie dalsze o strukturze ATPazy typu P.
Do białek ABC należą m.in.: białko odporności wielolekowej oraz przezbłonowe białko regulacyjne mukowiscydozę.1,2
Transport aktywny napędzany przez jony
Energia potrzebna do transportu jonów może pochodzić również z przemieszczania innych jonów np. Na+ oraz H+. Do przemieszczania wykorzystuje się energię wytworzoną w wyniku przepływu jonów w dół gradientu stężenia. Wyróżniamy dwa rodzaje transportu: symport i antysport.1,2
O symporcie mówimy, gdy cząsteczka i jon transportowane są w tym samym kierunku, białko transportujące nazywamy przenośnikiem synportowym ( np. przenośnik Na+/glukoza ). Natomiast gdy transport jonu i cząsteczki następuje w przeciwnych kierunkach, mamy do czynienia z antyportem. Białko biorące udział w przenoszeniu nazywamy antyportowym ( np. wymiennik anionów, będący białkiem pasma 3 erytrocytów).
Antybiotyki jonoforowe
Niektóre mikroorganizmy mogą wytwarzać związki, pod wpływem których błony stają się przepuszczalne dla określonych jonów. Te małe cząsteczki, zwane antybiotykami jonoforowymi funkcjonują na zasadzie ruchu posuwisto-zwrotnego w celu transportowania jonów przez błonę. W swojej budowie jonofory posiadają centra hydrofilowe, które wiążą określone jony. Centra otoczone są przez rejony hydrofobowe. Struktura ta pozwala cząsteczkom dobrze rozpuszczać się w błonach i dyfundować przez nie. Działają one jako przenośniki, albo jako elementy tworzące kanał. Jako przenośniki wiążą jon po jednej stronie przenoszą go na drugą stronę.1,11
Mechanizm działania jonoforów typu przenośników polega na związaniu koordynacyjnym jonu metalu z kilkoma atomami tlenu, które otaczają wnękę. Centralnie umieszczone atomy tlenu oraz grupy węglowodorowe, umieszczone na obwodzie przenośnika, pełnią istotną rolę. Antybiotyk jonoforowy wiąże jon poprzez chelatowanie z atomami tlenu w swojej centralnej przestrzeni. Tworzy się kompleks jon-przenośnik, rozpuszczalny w lipidowym wnętrzu błony. Umożliwia to przepływ jonów przez błonę.2
Rysunek 7. Mechanizm działania jonoforów. Jonofor (oznaczony kolorem zielonym) kompleksuje kation metalu (czerwony) i przenosi na drugą stronę błony komórkowej.
Jonofory, jak dotąd, nie są grupą związków, która posada jednolity system klasyfikacji. Najprościej antybiotyki jonoforowe podzienić można na syntetyczne i naturalne. Do tych ostatnich zaliczyć można, wymienione już, jonofory przenośnikowe oraz tworzące kanały. Do jonoforów przekaźnikowych zalicza się zazwyczaj cykliczne jonofory neutralne oraz niecykliczne jonofory karboksylowe. W grupie niecyklicznych jonoforów karboksylowych znajdują się: jonofory kompleksujące kationy jednowartościowe (np. monenzyna, nigerycyna) oraz kompleksujące kationy dwuwartościowe (np. kwas lasalowy). Znanych jest także wiele jonoforów syntetycznych, wśród których wyróżniamy: etery koronowe.8
Monenzyna jako przykład karboksylowego antybiotyku jonoforowego.
Monenzyna A jest znanym naturalnym, polieterowym antybiotykiem jonoforowym, zdolnym do transportu jednowartościowych kationów metali przez błony lipidowe, tworząc z jonami pseudo-makrocykliczne kompleksy. Należy więc do grupy cząsteczek wysoko bioaktywnych.6,11
Związki należące do tej grupy mają podobną strukturę, najczęściej cykliczną i składają się podstawowego szkieletu do którego najczęściej przyłączane są pierścienie: trzy pierścienie tetrahydrofuranowe, dwa pierścienie tertahydopiranowe. W skład monenzyny wchodzą, także trzy grupy hydroksylowe oraz grupa karboksylowa. Związki te najczęściej różnią się liczbą grup metylowych. Wśród związków monenzyny najczęściej występuje monenzyna A.12
Rysunek 8. Struktura monenzyny A
Po raz pierwszy monenzynę wyizolowano w 1967 roku, monenzyna A występuje w postaci soli sodowej. Monenzyna ma bardzo ważne i pożyteczne czynności biologiczne, takie jak hamowanie wzrostu bakterii Gram-dodatnich (aktywność przeciwbakteryjna), oraz skutecznej kontroli kokcydiozy u kur i bydła . Wykazuje również aktywność antybiotyczną, wspomagające apoptozę komórek nowotworowych.3,4,5
Transport kationów przez błony komórkowe za pomocą antybiotyków jonoforowych - monenzyny A
Monenzyna A tworzy kompleksy w wyniku wiązania jednowartościowych kationów metali. Powstaje pseudo-cykliczna struktura stabilizowana przez wiązania wodorowe. Wiązania wodorowe tworzą się między grupą karboksylową, a dwoma grupami hydroksylowymi. Monenzyna jest w stanie tworzyć kompleksy z kationami metali podobne do niektórych sztucznych analogów, takich jak etery koronowe.4,11
Monenzyna A wykazuje większe powinowactwo do jonów Na+ niż K+. Uczestniczy w wymianie Na+/H+ w komórkach. Kationy metalu wiązane są w hydrofilowej wnęce. Kation zostaje osłonięty od środowiska zewnętrznego i pozostaje w wewnętrznej jamie zachowując sześciokrotną koordynację z atomami tlenu. Kompleks łatwo pokonuje barierę błony dzięki swojej rozpuszczalności w hydrofobowych rozpuszczalnikach i obojętności elektrycznej.4,5,7,11
Transport odbywa się po dwóch stronach. Po jednej stronie anion monenzyny A wiąże kation metalu, tworzy się obojętny kompleks. Kompleks przechodzi przez błonę komórkową. Po drugiej stronie kation zostaje uwolniony, następuje deprotonacja. Jonofor może ponownie kompleksować kolejne kationy.3,5,9
Monenzyna powoduje zmianę pH we wnętrzu struktur komórkowych, co prowadzi do zmiany ciśnienia osmotycznego i śmierci komórki.6
Pochodne oraz toksyczność monenzyny A
Właściwości monenzyny sprawiły, że stała się ona obiektem zainteresowania chemicznych modyfikacji. W zależności od miejsca modyfikacji pochodne wykazują różnice w stosunku do struktury macierzystej. Pochodne te różnią się selektywnością kompleksowania kationów, strukturą tworzących się kompleksów, toksycznością i aktywnością biologiczną.12
Pośród otrzymanych pochodnych monenzyny najczęściej spotykamy estry, amidy, uretany. Pierwszą grupę stanowią związki, w których przekształceniu uległa grupa hydroksylowa: OIVH lub OXIH. Wśród pochodnych ze zmieniona grupą OIVH można wyróżnić pochodne estrowe, pochodne eterowe. Przekształcając grupę OXIH otrzymano uretany, związki sprawniej transportujące jednowartościowe kationy niż monenzyna. Modyfikując atom węgla C-26 otrzymano pochodne estrowe, eterowe, aminowe, sulfonowe. Ostatnią grupę stanowią związki z przekształconą grupą karboksylową, są nimi amidy.7,12
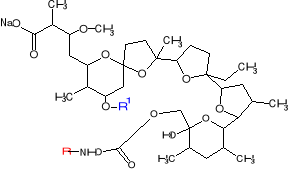
Rysunek 9. Struktura wybranych pochodnych monenzyny A.
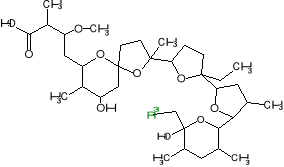
Rysunek 10. Pochodne monenzyny z modyfikacją chemiczną przy atomie węgla C-26
Pomimo wielu interesujących i użytecznych efektów stosowania monenzyny A jej wykorzystanie jest ograniczone, ze względu na wiele skutków ubocznych. Toksyczność jonoforu związana jest z zakłóceniami w transporcie jonów jednowartościowych: sodu (Na), potasu (K), rubidu (Rb), cezu (Cs) przez błony komórkowe. Prowadzi to do nieprawidłowego funkcjonowania błony komórkowej i aparatu Golgiego oraz uszkodzenia struktur mitochondrialnych, co w konsekwencji prowadzi do śmierci komórki.10,11,13 Prowadzone liczne badania oraz modyfikacje nad strukturą monenzyny A powodują obniżenie toksyczności jonoforu.
Podsumowanie
W pracy została przedstawiona budowa, skład i funkcje błony komórkowej. Jedna z funkcji została opisana szerzej, jest to transport. Jony mogą być transportowane przez błony, przy użyciu dwóch typów transportu: biernego lub aktywnego.
W pracy zostały przedstawione również substancje wspomagające transport - antybiotyki jonoforowe. Pokrótce przedstawiono ich historię, podział i ogólny mechanizm. Działanie antybiotyków jonoforowych zostało dokładniej przedstawione na przykładzie monenzyny A.
Monenzyna A jest przykładem naturalnego, karboksylowego antybiotyku jonoforowego. Jonofor transportuje jednowartościowe kationy metali przez błony komórkowe. Tworząc pseudo-makrocykliczne kompleksy, które zostają przenoszone na drugą stronę błony.
Pomimo wielu zastosowań monenzyna jest substancja toksyczną dla organizmu. Jej liczne modyfikacje oraz tworzenie nowych pochodnych obniża ryzyko jej stosowania.
Bibliografia
1. Murray R. K., Granner D. K., Mayes P. A., Rodwell V. W. Biochemia Harpera. Warszawa : Wydawnictwo Lekarskie PZWL, 1995. ISBN 83-200-1798-X.
2. L., Stryer. Biochemia. Warszawa : Wydawnictwo Naukowe PWN, 2003.
3. Brzeziński B., Huczyński A., Łowicki D.,Stefańska J. Syntheses, structural and antimicrobial studies of a new N-allylamide of monensin A and its complexes with monovalent metal cations. Tetrahedron. 36, September 2009, Vol. 65, pp. 7730-7740 .
4. Huczyński, A., Ratajczak-Sitarz, M., Katrusiak, A., Brzezinski, B. Molecular structure of rubidium six-coordinated dihydrate complex with monensin A. Journal of Molecular Structure. 1-3, October 2008, Vol. 888, pp. 224-229 .
5. Huczyński A., Łowicki D., Brzezinski, Bartl F. Spectroscopic, mass spectrometry, and semiempirical investigations of a new 2-(2-methoxyethoxy)ethyl ester of Monensin A and its complexes with monovalent cations. Journal of Molecular Structure. 1-3, 2008, Vol. 879, pp. 14-24 .
6. Huczyński A., Brzezinski B., Bartl F. Structures of complexes of benzyl and allyl esters of monensin A with Mg2+, Ca2+, Sr2+, Ba2+ cations studied by ESI-MS and PM5 methods. Journal of Molecular Structure. 1-3, 2008, Vol. 886, pp. 9-16.
7. Huczyński A., Stefańska J., Przybylski P., Brzezinski B., Bartl F. Synthesis and antimicrobial properties of Monensin A esters. Bioorganic and Medicinal Chemistry Letters. 8, 2008, Vol. 18, pp. 2585-2589 .
8. Schroeder, Grzegorz. Syntetyczne receptory jonowe. Poznań : „BETAGRAF”P.U.H. Poznań, 2009, pp. 4-6.
9. Janczak J., Huczyński A., Brzezinski B. Crystal structure and FT-IR study of aqualithium 1-naphthylmethyl ester. Journal of Molecular Structure. 1, 2011, Vol. 985, pp. 70-74.
10. Dorne J.L.C.M., Fernández-Cruz M.L., Bertelsen U., Renshaw D.W., Peltonen K., Anadon A., Feil A., Sanders P., Wester P., Fink-Gremmels, J. Risk assessment of coccidostatics during feed cross-contamination: Animal and human health aspects. Toxicology and Applied Pharmacology. 2010.
11. Pantcheva IN, Dorkov P, Atanasov VN, Mitewa M, Shivachev BL, Nikolova RP, Mayer-Figge H, Sheldrick WS. Crystal structure and properties of the copper(II) complex of sodium monensin A. Journal of Inorganic Biochemistry. 10, 2009, Vol. 103, pp. 1419-1424.
12. Stefańska J., Huczyński A. Biologiczne właściwości monenzyny A. Biuletyn Wydziału Farmaceutycznego Warszawskiego Uniwersytu Medycznego. 2, 2008, pp. 12-18.
13. Radko L., Cybulski W., Wessely-Szponder J.,Rzeski W. Badania cytotoksyczności monenzyny i narazyny w hodowli linii ciągłej hepatocytów szczura. Medycyna Wet. 2006, Vol. 62, 7, pp. 834-836.
11
Uretany:
R= CH3, Ph, CH2CH2Ph, C6H11, p-C6H4-Cl
Modyfikacja grupy OIVH:
Estry: R1= COCH3, COCH2CH3, COPh,
Etery: R1= CH3, CH2Ph, CH2-p-C6H4-Cl
R3= OC(O)Ph, OCH2Ph, NHPh,
OSO2-p-C6H4Me
Wyszukiwarka