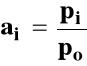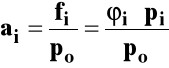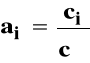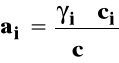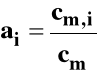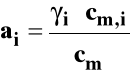Równowagi chemiczne
Rozpatrujemy układ zamknięty, w którym zachodzi reakcja chemiczna :
![]()
Entalpia swobodna jest w tym wypadku funkcją temperatury, ciśnienia i liczby postępu reakcji.
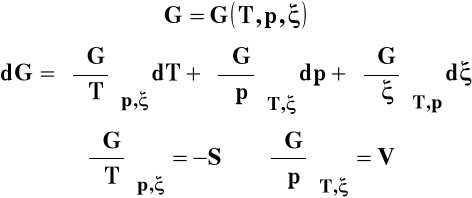
Gdy reakcja zachodzi w stałej temperaturze i pod stałym ciśnieniem :
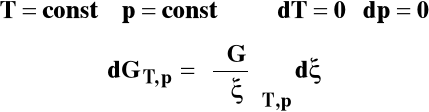
Zmiany entalpii swobodnej układu, w którym zachodzi reakcja chemiczna w funkcji liczby postępu reakcji
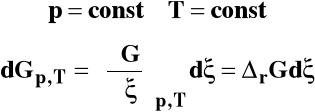
Gdy rG < 0 to reakcja zachodzi samorzutnie z lewa na prawo.
Gdy rG > 0 to reakcja zachodzi samorzutnie z prawa na lewo.
Gdy rG = 0 to reakcja jest w stanie równowagi.
Co powoduje, że na krzywej zależności entalpii swobodnej układu, w którym zachodzi reakcja chemiczna, od liczby postępu reakcji pojawia się minimum ?
1 - Zmiany entalpii swobodnej towarzyszące tylko zmieniającej się liczbie moli reagentów
2 - Zmiany entalpii swobodnej towarzyszące tylko mieszaniu się zmiennej liczbie moli reagentów
3 - Zmiany entalpii swobodnej układu zachodzące w układzie, w którym zachodzi reakcja chemiczna - suma krzywych 2 + 3.
Zależność entalpii swobodnej reakcji od liczby postępu reakcji
Gdy rG < 0 reakcja egzergoniczna (produkująca pracę) - entalpię swobodną reakcji można zamienić na pracę nieobjętościową.
Gdy rG > 0 reakcja endergoniczna (zużywająca pracę) - aby reakcja zaszła w określonym kierunku, należy dostarczyć do układu energię w postaci pracy nieobjętościowej.
Gdy rG = 0 to reakcja nie jest ani egzergoniczna ani endergoniczna.
Dla układu wieloskładnikowego w warunkach izotermiczno- izobarycznych różniczka entalpii swobodnej wyraża się jako :
![]()
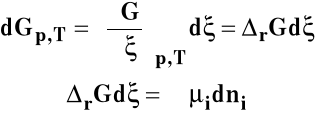
Zmianę liczby moli poszczególnych reagentów można wyrazić jako :
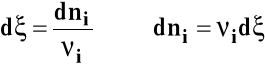
![]()
Dla przykładowej reakcji :
![]()
Potencjał chemiczny można wyrazić ogólnie jako :
![]()
![]()
- potencjał chemiczny standardowy
ai - bezwymiarowa aktywność
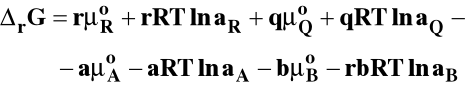
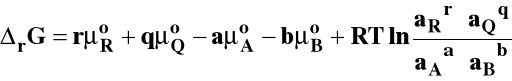
![]()
standardowa entalpia swobodna reakcji chemicznej
Izoterma van't Hoffa
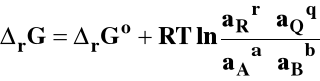
Izoterma van't Hoffa określa kierunek przebiegu reakcji chemicznej w warunkach izotermiczno-izobarycznych w zależności od aktualnego składu mieszaniny reakcyjnej.
Gdy reakcja osiąga stan równowagi :
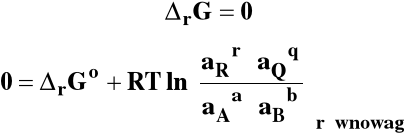
Stała równowagi reakcji chemicznej :
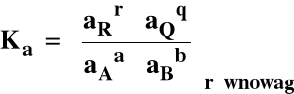
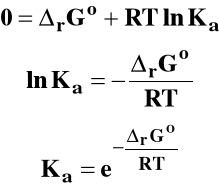
Jeśli rGo < 0 to Ka > 1
Jeśli rGo > 0 to Ka < 1
Sposób wyrażenia potencjału chemicznego, aktywności, a w efekcie izotermy van't Hoffa i stałej równowagi zależy od stanu skupienia reagentów i sposobu doboru stanu standardowego (patrz tabela). W zależności od tego wyróżniamy Kp, Kx, Kc i Km.
Reakcja w stanie gazowym
Gazy doskonałe :
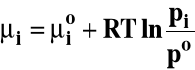
![]()
Gazy rzeczywiste :
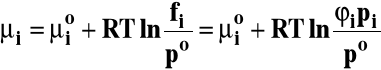
![]()
Reakcja w stanie ciekłym (w roztworze)
Roztwory doskonałe :
![]()
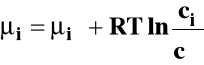
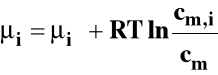
Roztwory rzeczywiste :
![]()
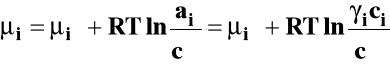
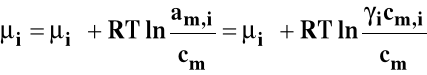
Aktywności stałych, czystych reagentów w zapisie stałej równowagi pomijamy ![]()
.
![]()
zależy tylko od temperatury, wobec tego Kp zależy też tylko od temperatury.
![]()
, ![]()
i ![]()
zależą od temperatury i ciśnienia, wobec tego Kx, Kc i Km zależą od temperatury i ciśnienia.
Sposoby wyrażania stałych równowagi i ich zastosowanie
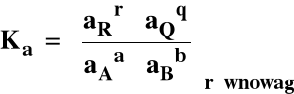
Ka |
stan standardowy |
aktywność |
zastosowanie |
Kp |
czysty składnik pod ciśnieniem standardowym 105 Pa w dowolnej temperaturze |
|
gaz doskonały |
Kp |
czysty składnik pod ciśnieniem standardowym 105 Pa w dowolnej temperaturze |
|
gaz rzeczywisty |
Kx |
czysty składnik pod dowolnym ciśnieniem i w dowolnej temperaturze (w odpowiednim stanie skupienia) |
|
gaz doskonały ; roztwór doskonały |
Kx |
czysty składnik pod dowolnym ciśnieniem i w dowolnej temperaturze (w odpowiednim stanie skupienia) |
|
gaz rzeczywisty; roztwór rzeczywisty |
Kc |
substancja rozpuszczona pod dowolnym ciśnieniem i w dowolnej temperaturze przy stężeniu standardowym c⊗ = 1 mol/dm3 |
|
roztwór doskonały |
Kc |
substancja rozpuszczona pod dowolnym ciśnieniem i w dowolnej temperaturze przy stężeniu standardowym c⊗ = 1 mol/dm3 |
|
roztwór rzeczywisty |
Km |
substancja rozpuszczona pod dowolnym ciśnieniem i w dowolnej temperaturze przy stężeniu standardowym cm⊕ = 1 mol/kg |
|
roztwór doskonały |
Km |
substancja rozpuszczona pod dowolnym ciśnieniem i w dowolnej temperaturze przy stężeniu standardowym cm⊕ = 1 mol/kg |
|
roztwór rzeczywisty |
Wpływ temperatury i ciśnienia na stan równowagi reakcji chemicznej
W sposób jakościowy wpływ warunków (temperatury i ciśnienia) na stan równowagi reakcji chemicznej określa reguła (zasada) przekory Le Chateliera.
Wpływ temperatury na stałą równowagi reakcji chemicznej
Rozpatrujemy układ przy stałym ciśnieniu p = const. Skorzystamy ze wzoru Gibbsa-Helmholtza :
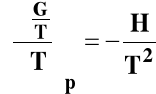
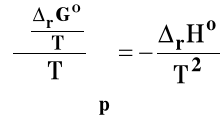
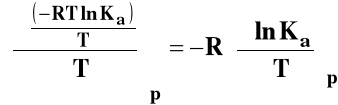
Izobara van't Hoffa
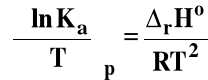
Jeśli rHo < 0 (reakcja egzotermiczna), to stała równowagi Ka maleje, gdy temperatura rośnie.
Jeśli rHo > 0 (reakcja endotermiczna), to stała równowagi Ka rośnie, gdy temperatura rośnie.
Zakładając, że standardowa entalpia reakcji jest stała, można po rozdzieleniu zmiennych izobarę van't Hoffa scałkować następująco :
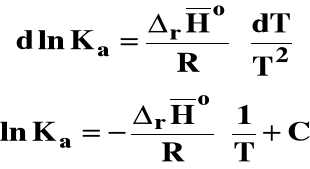
![]()
Wpływ ciśnienia na stałą równowagi reakcji chemicznej
Rozpatrujemy układ przy stałej temperaturze T = const. Skorzystamy ze znanej z termodynamiki zależności :
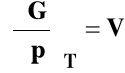
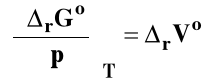
rVo - standardowa zmiana objętości w reakcji chemicznej czyli różnica objętości czystych, rozdzielonych produktów i substratów w stanie standardowym.
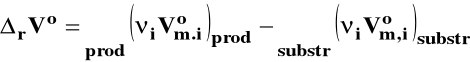
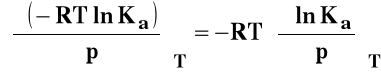
Izoterma van Laara-Plancka
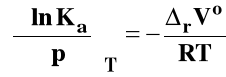
Jeżeli rVo < 0 (reakcja zachodzi ze zmniejszeniem objętości), to Ka rośnie, gdy ciśnienie rośnie.
Jeżeli rVo > 0 (reakcja zachodzi ze wzrostem objętości), to Ka maleje, gdy ciśnienie rośnie.
Dla Kx, Kc i Kx izotermę van Laara-Plancka można zapisać odpowiednio :
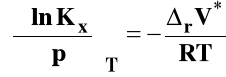
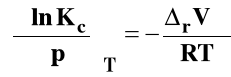
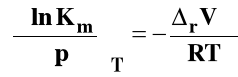
Dla reakcji przebiegających w fazach skondensowanych (w roztworze czy też w stanie stałym) rVo ma bardzo małą wartość i w związku z tym wpływ ciśnienia na stan równowagi dla takich reakcji obserwuje się pod bardzo wysokimi ciśnieniami.
Dla reakcji w fazie gazowej :
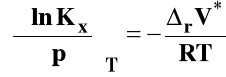
uwzględniamy w zmianie objętości tylko reagenty gazowe
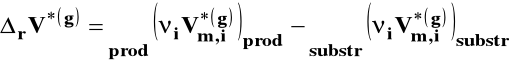
Reagenty gazowe możemy w pierwszym przybliżeniu potraktować jako gazy doskonałe :
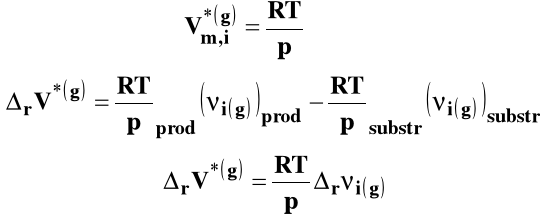
Izoterma van Laara-Plancka przybiera wówczas postać :
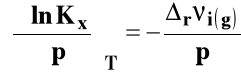
Jeżeli ![]()
(liczba moli gazowych produktów jest mniejsza niż substratów), to Kx rośnie wraz ze wzrostem ciśnienia.
Jeżeli ![]()
(liczba moli gazowych produktów jest większa niż substratów), to Kx maleje wraz ze wzrostem ciśnienia.
Jeżeli ![]()
(liczba moli gazowych produktów jest taka sama jak substratów), to ciśnienie nie ma wpływu na Kx (lub ma nieznaczny wpływ dla gazów rzeczywistych, ale aby go ocenić trzeba wiedzieć, jak zmienia się lotność wszystkich reagentów wraz ze zmianą ciśnienia).
12
rG>0
rG=0
rG<0
![]()
p,T = const
0 ξ * 1
G
![]()
![]()
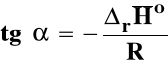
reakcja endotermiczna
reakcja egzotermiczna
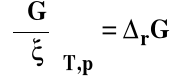
Entalpia swobodna reakcji chemicznej rG to zmiana entalpii swobodnej układu zamkniętego o nieskończenie dużej ilości, w którym zachodzi reakcja chemiczna w warunkach izotermiczno-izobarycznych, gdy liczba postępu reakcji zmienia się o jeden.
rG
![]()
rG
T,p = const
![]()
Gdy układ znajdujący się w stanie równowagi zostanie poddany działaniu czynnika zaburzającego równowagę (bodźca), reaguje w taki sposób, aby zminimalizować zaburzenie.
reakcja egzergoniczna
reakcja endergoniczna
Wyszukiwarka