6.5.2. Owadobójcze deltaendotoksyny
Na przestrzeni ostatniego półwiecza zużycie chemicznych środków owadobójczych podwaja się co 10 lat. Stosuje się je do zwalczania szkodników upraw oraz owadów roznoszących rozmaite choroby. Jednakże poważną wadą tych substancji jest ich mała specyficzność w stosunku do żywych organizmów. Stąd, mogą powodować liczne zatrucia ludzi i zwierząt. Ponadto likwidują nie tylko szkodniki, ale również pożyteczne owady, w tym naturalnych wrogów danego szkodnika. Wiele z tych związków jest trudno biodegradowalnych i ich stężenie w wielu regionach niepokojąco rośnie, powodując zachwianie równowagi w naturalnych ekosystemach.
Od 25 lat alternatywą dla stosowania owadobójczych substancji chemicznych stały się biopestycydy. Najlepiej poznanym i szeroko stosowanym biopestycydem są białka δ-endotoksyn otrzymywane z hodowli różnych odmian bakterii Bacillus thuringiensis (Bt). Ta pospolita bakteria glebowa najczęściej spotykana jest w pyle zbożowym zalegającym silosy i inne pomieszczenia służące do przechowywania zboża. Ustalono, że istnieją tysiące odmian B.thuringiensis. Każda odmiana w trakcie sporulacji produkuje własne unikalne kryształy insektycydowego białka, które są odkładane w komórkach poza przetrwalnikiem. Insektycydowa aktywność toksyn z każdej odmiany Bt różni się. Dlatego też, zespół Bt delta-endotokyn atakuje rozmaite gatunki z rzędów chrząszczy (Coleoptera), ciem i motyli (Lepidoptera) czy much i moskitów (Diptera). Niektóre Bt delta-toksyny wykazują skuteczność toksycznego działanie na równi z syntetycznymi pestycydami (np. organofosforowymi). W odróżnieniu od organofosforowych pestycydów, które wykazują działania ogólne, Bt toksyny są bardzo wąsko specyficzne; wykazują skuteczność jedynie w stosunku do pewnych szkodliwych insektów i tym samym są bezpieczne dla większości nieszkodliwych, a nawet pożytecznych insektów i innych zwierząt. Ponadto Bt toksyny są biodegradowalne i nie zaśmiecają środowiska.
Poznano 34 podgatunki B.thuringiensis. Najbardziej wśród nich rozpowszechnione to: podgatunek kurstaki (przeciw Lepidoptera), israelensis (przeciw Diptera, głównie moskitom i czarnym muchom) i podgatunek tenebrionis (przeciw Leptinotarsa decemlineata, czyli stonce ziemniaczanej). Dwie główne grupy insektycydowych białkowych kryształów produkowanych przez odmiany tych bakterii zostały zidentyfikowane jako: Cyt (cytolizyny) i Cry (kryształy delta-endoksyn). W roku 1989 zdefiniowano cztery klasy genów Cry i dwie klasy genów Cyt. Toksyny CryI i CryII są aktywne przeciw ćmom i motylom, CryII i CryIV są przeciw muchom i moskitom a toksyna CryIII przeciw chrząszczom. Toksyny Cyt są aktywne w stosunku do much, moskitów oraz chrząszczy i ponadto przeciwko prawdziwym robakom (hemipterans) oraz karaluchom i termitom (dictyopterans). Toksyny CryIII są produkowane przez podgatunki B.thuringiensis zwane tenebrionis i tolworthi a CryIV przez israelensis. Ogólnie, nie znaleziono dotychczas jakiejś wyraźnej korelacji pomiędzy rodzajem toksyny a produkującym ją podgatunkiem bakterii. Toksyny Cry wiążą się ze specyficznymi receptorami komórkowymi środkowego fragmentu przewodu pokarmowego insektów. Toksyny Cyt, w odróżnieniu od toksyn Cry, nie rozpoznają specyficznych miejsc wiązania.
Delta-endotoksyny dzieli się ze względu na specyficzność w stosunku do poszczególnych rzędów owadów na cztery klasy: od CryI do CryIV; a te dalej - na podklasy i odmiany. Przykładowo białko δ-endotoksyny CryIA(c) jest toksyczne względem wielu owadów z rzędu Lepidoptera, ale tylko dla trzech gatunków z rodziny Torticidae (zwójki). Ta ukierunkowana specyficzność δ-endotoksyn ma najprawdopodobniej związek z ich wiązaniem się z odpowiednimi receptorami na powierzchni komórek nabłonka jelita danego owada. Brak receptorów rozpoznających określone toksyny decyduje o niewrażliwości owadów.
Bacillus thuringiensis bezpośrednio powoduje śmiertelność insektów. Podobny skutek wywołują toksyny z rozmaitych odmian tych bakterii w następstwie podobnego sposobu działania. Po połknięciu przez insekta, kryształy delta-endotoksyn rozpuszczają się w jego środkowym fragmencie przewodu pokarmowego, uwalniając prototoksynę, z której są zbudowane. Ta dalej proteolitycznie przetwarzana jest do fragmentów, które wiążą się z błonami pokrywającymi wnętrze przewodu pokarmowego. Aktywne białka zakłócają osmolityczną równowagę tych komórek przez tworzenie por w membranach komórkowych prowadząc do lizy komórek. Jelito staje się sparaliżowane i insekt przestaje spożywać pokarm i większość z nich ginie w przeciągu kilku godzin. Toksyczność wspomnianych fragmentów toksyn w stosunku do danego insekta zależy od powinowactwa wiązania się z membranami komórkowymi.
B. thuringiensis po raz pierwszy na skalę przemysłową został zastosowany we Francji w 1938 roku. W Stanach Zjednoczonych jego handlowe znaczenie datuje się od 1950 roku. Od wiele lat, w formie aerozolu stosowany jest powszechnie przy uprawach roślin oraz do zwalczania owadów w leśnictwie. W latach 80-tych komercyjne zainteresowanie preparatami Bt bardzo szybko wzrosło, gdy okazało się, że wiele popularnych syntetycznych insektycydów staje się nieefektywnych z powodu wytworzenia się oporności insektów czy też nie nadaje się do użycia z powodu środowiskowych ograniczeń. Ponadto w tym samym czasie następuje rozwój inżynierii genetycznej. W 1987 roku pojawia się pierwszy raport o wbudowaniu genu kodującego biosyntezę delta-toksyn Bt do roślin. Pierwszymi (1993) transgenicznymi roślinami z ekspresją Bt toksyn były tytoń i pomidory. Dzisiaj, znaczące Bt transgeniczne uprawy obejmują kukurydzę, bawełnę, ziemniaki i ryż.
Równocześnie prowadzone są badania nad wyeliminowaniem kilku niekorzystnych cech dotychczas stosowanych preparatów. Chodzi tu głównie o zwiększenie ich trwałości, a także o wyeliminowanie z nich spor i niektórych metabolitów wtórnych (m.in. -egzotoksyny i hemolizyny, które mogą być toksyczne dla wielu organizmów). Badania te polegają na wprowadzaniu genów kodujących δ-endotoksyny Bacillus thuringiensis do innych komórek bakteryjnych (m.in. Pseudomonas fluorescens, Bacillus megaterium czy Bacillus sphaericus, który również produkuje swoiste toksyny (w stosunku do owadów z rzędu Diptera) lub na ich wprowadzaniu do roślin.
Również niektóre inne gatunki Bacillus (wspomniany już Bacillus sphaericus, Bacillus cereus, Bacillus popilliae, Bacillus larvae i Bacillus lentimorbis) wytwarzają toksyny o białkowej naturze, aktywne w zwalczaniu owadów.
6..5.3. Antybiotyki
Początek ery antybiotyków datuje się na rok 1929r., gdy A. Fleming zaobserwował hamujący wpływ grzyba Penicillium notatum na wzrost bakterii Staphylococcus. W 1942r. wyizolowana została z Penicillium notatum penicylina, a z bakterii Bacillus brevis tyrotrycyna. W następnych latach odkryto wiele innych antybiotyków. Obecnie w lecznictwie stosuje się ich około 100. Niektóre z nich wytwarzane są w oparciu o wgłębną hodowlę bakterii Bacillus. Jako przykład można wymienić gramicydynę S, pierścieniowy dziesięciopeptyd wytwarzany przez Bacillus brevis. Gramicydynę S stosuje się jako składnik maści i roztworów używanych zewnętrznie do leczenia owrzodzeń oraz zainfekowanych ran i oparzeń.
Bakterie Bacillus brevis wytwarzają jeszcze inne antybiotyki, m.in. tyrocydyny A, B i C (główne składniki tyrotrycyny), będące również cyklicznymi oligopeptydami, zawierającymi -D-fenyloalaninę, podobnie jak gramicydyna S. Znanych jest obecnie ponad 25 antybiotyków wytwarzanych przez różne szczepy tych bakterii.
Innym przykładem antybiotyku o budowie peptydowej jest bacytracyna, wytwarzana na skalę przemysłową (m.in. w PZF „POLFA” w Pabianicach) w oparciu o hodowlę bakterii Bacillus subtilis.
Bacytracyna jest mieszaniną spokrewnionych ze sobą cyklicznych peptydów wytwarzanych przez bakterie Bacillus licheniformis i Bacillus subtilis. Mieszanina ta zawiera co najmniej 10 komponentów, z których tylko najbardziej znaczący, bacytracyna A, i jej utleniony odpowiednik, bacytracyna F, mają w pełni zdefiniowaną strukturę chemiczną.
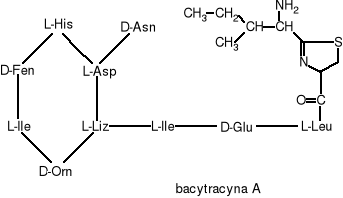
Bacytracyna F powstaje z bacytracyny A: na drodze oksydatywnej zostaje usunięta grupa aminowa a tiazolowy pierścień ulega odwodornieniu. Wiadomo również, że bacytracyna B posiada trzy zmienione miejsca w stosunku do bacytracyny A (między innymi izoleucyna została zastąpiona waliną).
Bacytracyna w postaci soli cynkowej, a także w kombinacji z innymi antybiotykami (przeważnie polimyksyną B i neomycyną) jest używana w maściach (np. o nazwie handlowej „Neosporin” USA) w leczeniu infekcji skóry i oczu, a także zapobiegawczo przeciw infekcjom ran. Skuteczna jest przeciwko bakteriom Gram-dodatnim (gronkowce, paciorkowce), pałeczkom beztlenowców i niektórym pierwotniakom. Jest inhibitorem fosfatazy lipidowej. Używana bywa także, jako dodatek do paszy dla drobiu, świń, bydła i zwierząt futerkowych (z wyłączeniem królików).
Poszczególne szczepy bakterii Bacillus subtilis, obok bacytracyny, produkują ponad 65 innych antybiotyków o budowie polipeptydowej. Jednym z lepiej poznanych jest subtilina (podobna do bacytracyny), antybiotyk o wysokiej aktywności w stosunku do bakterii gram-dodatnich i rozmaitych patogennych grzybów. Należy do grupy lantibiotyków, czyli antybiotyków peptydowych zawierających lantioninę - bis(2-amino-2-karboksyetylo)siarczek - o wzorze chemicznym HOOC-CH(NH2)-CH2-S-CH2-CH(NH2)-COOH.
Z kolei Bacillus polymyxa wytwarza polimiksyny. Z punktu widzenia budowy chemicznej przypominają one peptydy. DAB jest kwasem α,γ-diaminomasłowym, połączony z innymi aminokwasami wiązaniami peptydowymi. Stąd antybiotyki te zalicza się do polipeptydowych.
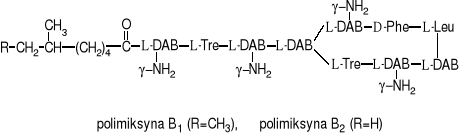
Polimiksyny należą do antybiotyków o wąskim zakresie działania, działają jedynie na bakterie Gram-ujemne. Jednakże charakteryzują się silnymi właściwościami bakteriobójczymi.
TabelaAntybiotyki produkowane przez bakterie z rodzaju Bacillus
Gatunek |
Produkowany antybiotyk |
B. brevis |
gramicydyna, tyrotrycyna i inne |
B. cereus |
cereksyna, zwittermycyna, i inne, |
B. circulans |
cyrkulina, butyrozyna |
B. colistinus |
kolistyna |
B. laterosporus |
laterosporyna |
B. licheniformis |
bacytracyna, surfaktyna |
B. polymyxa |
polimiksyna |
B. pumilus |
pumulina |
B. subtilis |
bacytracyna, polimiksyna, difficydyna, surfaktyna, subtilina, mykobacilina, i inne |
Antybiotyki bakterii z rodzaju Bacillus wykazują pełny przedział antymikrobiologicznej aktywności: bacytracyna, pumulina, laterosporyna, gramicydyna i tyrocydyny są efektywne przeciw Gram-dodatnim bakteriom; kolistyna i polimiksyna są anty-Gram-ujemne; difficydyna posiada szerokie spektrum działania; a mykobacilina i zwittermycyna są przeciw grzybom. Ich działanie jest różne. Niektóre blokują syntezę ściany komórkowej lub zakłócają funkcje błon biologicznych, inne, mniej liczne, zakłócają replikację, transkrypcję lub translację.
Wyjątkowy wśród bakterii z tego rodzaju jest Bacillus circulans, który syntetyzuje butyrozynę - antybiotyk aminoglukozydowy. Na drodze biotransformacji otrzymuje się obecnie z niego jeden z najefektywniejszych mutasyntetycznych antybiotyków, jakim jest amikacyna.
6.5.4. Nukleotydy purynowe
Nukleozydy i nukleotydy purynowe znalazły zastosowanie w medycynie i jako środki poprawiające smak. Nukleotydy: kwas guanylowy (guanozyno-5'-fosforan - GMP), kwas inozynowy i kwas ksantynowy są produkowane głównie w oparciu o hodowle Corynebacterium glutamicum, ale alternatywną drogą jest użycie Bacillus subtilis syntetyzującego nukleozydy i ich późniejsza chemiczna fosforylacja.
Biosynteza rybonukleotydów purynowych u Bacillus subtilis podlega złożonej inhibicji na zasadzie sprzężenia zwrotnego i represji końcowym produktem. Jedynie mutanty odporne na efekt sprzężenia zwrotnego są wykorzystywane do celów produkcyjnych. Do przemysłowej produkcji inozyny używa się mutantów Bacillus subtilis K, u których nukleozyd łatwo przechodzi przez membrany komórkowe do podłoża hodowlanego. Wydajność większą niż 20g/dm3 uzyskuje się z zastosowaniem adenino-auksotrofowych mutantów.
Z kolei u guanozyno-produkcyjnych szczepów Bacillus subtilis, brakuje reduktazy GMP (EC 1.7.1.7). Mutanty te wywodzą się z producentów inozyny. Wydajność guanozyny w tym procesie jest nie mniejsza niż 8g/dm3.
Mutanty Bacillus subtilis stosowane do produkcji ksantyny są guanino-auksotrofami. Wydajność biosyntezy tego nukleozydu sięga nawet 15g/dm3.
6.5.4. Witaminy
W chwili obecnej jedynie niewielka ilość witamin produkowana jest komercyjnie przez hodowlę drobnoustrojów. Jednakże postęp w klonowaniu genów strukturalnych ryboflawiny, kobalaminy i biotyny w genomie bakterii Bacillus, w kombinacji z wykorzystaniem genetycznej i metabolicznej strategii rekonstrukcji, zapewnia potencjał skłaniający do wykorzystania szczepów Bacillus w produkcji witamin na skalę przemysłowa. Ponadto stwierdzono, że mutacja w operatorze ribO ryboflawinowego operonu, prowadzi do kilkakrotnej nadprodukcji ryboflawiny.
Do tradycyjnie używanych przemysłowych producentów witamin zalicza się wyższe grzyby (Ascomycetes), Eremothecium ashbyii i Ashbya gossypii. Jednakże, bakterie i drożdże mają przewagę nad nimi z uwagi na możliwość obwitego wzrostu i użycia prostych syntetycznych podłoży. Aktualnie rozważa się wykorzystanie trzech różnych mikroorganizmów do produkcji ryboflawiny: nitkowatego grzyba Ashbya gossypii; drożdży Candida famata i Bacillus subtilis. Dwa pierwsze mikroorganizmy w piątym dniu hodowli wytwarzają maksymalne ilości ryboflawiny na poziomie 20g/dm3. Corynebacterium ammoniagenes również nagromadza w podłożu ryboflawinę na poziomie 20g/dm3, ale w krótszym trzydniowym cyklu.
Bacillus subtilis, w optymalnych warunkach, zapewnia wydajność produkcji ryboflawiny na poziomie 30g/dm3 w ciągu trzech dni hodowli. W związku z tym, staje się najbardziej atrakcyjnym mikrobiologicznym producentem ryboflawiny.
6.5.5. Kwas poliglutaminowy
Kwas poliglutaminowy (PGA) jest anionowym naturalnym homopoliamidem, który jest zbudowany z jednostek kwasu D- i L-glutaminowego połączonych amidowym (ściśle biorąc peptydowym) wiązaniem pomiędzy aminowymi i karboksylowymi grupami. PGA jest rozpuszczalny w wodzie i, co najważniejsze, jest biodegradowalny. Znalazł zastosowanie w przemyśle spożywczym, kosmetycznym, w medycynie i w oczyszczalni ścieków. Specyficznym zastosowaniem PGA i jego pochodnych jest ich używanie jako zgęszczaczy, hemektantów nawilżających, krioprotektantów, nośników wielu leków, hydrożeli o wysokiej adsorbancji wody, flokulantów, absorbentów ciężkich metali i dodatku do pasz dla zwierząt.
Kilka gatunków bakterii z rodzaju Bacillus jest zdolnych do syntezy PGA, jednakże najintensywniej badane są Bacillus licheniformis i Bacillus subtilis.
Geny wymagane dla biosyntezy PGA udało się w ostatnim czasie (2002) sklonować w Bacillus subtilis. Charakterystyka produktów tych genów wskazuje, że syntetaza PGA (ligaza glutamylo-poliglutaminianowa - enzym z podpodklasy EC 6.3.2.) jest kluczowa dla biosyntezy PGA.
W przypadku Bacillus licheniformis ATCC 9945A w skali laboratoryjnej - bioreaktor o pojemności 2,5dm3 - wydajność biosyntezy PGA wynosi 35g z jednego litra podłoża. Uruchomiona w Japonii dla celów komercyjnych produkcja PGA w oparciu o hodowlę bakterii Bacillus subtilis F-2-01 pozwala osiągnąć wydajność powyżej 50g/dm3.
6.5.6. D-Ryboza
D-Ryboza jest często używana jako przyprawa poprawiająca smak żywności, farmaceutyk, kosmetyk, w zdrowej żywności, w leczeniu zawału mięśnia sercowego i bólu mięśni. Na możliwość mikrobiologicznej produkcji D-rybozy zwrócono uwagę stosunkowo późno, bo dopiero w 1997 roku. Jednakże już w 2000 roku światowa produkcja tego związku na drodze fermentacji sięga 2000 ton.
Mikroorganizmy, które wytwarzają D-rybozę są pozbawione transketolazy (EC 2.2.1.1) i/lub 3-epimerazy D-rybuluzo-fosforanowej (EC 5.1.3.1). Kilka szczepów Bacillus subtilis i Bacillus pumilus oraz ich mutanty produkują znaczące ilości D-rybozy. Dzięki rozwojowi inżynierii genetycznej i biotechnologii udało się w ostatnim czasie przekroczyć w 1dm3 podłoża 90g D-rybozy przy wyjściowym stężeniu glukozy 200g/dm3 przy jednoczesnym znaczącym skróceniu czasu hodowli bakterii i obniżeniu stężenia niepożądanych ko-produktów.
6.5.7. Rozmaite inne produkty z bakterii Bacillus spp.
Obok wyżej opisanych, bakterie z rodzaju Bacillus wytwarzają rozmaite inne produkty o znaczeniu przemysłowym. Niektóre z tych produktów oraz ich zastosowanie przedstawiono w tabeli 6.5.
Tabela 6. Różnorodne produkty o znaczeniu przemysłowym z bakterii Bacillus.
Produkt |
Zastosowanie |
Gatunek bakterii Bacillus |
δ-Endotoksyny |
Biopestycydy, insektycydy |
B .thuringiensis, B .sphaericus, B .popilliae, B .lentimorbus |
Nukleotydy purynowe |
Środki poprawiające smak żywności oraz medycyna |
B. subtilis |
Ryboflawina |
Witaminowy składnik zdrowej żywności |
B. subtilis |
Kwas poliglutaminowy (PGA) |
Biopolimer, zagęszczacz, przemysł spożywczy, kosmetyczny, medycyna |
B. subtilis |
D-Ryboza |
Przyprawa poprawiająca smak żywności, zdrowa żywność, farmaceutyk, kosmetyk, |
B. subtilis, B. pumilus |
Taumatyna |
Super słodkie białko - środek słodzący |
B. subtilis |
Polihydroksymaślan (PHB) |
Biodegradowalny plastik |
B. megaterium |
Streptawidyna |
Białko o wysokim powinowactwie do biotyny. Testy immunoenzymatyczne i w biologii molekularnej. |
B. subtilis |
2-Acetylo-1-pirolina |
Naturalne środki smakowe i zapachowe. |
B. cereus |
Taumatyna jest super słodkim monomerycznym białkiem o masie 22 kDa z afrykańskiej rośliny Thaumatococcus daniellii. Występuje pięć form taumatyny, ale najobficiej występują formy I i II. Formy I i II taumatyny stanowią pojedyncze łańcuchy polipeptydowe zbudowane z 207 reszt aminokwasów, które różnią się między sobą jedynie pięcioma aminokwasami. Taumatyna jest potencjalnym niskokalorycznym substytutem cukru stosowanym jako substancja słodząca (E 957).
Gen taumatyny II z Thaumatococcus daniellii transformowano do bakterii Bacillus subtilis. Do transformacji użyto wektor plazmidowy, który zawierał cDNA taumatyny II pod kontrolą promotora α-amylazy i rybosomalny 35S RNA. U bakterii tych dokonano ekspresji transformowanego genu.
Polimer polihydroksymaślan (PHB) dodany do leku utrzymuje stałe jego stężenie w organizmie oraz kieruje go dokładnie w miejsce, w którym jest potrzebny. Polimer umożliwia kontrolowane stałe uwalnianie leku. Dzięki temu można np. podawać mniej antybiotyków. Leki antyrakowe są z kolei kierowane dokładnie do chorych komórek, co oznacza mniejsze skutki uboczne. PHB występuje naturalnie w przyrodzie - jest syntetyzowany m.in. w ludzkim organizmie i roślinach. Dzięki temu jest bioakceptowalny, biodegradowalny i biokompatybilny - czyli ani on sam, ani produkty jego rozkładu nie są szkodliwe dla człowieka.
PHB otrzymuje się metodą polimeryzacji β-butyrolaktonu z zastosowaniem nowoczesnych inicjatorów supramolekularnych. Alternatywną metodą jest produkcja oparta o hodowle drobnoustrojowe. Np. Bacillus megaterium nagromadza w komórkach w 14 dniu hodowli w podłożu zawierającym 5% melasy kwas polihydroksymasłowy w ilości ponad 3,4g/dm3 podłoża. Szczep jest tak skonstruowany, że po zakończeniu hodowli następuje samouszkodzenie komórek i PHB jest uwalniany do podłoża, z niego ekstrahowany i dalej czyszczony. Gotowy polimer PHB jest tańszy niż antybiotyk, do którego jest dodawany.
Streptawidyna jest tetramerycznym białkiem (4x13kDa), które ma rozmaite biochemiczne zastosowania. Wykazuje wysokie powinowactwo do biotyny i biotynylowanych cząstek. Każdy monomer wiąże jedną molekułę biotyny. To powoduje, że powierzchnie pokryte streptawidyną są idealne do wiązania małych cząstek takich jak peptydy i oligonukleotydy. Płytki ze streptawidyną wykorzystywane są w testach immunoenzymatycznych i w biologii molekularnej. Generalnie stosowane są tam gdzie istnieje potrzeba immobilizacji cząstek, które trudno poddają się pasywnej adsorbcji.
Atrakcyjnym producentem streptawidyny są bakterie Bacillus subtilis (m.in. z uwagi na dostępność szczepów wytwarzających pozakomórkowo łatwo odzyskiwalne białka, przy jednoczesnym deficycie aktywności endopeptydaz). Bakterie te produkują streptawidynę na poziomie 40-50mg/dm3 podłoża.
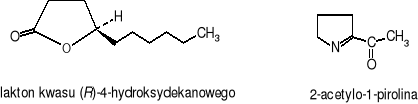
Generacja naturalnych środków smakowych i zapachowych otrzymywanych metodami biotechnologicznymi szybko opanowuje rynki światowe. Do tego typu komponentów zalicza się: wanilino-podobne związki, aldehyd benzoesowy (gorzkie migdały, wiśnie) i lakton kwasu (R)-4-hydroksydekanowego (oleisto-słodki, o nutcie owocowej). Ich produkcja sięga kilku tysięcy ton rocznie. Związki smakowe pochodzące z hodowli bakterii Bacillus występują często w połączeniu z aminokwasami lub peptydami. Lotne związki zapachowe wytwarzane w trakcie fermentacji soi z zastosowaniem bakterii z rodzaju Bacillus są aldehydami, ketonami i kwasami. Niektóre szczepy Bacillus cereus, izolowane podczas fermentacji kakao, produkują 2-acetylo-1-pirolinę jako podstawowy komponent odpowiedzialny za znany powszechnie charakterystyczny aromat prażonej kukurydzy.
6.5.8. Biotransformacja
Biotransformacja to jednoetapowe (rzadziej dwuetapowe) chemiczne przekształcenie egzogennych związków organicznych w strukturalnie im podobne produkty dokonywane przez żywą komórkę. Produkty tych przekształceń bardzo często nie mają żadnego znaczenia dla komórki, a niekiedy wręcz mogą okazać się dla niej toksyczne.
Biotransformacja nie jest celem działania komórki; zachodzi ona często jako proces niezależny od jej funkcji życiowych. Można uznać, że w wielu przypadkach „komórka nawet nie zdaje sobie sprawy z tego, że zostaje oszukana i wykorzystana do przekształcenia podsuniętego jej związku organicznego”. Biotechnolog wykorzystuje naturalny aparat enzymatyczny komórki, podstawia jej pewne związki organiczne i oczekuje, że zostaną one przekształcone zgodnie z jego przewidywaniami. Bakterie z rodzaju Bacillus znalazły zastosowanie w wielu takich bioprocesach.
6.5.8.1. Hydroliza estrów
Wykorzystanie biotransformacji w procesach przemysłowych wymagających stosowania wysoko selektywnych reakcji hydrolitycznych (do których należy zaliczyć znaczną część reakcji hydrolitycznego rozkładu estrów pochodzenia nienaturalnego) ograniczone jest niewielką ilością odpowiednich enzymów drobnoustrojowych. W przeciwieństwie do lipaz, esterazy właściwe - a więc o takiej specyficzności, jaką wykazują esterazy izolowane z wątroby świni (PLE) lub konia (HLE) - są słabo rozpowszechnione u drobnoustrojów. U niektórych mikroorganizmów (m.in. u Bacillus subtilis i Bacillus coagulans) znaleziono jednak nowy typ esteraz (tzw. karboksyloesterazy - NP), wykazujących wysoką specyficzność dla pewnego rodzaju substratów.
Reakcja hydrolitycznego rozkładu estrów prowadzona z udziałem bakterii z rodzaju Bacillus może być wysoce stereospecyficzna i regioselektywna, co ma niewątpliwie istotne znaczenie z praktycznego punktu widzenia, (np. przy rozdziale enancjomerów lub hydrolizie estrów związków z kilkoma chiralnymi atomami węgla). Poniżej podano kilka takich przykładów.
Rys. VI-24. Hydroliza octanu drugorzędowego alkoholu przez Bacillus sp.
Na rys. VI-24 przedstawiono rozdział racematu drugorzędowego alkoholu przez stereospecyficzną hydrolizę jego octanu przez Bacillus sp. W tym przypadku konieczne okazało się zamaskowanie terminalnej polarnej grupy karboksylowej t-butanolem. Wydajność enancjomeru R wynosi w tej reakcji 94%.
Rys. IV-25. Rozdział -pochodnych kwasu propionowego z wykorzystaniem esterazy z Bacillus sp.
Innym przykładem może być rozdział mieszaniny podstawionych enancjomerów -arylo- i -aryloksy- pochodnych kwasu propionowego (rys. VI-25.). Pochodne te znane są dobrze jako leki przeciwzapalne (np. Naproxen) i agrochemikalia (np. Diclofop). Jednakże główną biologiczną aktywność wykazuje z reguły jedynie jeden z enancjomerów (np. S w przypadku Naproxenu). Cytowany przykład pokazuje możliwość zastąpienia konwencjonalnej metody rozdziału tych enancjomerów przez biotransformację z wykorzystaniem fragmentów komórek Bacillus sp. lub esterazy z nich izolowanej.
Rys. VI-26. Hydroliza racemicznych estrów z chiralnymi atomami węgla przez Bacillus subtilis
Rys. VI-27. Regioselektywna hydroliza estrów katalizowana przez subtilizynę
Kolejny przykład dotyczy hydrolizy racemicznych estrów kwasów i alkoholi z kilkoma chiralnymi atomami węgla (rys. VI-26). Komórki Bacillus subtilis var. niger IFO 3108 zastosowano do hydrolizy racemicznej mieszaniny octanu trans/cis-2,trans-4-dimetylocykloheksanolu. W wyniku tej reakcji rozdzielono obydwa enancjomery, otrzymując alkohol trans-2,trans-4-dimetylocykloheksanolowy z wydajnością 94%.
Również endopeptydazy produkowane przez bakterie z rodzaju Bacillus mogą selektywnie hydrolizować estry. Na rys. VI-27 przedstawiono przykłady reakcji regioselektywnej hydrolizy estrów karboksylowych katalizowanych przez subtilizynę. Estry dibenzylowe kwasu asparaginowego i glutaminowego są hydrolizowane przy pierwszym atomie węgla. Natomiast estry etylowe kwasu cytrynowego i 1,2,3-trikarboksylopropanu są hydrolizowane przy środkowym atomie węgla. Okazało się, że inne możliwe regioizomeryczne estry nie były wykrywane wśród produktów hydrolizy.
Subtilizyny, obok właściwej sobie specyficzności charakterystycznej dla endopeptydaz, wykazują również zdolność do hydrolizy estrów wielu aminokwasów. Najefektywniej hydrolizują estry niepolarnych N-acetylo- lub N-benzoilo- podstawionych L-aminokwasów. Natomiast nie hydrolizują estrów D-aminokwasów i stąd znalazły zastosowanie do rozdziału racemicznych mieszanin DL-aminokwasów.
6.5.8.2. Produkcja aminokwasów
Naturalnie występujące w świecie ożywionym L-aminokwasy, których roczne zapotrzebowanie przekracza 1000 ton (np. kwas L-glutaminowy i L-lizyna) produkuje się na drodze biosyntezy. Inne aminokwasy, zwłaszcza szeregu D-, które są niezwykle wartościowe dla przemysłu farmaceutycznego i agrochemicznego, otrzymuje się skojarzonymi metodami enzymatyczno-chemicznymi. Przykładem takiej metody może być produkcja D-aminokwasów poprzez stereospecyficzną (S-specyficzną) hydrolizę odpowiednich pochodnych hydantoiny. Pochodne te, stanowiące mieszaninę D- i L-enancjomerów, otrzymuje się znanymi metodami chemicznymi (np. metodą Bücherera-Berga). Z racematu tego można wydzielić D-aminokwas w procesie biotransformacji, wykorzystując komórki Bacillus brevis lub w procesie enzymatycznej transformacji używając hydantoinazy (dihydropirydyminazy - EC 3.5.2.2.) i hydrolazy N-karbamoilo-D-aminokwasowej (EC 3.5.1.77) produkowanych przez te same bakterie. (Rys. VI-28.). Hydantoinazę produkuje również Bacillus stearothermophilus SD1.
Hydantoinaza działa stereospecyficznie, powodując rozerwanie jedynie pierścienia D-hydantoiny, w wyniku czego powstaje rozpuszczalna pochodna N-karbamoilowa D-aminokwasu. Przy odpowiednim pH nierozpuszczalna pochodna L-hydantoiny szybko ulega racemizacji, tak że wydajność procesu sięga 100% wydajności teoretycznej. W następnym etapie produkcyjnym otrzymany N-karbamoilo D-aminokwas poddaje się hydrolizie konwencjonalnymi metodami, lub enzymatycznie otrzymując w efekcie D-aminokwas. Na drodze biotransformacji hydantoiny na dużą skalę produkuje się obecnie D-(4-hydroksylofenylo)glicynę, która jest półproduktem do wytwarzania amoksycyliny, ważnego półsyntetycznego antybiotyku.
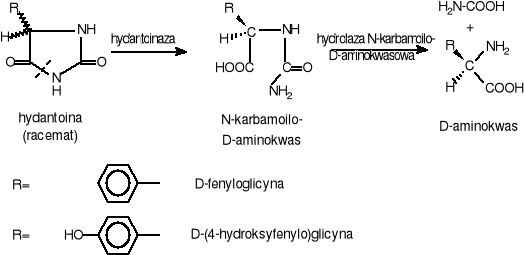
Rys. VI-28. Rozdział pochodnych D,L-hydantoiny z wykorzystaniem enzymów bakterii Bacillus
Niektóre gatunki bakterii z rodzaju Bacillus zdolne są w odpowiednich warunkach do nadprodukcji aminokwasów i stąd mogą być używane do ich biosyntezy. I tak np. Bacillus subtilis w podłożach hodowlanych z dodatkiem prekursora (jakim może być 2-ketomaślan, D,L--hydroksymaślan bądź też D,L--aminomaślan) może nagromadzać L-izoleucynę, a w podłożach z L-homoseryną nagromadza L-treoninę.
6.5.8.3. Antybiotyki
Głównym półproduktem do otrzymywania szeregu półsyntetycznych penicylin (m.in. ampicyliny i amoksycyliny) jest kwas 6-aminopenicylanowy (kwas 6-AP). Otrzymuje się go przez biotransformację penicyliny G (benzylopenicyliny) lub penicyliny V (fenoksymetylopenicyliny). Oba te antybiotyki produkuje się na drodze biosyntezy w hodowlach pleśni Penicillium chrysogenum Do ich przekształcenia w kwas 6-AP wykorzystuje się immobilizowaną acylazę (amidazę) penicylinową (EC 3.5.1.11.) pozyskiwaną z bakterii Escherichia coli, Bacillus sphaericus, Bacillus megaterium lub innych drobnoustrojów (patrz rozdział 8, część VI).
6.5.8.4. Steroidy
Chemiczna synteza leków steroidowych wymaga dużej liczby operacji technologicznych. Skojarzenie typowych przekształceń chemicznych z procesami biotransformacji znacznie ograniczyło ich liczbę.
Duże znaczenie praktyczne w produkcji związków steroidowych ma reakcja odwodornienia w pozycji pierścienia A. Do przekształcenia kortyzonu w prednizon (a także innych analogów kortykosteroidowych) można zastosować bakterie Bacillus lentus lub Bacillus sphaericus (Rys. VI-29.). Dzięki działaniu -dehydrogenazy 3-oksosteroidowej (EC 1.3.99.4.) w sposób wybiórczy ulega odwodornieniu wyłącznie pierścień A, a ilość reakcji ubocznych jest niewielka w porównaniu do pojawiających się podczas stosowania do tego celu innych drobnoustrojów.
Rys. VI-29. odwodornienie kortyzonu przez Bacillus lentus lub Bacillus sphaericus
Monooksygenazy wielu mikroorganizmów mogą regioselektywnie i stereospecyficznie hydroksylować steroidy. To, czy hydroksylowanie nastąpi w pozycji lub oraz w którym pierścieniu i przy którym atomie węgla zależy od użytego szczepu oraz w pewnym stopniu od budowy cząsteczki substratu. Bakterie Bacillus megaterium ATCC, jako jedne z nielicznych, hydroksylują progesteron przy 15 atomie węgla w pozycji i Monooksygenazy szczepu Bacillus megaterium KM hydroksylują progesteron w kilku pozycjach: 15 i , 6 oraz 11.
6.5.8.1. Inne przykłady biotransformacji
Bacillus megaterium PYR291 wykorzystywany jest do mikrobiologicznej syntezy kwasu 2-karboksypirolowego z pirolu.
Bacillus subtilis przekształca rapamycynę (antybiotyk o właściwościach immunosupresyjnych), do 24-hydroksyrapamycyny (terapeutycznego środka zapobiegającego odrzutom przy transplantacji organów).
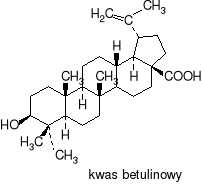
Bacillus megaterium ATCC 13368 wykazuje zdolność do biotransformacji kwasu betulinowego (pentacyklicznego triterpenu, znalezionego w obfitości w zewnętrznej korze białej brzozy), związku o właściwościach antynowotworowych (antymelanoma - przeciw czerniakowi skóry), opóźniającego postęp infekcji spowodowanej wirusem HIV(2), a ponadto hamującego wzrost Staphylococcus aureus i Escherichia coli. Produkty transformacji kwasu betulinowego (m.in. pochodna 3-ketonowa otrzymana przez utlenienie grupy hydroksylowej C-3, lub pochodne hydroksylowe C-1 i C-11) wykazują aktywność cytotoksyczną (niszczą komórki ludzkiego czerniaka).
Bacillus cereus transformuje kwercetynę (pochodną flawonu, z grupy flawonoidów) do kwasu protokatechowego.
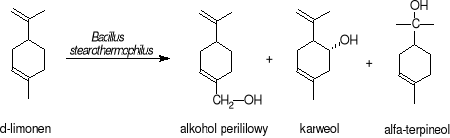
Opisano sposób otrzymywania alkoholu perililowego, karweolu i α-terpineolu z limonenu z wykorzystaniem Bacillus stearothermophilus, który efektywnie prowadzi proces transformacji w temperaturze 55-70°C.
6.5.9. Biodegradacja
Biodegradacja to biochemiczny rozkład związków organicznych na prostsze składniki chemiczne zachodzący przy udziale żywych organizmów. Termin ten w odróżnieniu od pojęcia mineralizacji używany jest na ogół w odniesieniu do ksenobiotyków - substancji obcych i szkodliwych dla środowiska naturalnego, syntetyzowanych sztucznie przez człowieka i nie występujących naturalnie w przyrodzie.
W układach drobnoustrojów wielogatunkowych proces biodegradacji niektórych ksenobiotyków sprzężony bywa z procesami asymilacji wytworzonych w jego efekcie prostszych składników. Jedne gatunki drobnoustrojów prowadzą proces biodegradacji do prostszych składników, a inne - wchodzące w skład takich wielogatunkowych układów - przyswajają powstałe przejściowo związki chemiczne.
Procesem pokrewnym do biodegradacji jest detoksykacja. Mianem tym niekiedy w literaturze określa się procesy, w wyniku których toksyczne dla środowiska substancje chemiczne są przekształcane w związki nietoksyczne, które z kolei dalej są biodegradowane, mineralizowane lub asymilowane.
6.5.5.1. Biodegradacja n-alkanów o długości łańcucha C9-C44
Znane są trzy główne drogi biodegradacji n-alkanów o długości łańcucha C9-C44: mono- lub diterminalna oksydacja, subterminalna oksydacja oraz poprzez alkeny. Bakterie z rodzaju Bacillus aktywnie mogą uczestniczyć w monoterminalnej lub subterminalnej degradacji tych związków. Zwłaszcza ich rola w biodegradacji n-alkanów o długości łańcucha powyżej C16 (tj. parafin, będących ciałami stałymi) jest niezwykle istotna. Tylko nieliczne drobnoustroje mogą degradować te węglowodory, będące składnikami wielu kosmetyków, maści leczniczych, smarów, a także stosowanych w produkcji świec i do pokrywania papieru oraz w wielu innych produktach codziennego użytku.
Problem biodegradacji n-alkanów o długości łańcucha powyżej C16 polega na tym, że katabolizowane są one wewnątrzkomórkowo i stąd w znacznym stopniu ich rozkład zależy od dostępu do komórki mikroorganizmu. Bakterie Bacillus subtilis problem ten pokonują, wytwarzając bioemulgator -surfaktynę, ułatwiający wnikanie cząstek n-alkanu do komórek i to nie tylko własnych, ale także innych mikroorganizmów żyjących w środowisku ich bytowania.
Surfaktyna wytwarzana jest przez liczne szczepy bakterii Bacillus subtilis hodowane w podłożach zawierających różne frakcje ropy naftowej, niezależnie od obecności innych składników. Dodatek surfaktyny do podłoży hodowlanych Bacillus subtilis O9 zwiększa biodegradację alifatycznych węglowodorów ropy naftowej z 21 do 36%, a w przypadku węglowodorów aromatycznych z zera do 41%. Poprawa biodegradacji węglowodorów alifatycznych dotyczy głównie długołańcuchowych n-alkanów takich, jak n-C17 i n-C18.
Rys. VI-30. Surfaktyna - biosurfaktant wytwarzany przez bakterie Bacillus subtilis
Surfaktyna, zwana też subtilizyną (nie mylić z enzymem subtilizyną) jest cyklicznym lipopeptydem (Rys. VI-30). Jest najefektywniejszym poznanym biosurfaktantem; w stężeniu 20mg/dm3 redukuje napięcie powierzchniowe wody z 72 do 27mN/m.
Rys. VI-31. Mono- i subterminalna oksydacja n-alkanów o długości łańcucha C9-C44
Monoterminalna oksydacja n-alkanów (Rys. VI-31) inicjowana jest działaniem monooksygenazy metanowej (EC 1.14.13.25). Enzym ten, dość szeroko rozpowszechniony w świecie drobnoustrojów, u niektórych z nich (np. Bacillus megaterium) sprzężony bywa z całym systemem cytochromu P-450, co znacznie podnosi skuteczność jego działania. Z kolei subterminalna oksydacja n-alkanów inicjowana jest działaniem mechanizmu hydroperoksydazy (którego przypuszczalnym składnikiem jest dioksygenaza z podpodklasy EC 1.14.99.). Bakterie i pleśnie dysponujące tym mechanizmem wprowadzają grupę hydroksylową do łańcucha n-alkanu zazwyczaj przy 2 atomie węgla, rzadziej przy 2, 3 lub 4 (np. grzyby strzępkowe z rodzaju Fusarium, Penicillium, lub bakterie Bacillus coagulans, Bacillus lentus). Bacillus macerans zdolny jest hydroksylować 4, 5 i 6 atom węgla. Natomiast mieszane kultury Bacillus i Streptomyces hydroksylują długie n-alkany w dowolnym miejscu, co jest korzystne z punku widzenia ich dalszego katabolizmu. Stwierdzono ponadto, że Bacillus coagulans, Bacillus lentus, Bacillus macerans i Bacillus stearothermophilus mogą prowadzić disubterminalną oksydację n-alkanów o długości łańcucha powyżej C16.
6.5.5.2. Biodegradacja związków amidowych
Pochodne aromatycznych amidów (anilidów) i fenylokarbamidów (fenylomocznika) są powszechnie stosowanymi pestycydami. W związku z tym, ich biodegradacja jest ważnym problemem ze względu na wpływ, jaki mogą wywierać na środowisko naturalne i pośrednio na człowieka. Biodegradację tych związków prowadzą m.in. bakterie Bacillus firmus i Bacillus sphaericus. Hydrolizę wiązania amidowego w tego typu pochodnych aromatycznych katalizuje arylo-acyloamidaza (amidohydrolaza arylo-acyloamidowa, EC 3.5.1.13.) wytwarzana przez te bakterie. W wyniku jej działania na anilidy, powstaje kwas karboksylowy i anilina (Rys. VI-32).
Rys. VI-32. Schemat hydrolizy związków anilidowych
Bakterie Bacillus firmus i Bacillus sphaericus wykorzystując arylo-acyloamidazę są w stanie biodegradować wiele herbicydów i fungicydów o budowie opartej o anilidy i fenylokarbamidy (Rys. VI-33.).
Rys.VI-33. Biodegradacja pestycydów anilidowych i fenylokarbamidowych przez Bacillus firmus lub Bacillus sphaericus
6.5.5.3. Biodegradacja innych związków
Bakterie z rodzaju Bacillus uczestniczą w biodegradacji wielu innych ksenobiotyków, ponad te, które wymieniono powyżej. Przykładowo Bacillus pumilus dzięki wytwarzaniu hydratazy cyjanidowej (EC 4.2.1.66) detoksyfikuje środowisko z niezwykle toksycznego cyjanowodoru. Niektóre szczepy tego gatunku bakterii mogą ponadto biodegradować nitryle (dzięki wytwarzaniu hydratazy nitrylowej - EC 4.2.1.84).
Bakterie Bacillus subtilis (dzięki posiadaniu odpowiedniej monooksygenazy) zdolne są do eliminacji grupy nitrowej z trudno degradowalnych nitrowych pochodnych fenoli. Na szczególną uwagę zasługują 2- i 4-nitrofenole, które zaliczane są do głównych substancji zanieczyszczających środowisko naturalne. Np. 4-nitrofenol jest często obecny w ściekach przemysłowych, a także w glebie jako produkt hydrolizy wielu insektycydydów. Wykazano, że niektóre drobnoustroje glebowe przy współdziałaniu z bakteriami Bacillus subtilis mają zdolność do degradacji tego uciążliwego ksenobiotyku. Znaleziono również Bacillus sp., który w warunkach tlenowych intensywnie degraduje 2,4,6-trinitrotoluen.
Niektóre gatunki bakterii z rodzaju Bacillus biorą udział w biodegradacji związków aromatycznych. Znaleziono u nich m.in. dehydrogenazy cis-dihydrodiolowe (z pod-podklasy EC 1.3.1), które pozwalają przywracać aromatyzację pierścienia utraconą w wyniku działania dioksygenaz hydroksylujących. Dehydrogenaza cis-1,2-dihydrobenzeno-1,2-diolowa (EC 1.3.1.19) występująca u bakterii Bacillus działa zwłaszcza skutecznie na pochodne dihydrodiolowe toluenu. Z kolei Bacillus macerans wytwarza 2,3-dioksygenazę protokatechanową, która powoduje ekstradiolowe rozerwanie pierścienia w kwasie protokatechowym.
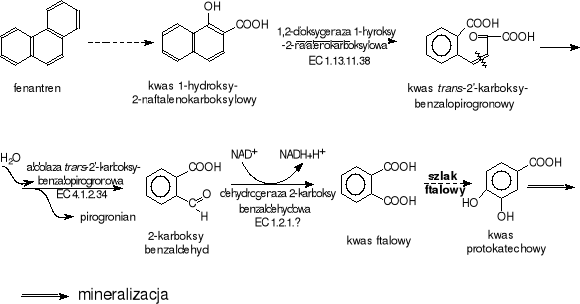
Rys.VI-34. Biodegradacja fenantrenu przez Bacillus sp.
Z gleby wyizolowano Bacillus sp., który utylizuje fenantren, traktując go jako jedyne źródło węgla. Bakterie biodegradują także naftalen, bifenyl, antracen i kilka innych aromatycznych związków. Ustalono, że pośrednimi metabolitami degradacji są: kwas 1-hydroksy-2 naftalenowy, który dalej jest metabolizowany poprzez o-ftalan i dalej szlakiem ftalanowym poprzez kwas protokatechowy (Rys.VI-34).
Termofilny Bacillus pallidus wykazuje uzdolnienia do biodegradacji izopropanolu oraz acetonu, przy czym wyróżnia się odpornością na wysokie stężenia tych rozpuszczalników, sięgające nawet 24g/dm3. Oba rozpuszczalniki są całkowicie usuwane z podłoży hodowlanych bakterii po 160-175 godzinach. Rezultaty te wskazują na potencjalne możliwości stosowania Bacillus pallidus w procesach bioremediacji podgrzanych ścieków przemysłowych zawierających rozpuszczalniki typu izopropanol i aceton.
Bacillus subtilis biodegraduje p-aminoazobenzen, składnik wielu barwników azowych stosowanych w przemyśle tekstylnym i często zanieczyszczający ścieki przemysłowe. Proces ten jednocześnie jest przykładem kometabolizmu - p-aminoazaobenzen jest kometabolizowany przez bakterie w obecności glukozy w podłożu jako źródła węgla. W wyniku biodegradacji powstaje anilina i p-fenylenodiamina, co wskazuje na rozszczepienie podwójnego wiązania w azobenzenie. Podobnie Bacillus cereus zdolny jest do biodegradacji wiązania azowego i stąd uczestniczy w rozkładzie wielu barwników azowych.
Ponadto niektóre gatunki bakterii z rodzaju Bacillus degradują pirydynę oraz kwas nikotynowy, traktując je jako źródło węgla, azotu i energii.
Przedstawione kierunki wykorzystania bakterii z rodzaju Bacillus wskazują na ich bardzo istotną rolę w biotechnologii. Należy jednocześnie pamiętać, że występując we wszystkich rejonach świata w różnorodnych naturalnych środowiskach uczestniczą w rozkładzie martwych tkanek, biorą udział w obiegu biogennych pierwiastków oraz stanowią naturalną ochronę roślin przed patogennymi drobnoustrojami. Szczególnie istotna jest możliwość przemysłowego wykorzystania właściwości ich komórek do wytwarzania wielu poza- i wewnątrzkomórkowych enzymów i innych metabolitów wtórnych.
3
21
Wyszukiwarka