TERMODYNAMIKA jest to nauka zajmująca się przemianami wszelkich postaci energii zachodzących w ciałach makroskopowych ilości cząstek.
Rozróżniamy 2 metody badań zjawisk termodynamicznych
1)metoda traktuje czynnik termodynamiczny jako zbiór punktów materialnych i przemiany w nim zachodzące bada metodami mechaniki statycznej.
2)polega na badaniu związków między wielkościami makroskopowymi badanego układu termodynamicznego jak :
T- temperatura
P- Ciśnienie
- Energię
Te trzy wielkości nie wnikając w mikrostrukturę czynnika.
Ustala się pewne zasady na podstawie których buduje się teorię zjawisk termodynamicznych. Tak skonstruowaną teorię nazywamy TERMODYNAMIKĄ FENOMENOLOGICZNĄ .
PODSTAWOWE POJĘCIA TERMODYNAMIKI
1 Układ Termodynamiczny - jest to część przestrzeni materialnej wyodrębnionej do rozważań z otaczającego świata. Wszystko to co nie należy do układu nazywamy otoczeniem. Granica pomiędzy układem a otoczeniem nazywa się osłoną bilansową.
2. Osłona -
- nieprzepuszczalna dla substancji materialnej.
- półprzepuszczalna może przepuszczać niektóre substancje a inne nie
- diatermiczna - pozwala na wymianę ciepła
- adiabatyczna - nie pozwala na wymianę ciepła z otoczeniem.
3. Ścianki układu - nie przepuszczają substancji , mówimy wtedy o ukł. Zamkniętym.
4. Jeżeli tylko część przepuszcza substancję to wtedy mówimy że jest to układ otwarty.
5. Układ izolowany mechanicznie - jest otoczony osłoną sztywną we wszystkich jej punktach.
6.Układ izolowany termicznie - jest otoczony osłoną adiabatyczną we wszystkich jej punktach.
7. PARAMETRY TERMODYNAMICZNE - nazywamy taką wielkość fizyczną której zmiana wywiera wpływ na przebieg procesów termodynamicznych i która jest konieczna do jednoznacznego określenia stanu danego układu.
A). Do parametrów term. Zaliczamy:
-ilość substancji układu najczęściej wyrażamy w kg. Ale nie wszystko [kg.]
-objętość układu [V]
-temperatura [ t]
-prędkość [C]lub [W]
B). Zbiór parametrów termodynamicznych koniecznych do jednoznacznego określenia jego własności termodynamicznych nazywamy stanem układu .
C). Parametry dzielimy na:
- Intensywne - takie których wartość nie zależy od ilości substancji danego ciała , przykładem jest - temp., - gęstość, - ciśnienie.
- Ekstensywne - to takie w których wartości zależą od ilości substancji np. - masa, - energia, lub - objętość.
8. Równowaga termodynamiczna - nazywamy stan , który ustala się samorzutnie w czasie w układzie odizolowanym od oddziaływań zewnętrznych i pozostaje niezmienny w czasie jeśli nie występują oddziaływania zewnętrzne.
9. Przemiana złożona z kolejno po sobie stanach równowagi nazywamy przemianą quazi - statyczną.
10. Prędkość v = (dr/dt) (wielkość wektorowa )
11. Praca L= ƒ12Pds (ƒ-całka w granicach od 1 do 2 ) - w termodynamice nie zawsze udaje się w jednoznaczny sposób powiązać pracę z siłą działającą w nazwanym układzie i dlatego pracę?
PRACA BEZWZGLĘDNA
PRACA_ _- jest to takie oddziaływanie energetyczne , występujące między układem zamkniętym a otoczeniem którego efekt daje się zredukować wyłącznie do zmiany położenia ciężaru znajdującego się otoczeniu.
W przypadku gdy siła wywołana jest ciśnieniem czynnika wykonanie pracy związane jest z objętością układu.
Wykonana praca dl przy przesunięciu tłoka ds. wynosi dl=P .ds. = p F ds
dl = P dv L = ƒ12 p dv .
Obliczona praca L jest pracą mechaniczną i nazywa się pracą zewnętrzną lub absolutną. dl=(p-p0)dv
Wielkość pracy możemy przedstawić jako układ pracy.
Wynika z tego , że wielkość pracy zależy od drogi przemiany termicznej a więc nie jest różniczką zupełną.
Praca bezwzględna wyrażona równaniem dotyczy przemian bez strat.
Jeśli w układzie termodynamicznym występują straty (np. tarcie tłoka w cylindrze) to wykonana praca jest mniejsza od pdv dl<pdv bo dl =p . dv + ?qf Praca techniczna.
Duże znaczenie praktyczne w zastosowaniach technicznych mają przemiany zachodzące w układach otwartych w których występuje stały i ustalony przepływ czynnika przez układ.
Praca całkowita składa się z wszystkich prac.
Jeżeli obieg jest zgodny z ruchem zegara uważamy układ za dodatni a gdy w przeciwnym kierunku ujemny.
Praca techniczna podobnie jak praca absolutna nie jest funkcją stanu.
Przy rozprężaniu czynnik wykonuje pracę wtedy gdy przyrost ciśnienia jest ujemny wobec tego uzasadniony jest znak [ -] we wzorze.
ENERGIA - jest wielkością skalarną ściśle spełniającą zasadę zachowania . Różnym formom ruchu i oddziaływań odpowiadają różne postacie energii (mechaniczna, elektryczna , chemiczna ). Energia może być przekazywana z jednego układu do drugiego.
PRACA I CIEPŁO - są formami przekazania energii.
UKŁADEM ZACHOWAWCZYM nazywamy układ mechaniczny dla którego ? energii kinetycznej i potencjalnej podczas jego ruchu pozostaje stała.
ENERGIA WEWNĘTRZNA U układu nazywa się tę część energii , która zależy tylko od jego stanu wewnętrznego .
Energia wewnętrzna jest funkcją stanu i ma różniczkę zupełną.
Zmiana energii wewnętrznej jest =różnicy energii wewnętrznej w stanach 1 i 2 U1 - U2. Różnica ta nie zależy od stanów poślednich tylko od stanów początkowego i końcowego.
ZEROWA ZASADA TERMODYNAMIKI
Jeśli A jest w równowadze z B i B jest w równowadze z C to A jest w równowadze z C.
Jeżeli rozważymy dwa ciała proste 1, 2 rozdzielone ścianką adiabatyczną (rys .A) oraz stykające się z ciałem 3 poprzez ściankę diatermiczną to układ dąży samorzutnie do równowagi termicznej pomiędzy 1 i 3 oraz 2 i 3 .
T1.= T3. T2.= T3.
Jeśli następnie rozdzielimy ciała 1 i 3 oraz 2 i 3 ścianką adiabatyczną i połączymy ciała 1 i 2 ścianką diatermiczną to również T1 = T2 . Wobec tego można sformułować wniosek postaci zasady tranzytywności , równowagi termicznej.
WNIOSEK - Dwa ciała znajdujące się w równowadze termicznej z 3 ciałem są również w równowadze termicznej między sobą, powyższa zasada została uznana za ZEROWĄ ZASADĘ TERMODYNAMIKI.
W układzie Si podstawową jednostką temp. jest Kelwin [K] ![]()
części temp. termodynamicznej punktu podwójnego wody. tc = (T− 273,16 [K])°C ≈ (T - 273)°C![]()
T = (tc + 273,16)°K ≈ T(tc + 273 )°K
tc - stopnie Cencliusza (małe tc)
T - stopnie Kelwina (duże T)
tF - stopnie Faradaja
tF=9/5tc+32°F
tc=(9/5 tF - 32) °C
CIŚNIENIE - (ρ) jest to stosunek siły do powierzchni. ρ=F/S F - siła, S - powierzchnia. Siła jest wielkością wektorową będącą miarą mechanicznego oddziaływania ciał na siebie. Siła działająca na wszystkie cząstki ciała nazywa się siłą masową (objętościową). Do pomiaru ciśnień wyższych od atmosferycznego stosowane są manometry, które wskazują nad lub pod ciśnienie w obliczeniach termodynamicznych, stosuje się ciśnienie bezwzględne. Podstawową jednostką w układzie Si jest 1[Pa]=[N/m2]. Często podaje się wielkość ciśnienia za pomocą wysokości słupa cieczy wtedy nadciśnienie jest równe: ρn=ρ-ρat=Z·g (ςc - ς). Z - wysokość słupa cieczy, ςc - gęstość cieczy manometrycznej, ς - gęstość płynu, którego mierzymy.
GAZ DOSKONAŁY - jest to taki gaz o nieskończenie małych cząstkach między którymi nie występują oddziaływania a odbicia są idealnie sprężyste, zakłada się także że miarą temp. jest średnia energia kinetyczna cząstek. Wielkość pędu jest równa masa razy prędkość. m·w1 - (- m·w1) = 2m·w1 Mnożąc tę wielkość zmiany pędu przez liczbę zderzeń z rozważaną ścianką w jednostce czasu równą prędkości przez drogę otrzymamy zmianę pędu pojedynczej cząstki w skutek uderzeń o jedną ściankę zbiornika.
PRAWO BOLIA - MARIOTTA - wyraża stosunek objętości stałej ilości gazu doskonałego przy stałej temperaturze są odwrotnie proporcjonalne do stosunku ciśnień bezwzględnych. p1V1 = p2V2 = pV = const.
Dla T = const. Równanie wymiany izotermy.
I ZASADA TERMODYNAMIKI - gdy na układ nie działają siły zewnętrzne i nie wymienia on energii z otoczeniem poprzez pracę wówczas jego energia jest stała. Jeżeli układ przechodząc od stanu I do stanu II wykonuje pracę L12 na otoczeniu, to: U1 - U2 = L12 , bo U2 - U1 = - L12 . Jeżeli podczas przemiany termodynamicznej od stanu I do stanu II układ wykonuje pracę to bilans energii wewnętrznej ma postać
U2 - U1 =Q12 - L12 . Powyższe równanie wyraża nam I zasadę termodynamiki. Tą zasadę możemy wyrazić następująco: energia doprowadzona do układu poprzez ciepło jest = Σ przyrostów energii wewnętrznej układu i energii przekazanej przez układ w postaci pracy. Jeżeli układ znajduje się w polu sił grawitacji to równanie należy uzupełnić poprzez o zmianę energii kinetycznej i energii potencjalnej. Jeżeli przyrosty będą zbyt małe to I zasadę termodynamiki można zapisać w postaci: dU = dq - dL
CIEPŁO WŁAŚCIWE - ciepłem właściwym w danej temp. T nazywa się granicę stosunku ilości ciepła pobranego przez jednostkę masy do zmiany jego temp. (delta) T będącej rezultatem pobrania tego ciepła gdy (delta) T dąży do zera. Zatem ciepłem właściwym w danej substancji nazywamy tę ilość ciepła właściwego, którą należy doprowadzić do jednego czynnika przy realizowaniu przemiany termodynamicznej α, aby podnieść temp. o 1o. Takie gazy, które zależą od temp. nazywamy gazami półdoskonałymi. Procesy termodynamiczne charakteryzujące się stałym ciepłem właściwym nazywa się procesami politropowymi w tym przypadku ciepło wymienione przez układ jest równe dq=C*dT, gdzie C - jest ciepłem właściwym politropi.
II ZASADA TERMODYNAMIKI - z I zasady termodynamiki wynika, że istnieje możliwość przekształcenia ciepła w pracę i odwrotnie jeżeli tylko ilość ciepła i pracy są sobie równe. Warunki zamiany ciepła w pracę określa nam II zasada termodynamiki. Zasada ta ma ścisły związek z nieodwracalnym charakterem procesów występujących w przyrodzie. Przykładami takimi są: - tarcie, - przewodnictwo cieplne czyli dyfuzja.
1)- Niemożliwe jest zrealizowanie perpetum mobile drugiego rodzaju tz.: zbudowanie takiego silnika, który czerpał by ciepło z jednego źródła ( np. z otoczenia) i oddawał by pracę.
2)- Ciepło nie może być przekazywane od ciała zimniejszego do ciała cieplejszego.
II zasada termodynamiki rozdziela przemiany na: - rzeczywiste (czyli nieodwracalne), - nierzeczywiste (czyli odwracalne).
CYKL CARNOTA - sprawność obiegu, klasycznym przykładem obiegu kołowego jest przemiana w silniku cieplnym. Cykl Carnota składa się z 4 etapów zwanymi suwami:
1 - etap - gaz ulega izotermicznej ekspansji od objętości V1 doV2. Izotermiczny odbiór ciepła w temp. Tz warunkuje odwracalność przemiany 1 i 2.
2 - etap - następuje adiabatyczna ekspansja gazów od V2 do V3 , podczas której temp. obniża się od Tz do T0, a gaz wykonuje pracę Lz wobec braku wymiany ciepła.
3 - etap - następuje izotermiczna kompresja przy temp. T0 od objętości V3 do V4 . Tłok wykonuje na gazie pracę L3, której towarzyszy oddanie pewnej ilości ciepła Q3 do chłodnicy
4 - etap - gaz ulega adiabatycznej kompresji od V4 do V1 temp. gazu wzrasta od T0 do Tźródła. Na gazie wykonywana jest praca L4 , a wymiana ciepła Q4 = 0.
MECHANIKA PŁYNÓW - jest to nauka która wykrywa, bada, i opisuje prawa jakie żądzą płynami w ruchu i spoczynku, często mylimy z hydromechaniką.
HYDROMECHANIKA - jest zbiorem opisów, wzorów empirycznych jest praktycznym opisem hydromechaniki.
HYDROSTATKA - zajmuje się siłami występującymi w płynach będących w spoczynku.
KINEMATYKA - zajmuje się opisem ruchu cieczy (płynów) bez rozróżnienia sił oraz przyczyn ruchu.
DYNAMIKA - opis ruchu z uwzględnieniem przyczyn które ten ruch powodują.
PŁYNY - traktujemy jako ośrodek ciągły. Ośrodkiem ciągłym nazywamy układ mechaniczny zawierający dostateczną ilość cząstek wypełniający w sposób ciągły daną objętość ( stanowi to pewną umowę gdyż nie uwzględnia molekularnej struktury).
WŁASNOŚCI FIZYCZNE CIECZY I GAZÓW -
1)- ciężar właściwy - określony jest stosunkiem ciężaru G płynu jednorodnego do objętości V γ = G / V
G = M g M = G / g
2)- gęstość płynu - (ro) ς śr nazywamy stosunek masy płynu M do zajmowanej objętości V ; ς śr = M / V
3)- ściśliwość płynu - nazywamy jego zdolność do zmniejszenia pierwotnej objętości na skutek działania sił zewnętrznych np. wody w temp. 0 - 20oC ściśliwości 1 ς = const. - dotyczy cieczy; ς ≠ const. - dotyczy gazów.
4)- lepkość - nazywamy zdolność płynów do przenoszenia naprężeń stycznych przy wzajemnym przemieszczaniu się elementów z różną prędkością.
PARAMETRY HYDRODYNAMICZNE - jeśli parametry hydrodynamiczne zmieniają się w czasie i przestrzeni to mówimy o ruchu nieustalonym. Jeśli poszczególne parametry zależą tylko od położenia to mówimy o ruchu ustalonym.
A)- gęstość - funkcja położenia i czasu ς = ς (x, y, z, t)
B)- ciśnienie - p = p (x, y, z, t)
C)- temp. - T = T(x, y, z, t)
D- prędkość - V = V(x, y, z, t)
E)- przyśpieszenie - a =a (x, y, z, t)
F)-lepkość - μ ,
RUCH - Jest to zmiana parametrów hydrodynamicznych w czasie i przestrzeni. Ψ = Ψ (p, t)
TOR - torem elementu płynu nazywamy linię wzdłuż której porusza się element płynu.
LINIA PRĄDU - jest to taka krzywa w polu prędkości do której wektory prędkości styczne w każdym ich punkcie.
RURKA PRĄDU - nazywamy powierzchnię S składającą się z linii prądu przechodzącą przez kontur zamknięty C leżący w obszarze przepływu. Pęk linii prądu wypełniający rurkę prądu nazywamy strumień, którego przekrój poprzeczny nazywamy strugą.
STRUGA - pęk linii prądu.
Własności strugi w ruchu ustalonym
1)- Kształt strugi nie ulega zmianie ponieważ przebieg linii prądu jest niezależny od czasu.
2)- Płyn nie może przepływać przez powierzchnię boczną strugi gdyż jej kontur ograniczony jest liniami prądu do której wektory V są styczne.
3)- Prędkość przepływu w przekroju poprzecznym strugi w przybliżeniu można traktować jednakowo, z powodu nieznacznych wymiarów tego przekroju.
Strumieniem przepływu nazywa się strumień pola wektorowego, wektora prędkości elementarnym, objętościowym dV przez element powierzchni dF nazywa się iloczyn skalarny
Wielkość Vn jest składową prędkości w pkt. P odpowiadającą n- normalnej. Wielkość dV jest dodatnia wówczas, gdy płyn przepływa przez element powierzchniowy w stronę normalnej n tz. Gdy kąt α jest ostry. Strumień objętości przepływu zwany też wydatkiem objętościowym przez powierzchnię
METODA LAGRANŻA - (obserwator ruchomy) metoda ta polega na badaniu zmiany położenia poszczególnych elementów taktownych w danym ośrodku indywidualnie.
Jeżeli w chwili t0 położenie pkt. A określone jest początkowe współrzędne a, b, c, to w dowolnym czasie t pkt. ten będzie opisany przez współrzędne x, y, z, ruch płynu będzie określony jeśli potrafimy wyrazić współrzędne x, y, z, każdego elementu płynu zależności od czasu t oraz początkowych współrzędnych a, b, c. x = x (a, b, c, t);
y = y (a, b, c, t); z = z (a, b, c, t)
METODA EULERA - (obserwator nieruchomy)metoda ta polega na obserwowaniu tego co się dzieje w określonym pkt. przestrzeni i określeniu parametrów kinematycznych i fizycznych elementów płynu przechodzących przez ten pkt. w czasie t. Składowe prędkości elementów płynu w zależności od współrzędnych x, y, z, oraz czasu t można przedstawić w postaci równań Eulera, a składowe przyśpieszeń określa się w postaci pochodnej substancjonalnej (zupełnej). Vx =Vx (x, y, z, t); Vy =Vy (x, y, z, t); Vz =Vz (x, y, z, t)
CYRKULACJA - wektora V wzdłuż łuku AB nazywamy całkę V·ds. Jeśli jest dodatnie to oznacza, że elementy płynów znajdujące się na konturze wykazują tendencję do poruszania się kierunkiem zgodnym. Jeśli całka po konturze zgodna z ruchem wskazówek zegara to cyrkulacja jest dodatnia jeśli odwrotnie to ujemna. Jeśli = 0 oznacza to, że tendencja poruszania się płynu po tym konturze znoszą się lub wektor prędkości V jest prostopadły wszędzie do tego kontura. Jeśli obszar jednospójny ograniczony konturem K podzielony na dowolną ilość pól to zachodzi związek: K = K1 + K2 + ....... cyrkulacja K jest równa sumie cyrkulacji.
TW. STORCA - cyrkulacja wektora o konturze C jest równa sumie rotacji po obszarze ograniczonym tym konturem Ω
PARCJE - jest to siła powierzchniowa pochodząca od ciśnień. dN = p dF , p = γ z
PRAWO AWOGADRO - przyjmujemy dwa różne gazy, które są w dwóch różnych naczyniach, ale występuje w nich to samo ciśnienie. N1 = N2 wynika stąd, że przy jednakowych objętościach, ciśnieniu i temp. w różnych gazach znajduje się jednakowa ilość drobin.
RÓWNANIE CIĄGŁOŚCI - dotyczy zasady zachowania masy
RÓWNANIE RUCHU - dotyczy zasady zachowania pędu
GAZ DOSKONAŁY - składa się z wielkiej ilości kulek pędzących bezładnie i zderzających się sprężyście ze sobą i ścianami naczynia. Rozmiary kulek są pomijalnie małe, kulki oddziałują ze sobą tylko podczas zderzeń i między zderzeniami poruszają się po liniach prostych. Ilość kulek jest tak duża (rzędu 1020 i więcej), iż posługujemy się wartościami średnimi (prędkości, drogi między zderzeniami, energii kinetycznej itd.).
PRZEMIANY GAZOWE - ciśnienie p, objętość V i temp. bezwzględna T to parametry stanu gazu. W najogólniejszym przypadku zmieniają się wszystkie trzy, ale (przy założeniu stałej masy gazu)
(p1 ·V1) / T1 = (p2 ·V2) / T2 .
1 - przemiana izotermiczna - gdy T jest stałe p1 V1 = p2 V2 jest to prawo Boylea-Marriotta. Przy stałej temp., iloczyn objętości i ciśnienia pozostaje stały. Krzywą na wykresie (hiperbolę) nazywamy izotermą. Ponieważ
p·V = n·R·T, zwiększenie temp. oznacza zwiększenie iloczynu pV (izotermy oddalają się od początku układu). Widać że dla danej objętości V0 wzrost temp. pociąga za sobą wzrost ciśnienia. Podobnie dla danego ciśnienia wzrost temp. oznacza też wzrost objętości.
2 - przemiana izochoryczna - gdy V jest stałe p1/T1 = p2/T2 jest to prawo Charlesa. Przy stałej objętości, stosunek ciśnienia temp. pozostaje stały. Rośnie z maleniem objętości.
3 - przemiana izobaryczna - gdy p jest stałe V1/T1 = V2/T2 jest to prawo Gay-Lussaca. Przy stałym ciśnieniu objętość do temp. jest stały. Rośnie ze zmniejszeniem ciśnienia.
PRZEPŁYW LAMINARNY I TURBULENTNY - laminarny (stacjonarny) jest przepływ wówczas, gdy - według Eulera - każdy z elementów objętości cieczy kolejno nadpływających do dowolnie wybranego punktu przepływa przezeń z taką samą co do wielości i kierunku prędkością. Mówiąc zwięźlej: gdy w dowolnie wybranym punkcie wektor prędkości cieczy jest stały. Turbulentny ( niestacjonarny) - przy przepływie turbulentnym wektor prędkości (a także np. wartość ciśnienia) w wybranym punkcie obserwacji szybko i nieregularnie zmienia się w czasie (fluktuuje). Nieustannie zmieniająca się z czasem prostopadła do kierunku ruchu składowa prędkości powoduje silne mieszanie się warstw płynącej cieczy.
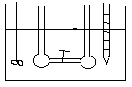
DOŚWIADCZENIE JOLIOTA -
Po otwarciu zaworu 1 nie zaobserwowano zmian temp. (w gazach rzeczywistych przy dokładnych pomiarach obserwuje się niewielkie zmiany temp.). Ponieważ w eksperymencie Joliota gaz nie wykonuje żadnej pracy i nie stwierdza się wymiany ciepła wobec tego energia wewnętrzna gazu jest stała. Ponieważ energia wewnętrzna tak jak entalpia nie jest funkcją stanu, a każda funkcja stanu zależy od dwóch zmiennych U = U (V, T). Z doświadczenia Joliota wynika że U = const. , .................. wobec tego zróżniczkujemy funkcję stanu.
dU=( U/ V)·dT+( U/ T)·dV=0
( U/ V)= - ( U/ T)·( T/ V)
Z doświadczenia Joliota wynika że ( T/ V)=0 , nie zmiany temp. względem objętości.
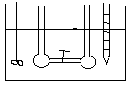
DOŚWIADCZENIE JOLIOTA -
Po otwarciu zaworu 1 nie zaobserwowano zmian temp. (w gazach rzeczywistych przy dokładnych pomiarach obserwuje się niewielkie zmiany temp.). Ponieważ w eksperymencie Joliota gaz nie wykonuje żadnej pracy i nie stwierdza się wymiany ciepła wobec tego energia wewnętrzna gazu jest stała. Ponieważ energia wewnętrzna tak jak entalpia nie jest funkcją stanu, a każda funkcja stanu zależy od dwóch zmiennych U = U (V, T). Z doświadczenia Joliota wynika że U = const. , .................. wobec tego zróżniczkujemy funkcję stanu.
dU=( U/ V)·dT+( U/ T)·dV=0
( U/ V)= - ( U/ T)·( T/ V)
Z doświadczenia Joliota wynika że ( T/ V)=0 , nie zmiany temp. względem objętości.
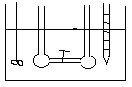
DOŚWIADCZENIE JOLIOTA -
Po otwarciu zaworu 1 nie zaobserwowano zmian temp. (w gazach rzeczywistych przy dokładnych pomiarach obserwuje się niewielkie zmiany temp.). Ponieważ w eksperymencie Joliota gaz nie wykonuje żadnej pracy i nie stwierdza się wymiany ciepła wobec tego energia wewnętrzna gazu jest stała. Ponieważ energia wewnętrzna tak jak entalpia nie jest funkcją stanu, a każda funkcja stanu zależy od dwóch zmiennych U = U (V, T). Z doświadczenia Joliota wynika że U = const. , .................. wobec tego zróżniczkujemy funkcję stanu.
dU=( U/ V)·dT+( U/ T)·dV=0
( U/ V)= - ( U/ T)·( T/ V)
Z doświadczenia Joliota wynika że ( T/ V)=0 , nie zmiany temp. względem objętości.
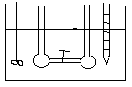
DOŚWIADCZENIE JOLIOTA -
Po otwarciu zaworu 1 nie zaobserwowano zmian temp. (w gazach rzeczywistych przy dokładnych pomiarach obserwuje się niewielkie zmiany temp.). Ponieważ w eksperymencie Joliota gaz nie wykonuje żadnej pracy i nie stwierdza się wymiany ciepła wobec tego energia wewnętrzna gazu jest stała. Ponieważ energia wewnętrzna tak jak entalpia nie jest funkcją stanu, a każda funkcja stanu zależy od dwóch zmiennych U = U (V, T). Z doświadczenia Joliota wynika że U = const. , .................. wobec tego zróżniczkujemy funkcję stanu.
dU=( U/ V)·dT+( U/ T)·dV=0
( U/ V)= - ( U/ T)·( T/ V)
Z doświadczenia Joliota wynika że ( T/ V)=0 , nie zmiany temp. względem objętości.
Wyszukiwarka