Agnieszka Wróbel
II CD L-6
Ćwiczenie numer 1
|
Temat: Otrzymywanie kwasu benzoesowego z chlorku benzylu
|
||
Data wykonania: 20. 02. 2008 |
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
W kolbie o pojemności 500 cm3 zaopatrzonej w chłodnicę zwrotną umieszcza się 4 g bezwodnego węglanu sodu, 200 cm3 wody, 9,0 g manganianu(VII) potasu, 4,5 cm3 (5 g) chlorku benzylu i kilka kawałków porcelanki. Mieszaninę ogrzewa się do wrzenia i utrzymuje w tym stanie przez ok. 60÷90 min, czyli do zaniku oleistych kropel chlorku benzylu w chłodnicy zwrotnej (w trakcie ogrzewania obserwuje się wytrącanie brunatnego osadu tlenku manganu(IV)). Po ostudzeniu mieszaninę reakcyjną zakwasza się stężonym roztworem kwasu solnego. Następnie dodaje się 20 % wodny roztwór siarczanu(IV) sodu, aż do całkowitego roztworzenia osadu tlenku manganu(IV). Pozostały osad - kwas benzoesowy odsącza się na lejku Büchnera i przemywa zimną wodą. Surowy produkt oczyszcza się przez krystalizację z wody. Otrzymuje się 4 g kwasu benzoesowego (82 % wyd.) o tt =. 121,5°C.
2. Spis odczynników:
Kwas benzoesowy- najprostszy organiczny, aromatyczny kwas karboksylowy. W temperaturze pokojowej jest stały- tworzy białe, igłowe kryształy. W czasie ogrzewania łatwo sublimuje. Jedną z metod laboratoryjnego otrzymywania kwasu benzoesowego jest utlenienie toluenu za pomocą nadmanganianu potasu. Gęstość: 32 g/cm3. Stan skupienia: ciało stałe. Temperatura topnienia 122,4°C. Temperatura wrzenia 249°C. Kwasowość (pKa) 4,21. Moment dipolowy 1,72 D. Szkodliwy, temperatura zapłonu 121°C, temperatura samozapłonu 532°C.
Węglan sodu-biała substancja krystaliczna, rozpuszczalna w wodzie, o temperaturze topnienia 854°C. Tworzy hydraty, posiada własności higroskopijne, w roztworach wodnych hydrolizuje.
Pod wpływem kwasów ulega rozkładowi wydzielając tlenek węgla(IV). Stosowany w przemyśle szklarskim, do produkcji środków piorących i papieru, do zmiękczania wody, w pastach do zębów, jako odczynnik laboratoryjny i topnik. Ciało stałe o gęstości 2.53 g/cm3 o niskim stopniu niebezpieczeństwa, drażniąca
Manganian (VII) potasu- ciało stałe o gęstości 2,7 g/cm³. Higroskopijny. Tworzy charakterystyczne niebieskofioletowe kryształki. Słabo rozpuszcza się w wodzie (w temp. 20 °C 6,4 g w 100 cm³). W temp. powyżej 230 °C rozkłada się zgodnie z równaniem: 2KMnO4 → K2MnO4 + MnO2 + O2
Jest silnym utleniaczem. Reakcja silnie zależy od pH roztworu. Gęstość i stan skupienia 2,703 g/cm3 ; ciało stałe. Rozpuszczalność w wodzie 6,38 g/100 cm3 (20°C). Temperatura topnienia 270°C. Silny utleniacz, szkodliwy, groźny dla środowiska.
Chlorek benzylu- bezbarwna ciecz o ostrym zapachu, gęstość 1.1 g/cm³, temp. wrzenia 179°C, topnienia 39°C. Nie miesza się z wodą, miesza się z większością rozpuszczalników organicznych. Atom chloru jest bardzo reaktywny i łatwo ulega wymianie na inne podstawniki. Moment dipolowy wynosi 1.82 D. Może powodować utratę przytomności w dużych ilościach lub podrażnienia oczu i skóry. Jest palny, może być wybuchowy.
3. Schemat reakcji:
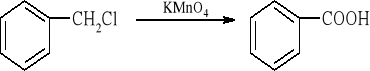
4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-6
Ćwiczenie numer 2
|
Temat: Otrzymywanie cykloheksenu z cykloheksanolu
|
||
Data wykonania: 27. 02. 2008 |
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
|
W kolbie dwuszyjnej o pojemności 250 cm3 umieszcza się 21 cm3 (20 g) cykloheksanolu oraz 10 cm3 85% kwasu fosforowego(V) i wrzuca się kilka kawałków porcelanki. Kolbę zaopatruje się we wkraplacz i w kolumnę Vigreux o długości 60 cm (φ = 2 cm). Do kolumny frakcjonującej dołącza się chłodnicę Liebiega zaopatrzoną w odbieralnik. Mieszaninę reakcyjną ogrzewa się w czaszy grzejnej regulując tempo ogrzewania tak, aby na szczycie kolumny temperatura nie przekraczała 90°C. W chwili ustabilizowania się warunków reakcji, z wkraplacza dodaje się jeszcze 31,6 cm3 (30 g) cykloheksanolu. Gdy cykloheksen przestanie destylować przerywa się ogrzewanie a destylat nasyca się solą. Następnie oddziela się górną warstwę, suszy ją bezwodnym chlorkiem wapnia i destyluje ponownie używając podobnej aparatury (uprzednio wysuszonej). Otrzymuje się 30÷35 g cykloheksenu (70÷80% wyd.) teoretycznej o temperaturze wrzenia 81÷83 °C i ![]()
2. Spis odczynników:
Cykloheksanol- ciecz bezbarwna, klarowna o charakterystycznym zapachu (kamfory), higroskopijna. Temp. topnienia: 22°C , wrzenia:161°C a temp. zapłonu: 68°C. Jest łatwopalna i rozpuszczalna w większości rozpuszczalników organicznych. Jest szkodliwy i drażniący, działa na drogi oddechowe i skórę.
Kwas fosforowy (V)- białe krystaliczne ciało stałe o temp. topnienia 42°C i wrzenia 158°C, dobrze rozpuszczalnym w wodzie. Nie posiada właściwości utleniających. Jest kwasem średniej mocy, jego gęstość: 1.685 g/cm3. Substancja silnie żrąca.
Cykloheksen- bezbarwna ciecz o słodkawym zapachu, niemieszająca się z wodą. Jest związkiem szkodliwym, łatwopalnym, drażniącym oczy, skórę i układ oddechowy.
3. Schemat reakcji:
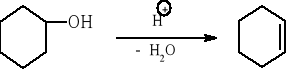
4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-8
Ćwiczenie numer 3
|
Temat: Otrzymywanie dichloronorkaranu z cykloheksenu.
|
||
Data wykonania: 6. 03. 2008 |
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
|
W kolbie trójszyjnej o pojemności 250 cm3 zaopatrzonej w silne mieszadło, wkraplacz i termometr umieszcza się 5,05 cm3 (4,2 g) cykloheksenu, 8,05 cm3 (12 g) czystego chloroformu i 0,3 g chlorku benzylotrietyloamoniowego (TEBA, katalizator). Następnie przy bardzo energicznym mieszaniu wkrapla się 10 cm3 50 % wodnego roztworu wodorotlenku sodu, chłodząc przy tym kolbę tak, aby temperatura mieszaniny nie przekraczała 30÷40°C. Po zaniku efektu egzotermicznego mieszanie i ogrzewanie kontynuuje się jeszcze przez 2 godziny, potem mieszaninę chłodzi się do temperatury pokojowej i dodaje 10 cm3 wody (w celu lepszego rozdzielenia warstw). Warstwę organiczną oddziela się w rozdzielaczu, a warstwę wodną przemywa 5÷10 cm3 chlorku metylenu, po czym łączy się ciecze organiczne razem, przemywa rozcieńczonym kwasem solnym, ponownie wodą i suszy chlorkiem wapnia, a następnie destyluje. Po oddestylowaniu rozpuszczalnika i nieprzereagowanych substratów pozostały dichloronorkaran destyluje się pod zmniejszonym ciśnieniem otrzymując ok.
5 g (60 % wyd.) produktu o ![]()
= 1,5010.
2. Spis odczynników:
Cykloheksen- bezbarwna ciecz o słodkawym zapachu, niemieszająca się z wodą. Jest związkiem szkodliwym, łatwopalnym, drażniącym oczy, skórę i układ oddechowy. ![]()
=1.4460
Chloroform- trichlorometan; bezbarwna klarowna ciecz o gęstości 1.4797 g/cm3. Temp. topnienia=-630C, a wrzenia 620C. Jest niepalny i mało reaktywny, szkodliwy i groźny dla środowiska. Działa drażniąco na skórę i oczy.
Chlorek benzylotrietyloamoniowy-TEBA:M=227.78 g/mol, wzór cząst: C6H5CH2(C2H5)3NCl.
Proszek drobnokrystaliczny barwy białej o charakterystycznym zapachu. Temp. topnienia 1920C. Temp wrzenia nieznana, samozapłonu powyżej 2750C. Działa drażniąco na oczy, drogi oddechowe i skórę. Palny, może tworzyć wybuchowe mieszaniny z powietrzem.
Wodorotlenek sodu- białe pastylki lub kryształki o gęstości 2,1 g/cm3. Temp. topnienia=3230C, wrzenia= 1390 0C. Silnie żrący, niepalny, higroskopijny, dobrze rozpuszcza się w wodzie w reakcji egzotermicznej. Może wywoływać łzawienie oczu, pieczenie w gardle i nosie.
Kwas solny- bezbarwna ciecz dymiąca na powietrzu.Temp.topn= -260C i wrz=480C.Gęstość: 1.2g/cm3
Chlorek metylenu- bezbarwna słodkawa ciecz; temp.t=-960C, temp.wrz=400C. Szkodliwy, niepalny, mało reaktywny.
Chlorek wapnia- białe ciało stałe bez zapachu, o właściwościach higroskopijnych. Temp. topnienia wynosi 7720C, wrzenia= 16000C. Najczęściej występuje w postaci sześciowodnej. Drażniący. Gęstość 1.68 g/cm3.
3. Schemat reakcji:

4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-8
Ćwiczenie numer 4, 5
|
Temat: Otrzymywanie trans-cykloheksano-1,2-diolu z cykloheksenu
|
||
Data wykonania: 13. 03. 2008 |
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
|
W kolbie trójszyjnej o pojemności 250 cm3, zaopatrzonej w mieszadło, chłodnicę zwrotną i wkraplacz umieszcza się 58 cm3 85 % kwasu mrówkowego oraz 6,65 cm3 (6,8 g) 30 % nadtlenku wodoru. Następnie mieszając mechanicznie wkrapla się 5,05 cm3 (4,1 g) cykloheksenu w ciągu 5 minut. Mieszanina rozgrzewa się do temperatury 65÷75°C i staje się klarowna. Zawartość kolby utrzymuje się w tej temperaturze jeszcze przez dwie godziny, po czym wykonuje próbę z roztworem jodku potasu, w celu sprawdzenia czy cały nadtlenokwas przereagował. W wypadku wydzielania się jodu ogrzewanie należy jeszcze kontynuować. Główną ilość kwasu mrówkowego i wody oddestylowuje się pod zmniejszonym ciśnieniem. Do pozostałości dodaje się 20 % roztworu wodorotlenku sodu (do odczynu silnie zasadowego) i ogrzewa 45 minut. Po oziębieniu, roztwór zobojętnia się kwasem solnym i odparowuje rozpuszczalnik w wyparce obrotowej. Pozostałość ekstrahuje się wielokrotnie ciepłym octanem etylu, ekstrakty organiczne łączy się, a rozpuszczalnik usuwa w wyparce obrotowej. Produkt oczyszcza się przez krystalizację z octanu etylu. Uzyskuje się ok. 4,05 g (70 % wyd.)
trans-cykloheksano-1,2-diolu o tt = 103°C.
2. Spis odczynników:
Kwas mrówkowy- kwas metanowy HCOOH; bezbarwna klarowna ciecz o ostrym drażniącym zapachu, dobrze rozpuszczalna w wodzie. Gęstość: 1.22 g/cm3, temp. topn: 8.30C, temp. wrz: 100.50C, moment dipolowy: 1.41 D. Silnie żrący, o dużej lotności, silnie redukujący i korodujący, powoduje podrażnienia śluzówki i skóry.
Nadtlenek wodoru- dioksydan, perhydrol, woda utleniona; lekko niebieskawa ciecz, bezbarwna gdy w roztworze 1.4 g/cm3, temp. topn: -110C, temp. wrz: 150.20C, moment dipolowy: 2.26D. Silnie żrący, silny utleniacz. Czysty nadtlenek wodoru jest bardzo nietrwały i ulega egzotermicznemu rozkładowi.
Cykloheksen- bezbarwna ciecz o słodkawym zapachu, niemieszająca się z wodą. Jest związkiem szkodliwym, łatwopalnym, drażniącym oczy, skórę i układ oddechowy. ![]()
=1.4460
Jodek potasu- bezbarwne kryształki lub biały proszek o gęstości 3.13 g/cm3, temp. topn: 681 0C, temp. wrz: 13300C. Brak własności toksycznych
Wodorotlenek sodu- białe pastylki lub kryształki o gęstości 2,1 g/cm3. Temp. topnienia=3230C, wrzenia= 1390 0C. Silnie żrący, niepalny, higroskopijny, dobrze rozpuszcza się w wodzie w reakcji egzotermicznej. Może wywoływać łzawienie oczu, pieczenie w gardle i nosie.
Octan etylu- bezbarwna ciecz o gęstości 0.902 g/cm3, temp. topn:-83.60C, temp. wrz: 770C, przyjemnym, charakterystycznym zapachu. Moment dipolowy: 1.78 D. Łatwopalny, drażniący, opary powodują zawroty głowy.
3. Schemat reakcji:

4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-8
Ćwiczenie numer 6, 7
|
Temat: Otrzymywanie chlorku cykloheksylu z cykloheksanolu
|
||
Data wykonania:
|
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
|
W kolbie okrągłodennej o pojemności 250 cm3 umieszcza się 30 cm3 (29 g) cykloheksanolu, 120 cm3
38 % kwasu solnego oraz kilka kawałków porcelanki i łączy z chłodnicą zwrotną połączoną z urządzeniem do pochłaniania gazów. Kolbę ogrzewa się do łagodnego wrzenia, a po upływie 20 min zwiększa intensywność ogrzewania utrzymując przez 2,5 godziny dość energiczne wrzenie.
Po oziębieniu mieszaninę reakcyjną przelewa się do rozdzielacza i usuwa, możliwie jak najdokładniej, warstwę wodną. Do chlorku dodaje się stężonego kwasu siarkowego(VI) i dokładnie wytrząsa (stężony kwas siarkowy(VI) może spowodować poważne oparzenia skóry; należy, zatem sprawdzić czy kran i korek w rozdzielaczu są szczelne). Mieszaninę pozostawia się do rozwarstwienia na 10÷15 minut, a następnie wypuszcza dolną warstwę kwasu siarkowego(VI). Warstwę chlorku przemywa się 20 cm3 wody, a powstałą emulsję pozostawia na dłuższy czas do rozdzielenia, po czym usuwa warstwę wodną. Mętną warstwę chlorku zawierającą nadal wodę w postaci emulsji przemywa się 10 % wodnym roztworem Na2CO3. Tym razem rozdzielanie zachodzi szybciej, dodatek niewielkiej ilości NaCl przyspiesza rozdzielanie warstw. Surowy chlorek przemywa się ponownie wodą, suszy wytrząsając z chlorkiem wapnia i sączy przez sączek karbowany do kolby okrągłodennej o pojemności 50 cm3 po czym destyluje, zbierając do zważonego odbieralnika destylat o temperaturze wrzenia 138÷142°C i ![]()
= 1,4626.
2. Spis odczynników:
Kwas solny- bezbarwna ciecz dymiąca na powietrzu.Temp.topn= -260C i wrz=480C.Gęstość: 1.2g/cm3
Cykloheksanol- ciecz bezbarwna, klarowna o charakterystycznym zapachu (kamfory), higroskopijna. Temp. topnienia: 22°C , wrzenia:161°C a temp. zapłonu: 68°C. Jest łatwopalna i rozpuszczalna w większości rozpuszczalników organicznych. Jest szkodliwy i drażniący, działa na drogi oddechowe i skórę.
Węglan sodu- biała substancja krystaliczna, rozpuszczalna w wodzie, o temperaturze topnienia 854°C. Tworzy hydraty, posiada własności higroskopijne, w roztworach wodnych hydrolizuje.
Pod wpływem kwasów ulega rozkładowi wydzielając tlenek węgla(IV). Stosowany w przemyśle szklarskim, do produkcji środków piorących i papieru, do zmiękczania wody, w pastach do zębów, jako odczynnik laboratoryjny i topnik. Ciało stałe o gęstości 2.53 g/cm3 o niskim stopniu niebezpieczeństwa, drażniąca.
Chlorek wapnia- białe ciało stałe bez zapachu, o właściwościach higroskopijnych. Temp. topnienia wynosi 7720C, wrzenia= 16000C. Najczęściej występuje w postaci sześciowodnej. Drażniący. Gęstość 1.68 g/cm3.
Chlorek sodu- ciało stałe barwy białej, bez zapachu; gęstość 2.16g/cm3, temp. topn: 8000C, temp. wrz: 14610C. Nie jest substancją niebezpieczną, wybuchową ani żrącą.
Kwas siarkowy (VI)- bezbarwna lub lekko żółta, klarowna, gęsta, oleista ciecz o gęstości 1.84 g/cm3, temp. topn: 10.360C, temp. wrz: 3380C. Niepalny, silnie żrący, niewybuchowy.
3. Schemat reakcji:
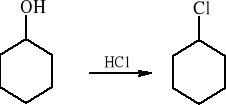
4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-8
Ćwiczenie numer 8
|
Temat: Otrzymywanie cykloheksylo(fenylo)metanolu z chlorku cykloheksylu i benzaldehydu- synteza Grignarda
|
||
Data wykonania:
|
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
|
W kolbie trójszyjnej o pojemności 250 cm3 zaopatrzonej w chłodnicę zwrotną (płaszcz chłodnicy wypełniamy wodą i zamykamy przepływ) i wkraplacz, które zabezpiecza się rurkami suszącymi, umieszcza się 0,5 g magnezu w postaci wiórek i 10 cm3 bezwodnego eteru dietylowego. Przez wolną szyjkę kolby (zatkaną wcześniej korkiem), dodaje się za pomocą pipety bezpośrednio na wiórki magnezowe 0,5 cm3 (0,5 g) chlorku cykloheksylu. Kolbę ogrzewa się delikatnie nie mieszając jej zawartości. Zmętnienie mieszaniny reakcyjnej oznacza zainicjowanie reakcji. Jeżeli reakcja nie rozpocznie się samorzutnie, to należy dodać kilka kryształków jodu. Po rozpoczęciu reakcji otwiera się przepływ wody w chłodnicy i z wkraplacza dodaje się roztwór 2 cm3 (2 g) chlorku cykloheksylu w 6 cm3 bezwodnego eteru dietylowego z szybkością zapewniającą energiczny przebieg reakcji. Po wkropleniu całego roztworu, zawartość kolby utrzymuje się w stanie wrzenia przez 40 minut. Następnie mieszaninę reakcyjną oziębia się i wkrapla powoli roztwór 1,5 cm3 (1,6 g) benzaldehydu w 6 cm3 bezwodnego eteru dietylowego, po czym utrzymuje się zawartość kolby w stanie lekkiego wrzenia przez 20 minut. Oziębioną mieszaninę reakcyjną przelewa się do kolby stożkowej o pojemności 250 cm3, a kolbę kulistą płucze 10 cm3 eteru dietylowego. Eter dodaje się do kolby stożkowej i wrzuca kilka kawałków lodu, a po ich rozpuszczeniu mieszaninę przelewa do rozdzielacza i dodaje po 5 cm3 nasyconego roztworu NH4Claq, aż do zaniku galaretowatego osadu chloru wodorotlenku magnezu. Jeżeli po dodaniu roztworu chlorku amonu osad nie zanika, to dodaje się rozcieńczonego roztworu kwasu solnego. Po oddzieleniu warstwy wodnej sprawdza się za pomocą papierka wskaźnikowego odczyn warstwy organicznej (powinien być obojętny; w przeciwnym razie należy przemywać wodą aż do odczynu obojętnego). Warstwę organiczną ekstrahuje się dwiema porcjami wodnego nasyconego roztworu wodorosiarczanu(IV) sodu, a po każdej ekstrakcji warstwę organiczną przemywa 10 cm3 wody. Warstwę organiczną przenosi się do kolby okrągłodennej i odparowuje w wyparce obrotowej eter dietylowy, a następnie wodę. Surowy produkt oczyszcza się przez krystalizację z pentanu lub eteru naftowego.
2. Spis odczynników:
Magnez- srebrzystobiałe ciało stałe o gęstości 1.745g/cm3, temp. topn: 6500C i temp. wrz:1090 0C. Dość łatwo utlenia się na powietrzu, ulega pasywacji.
Eter dietylowy- ciecz bezbarwna o charakterystycznym zapachu i gęstości 0.71 g/cm3, temp. topn: -116,30C, temp. wrz: 34,60C. Łatwopalny, może tworzyć wybuchowe nadtlenki, działa szkodliwie po połknięciu, może powodować uczucie senności i zawroty głowy.
Benzaldehyd- ciecz bezbarwna o zapachu gorzkich migdałów i gęstości 1.05 g/cm3,temp. topn:-26 0C, temp. wrz: 1800C. Czuły na światło i powietrze, raczej nietoksyczny; może powodować podrażnienie oczu, skóry, dróg oddechowych, a po spożyciu uszkodzenie nerek.
Chlorek amonu- bezbarwne kryształki lub biały krystaliczny proszek, bezwonny o gęst.1.53 g/cm3, temp. topn: 3350C, temp. wrz: 5200C, łatwo rozpuszczalny w wodzie. Może powodować podrażnienie błon śluzowych, kaszel, duszności, bóle głowy i mdłości; szkodliwy
Kwas solny- bezbarwna ciecz dymiąca na powietrzu.Temp.topn= -260C i wrz=480C.Gęstość: 1.2g/cm3
3. Schemat reakcji:
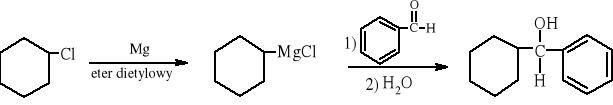
4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-8
Ćwiczenie numer 9
|
Temat: Otrzymywanie eteru dibutylowego z butan-1-olu
|
||
Data wykonania:
|
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
|
W kolbie dwuszyjnej o pojemności 250 cm3, zaopatrzonej w nasadkę Deana-Starka (nóżkę z kranikiem nasadki Deana-Starka wypełnia się wodą, a następnie usuwa się z niej 6 cm3 wody) i chłodnicę zwrotną umieszcza się 61 cm3 butan-1-olu oraz 9 cm3 stężonego kwasu siarkowego(VI). Kolbę ogrzewa się tak, aby ciecz wrzała i skraplała się w chłodnicy. Destylująca azeotropowo woda i butan-1-ol zbierają się w nóżce nasadki, gdzie następuje ich samoczynne rozdzielenie i lżejszy od wody
butan-1-ol spływa z powrotem do kolby. Ogrzewanie prowadzi się tak długo, aż temperatura wewnątrz kolby wzrośnie do 134÷135°C co trwa ok. 30÷40 min, w ciągu tego czasu w nóżce nasadki przybywa ok. 5÷6 cm3 wody i reakcję można uznać za zakończoną. Mieszaninę poreakcyjną oziębia się i wraz z zawartością nasadki przelewa się do rozdzielacza, w którym znajduje się 100 cm3 wody. Po wytrząśnięciu oddziela się górną warstwę złożoną z surowego eteru oraz niewielkiej ilości wyjściowego alkoholu. Surowy eter wytrząsa się dwukrotnie z 25 cm3 50% wag. roztworu kwasu siarkowego(VI) (20 cm3 kwasu i 35 cm3 wody) przez 2÷3 min. Na koniec warstwę organiczną przemywa się dwoma porcjami po 25 cm3 wody i suszy 2 g chlorku wapnia. Następnie sączy się do kolby destylacyjnej o pojemności 50 cm3 i destyluje. Eter dibutylowy zbiera się w temperaturze 139÷142°C z wydajnością 15 g (34 % wyd.) (![]()
= 1,3980).
2. Spis odczynników:
Butan-1-ol- ciecz bezbarwna, klarowna o gęstości 0.81 g/cm3, temp. topn: -890C, temp. wrz: 1180C. Łatwopalna, może powodować podrażnienia skóry, oczu, dróg oddechowych, kaszel, ból głowy.
Kwas siarkowy (VI)- bezbarwna lub lekko żółta, klarowna, gęsta, oleista ciecz o gęstości 1.84 g/cm3, temp. topn: 10.360C, temp. wrz: 3380C. Niepalny, silnie żrący, niewybuchowy.
Chlorek wapnia- białe ciało stałe bez zapachu, o właściwościach higroskopijnych. Temp. topnienia wynosi 7720C, wrzenia= 16000C. Najczęściej występuje w postaci sześciowodnej. Drażniący. Gęstość 1.68 g/cm3.
3. Schemat reakcji:
![]()
4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-8
Ćwiczenie numer 10
|
Temat: Otrzymywanie estrów metylowych kwasu benzoesowego i jego pochodnych
|
||
Data wykonania:
|
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
|
W okrągłodennej kolbie dwuszyjnej o pojemności 100 cm3 umieszcza się 46 cm3 butan-1-olu i 28,6 cm3 lodowatego kwasu octowego. Po dokładnym wymieszaniu, pobiera się próbkę o objętości 1 cm3 do kolby stożkowej o pojemności 125 cm3 zawierającej 20 cm3 wody. Do kolbki dodaje się kilka kropli roztworu fenoloftaleiny i roztwór miareczkuje za pomocą 0,5 M NaOH (V0) do powstania różowego zabarwienia. Do mieszaniny reagującej dodaje się 6 kropli stęż. H2SO4 (ok. 150 mg) oraz porcelankę i ogrzewa 40 minut w stanie wrzenia. Podczas ogrzewania wydziela się mała ilość estru w postaci odrębnej, górnej warstwy. Następnie roztwór oziębia się i pobiera z dolnej warstwy kolejną próbkę o objętości 1,00 cm3 (pipetkę zanurza się poniżej powierzchni, wydmuchuje kilka pęcherzyków powietrza i pobiera roztwór). Próbkę miareczkuje się tak jak poprzednio. Roztwór ogrzewa się przez następne 20 minut, dodając wcześniej świeżą porcelankę, po czym ponownie ochładza i pobiera następną 1,00 cm3 próbkę do miareczkowania. Stan równowagi reakcji estryfikacji zostaje osiągnięty, jeżeli zużywa się taką samą ilość zasady w dwóch kolejnych miareczkowaniach (różnica ≤ 0,3 cm3), otrzymuje się wówczas wielkość VE reprezentującą ilość kwasu obecnego w stanie równowagi.
Na podstawie otrzymanych danych oblicza się stałą równowagi reakcji estryfikacji, zaniedbując niewielki błąd spowodowany nieuwzględnieniem tego, że część kwasu mogła pozostać w górnej warstwie (zakłada się, że objętości nie uległy zmianie). Stała równowagi określona jest równaniem:

(1)
Przy użyciu równomolowych ilości kwasu i alkoholu oraz założeniu, że w trakcie reakcji nie następuje zmiana objętości (co pozwala na zastąpienie stężeń w równaniu (1) liczbą moli), można oznaczyć stałą równowagi przez odmiareczkowanie kwasu na początku reakcji i po osiągnięciu stanu równowagi. Ilość kwasu otrzymuje się bezpośrednio z objętości zużytej na zmiareczkowanie zasady. Oznaczając przez: n - liczbę moli kwasu = początkową liczbę moli alkoholu = V0 ⋅ N zasady, x - liczbę moli kwasu = liczbę moli alkoholu w stanie równowagi = VE ⋅ N zasady, (n - x) - liczbę moli estru = liczbę moli wody w stanie równowagi,
oblicza się stałą równowagi reakcji estryfikacji wg wzoru:
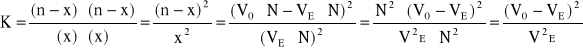
gdzie: N - miano wodorotlenku sodu = 0,5 mol/dm3.
Po ochłodzeniu mieszaninę przenosi się do rozdzielacza, w którym znajduje się 250 cm3 H2O, wytrząsa i oddziela górną warstwę surowego estru. Warstwę tę przemywa się kolejno 100 cm3 H2O, 25 cm3 nasyconego wodnego roztworu NaHCO3 i znowu 50 cm3 H2O, a następnie suszy 5÷6 g bezwodnego Na2SO4. Po odsączeniu środka suszącego na sączku karbowanym, ester oczyszcza się na drodze destylacji, zbierając frakcję w temperaturze 124÷125°C (![]()
= 1,3940).
2. Spis odczynników:
Butan-1-ol- ciecz bezbarwna, klarowna o gęstości 0.81 g/cm3, temp. topn: -890C, temp. wrz: 1180C. Łatwopalna, może powodować podrażnienia skóry, oczu, dróg oddechowych, kaszel, ból głowy.
Kwas octowy- bezbarwna ciecz lub kryształy o ostrym zapachu, gęstość 1.05 dla cieczy i 1.27 g/cm3 dla ciała stałego, temp. topn: 16.20C, temp. wrz: 117.50C. Substancja silnie żrąca, może powodować nieprzyjemne skutki po spożyciu; samozapłon możliwy tylko gdy jest wystawiona na wysoką temperaturę bądź ogrzewana.
Wodorotlenek sodu- białe pastylki lub kryształki o gęstości 2,1 g/cm3. Temp. topnienia=3230C, wrzenia= 1390 0C. Silnie żrący, niepalny, higroskopijny, dobrze rozpuszcza się w wodzie w reakcji egzotermicznej. Może wywoływać łzawienie oczu, pieczenie w gardle i nosie.
Kwas siarkowy (VI)- bezbarwna lub lekko żółta, klarowna, gęsta, oleista ciecz o gęstości 1.84 g/cm3, temp. topn: 10.360C, temp. wrz: 3380C. Niepalny, silnie żrący, niewybuchowy.
Wodorowęglan sodu: biała substancja krystaliczna o gęstości 2.16 g/cm3, temp. topn: 2700C, temp. wrz: 2700C. Rozpuszczalny w wodzie; po podgrzaniu rozkłada się do węglanu sodu, wody i tlenku węgla (IV). Może powodować nudności, pobolewanie gardła.
Siarczan (VI) sodu: biały proszek lub bezbarwne kryształy, o gęstości 2.70 g/cm3, temp. topn: 8840C, temp. wrz: 16890C. Substancja higroskopijna, gdy występuje jako bezwodnik lub powoduje hydratację, gdy ma postać uwodnioną.
3. Schemat reakcji:
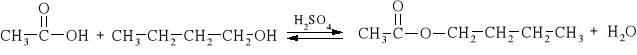
4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-8
Ćwiczenie numer 11
|
Temat: Otrzymywanie acetanilidu z aniliny
|
||
Data wykonania:
|
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
|
W cylindrze o pojemności 10 cm3 odmierza się 4 cm3 technicznej aniliny i waży z dokładnością ±0,1 g. Anilinę wlewa się do kolby stożkowej o pojemności 250 cm3, a cylinder ponownie waży. Do kolby dodaje się 30 cm3 wody, a następnie małymi porcjami 15 cm3 bezwodnika octowego przez cały czas wstrząsając. Do surowego acetanilidu dodaje się 100 cm3 wody oraz porcelankę i ogrzewa do rozpuszczenia zarówno osadu jak i oleju. Przed zakończeniem ogrzewania do roztworu dodaje się ok. 1 g węgla aktywnego, dokładnie miesza i całość ogrzewa łagodnie przez kilka minut. Następnie roztwór sączy się do kolby stożkowej o pojemności 250 cm3 przez sączek karbowany umieszczony w gorącym lejku szklanym. Jeżeli związek zaczyna krystalizować na lejku, to w celu rozpuszczenia osadu przez lejek przelewa się gorącą wodę. Kolbę i zawartość lejka przemywa się małą ilością gorącej wody. Przesącz oziębia się w łaźni z lodem, aż do całkowitego wykrystalizowania amidu. Osad odsącza się na lejku Büchnera i suszy. Uzyskuje się białe kryształy acetanilidu o tt = 114°C
z 90 % wydajnością.
2. Spis odczynników:
Anilina- najprostsza amina aromatyczna; ciecz bezbarwna o gęstości 1.022 g/cm3, temp. topn: -6.30C, temp. wrz: 1840C. Toksyczna, groźna dla środowiska, temp. zapłonu wynosi 760C. Szczególnie silnie działa na krew i układ krwionośny. Może powodować nudności, ból w klatce piersiowej i osłabienie, niedotlenienie, sinice płatków uszu, warg oraz skrócenie oddechu.
Bezwodnik octowy- bezbarwna klarowna ciecz o ostrym zapachu octu i gęstości 1.081 g/cm3,
temp. topn: -730C, temp. wrz: 1390C. Silnie żrący, temp. zapłonu 490C zatem jest łatwopalny, działa szkodliwie na drogi oddechowe, powoduje oparzenia. Nie należy zobojętniać, gdy dojdzie do oparzenia. Może gwałtownie reagować z wodą.
Acetanilid- pochodna aniliny; ciało stałe bezbarwne lub białe o charakterystycznym zapachu; gęstość: 1.219 g/cm3, temp. topn: 1140C, temp. wrz: 3040C. Substancja palna, która może wydzielać pary tlenku azotu. Przy wdychaniu pyłów mogą pojawić się objawy podrażnienia dróg oddechowych, po spożyciu nudności, wymioty, bóle głowy.
Węgiel aktywny- substancja składająca się głównie z węgla pierwiastkowego w formie sadzy i częściowo drobnokrystalicznego grafitu. Ma dużą powierzchnię w przeliczeniu na jednostkę masy, dzięki czemu jest doskonałym absorbentem. Jest nietoksyczny, tani w produkcji, łatwy w utylizacji. Ma zastosowanie jako katalizator, stały nośnik dla innych katalizatorów, składnik pochłaniaczy gazów, substancja usuwająca bakterie i toksyny po zatruciu pokarmowym.
3. Schemat reakcji:
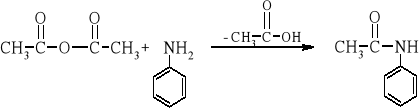
4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-8
Ćwiczenie numer 12
|
Temat: Otrzymywanie nitroanilin z acetanilidu
|
||
Data wykonania:
|
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Przepis literaturowy:
|
W kolbie stożkowej o pojemności 125 cm3 umieszcza się 2,7 g suchego acetanilidu. Cylindrem odmierza się 9 cm3 stężonego kwasu siarkowego(VI); mniej więcej połowę tej ilości wlewa do kolby i miesza prawie do całkowitego rozpuszczenia acetanilidu. Kolbę umieszcza się w łaźni z lodem. Do pozostałej ilości kwasu siarkowego(VI) dodaje się 1,5 cm3 stężonego kwasu azotowego(V). Kwasy miesza się pobierając ciecz pipetką z dna cylindra i opróżniając ją przy górnej krawędzi, a następnie za pomocą banieczek powietrza wypuszczanych z pipety umieszczonej przy dnie cylindra. Mieszaninę kwasów dodaje się małymi, ok. 0,5 cm3 porcjami (za pomocą pipetki) do oziębionego roztworu acetanilidu w kwasie siarkowym(VI). Po dodaniu każdej porcji miesza się ciecz w kolbie umieszczonej w łaźni z lodem. Dodawanie kwasu powinno trwać ok. 10÷15 minut, przy czym szybkość dodawania powinna być taka, aby kolba nie była ciepła w dotyku. Po 20 minutach od momentu rozpoczęcia dodawania mieszaniny kwasów, do kolby wlewa się 25 cm3 wody z lodem (do 25 cm3 probówki wypełnionej lodem dodaje się wody).
Do kolby wrzuca się porcelankę i ogrzewa łagodnie do wrzenia przez 15 min. W trakcie ogrzewania obserwuje się zmianę zabarwienia i rozpuszczanie osadu (w razie pienienia lub zbyt intensywnego wrzenia zmniejsza się ogrzewanie). Następnie zawartość kolby oziębia się w łaźni z lodem i dodaje w 5 lub 6 porcjach 25 cm3 stężonego wodnego roztworu amoniaku, mieszając po dodaniu każdej porcji. Wytrącone nitroaniliny odsącza się na lejku Büchnera, kolbę przepłukuje 3 cm3 wody i przemywa nią osad. Po dokładnym odsączeniu i wstępnym osuszeniu (2÷3 minuty przy włączonej pompie próżniowej) otrzymane kryształki przenosi się do probówki, dodaje 4 cm3 etanolu i ogrzewa do wrzenia. Gdy osad ulegnie prawie całkowitemu rozpuszczeniu, roztwór oziębia się przez 10÷15 minut w łaźni z lodem w celu wykrystalizowania p-nitroaniliny. Kryształy p-nitroaniliny odsącza się pod próżnią na lejku Hirscha, przemywa niewielką ilością alkoholu i suszy. Otrzymuje się żółto-pomarańczowy drobnokrystaliczny osad o temperaturze topnienia 146÷149°C.
2. Spis odczynników:
Acetanilid- pochodna aniliny; ciało stałe bezbarwne lub białe o charakterystycznym zapachu; gęstość: 1.219 g/cm3, temp. topn: 1140C, temp. wrz: 3040C. Substancja palna, która może wydzielać pary tlenku azotu. Przy wdychaniu pyłów mogą pojawić się objawy podrażnienia dróg oddechowych, po spożyciu nudności, wymioty, bóle głowy.
Kwas siarkowy (VI)- bezbarwna lub lekko żółta, klarowna, gęsta, oleista ciecz o gęstości 1.84 g/cm3, temp. topn: 10.360C, temp. wrz: 3380C. Niepalny, silnie żrący, niewybuchowy.
Kwas azotowy (V)- bezbarwna przejrzysta ciecz o charakterystycznym zapachu, mieszająca się z wodą w każdych proporcjach. Gęstość: 1.51g/cm3, temp. topn: -420C, temp. wrz: 830C. Silnie żrący, silny utleniacz; wdychanie wywołuje ostre stany zapalne dróg oddechowych, może powodować podrażnienia skóry, łzawienie, pieczenie oczu.
Amoniak- gaz o gęstości 0.00077g/cm3, temp. topn: -77.70C, temp. wrz: -33.30C. Silnie żrący, toksyczny, groźny dla środowiska, łatwopalny, powodujący oparzenia, może podrażniać drogi oddechowe.
3. Schemat reakcji:
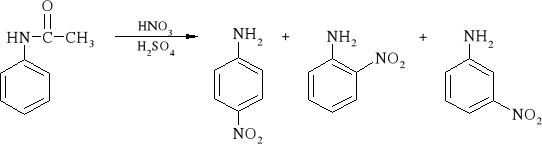
4. Przebieg doświadczenia i wnioski:
Agnieszka Wróbel
II CD L-8
Ćwiczenie numer 13
|
Temat:
|
||
Data wykonania: . . 2008 |
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia:
Podpis prowadzącego: |
1. Opis stosowanej techniki laboratoryjnej:
2. Przepis literaturowy:
Oranż II
|
|
W kolbie stożkowej o pojemności 10 cm3 umieszcza się 5,25 g dwuwodnego kwasu sulfanilowego, 1,325 g bezwodnego węglanu sodu oraz 50 cm3 wody i ogrzewa aż do otrzymania przezroczystego roztworu. Zawartość kolby chłodzi się pod bieżącą wodą do ok. 15°C i dodaje roztwór 1,85 g azotanu(III) sodu w 5 cm3 wody. Otrzymaną mieszaninę wlewa się powoli mieszając do zlewki o pojemności 250 cm3, zawierającej 5,25 g stęż. kwasu solnego i 30 g pokruszonego lodu (wyjaśnij, dlaczego obniżamy temperaturę mieszaniny reakcyjnej). Po 15 minutach sprawdza się obecność wolnego kwasu azotowego(III) papierkiem jodoskrobiowym (podaj odpowiednie reakcje). Po tym czasie zaczynają wypadać drobne kryształy sulfonianu benzenodwuazowego, których nie trzeba odsączać, gdyż w następnym etapie ulegają rozpuszczeniu. Zawiesinę związku dwuazowego przechowuje się w wodzie z lodem.
W zlewce o pojemności 250 cm3 rozpuszcza się 3,6 g czystego 2-naftolu w 20 cm3 zimnego 10 % roztworu wodorotlenku sodu (jaką rolę on odgrywa?). Roztwór oziębia się do 5°C i mieszając wlewa do niego dobrze rozmieszaną zawiesinę zdwuazowanej pochodnej kwasu sulfanilowego (sprzęganie zachodzi szybko i barwnik wydziela się w postaci krystalicznej pasty). Energiczne mieszanie kontynuuje się przez 10 minut, a następnie zawiesinę ogrzewa aż do rozpuszczenia osadu. Do gorącego roztworu dodaje się 10 g chlorku sodu (w jakim celu ?) i ogrzewa aż do rozpuszczenia. Roztwór pozostawia się na godzinę do samorzutnego ostygnięcia, a następnie chłodzi w lodzie aż do zakończenia krystalizacji. Produkt odsącza się na lejku Büchnera stosując łagodne ssanie, przemywa niewielką ilością nasyconego roztworu soli kuchennej i suszy w temperatury 80°C. Masa surowego produktu wynosi ok. 11 g (ok. 20 % stanowi chlorku sodu). Aby otrzymać czysty, krystaliczny oranż II, surowy produkt rozpuszcza się w możliwie jak najmniejszej objętości wrzącej wody, studzi do 80°C, dodaje ok. dwukrotną objętość alkoholu etylowego i pozostawia do samorzutnej krystalizacji. Czysty barwnik (jest to produkt dwuwodny) sączy się pod zmniejszonym ciśnieniem, przemywa niewielką ilością etanolu i suszy na powietrzu. Otrzymuje się 7 g
(80 % wyd.) oranżu II.
3. Spis odczynników:
4. Schemat reakcji:
5. Przebieg doświadczenia i wnioski:
g/cm3, temp. topn: 0C, temp. wrz: 0C. ![]()
=
Wyszukiwarka

