Pytania egzaminacyjne z chemii fizycznej
Dlaczego lód jest śliski - mechanizm ślizgania.
Dlaczego kredą można pisać po tablicy?
![]()
może występować w postaci rozmaitych form (bezpostaciowa kreda - substancja stała, nierozpuszczalna w wodzie, krucha, miękka, łatwo się ściera; marmury - substancja krystaliczna, nierozpuszczalna w wodzie, twarda, nieścieralna). Występuje tutaj zjawisko polimorfizmu, czyli występowanie minerałów - także pierwiastków i związków chemicznych - o tym samym składzie chemicznym, w kilku odmianach, różniących się strukturą, postaciami krystalograficznymi, własnościami fizycznymi i niektórymi chemicznymi.
Kreda techniczna jest substancją miękką, białą, zawierającą zależnie od gatunku 90-95% ![]()
, stosowana w przemyśle gumowym, tworzyw sztucznych, lakierniczym, papierniczym, elektrotechnicznym jako napełniacz lub nośnik
Dlaczego asfalt w lecie staje się miękki?
Asfalty zaliczane są do bitumów mieszaniny różnych węglowodorów i związków organicznych, zawierających siarkę, tlen i azot o konsystencji stałej, półstałej lub ciekłej o dużej lepkości. Rozpuszczają się w CS![]()
, pod wpływem ogrzewania topią się bez rozkładu. Rozróżnia się asfalty naturalne (kopalne) i sztuczne, otrzymywane z ropy naftowej. Charakteryzuje je ciemne zabarwienie specyficzny zapach, odporność na działanie czynników atmosferycznych, mała przewodność cieplna i elektryczna, duża przyczepność do materiałów mineralnych. Stosowane do produkcji dróg, papy, w budownictwie, w przemyśle elektrotechnicznym, papierniczym (do impregnacji papieru), gumowym (zmiękczanie) oraz do produkcji lakierów asfaltowych.
Dlaczego olej rozpływa się po powierzchni wody?
Układ olej-woda jest przykładem emulsji. W tym przypadku cząsteczki emulgatora kierują się swoimi rodnikami hydrofobowymi ku kropli oleju, natomiast grupa hydrofilowe sterczą na zewnątrz ku otaczającej je fazie wodnej. Do tak ustabilizowanej „kropli” oleju mogą wbudować się z kolei cząsteczki substancji hydrofobowych obecne w ośrodku wodnym. [ w przypadku odwrotnym woda w oleju - cząsteczki substancji powierzchniowo czynnych spełniających rolę emulgatora skierowane są częścią hydrofilową do fazy olejowej]
Mianem emulsji określamy układy koloidalne, w których zarówno ośrodek rozpraszający, jak i substancja rozproszona znajdują się w stanie ciekłym. Emulsjami nazywane są także układy zdyspergowane, w których kropelki substancji rozproszonej posiadają rozmiary znacznie większe od rozmiarów typowych cząstek koloidalnych; w tzw. emulsjach „technicznych”, średnica kropelek substancji rozproszonej sięga nawet 10−3 cm.
Podstawowym warunkiem utworzenia emulsji w układzie dwóch cieczy jest zupełny brak lub bardzo mała ich rozpuszczalność wzajemna. Z tego względu są to układy termodynamicznie nietrwałe; oznacza to, że otrzymana przez mechaniczne rozdrobnienie emulsja, np. oleju w wodzie (lub wody w oleju) rozdzieli się samorzutnie na dwie fazy ciekłe, będące nasyconymi roztworami oleju w wodzie i wody w oleju. Proces łączenia się kropelek emulsji w większe krople w wyniku ich zderzeń nosi nazwę koalescencji. Dla zapobieżenia koalescencji dodaje się substancji powierzchniowo czynnych, tzw. emulgatorów, które ulegając bardzo silnej adsorpcji na powierzchni zdyspergowanych kropelek, są ich czynnikiem stabilizującym.
Jeżeli napięcie międzyfazowe pomiędzy składnikami emulsji jest bardzo małe (ok. 0,1 erg⋅cm−2) to możliwy jest samorzutny proces emulgowania pod wpływem ruchu cieplnego cząsteczek, w wyniku czego powstają układy koloidalne (emulsje) trwałe termodynamicznie.
Emulsję zdyspergowanego oleju (lub innej podobnej substancji organicznej) w wodzie oznacza się krótko jako emulsję typu O/W i odwrotnie − emulsję zdyspergowanej wody w oleju (lub innej podobnej substancji organicznej) przez W/O. Typ tworzącej się emulsji zależy od zastosowanego emulgatora. Działanie emulgatorów polega w zasadzie na zmniejszeniu międzyfazowego napięcia powierzchniowego pomiędzy kropelkami substancji rozproszonej a cieczy rozpraszającej. Zmniejszenie międzyfazowego napięcia powierzchniowego, sprzyjające utworzeniu emulsji, jest wynikiem powstania cienkiego (na ogół monocząsteczkowego) filmu na powierzchni kropelek. Ponieważ zjawisko zagęszczania substancji na granicy faz zależy od rodzaju grup funkcyjnych, występujących w cząsteczkach chemicznych emulgatora, zatem dany emulgator będzie prowadził do utworzenia emulsji określonego typu. Niskocząsteczkowe emulgatory o przeważających właściwościach hydrofilowych, będą prowadziły do powstawania emulsji typu O/W. Z emulgatorów tych można wymienić mydła sodowe i potasowe, trójetanoloaminę i inne. Emulgatory o przeważających właściwościach hydrofobowych (np. stearyniany magnezu, wapnia) będą tworzyły emulsje typu W/O.
Do rozdzielenia emulsji na dwa tworzące ją składniki należy usunąć emulgator lub zahamować jego działanie. Można tego dokonać dodając do emulsji typu O/W emulgatora, wywołującego powstanie emulsji typu W/O.
Jak smary zmniejszają tarcie?
Smarami nazywamy stałe lub płynne substancje stosowane do oddzielania trących powierzchni mechanizmów, w celu zmniejszenia ich zużycia i zmniejszenia oporów tarcia, a co za tym idzie zmniejszenia rozproszenia energii. Przez wprowadzenie między metalowe powierzchnie trące oleju lub smaru dąży się do zmiany tarcia suchego na znacznie mniejsze tarcie płynne. Dzieje się tak dlatego, że siły przylegania cząsteczek oleju do metalu są większe niż siły przylegania pomiędzy cząsteczkami cieczy, stąd każda z przesuwających się metalowych powierzchni unosi ze sobą warstewkę cieczy, przez co wytwarzają się dwie warstwy cieczy przesuwające się względem siebie. Tarcie pomiędzy cząsteczkami cieczy, czyli lepkość jest miarą sił międzycząsteczkowego przyciągania cieczy. Tarcie płynne. Tarcie płynne podlega prawom hydrodynamicznym i jest proporcjonalne do lepkości oleju, pola powierzchni ciał trących i szybkości ich wzajemnego przesuwania się odwrotnie proporcjonalnie do grubości warstwy smarującej.
Smarowanie - to proces fizyczny związany ze zmianą tarcia suchego na inne rodzaje tarcia, może oznaczać specjalne zagadnienia techniczne związane ze sposobem technicznego doprowadzenia środka smarującego do węzłów trących, sposobem technicznego zrealizowania zasady tarcia płynnego w łożyskach, bądź też konsystencją zastosowanego smaru, może także oznaczać czynność wprowadzania smaru pomiędzy trące elementy. Smarowanie ma na celu zmniejszenie oporów tarcia i zużycia. Rodzaj tarcia występującego w węźle tarciowym zależy od względnej grubości warstwy smaru. Tarcie graniczne występuje, gdy powierzchnie trące nie są rozdzielone warstewką smaru, lecz są pokryte warstwą adsorpcyjną substancji smarowej. Tarcie zależy wówczas od materiałów pary trącej oraz od środka smarującego. Nie zależy natomiast od lepkości smaru. Istnienie tarcia granicznego jest uwarunkowane także nieprzekroczeniem temperatury krytycznej (temp. desorpcji). Na tarcie graniczne i mechanizm zachodzących zjawisk duży wpływ ma warstwa tlenków powstała w wyniku utlenienia się powierzchniowych warstw atomów metali. Własności smarne warstwy tlenków zależą także od zawartości wilgoci, zaabsorbowanych cząsteczek polarnych z otoczenia lub ze środowiska smarującego - w przypadku pokrycia tej warstwy olejem. Na powierzchni tlenku powstaje warstwa cząsteczek organicznych, mocno związana z podłożem o uporządkowanej budowie. Tarcie płynne polega na rozdzieleniu powierzchni trących się ciał stałych za pomocą płynu (cieczy) i zamianie tarcia zewnętrznego na tarcie wewnętrzne cieczy. Użycie trzeciego ciała - smaru mazistego (plastycznego) - nie wpływa na istotę mechanizmu, ponieważ z reguły mamy do czynienia z dużymi naciskami, występującymi w parze tnącej, zachowuje się on identyczne jak ciecz. Tarcie mieszane jest pośrednim rodzajem tarcia pomiędzy płynnym a granicznym. Występuje w parach ślizgowych maszyn w okresie ich rozruchu lub zatrzymania, przy małych prędkościach poślizgu, w okresie docierania oraz przy dużych obciążeniach. Opory tarcia mieszanego są sumą składowej tarcia płynnego, występującego we wgłębieniach nierówności powierzchni, tarcia granicznego i suchego.
Rodzaje smarów:
Ze względu na konsystencję: Stałe(grafit, talk), Maziste, plastyczne (smary stałe typu EUT), Płynne (oleje, woda destylowana - przy układach z samozapłonem, przy sprężarkach), Gazowe
Ze względu na pochodzenie: roślinne, zwierzęce, mineralne - z przeróbki ropy naftowej; ze względu na lepkość dzielimy je na: wrzecionowe, maszynowe, cylindrowe
Wymagania stawiane smarom: zmiana lepkości z temperaturą, temperatura zapłonu - przy odpowiedniej temperaturze może nastąpić zapłon, czystość smaru, smarność - zdolność przylegania smaru do czopa i panewki, odporność na starzenie
Kleje - mechanizm łączenia.
Kleje i spoiwa to bardzo rozległe pojęcia. Substancja, która służy do klejenia powinna charakteryzować się własnością dobrego rozprowadzania się i przylegania do klejonych powierzchni (adhezja) oraz dobrą spójnością wewnętrzną (kohezja) - cząsteczki własne kleju muszą łączyć się ze sobą odpowiednio mocno.
Kleje dzieli się na żywice (naturalne lub syntetyczne), kleje organiczne, wytwarzane z białek zwierzęcych lub roślinnych (np. kleje kostne) oraz cementy, które są substancjami mineralnymi. Kleje są zwykle nakładane w postaci gęstej, lepkiej cieczy, która z czasem zestala się lub przybiera zbliżoną do stałej formę żelu.
Kleje i żywice termoplastyczne („topliwe”) przed nałożeniem są roztapiane w podwyższonej temperaturze. Po złączeniu elementów substancje te stygną i zestalają się. Większość z nich można wielokrotnie stapiać i zestalać. Wyróżnia się również żywice termoutwardzalne, które powstają na skutek reakcji chemicznej pomiędzy składnikami mieszanymi bezpośrednio przed użyciem - dzięki czemu powstaje termoodporna substancja trwale wiążąca.
Kleje mogą być rozpuszczalne w rozpuszczalnikach ( woda, benzen, toluen). Po naniesieniu na klejone powierzchnie rozpuszczalnik odparowuje, pozostawiając cienką wiążącą warstwę kleju.
Elastomery to kleje kontaktowe. Sklejane powierzchnie powleka się roztworem elastomeru i pozostawia do wyschnięcia. Po wyparowaniu rozpuszczalnika tworzy się gumopodobna warstwa, a klejenie odbywa się przez ściśnięcie powierzchni ze sobą.
Kleje naturalne - klej zwierzęcy jest nie oczyszczoną formą żelatyny, ta z kolei wywodzi się z kolagenu. Klej ten roztapiany jest przez podgrzanie, jest szeroko wykorzystywany przy obróbce drewna (szereg wad: mała odporność na wilgoć). Klej kazeinowy - obróbka drewna, papiernictwo; jest odporny na szereg chemikaliów oraz zjadany przez mikroorganizmy. Guma arabska - klej naturalny; wytwarzana z soku drzewa akacjowego; aby wyschniętej gumie arabskiej przywrócić własności klejące należy ją zwilżyć.
Kleje syntetyczne - większość to elastomery lub żywice termoplastyczne (żywice typy poliwinylowego używane do klejenia drewna, przyklejania okładzin do płyt meblowych oraz łączenia tworzyw sztucznych z metalem; żywice acetylo - oraz nitrocelulozowe) lub termoutwardzalne (żywice epoksydowe) - tworzą silniejsze spoiny od klejów termoplastycznych, lecz są od nich znacznie mniej sprężyste i bardzo kruche; są wytwarzane przez zmieszanie ze sobą tuż przed użyciem dwóch komponentów: żywicy i utwardzacza. Kleje syntetyczne bardzo dobre przy łączeniu twardych i gładkich powierzchni. Najnowsze osiągnięcie to cyjonopan czyli kleje cyjanoakrylowe, którymi można skleić praktycznie wszystko w ciągu zaledwie paru sekund.
Kleje są substancjami niemetalicznymi, organicznymi lub nieorganicznymi, które wprowadzone w stanie ciekłym bądź ciastowatym między dwie powierzchnie wykazują po przejściu w stan stały zdolność trwałego ich połączenia w wyniku działania sił przyczepności (adhezji) między powierzchnią klejoną a warstwą klejoną oraz sił spójności wewnętrznej (kohezji) w warstwie klejonej.
Jakie jest działanie mydła w czasie prania?
Mydła są to sole potasowe lub sodowe kwasów: palmitynowego, stearynowego, oleinowego i in. Rozróżnia się mydła twarde - powstające przez gotowanie przeważnie stałych tłuszczów z NaOH, składające się więc z soli sodowych wyższych kwasów tłuszczowych; mydła miękkie - sole potasowe tych kwasów.
Do wyrobu mydeł używa się zarówno mydeł roślinnych i zwierzęcych. Najlepsze mydło toaletowe produkuje się z oleju rycynowego, produkuje się również dosyć powszechnie mydła z oleju palmowego lub kokosowego z dodatkiem łoju
Produkcja mydła - gotowanie tłuszczu z NaOH (KOH)![]()
klej mydlany (mydło, gliceryna, woda) ![]()
gotowanie kleju z NaCl (wysalanie mydła, czyli przeprowadzenie mydła ze stanu hydrazolu w hydrożel; na powierzchni zbiera się wówczas stały produkt tzw. mydło ziarniste) ![]()
gotowanie mydła ziarnistego z NaOH![]()
surowy produkt (lepsze gatunki otrzymuje się przez dalszą przeróbkę produktu surowego.
Działanie mydeł polega na zdolności do obniżania napięcia powierzchniowego roztworów, zwilżania tłuszczów i tworzenia z nimi emulsji. Wskutek zwilżającego działania roztwór mydła może wniknąć w najgłębsze i najdrobniejsze pory powierzchni zabrudzonego przedmiotu, a pod wpływem mechanicznego tarcia wytworzona z tłuszczem brudu emulsja łatwo daje się usunąć przez wypłukanie wodą. Czyli działanie mydła sprowadza się przeważnie do działania o charakterze fizycznym. Można mówić również o częściowym oddziaływaniu chemicznym - mydła jako związki bardzo słabych kwasów z silnymi zasadami w roztworach wodnych ulegają hydrolizie.
Wodny roztwór reaguje zatem alkalicznie i może oddziaływać hydrolizująco na cząstki tłuszczu zawartego w brudzie. Działanie to jest tym skuteczniejsze im temperatura jest wyższa, stąd pranie bielizny mydłem wykonuje się na gorąco.
Cząsteczki kwasów tłuszczowych zawierają długie łańcuchy węglowe, dlatego nie rozpuszczają się w wodzie. Rozpuszczalne są natomiast sole sole potasowe i sodowetych kwasów, ponieważ aniony są bardziej hydratowane niż niezdysocjowane cząsteczki. Dodatkowym czynnikiem ułatwiającym rozpuszczanie soli jest hydratacja kationów. Sole kwasów tłuszczowych z metalami oprócz litowców są nierozpuszczalne w wodzie. Osady powstające z mydła w twardej wodzie składają się z magnezowych i wapniowych soli kwasów tłuszczowych. W rozcieńczonych roztworach mydła znajdują się hydratowane kationy i aniony, których hydratacja jest ograniczona do polarnych końców, czyli grup![]()
. Wzrost stężenia pogarsza sytuację, bo wzrastająca liczba hydrofobowych grup alkilowych wymaga rozerwania coraz większej liczby wiązań wodorowych między cząsteczkami wody. Jest to niekorzystne, bo wymaga nakładu energii, ale wpływ tego zjawiska można zmniejszyć poprzez połączenie anionów w agregaty (micele), w których grupy alkilowe nie stykają się z wodą . grupy są skupione w wewnętrznej części miceli, gdzie stwarzają właściwe sobie hydrofobowe środowisko. Na powierzchni miceli znajdują się grupy ![]()
i kationy ![]()
otoczone przez cząsteczki wody. Powstanie miceli oznacza, że w wodnych roztworach działają siły zmierzające do skupienia grup alkilowych blisko siebie, jakby istniały między nimi siły przylegania - tzw. oddziaływanie hydrofobowe. Substancje hydrofobowe rozpuszczają się w rozpuszczalnikach niepolarnych, stąd hydrofobowe fragmenty nazywane są grupami lipofilowymi. Mydła są cząsteczkami amfifilowymi, czyli zawierają obok siebie grupy lipofilowe i hydrofilowe. Na granicy faz woda - tłuszcz cząsteczki te ustawiają się tak, aby końce lipofilowe stykały się z tłuszczem a hydrofilowe były otaczane przez wodę. Dzięki temu powierzchnia tłuszczu staje się hydrofilowa, co umożliwia powstanie emulsji, czyli rozdrobnienie tłuszczu do mikroskopijnych, silnie hydratowanych kropelek. Emulsje są trwałe, bo związane z powierzchnią kropelek cząsteczki wody utrudniają ich łączenie się ze sobą. Tłuszcz w obecności mydła rozpuszcza się w wodzie dzięki tworzeniu miceli, złożonych z tłuszczowego rdzenia, otoczonego jednomolekularną warstwą cząsteczek mydła, których polarne końce są otoczone przez silnie związane cząsteczki. Brud tworzą głównie cząsteczki niepolarne, tłuszczowe. Substancje te nie rozpuszczają się w wodzie. W roztworach mydła aniony kwasów tłuszczowych adsorbują się na zabrudzonych, tłustych powierzchniach, dzięki czemu stają się hydrofilowe. Po mechanicznym oderwaniu od zabrudzonej powierzchni cząsteczki brudu są ze wszystkich stron otoczone przez cząsteczki wody i przechodzą do roztworu w postaci miceli.
Skład i działanie proszków.
Detergentami nazywamy substancje powierzchniowo czynne, czyli zmniejszające napięcie powierzchniowe wody, co powoduje, że dużo lepiej rozpływa się ona po powierzchni tkanin, zwilżając brud. Detergenty oprócz substancji powierzchniowo czynnych zawierają wypełniacze (substancje w postaci proszków, włókien, ścinków dodawane do mieszanek gumowych, tworzyw sztucznych, farb w celu zmiany ich własności np. twardości, elastyczności), rozjaśniacze optyczne, środki zapachowe. Substancje powierzchniowo czynne mogą być anionowe, kationowe lub niejonowe. Cząsteczki substancji anionowych tworzą w roztworze wodnym jony ujemne, kationowe - jony dodatnie, a substancje niejonowe nie tworzą jonów. Substancje powierzchniowo czynne w mydłach są zawsze anionowe, natomiast detergenty syntetyczne mogą zawierać wszystkie ich rodzaje.
Proszki mydlane powstają przez stapianie mydła mieszanego z dodatkami wspomagającymi i polepszającymi działanie piorące oraz wygląd i strukturę pranej tkaniny. Następnie mieszaninę suszy się rozpryskowo. Podobne dodatki stosowane są w przypadków detergentów syntetycznych, produkowanych zarówno w formie proszków i płynów. Proszki zawierają około 20 -25% substancji powierzchniowo czynnych, produkowane są przez suszenie rozpryskowe. Niektóre proszki do prania zawierają enzymy proteolityczne, np. proteazę, które pomagają usunąć zabrudzenia pochodzenia białkowego (krew, jajka). Tego typu proszki nazywane są proszkami „biologicznymi”.
Detergenty syntetyczne produkuje się dodając do roztworu składników substancji zwanej hydrotropem, który zwiększa rozpuszczalność substancji w wodzie, nie pozwalając tym samym składnikom takiego płynu wracać do roztworu. Detergenty syntetyczne używane w proszkach czy mleczkach do szorowania, zawierają wówczas aniony, drobno sproszkowany związek mineralny (skaleń czy marmur) oraz wybielacz chlorowy.
Do proszków do prania dodawane są także substancje zmniejszające twardość wody. Obecność ![]()
w wodzie do picia jest korzystna ze względu na nadawanie walorów smakowych, natomiast w wodzie wykorzystywanej w przemyśle i w gospodarstwie domowym zwiększa twardość wody, która spowodowana jest obecnością soli magnezu i wapnia, przede wszystkim wodorowęglanów, siarczanów i chlorków. Woda twarda daje z mydłem obfity osad soli wapniowych kwasów palmitynowego i stearynowego. Gotowanie zmniejsza twardość wody, bo wodorowęglan wapnia przechodzi w węglan (twardość przemijająca). Twardość trwałą usuwa się dodając ![]()
, przez demineralizację jonitami, dodając polifosforanów ![]()
(jony polifosforanowe tworzą z jonami![]()
kompleksy nie ulegające wytrącaniu na włóknach tkanin po dodaniu mydła.
Wodorosiarczany otrzymywane z alkoholi o długich łańcuchach węglowych wykorzystywane są jako detergenty np. dodecylosiarczan sodu. Długołańcuchowe alkilosiarczany są typowymi związkami amfifilowymi, są rozpuszczalne w wodzie, ponieważ energia hydratacji kationu i hydrofilowej reszty siarczanowej wystarcza do przezwyciężenia straty energii wiązań wodorowych, które muszą się rozpaść, gdy w wodzie rozpuszcza się długi łańcuch hydrofobowy.
Dlaczego powstają chmury?
Chmura jest to zawieszony w atmosferze zbiór bardzo małych kropelek wody, kryształków lodów lub mieszaniny jednych i drugich; produkt kondensacji (krystalizacji) zawartej w powietrzu pary wodnej.
Im wyższa temperatura powietrza tym więcej pary wodnej może ono zawierać. Kiedy powietrze zawiera maksymalną ilość pary wodnej w danej temperaturze, mówimy, że jego wilgotność względna wynosi 100%. Temperatura przy której para wodna znajdująca się aktualnie w powietrzu nasyciłaby je, nazywana jest punktem rosy, kondensacja (para wodna w ciecz) ma miejsce w momencie, gdy temperatura powietrza spadnie do lub poniżej punktu rosy. Zdarza się również zjawisko sublimacji (przejście ze stanu gazowego w ciekły) oprócz spadku temperatury konieczna jest również obecność zawieszonych w powietrzu mikroskopijnych cząstek nazywanych jądrami kondensacji, na których osiadają jeszcze drobniejsze produkty kondensacji.
Jednym z głównych przyczyn kondensacji jest adiabatyczne ochłodzenie powietrza (adiabatyczne zmiany temperatury zachodzą wówczas, gdy nie ma wymiany ciepła z otoczeniem, przy rozprężaniu i sprężaniu powietrza na skutek zmian ciśnienia i objętości, głównie przy wznoszeniu i osiadaniu powietrza. Wznoszenie może być wymuszone przez przeszkody górskie. Część energii pochłaniana jest w wyniku rozszerzania się powietrza na większych wysokościach, ponieważ panuje tam mniejsze ciśnienie. Temperatura spada poniżej punktu rosy i zaczyna się kondensacja pary wodnej. Typowe dla obszarów górskich chmury to np. chmury stojące, soczewkowe i rotorowe.
Chmury stojące, zawieszone nad wierzchołkami szczytów, powstają, gdy wierzchołek wzniesienia zmusza poruszające się powietrze do podziału. Na zawietrznej stronie powstają wiry, w których dochodzi do turbulencyjnego wznoszenia powietrza i kondensacji pary wodnej. W miarę oddalania się od wierzchołka kropelki wody wyparowują, chmura rozmywa się i zanika.
Chmury soczewkowe powstają w grzbietach fal powietrza powstającymi nad obszarami o urozmaiconej rzeźbie. Chmury rotorowe formują się w wirach turbulencyjnych po zawietrznej stronie wzniesień górskich. Chmury falowe powstają najczęściej wzdłuż powierzchni styku dwóch warstw powietrza o różnej temperaturze i gęstości.
Dlaczego i w jaki sposób prowadzimy czyszczenie chemiczne?
Pranie chemiczne polega na usuwaniu zanieczyszczeń z wyrobów włókienniczych za pomocą rozpuszczalników organicznych np. benzyny, tri, czterochloroetylenu.. rozpuszczalniki te charakteryzują się małym napięciem powierzchniowym, dzięki czemu mogą wnikać we włókna tkaniny; tłuszcz jako związek niepolarny rozpuszcza się w tych rozpuszczalnikach i łatwo może być usunięty z powierzchni włókien. Pranie chemiczne stosuje się w przypadku, gdy istnieje zagrożenie kurczenia się włókien tkaniny podczas prania tradycyjnego, które w konsekwencji może prowadzić do zniszczenia materiału.
Co to są chmury śniegowe?
Śnieg jest to opad atmosferyczny złożonych z kryształków lodu gł sześcioramiennych gwiazdek; w temperaturze poniżej - 5 ![]()
kryształki łączą się tworząc płatki; śnieg ziarnisty złożony jest z bardzo małych , białych , nieprzeświecających ziarenek lodu.
Dolne piętro reprezentują stratocumulusy i stratusy. Są to szare warstwy chmur nisko rozpostarte nad ziemią, z tym, że w stratokumulusie można wyróżnić ciemniejsze bryły i płaty, podczas, gdy stratus jest bardziej jednorodnych. Są to chmury w całości zbudowane z kropelek wody, które wyjątkowo dają opady mżawki i drobniejszego deszczu. Przy temperaturze poniżej zera ze stratokumulusa może padać śnieg, a ze stratusa igiełki lodowe lub krupa śnieżna.
Woda z chmur dociera do ziemi w różnych postaciach, najczęściej jako deszcz i śnieg. Drobniutkie kropelki wody tworzące chmurę znajdują się w nieustannym ruchu, unoszą się i opadają. Gdy opadają łączą się z innymi kropelkami aż w końcu osiągają takie rozmiary, że są zbyt ciężkie, by unosić się w powietrzu i spadają na ziemię (jest to koalescencją) w postaci deszczu lub śniegu, co z kolei uzależnione jest od tego, czy powstałe w chmurach kryształki lodu w czasie opadania na ziemię stopiły się, czy nie. Grad powstaje wskutek przemieszczania się kryształków lodu w górę i w dół chmury. Kryształki obrastają wówczas kolejnymi warstwami lodu, aż do momentu, gdy stają się tak ciężkie, że spadają na ziemię w postaci lodowych bryłek. Śnieg pojawia się, gdy para wodna kondensuje w chmurze w temperaturze od -4 do -15![]()
. Gdy temperatura jest bliska 0![]()
, kryształki miękną i łatwo się zlepiają, tworząc duże płaty.
Dlaczego w lecie w górach (nad lasem) po burzy tworzą się chmurki?
Dlaczego zupy mają różne smaki, co nadaje smak?
Smak i węch to zmysły reagujące na obecność substancji chemicznych znajdujących się w otoczeniu. Aby powstał zapach substancja musi wysyłać w powietrze cząsteczki. Im więcej tych cząsteczek tym silniejszy zapach. Intensywność uwalniania cząsteczek wzrasta wraz ze wzrostem temperatury, ponieważ więcej cząsteczek odrywa się od pary unoszącej się np. nad zupą. Cząsteczki te zostają rozpoznane jako zapachy, ponieważ są rozpuszczalne w wodzie. Ciepło powoduje odrywanie cząsteczek, a wilgoć pozwala na większe ich skoncentrowanie; dlatego zapachy są intensywniejsze, gdy jest ciepło i wilgotno. U ssaków narządem smaku są kubki smakowe , będące owalnymi komórkami nabłonka , w których mieści się szereg receptorów smakowych. Walory smakowe potraw zależą od proporcji pomiędzy czterema podstawowymi smakami, w kombinacji z zapachem, konsystencją i temperaturą potrawy. Zapachy modyfikują doznania smakowe, ponieważ z jamy gębowej dostają się poprzez wewnętrzne nozdrza z komory nosowej. Naukowcy przypuszczają, że doznawanie smaku może być związane z występowaniem odpowiednich protein; przypuszcza się również, że kubki smakowe wchodzą w kontakt z rozpuszczonymi w wodzie substancjami chemicznymi, zaczyna wydzielać się odpowiedni ładunek elektryczny, który następnie zostaje przesłany do mózgu przez układ nerwowy. Na ocenę walorów smakowych składają się: gazy wydzielające się podczas żucia wędrują do nosa pobudzając zmysł węchu; struktura pożywienia; temperatura; ból; receptory dotyku i nacisku informują o strukturze pożywienia (chrupiące, kremowe..);dźwięki; pamięć.
Bicie piany.
Przez zdyspergowanie w cieczy substancji gazowej otrzymuje się piany; banieczki gazu rozdzielone są cienkimi warstwami cieczy, tworzącymi szkielet piany. Istnieją także piany stałe.
Trwałość pian, podobnie jak trwałość emulsji zależy od wzmocnienia błonek oddzielających banieczki gazu cienkimi warstewkami substancji powierzchniowo czynnych. Hydrofobowa część cząsteczki substancji powierzchniowo czynnej, ustawia się od strony banieczki gazu (np. powietrza) natomiast część hydrofilowa od strony cieczy (np. wody).
Tworzenie pian, wielkość banieczek zdyspergowanego gazu oraz ich trwałość posiadają istotne znaczenie w procesie wzbogacania rud, zwanym flotacją. Substancje powierzchniowo czynne dodawane do zawiesiny wodnej drobno zmielonej rudy tworzą z wtłaczanym powietrze drobne banieczki piany, które oddziaływując selektywnie z rudą, oddzielają ją od skały płonnej
Piana to układ, w którym fazą rozproszoną jest gaz a ośrodkiem dyspersyjnym ciecz. Piany mają wiele cech zolów koloidowych, mimo tego, że wymiary pęcherzyków gazu zawieszonych w cieczy znacznie przewyższają wymiary cząstek koloidalnych. Pianę można otrzymać poprzez wstrząsanie cieczy z nierozpuszczalnym w niej gazem. Wskutek małej gęstości banieczek gazu wznoszą się one w cieczy w kierunku pionowym. Im wyższa lepkość cieczy, tym ruch powolniejszy, przy czym małe banieczki gazu poruszają się wolniej niż duże. Ostatecznie następuje rozdzielenie się faz, ponieważ wszystkie banieczki gazu wzniosą się na powierzchnię swobodną cieczy i ulotnią się w powietrze. Dodanie substancji powierzchniowo czynnych utrwala piany. Te substancje nazywane są substancjami pianotwórczymi. Cząsteczki substancji pianotwórczej zwracają się swoimi liofilowymi końcami w stronę cieczy, a końce liofobowe zwrócone są na zewnątrz. Gdy zetkną się ze sobą dwie ochronione substancjami pianotwórczymi banieczki gazu, wówczas nie zlepiają się one ze sobą, ponieważ dotykają się nieczynnymi lub jednoimiennie naładowanymi końcami liofobowymi. Większa liczba banieczek zgromadzonych na powierzchni swobodnej cieczy tworzy skupiony zespół - pianę. Wskutek przypadkowych bodźców zewnętrznych, a także wskutek spływania cieczy błonki pod własnym ciężarem zmniejszając stopniowo grubość błonki z czasem banieczki pękają. Trwałość banieczek zależy od napięcia powierzchniowego i od lepkości warstewki. Pienienie może być zarówno zjawiskiem korzystnym i niekorzystnym. Korzystne w procesie prania, niepożądane podczas barwienia (nierówności wybarwień).
Jak zrobić dobrą galaretkę?
Żelatyna jest substancją otrzymywaną dzięki długotrwałemu gotowaniu w wodzie kolagenu ( gł. składnika tkanki łącznej, tworzącego tzw. włókna kolagenowe), który na skutek tego ulega denaturacji; do produkcji żelatyny używa się gł. kości zwierzęcych oraz innych tkanek zawierających kolagen; żywica handlowa składa się z glutyny i innych substancji powstających przy ogrzewaniu kolagenu; szerokie zastosowanie w przemyśle spożywczym, chemicznym, włókienniczym, farmaceutycznym i fotograficznym.
Galaretka może być bardziej lub mniej „sztywna”, na przykład galaretki owocowe są bardziej zwarte niż galareta z nóżek, galaretka zawierająca więcej wody będzie się bardziej trzęsła niż ta, która ma jej mniej.
Przykładem galaretki jest zsiadłe mleko. Gdy jest dobrze ukiszone, mówi się o nim, że można je krajać nożem. Doskonale jednak zdajemy sobie sprawę, że między „kawałkiem” zsiadłego mleka a kawałkiem lodu ułamanego z bryły jest zasadnicza różnica. Dziura, która powstanie po wyjęciu łyżki ze zsiadłego mleka, po krótkim czasie sama się wyrówna; w danym więc przypadku mleko zachowuje się jak ciecz.
Inne galaretki: kisiele i budynie przygotowywane z proszków. Zresztą kisiel ma wiele wspólnego z galaretką owocową albo też, co może wydać się dziwne, z galaretą z nóżek. Zależy to od substancji, której użyto do wyrobu proszków na kisiel. Przeważnie zawierają one żelatynę, czyli rozgotowany kolagen. Kolagen przy gotowaniu przechodzi w glutynę. Otóż żelatyna i glutyna to prawie to samo, gdyż żelatyna składa się głównie z glutyny. Nie będzie więc wielkim grzechem, jeśli powiem, że tkanka łączna zawarta w mięsie żelatynowacieje przy gotowaniu albo też że nóżki tworzą galaretę dzięki zawartej w nich żelatynie.
Istnieją jednak proszki na owocowe kisiele czy też galaretki, które nie zawierają żelatyny, lecz produkt zwany pektyną. Pektyna powoduje tworzenie się galaretek owocowych, podobnie jak żelatyna jest przyczyną powstawania galaretek mięsnych. Nie wszystkie owoce posiadają te same ilości pektyny. Jest jej dużo w kwaśnych jabłkach, w agreście, w porzeczkach, w białej części skórki pomarańczowej, mało natomiast w truskawkach, słodkich jabłkach, malinach.
A więc krótko : galaretki pochodzenia zwierzęcego zawdzięczamy kolagenowi, roślinne zaś pektynie. Nie znaczy to jednak, że nie znamy innych produktów powodujących powstawanie galaretek. Otóż rozgotowany krochmal używany do usztywniania pościeli też jest galaretką, galaretowacieje również „woda z ryżu”, czyli wyługowana z niego skrobia.
Poza pektyną i krochmalem istnieje jeszcze inny produkt roślinny tworzący galaretki. Jest nim tak zwany agar−agar występujący w niektórych gatunkach krasnorostów, rosnących na Dalekim Wschodzie. Agar po malajsku znaczy galareta i rzeczywiście produkt ten ma niezwykłe zdolności jej tworzenia. Wystarczy rozpuścić 5 g agaru w litrze wody, czyli zaledwie 0,5%, aby otrzymać dość ścisłą galaretę.
Dlaczego roztwory pektyny, żelatyny lub skrobi galaretowacieją. Wiemy tylko tyle, że niezbędnym warunkiem powstania galarety jest istnienie roztworu koloidalnego. Lecz co powoduje, że roztwór ten staje się „sztywny” ?
Wyobraźmy sobie, że jakaś cząstka zawieszona w roztworze koloidalnym spotka się z inną cząstką i zlepi się z nią, jeszcze trzecią lub czwartą, niech wreszcie ten proces zachodzi w całej cieczy i wszystkie cząstki w niej zawieszone utworzą większe skupienia. Wynik takiego łączenia się cząstek może być dwojaki. W pierwszym przypadku tworzą się poszczególne duże skupienia, które nie łączą się ze sobą. Są one zbyt wielkie, aby pozostać w roztworze, więc oddzielają się od niego. Mamy wtedy do czynienia z rozpadnięciem się roztworu koloidalnego na dwie wyraźne części: na substancję poprzednio rozpuszczoną w roztworze oraz rozpuszczalnik.
Poszczególne cząstki roztworu koloidalnego sklejają się ze sobą i w końcu cała substancja zawarta w roztworze tworzy jeden kłębek, a raczej coś w rodzaju gąbki z niezliczonymi otworami. Mamy tu więc również do czynienia z oddzielaniem się substancji rozpuszczonej, ale nie wypada ona z roztworu, jak w przypadku pierwszym, lecz wchłania go w siebie, jak gąbka wsysająca wodę.
Galareta więc powstaje z roztworu koloidalnego w ten sposób, że wytrącony koloid zlepia się w masę gąbczastą. Między nitkami tej gąbki znajduje się jednak nie czysta woda, lecz w dalszym ciągu mamy tu do czynienia z roztworem koloidalnym, znacznie tylko uboższym w koloid.
Obserwując w jaki sposób „psują” się niektóre galaretki owocowe, można wyróżnić pewne etapy tego procesu. Najpierw zaczynają „się pocić”, występują na nich krople cieczy. Później to pocenie jest coraz silniejsze, galaretka zaczyna puszczać sok, wreszcie samej galarety zostaje już niewiele, natomiast soku − bardzo dużo.
Co się dzieje w tym przypadku ? Po prostu niektóre żele przy dłuższym staniu wydzielają część ośrodka rozpraszającego pod postacią osobnej fazy ciekłej. Zjawisko to nosi nazwę synerezy. Pospolitym przykładem synerezy jest wydzielanie się serwatki z kwaśnego mleka. Inaczej mówiąc z „gąbki” zaczyna wyciekać jej zawartość. Gąbka kurczy się coraz bardziej, a soku przybywa coraz więcej. Nie dziwi również fakt, że z galaretki wypływa sok, a nie czysta woda, wiadomo bowiem, że między stężałymi nitkami w dalszym ciągu znajduje się koloidalny, bardziej wodnisty roztwór.
Taką galaretkę da się uratować. Wystarczy ostrożnie podgrzać całość i dokładnie wymieszać sok z nie rozłożoną częścią, aby się z powrotem wszystko zestaliło.
Galareta powstawać może jedynie i wyłącznie z roztworu koloidalnego, ale nie każdy roztwór koloidalny musi się zamienić w galaretę. Dla przykładu omówię białko jaja kurzego. Wbrew mniemaniom nie jest to czyste białko, lecz jego roztwór, zawierający ponad 70% wody. Nie jest to jednak roztwór rzeczywisty, lecz koloidalny. Można z niego ubić pianę. Mamy tu zatem przykład roztworu koloidalnego zachowującego się zupełnie inaczej niż roztwór żelatyny lub pektyny. Białko jajeczne jednak potrafi zachować się w inny. Jeśli dodamy do niego znaczną ilość soli kuchennej, to zaczną z niego wypadać kłaczki. Utworzą one dość gęstą, zbitą masę, którą można odfiltrować od reszty pozostałego roztworu. Jeśli poszczególne cząstki koloidu zaczynają łączyć się ze sobą w większe cząstki, to istnieją wtedy dwie możliwości : albo zlepią się one ze sobą w pewnego rodzaju gąbkę, albo wypadną z roztworu. W przypadku kurzego białka obserwujemy przypadek drugi : wysalanie białka powoduje jego wypadanie z roztworu. Istnieje bardzo dużo roztworów koloidalnych, które można wysalać w ten sam sposób jak kurze białko.
Wysalanie − koagulacja zoli liofilowych na skutek zmniejszenia potencjału ξ cząstek koloidalnych, wywołanego dodaniem elektrolitu do roztworu koloidu. Białko jajka można wysuszyć. Utworzy ono wtedy kruchą masę, dającą się nawet sproszkować. Tego rodzaju jajko w proszku czy też proszek jajeczny bywa w sprzedaży. Jeśli takie wysuszone białko jajeczne dać do wody, to zacznie ono pęcznieć, by w końcu całkowicie się rozpuścić. Otrzymamy roztwór koloidalny, który niczym nie różni się od normalnego białka jajecznego. Podobnie zachowuje się klej lub żelatyna, pektyna i agar. Żelatynę można nabyć w postaci płatków, z których łatwo można przyrządzić galaretkę, i odwrotnie − z galaretki tej przez ostrożne suszenie można z powrotem uzyskać płatki żelatyny. Mamy tu więc wszędzie do czynienia ze zjawiskami odwracalnymi. Tak samo można postąpić z wysolonym białkiem jaja kurzego. Wystarczy je odmyć od soli, a rozpuści się w wodzie i utworzy z powrotem roztwór koloidalny.
Spróbujmy jednak ogrzać białko kurze do 70 oC. Wiemy, co się wtedy stanie : jajko ugotuje się „na twardo”. Tym razem nie nastąpiło oddzielenie się koloidu od roztworu, jak w przypadku wysolenia, lecz wszystko razem − koloid łącznie z roztworem utworzyły sztywną, jednorodną masę. Jednak ta usztywniona masa bynajmniej nie jest „twarda”, jak to się mylnie mówi w życiu codziennym. Ugotowane białko bardziej jest podobne do galarety niż do ciała stałego − „trzęsie się” nie gorzej od galarety z nóżek. I co nie mniej ważne − owe 70% wody, które były w ciekłym białku, pozostały w nim nadal. Nie ma jednak takiego sposobu, aby ugotowane białko jaja kurzego z powrotem przemienić w ciekły roztwór koloidalny. Przemiana, która tu nastąpiła, jest nieodwracalna. Przemiana ta nosi nazwę denaturacji. Jest to zmiana struktury białka, zachodząca bez rozerwania wiązań peptydowych, natomiast związana ze zniszczeniem wiązań wodorowych i disiarczkowych. Proces ten może być odwracalny lub nieodwracalny jak w tym przypadku. Prowadzi do zmiany własności białek, jak rozpuszczalność w punkcie izoelektrycznym, zmiana skręcalności optycznej, utrata własności biologicznych. Denaturację powodują czynniki fizyczne (temperatura, promieniowanie nadfioletowe) i chemiczne (kwasy, zasady, rozpuszczalniki organiczne, jak aceton, etanol).
Co to są farby olejne i jakie mają praktyczne działanie?
Ogólnie rzecz biorąc farba składa się z jednego lub kilku dokładnie sproszkowanych pigmentów zawieszonych w cieczy zwanej nośnikiem. Nośnik pozwala na rozprowadzenie pigmentu na powierzchni i tworzy warstwę, w której cząsteczki pigmentu są związane po wyschnięciu. Do naturalnych pigmentów zalicza się ochry - żółte, pomarańczowe, czerwone ziemie zawierające tlenek żelaza. Umbra zawdzięcza swój brązowy kolor zawartości tlenków żelaza i manganu. Pigmenty wytwarzane sztucznie to czerń węglowa(forma sadzy) oraz biele, powstające na bazie tlenków cynku, ołowiu i tytanu. Nośnik farby określa jej własności fizyczne. Rozróżnia się farby emulsyjne (pigmenty rozpuszczone są w wodzie; woda jest rozpuszczalnikiem) farby olejne, powstające często na bazie żywic syntetycznych, np. żywice poliuretanowe nadają powłoce farby dużą twardość i odporność na temperaturę. Zwykle farby olejne zawierają terpentynę lub benzynę lakową, służące jako rozpuszczalnik. Dodaje się też oleju schnącego(sojowego lub lnianego). Po nałożeniu farby reaguje on z tlenem, tworząc wytrzymałą warstwę tlenku. Niekiedy w celu przyspieszenia tego procesu dodaje się suszków. Do farb dodawane są również dyspergatory, zapobiegające osiadaniu pigmentu na dnie pojemnika.
Farby są zawiesinami pigmentów w spoiwie olejnym lub syntetycznym; emalie są zawiesinami pigmentów w spoiwie lakierowym; lakiery natomiast są roztworami koloidowymi nielotnych substancji powłokotwórczych(np. żywic, pochodnych celulozy, asfaltów) w rozpuszczalnikach organicznych. Substancjami powłokotwórcze tzw. spoiwa, łączące cząstki pigmentu i utrzymujące pigment w postaci zawiesiny, mające zdolność tworzenia na pokrytych powierzchniach cienkiej, przyczepnej do podłoża powłoki. Rozróżnia się następujące substancje powłokotwórcze: s. termoplastyczne (powłoka tworzy się wskutek odparowania rozpuszczalnika), s. termoutwardzalne i samoutleniające się (powłoka tworzy się w wyniku reakcji chemicznych pod wpływem podwyższonej temperatury i tlenu zawartego w powietrzu), s. chemoutwardzalne (reakcja zachodzi pomiędzy żywicami syntetycznymi i środkami utwardzającymi). Pigmenty to organiczne lub nieorganiczne, nierozpuszczalne w olejach, żywicach, w wodzie i rozpuszczalnikach organicznych. Nadają powłoce lakierowej barwę, kryją podłoże, podwyższają odporność powłoki na wodę oraz działanie promieni słonecznych, niektóre pasywują powierzchnie metalowe.
Dlaczego węgiel aktywny absorbuje wszystko?
Adsorbenty są to najczęściej ciała stałe o bardzo rozwiniętej powierzchni. Na powierzchnię czynną adsorbenta składają się również zawarte w nim różne pory i kanaliki. Zależnie od stopnia rozdrobnienia adsorbenta zwiększa się jego powierzchnia właściwa.
Węgiel aktywny - najlepszy produkowany z łupiny dzrzewa kokosowego, z pestek owocowych, drewna dębowego, bukowego. Wyjątkowo korzystne właściwości adsorpcyjne węgla aktywnego wiążą się z jego charakterem amfolitycznym. Dzięki temu posiada on zdolność adsorbowania zarówno jonów kwasowych jak i zasadowych (wytrząsanie z kwasami [zasadami] powoduje zmniejszenie w danym roztworze jonów wodorowych [wodorotlenowych]).
Fizyczną przyczyną adsorpcji jest dążenie cząsteczek dwubiegunowych (dipolowych) lub jonów do ośrodka o wyższej stałej dielektrycznej . dipol lub jon ze swym polem elektrycznym dąży do ośrodka o wyższej stałej dielektrycznej. Adsorpcja fizyczna odgrywa szczególną rolę zwłaszcza w przypadku adsorbentów stałych. Węgiel aktywny zanieczyszczony pewnymi domieszkami odznacza się dużą pojemnością adsorpcji. Np. węgiel kostny, otrzymywany przez suchą destylację kości, składa się głównie z fosforanu wapniowego i bardzo rozdrobnionego węgla poprzedzielanego fosforanem wapniowym. Występują w nim więc dwa ośrodki pochłaniające: przewodzący elektryczność węgiel i dielektryk - fosforan wapniowy. Dlatego węgiel jest adsorbentem uniwersalnym i pochłania prawie wszystkie substancje zanieczyszczające roztwory. Np. cząsteczka kwasu tłuszczowego podczas adsorpcji na węglu aktywnym ustawia się alkilem ku fosforanowi a grupą karboksylową ku węglowi i tkwi mocno w adsorbencie. Oprócz adsorpcji fizycznej zachodzi bardzo często adsorpcja chemiczna - reakcja chemiczna z adsorbentem, czyli chemisorpcja. Podczas adsorpcji tlenu na węglu aktywnym w podwyższonej temperaturze zachodzi reakcja prowadząca do powstania tlenku węgla (CO).
Praktyczne znaczenie adsorpcji jest wykorzystanie węgla aktywnego w pochłaniaczach masek gazowych. Gazy o wysokich masach cząsteczkowych, a tym samym o wysokich temperaturach wrzenia są łatwo i w dużych ilościach adsorbowane przez węgiel, natomiast gazy takie jak tlen i azot przechodzą swobodnie przez pochłaniacz. Pochłaniacz z węglem aktywnym nie chroni jednak przed CO, który ma stosunkowo niską temperaturę wrzenia.
Układy kapilarne w przyrodzie.
Zjawiska kapilarne (włosowate) to zjawiska wywołane ciśnieniem kapilarnym powstającym w wyniku działania napięcia powierzchniowego cieczy. Najczęściej występującym zjawiskiem kapilarnym jest różnica poziomów cieczy w naczyniu i zanurzonych w niej cienkich rurkach, wąskich szczelinach lub porach, ciecz dobrze zwilżająca ścianki wznosi się, zaś nie zwilżająca opada poniżej poziomu cieczy w naczyniu. Zjawisko kapilarne jest przyczyną wsiąkania cieczy w głąb materiałów porowatych, np. przesiąkania wody (wilgoci) przez mury.
Woda kapilarna jest to woda podziemna występująca w drobnych porach i szczelinach skalnych ponad zwierciadłem wód gruntowych; wznoszenie się wody kapilarnej zależy od wielkości porów i jest przejawem zjawisk kapilarnych; woda kapilarna nie bierze udziału w podziemnym krążeniu wód; ma ogromne znaczenie dla życia roślin.
Naczynia włosowate tzw. włośniczki są to najcieńsze i najmniejsze naczynia krwionośne lub limfatyczne o średnicy około 7-15![]()
; tworzą w tkankach gęstą sieć łączącą najwęższe tętniczki i żyły, dzięki nim zachodzi między komórkami a krwią wymiana substancji odżywczych; u kręgowców 3 podstawowe typy kapilar typu mięśniowego, trzewnego, zatokowego.
Układu kapilarne spotykane są wręcz na każdym kroku w życiu codziennym. Przykładem mogą być tutaj kapilary tworzone przez włókna tkanin ( pranie).
Smarowanie kapilarne np. w sprężarki używanych w gospodarstwach rolnych (automatyczne dojarki do mleka)
Flotacja a podobne zjawiska w przyrodzie i w technologii.
Flotacja jest to metoda rozdzielania lub wzbogacania w ośrodku wodnym rozdrobnionych kopalin użytecznych, wykorzystująca zjawisko różnej zwilżalności przez wodę ziarn różnych ciał stałych. Flotację prowadzi się we flotownikach, w których następuje intensywne mieszanie rozdrobnionej kopaliny z wodą z dodatkiem odczynników flotacyjnych(pianotwórczych) i wytworzenie piany unoszącej się na powierzchni wody; ziarna składników użytecznych o małej zwilżalności przyczepiają się do pęcherzyków piany i unoszone są do odstojników, natomiast ziarna łatwo zwilżalne opadają na dno flotownika. Flotacja umożliwia 20-, 30- krotne zwiększenie zawartości składnika użytecznego w koncentracie w porównaniu z kopaliną; proces flotacji powtarza się zazwyczaj kilkakrotnie.
Flotacja i rozdzielenie składników metodą pianową wykorzystuje zjawisko adsorpcji. Na granicy faz roztwór-powietrze gromadzą się substancje powierzchniowo czynne obniżające napięcie powierzchniowe. W odpowiednich warunkach tworzą one pianę. Najtrwalszą pianę dają przy tym substancje, które wywołują największe obniżenie napięcia powierzchniowego. Jeżeli przez roztwór zawierający składniki powierzchniowo czynne przepuścimy strumień powietrza to tworzącą się na powierzchni roztworu pianę można usunąć odpowiednim przelewem. Okazało się, że na tej drodze można rozdzielić składniki, różniące się zdolnością obniżania napięcia powierzchniowego. Gdy w takiej mieszaninie wyczerpie się zapas substancji bardziej obniżającej napięcie powierzchniowe, wtedy po odpowiednim zwiększeniu dopływu powietrza (często pod ciśnieniem) w przepływającej przelewem pianie pojawi się następny składnik o mniejszej zdolności obniżania napięcia powierzchniowego.
Przykładem flotacji może być np. oczyszczanie rud miedzianych od piasku, ich powierzchnie składają się z różnych atomów, czyli zależy nam na przeprowadzeniu tych związków w związki o różnych powinowadztwach do wody (hydrofobowe i hydrofilowe). Cząsteczki hydrofobowe przyczepiają się do baniek wytworzonej piany.
Tworzenie pian wykorzystuje się również w neutralizacji wszelkich zanieczyszczeń (np. paliwa), niebezpiecznych dla bezpieczeństwa i ze względów ekologicznych.
W jakich warunkach wata mineralna będzie dobrym izolatorem?
Wata z wełny mineralnej, dzięki swej sprężystości sama dostosowuje się do kształtu konstrukcji ocieplanych powierzchni, jednocześnie nie obciążając ich zbytnio. Zapewnia izolację cieplną i akustyczną.
Dlaczego gąbka nasiąka wodą, będąc w kontakcie z wilgotnym powietrzem?
![]()
Prężność pary cieczy lub ciała stałego w przypadku powierzchni wklęsłych lub wypukłych jest określona równaniem Kelvina :
gdzie : p − prężność pary nad kroplą cieczy ( lub kryształkiem kulistym ) o promieniu r, pO − prężność pary nad powierzchnią płaską ( r = ∞ ), γ − napięcie powierzchniowe cieczy ( lub ciała stałego ), M − masa molowa rozpatrywanej substancji, d − jej gęstość.
Prawidłowa interpretacja równania Kelvina wymaga założenia, że w przypadku powierzchni wypukłych r > 0, w przypadku wklęsłych r < 0. Wynika stąd, że dla r > 0, p > pO i na odwrót, dla r < 0, p < pO. Ten stan rzeczy wydaje się zrozumiały, zważywszy, że w przypadku powierzchni wypukłych cząsteczka znajdująca się na powierzchni związana jest siłami przyciągania z mniejszą liczbą cząsteczek danej substancji skondensowanej niż w przypadku powierzchni płaskiej ( na odwrót w przypadku powierzchni wklęsłych ).
Powyższa zależność pomiędzy prężnością pary nad powierzchnią wypukłą lub wklęsłą, a jej promieniem krzywizny r wyjaśnia m.in. zjawisko kondensacji kapilarnej polegające na łatwiejszym (.tj. w temperaturze wyższej ) skraplaniu się pary nad powierzchniami wklęsłymi, o bardzo małym promieniu krzywizny, aniżeli nad powierzchniami płaskimi i na odwrót − trudniejszym wyparowywaniu cieczy z powierzchni o takim kształcie ( dlatego suszenie ciał porowatych wymaga ogrzewania powyżej temperatury wrzenia cieczy, którą nasiąknięte jest dane ciało ). Zjawisko łatwiejszej kondensacji na powierzchniach wklęsłych wyjaśnia również, dlaczego adsorpcja par zachodzi najłatwiej na adsorbentach o bardzo małej (np. rzędu kilku nanometrów ) średnicy porów. Ponieważ przy homogenicznej kondensacji pary muszą utworzyć się najpierw zarodki cieczy o kształcie w przybliżeniu kulistym, a prężność pary nad powierzchniami kulistymi zwłaszcza o bardzo małym promieniu krzywizny, jest znacznie większa niż nad powierzchniami płaskimi, nic więc dziwnego, że kondensacja pary nasyconej napotyka niekiedy na znaczne trudności i wymaga nieraz bardzo dużego stopnia przesycenia ( tj. znacznego obniżenia temperatury poniżej temperatury wrzenia ).
ADSORPCJA
Dlaczego torf trzyma wilgoć?
Torf jest skałą osadową, produktem częściowego przetworzenia substancji roślinnej (bagiennej) butwiejącej w warunkach dużej wilgotności; zawiera około60% węgla: stosowny po wysuszeniu jako paliwo, kompost, ściółka, surowiec leczniczy (borowina). Torf ma strukturę porowatą, kapilarną stąd j/w.
Dlaczego w Krakowie są często mgły?
AEROZOLE - Przez zdyspergowanie substancji stałej lub cieczy w gazie otrzymuje się aerozol; jeżeli rozproszeniu ulega substancja stała powstają dymy, jeżeli zaś ciecz otrzymuje się mgły.
Dym powstaje na ogół jako wynik rozdrobnienia ciał stałych w gazie, natomiast mgły jako wynik kondensacji cieczy w przesyconych parach. Dymy można również otrzymać jako wynik reakcji chemicznej, np. NH3 + HCl * NH4Cl.
Rozmiary cząstek w aerozolach wahają się w szerokich granicach od 10 A do 1000 A; np. cząstki dymy tytoniowego posiadają wymiary w granicach od 2 A do 10 A, zaś kropelki wody w chmurach posiadają średnice od 40 A do 100 A. Właściwości aerozoli zależą w dużej mierze od rozmiarów cząstek substancji rozproszonej; cząstki aerozolu o średnicach mniejszych od 10 A wykonują ruchy Browna, zaś cząstki aerozoli o rozmiarach większych od 10 A osiadają pod wpływem siły ciężkości. W wyniku tych procesów następuje szybkie zlepianie cząstek substancji rozproszonej. Ładunki elektryczne na powierzchni cząstek aerozolu powodują spadek jego trwałości; ładunki jednoimienne powodują osadzanie się cząstek aerozolu, np. na ścianach naczynia, natomiast ładunki różnoimienne zwiększają szybkość zlepiania się. Obecność w aerozolu substancji powierzchniowo czynnych tylko w nieznaczny sposób zmienia trwałość aerozolu.
Właściwości optyczne aerozoli uwarunkowane są między innymi średnicą cząstek substancji rozproszonej, np. dymy wykazują właściwości maskujące. Przy małych średnicach cząstek substancji rozproszonej, aerozol rozprasza światło zgodnie z teorią Rayleigha; ze wzrostem średnicy cząstek aerozolu oprócz rozpraszania światła zachodzi także jego odbicie, co prowadzi do odchyleń od teorii Rayleigha, a aerozol staje się nieprzezroczysty.
Dlaczego komórki żywych organizmów zmieniają swoją objętość?
Człowiek zawiera ok. 65% wody. Jeśli tej wody u nas nie widać, to tylko dlatego, że stanowi roztwór koloidalny rozmaitych substancji, przede wszystkim białek.. Wcale nie jest przypadkiem, że życie rozwinęło się nie w roztworach rzeczywistych i nie w ciałach stałych, lecz właśnie w roztworach koloidalnych. Protoplazma, z której zbudowane są wszystkie komórki, potrafi wchłaniać wodę i rozpuszczone w niej substancje, potrafi pęcznieć lub wiotczeć głównie dlatego, że jest w stanie koloidalnym. Obecnie termin ten jeżeli jest używany to ma znaczenie tylko ogólne. Część protoplazmy znajdująca sięna zewnątrz jądra nazywana jest cytoplazmą, a zawarta w nim nukleoplazmą. Komórki żywych organizmów charakteryzują się nie tylko różnorodnością rozmiarów, ale również kształtów. Najbardziej pierwotnym jest kształt kulisty, ale w złożonym organizmie może on istnieć tylko wtedy, gdy tego typu komórki występują w otoczeniu płynów i nie powodują żadnego wzajemnego ucisku. Ze wzrostem średnicy kuli jej powierzchnia rośnie wolniej niż objętość. Objętość jądra jest zależna od zawartego w nim materiału genetycznego. Wzrost objętości komórki jest ściśle uzależniony od zachowania właściwych odległości wymiany związków chemicznych między jądrem a cytoplazmą. Błona komórkowa ma budowę mozaikową, czego przejawem jest jej półprzepuszczalność.woda oraz małe cząsteczki mogą swobodnie dyfundować przez błonę, podczas gdy duże cząsteczki przez nią nie przenikają( mogą one dostać się do wnętrza za pomocą specjalnych przenośników).
Komórka roślinna ma zdolnośc do pobierania i oddawania wody. Podstawą tych zjawisk jest:
Dyfuzja - cząsteczki wszystkich substancji znajdującą się w nieustannym ruchu, który uwarunkowany jest energią kinetyczną, a ta z kolei wzrasta ze wzrostem temperatury. Dyfuzja polega na przemieszczaniu się cząsteczek od stężenia większego do mniejszego
Pęcznienie - czyli imbibicja, polega na hydratacji koloidów. Pęcznieniu ulegaja substancje, posiadające grupy hydrofilowe (
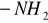
,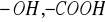
), przyciągające cząsteczki wody, wiążąc je wiązaniami wodorowymi, dzięki czemu tworzą się otoczki wodne. Niektóre koloidy mają ograniczoną zdolność pęcznienia (celuloza, skrobia), inne - mogą pęcznieć nieograniczenie i stopniowo rozpływać się (niektóre białka). Pęcznienie nie polega na wypełnieniu przez wodę pustych przestworów kapilarnych w ciałach porowatych (np. w kawałku kredy), które zwiększają tylko swą masę, nie zmieniając równocześnie objętości. Cząsteczki wody dyfundując pomiędzy micele koloidu rozsuwają je - zwiększają więc masę i objętość. Drogą pęcznienia wodę pobierają ściany komórkowe (zbudowane z celulozy, pektyn, hemiceluloz), białka wchodzące w skład protoplastu, ziarna skrobi, niektóre wielocukry, substancje zapasowe.Osmoza - zjawisko przenikania przez błonę półprzenikalną jedynie cząstek rozpuszczalnika, a nie substancji rozpuszczonej.
Jeżeli komórkę roślinną umieści się w czystej wodzie to zachodzić będzie osmoza, czyli dyfuzja wody przez selektywną warstwę cytoplazmy do wakuoli. Siłę z jaką woda wnikać nędzie do komórki nazyamy siłą ssącą komórki. W miarę wnikania wody wakuola powiększa się, czemu towarzyszy rozciąganie woreczka cytoplazmatycznego, a także ścian komórkowych. W rozciągnętej ścianie komórkowej pojawiają się siły sprężyste, przeciwdziałające dalszemu rozciąganiu. W końcu dochodzi do stanu równowagi, w którym siły osmotyczne są równoważone sprężystością ścian komórkowych. Komórka znajduje się w stanie pełnej turgoscencji, a ciśnienie wywierane przez zawartość komórki na jej ściany nazywa się ciśnieniem turgorowym.
Błony komórkowe - tzon błony stanowi dwucząteczkowa warstwa fosfolipidów. Hydrofobowe łańcuchy kwasów tłuszczowych obu warstw skierowane są ku sobie, natomiast hydrofilowe składniki fosfolipidów (glicerol, reszta fosforanowa i cholina) skierowane są do warstwy wodnej. W żywej błonie integralne białka globularne przemieszczają się w macierzy fosfolipidowej, nie zmieniając stopnia zanurzenia. Błony biologiczne mają cechy błony półprzepuszczalnej, przez którą łatwo przenika rozpuszczalnik, a wybiórczo substancje w niej zawarte, co ma istotne znaczenie w stosunku do błony komórkowej i błon zewnętrznych, które dzielą komórkę na przedziały. W poszczególnych przedziałach przebiegają zróżnicowane procesy biochemiczne.
Dlaczego układy koloidalne są lepkie?
Współczynnik lepkości koloidów - w przeciwieństwie do współczynnika lepkości gazów i cieczy - w stałej temperaturze nie jest wielkością stałą, zależy od wielkości działającej siły stycznej(zwykle maleje ze wzrostem działania siły). Zmienność ![]()
spowodowana tym, że cząsteczki koloidowe tworzą ze sobą lub rozpuszczalnikiem powiązane z różną siłą agregaty, które rozrywają się pod wpływem działającej siły stycznej. Lepkość koloidów liofilowych jest różna od liofobowych. Lepkość zolów liofobowych niewiele różni się od lepkości rozpuszczalnika, ponieważ stężenie roztworów koloidów liofobowych zwykle jest małe. Z kolei lepkość roztworów liofilowych, których stężenie może być duże różni się znacznie od lepkości rozpuszczalnika. Lepkość koloidów jest związana z ładunkiem cząstek i ich potencjałem elektrokinetycznym. W miarę wzrostu potencjału elektrokinetycznego rośnie objętość cząstek koloidowych otaczających się jonami przeciwnego znaku, co ostatecznie powoduje wzrost lepkości. W punkcie izoelektrycznym koloidy wykazują minimum lepkości. W tym punkcie potencjał elektrokinetyczny cząstek koloidowych jest równy zeru, czyli cząstki najsłabiej na siebie oddziaływują i lepkość roztworu osiąga minimum. Lepkość koloidów zmienia się ze zmianą pH.
Dlaczego mleko jest białe - nieprzezroczyste?
Emulsje są mieszaninami utworzonymi z co najmniej dwóch mieszających się ze sobą cieczy, z których jedna jest rozproszona w drugiej, stanowiącej ośrodek rozpraszający. Zemulgowane kropelki cieczy mają zazwyczaj większe rozmiary od rozmiarów cząsteczek koloidalnych. Emulsja na ogół jest układem nietrwałym, ponieważ małe kropelki cieczy dążą do zlewania się w duże krople, uzyskując przez to mniejszą swobodną energię powierzchniową. Emulgatory pozwalają na przedłużenie trwałości emulsji.
Mleko układ koloidalny zawdzięcza swój biały kolor rozproszeniu światła. Biały kolor powstaje w efekcie zmieszania wszystkich barw.
Rozpraszanie światła - zmiana kierunku rozchodzenia się światła będąca efektem oddziaływania fali świetlnej z ośrodkiem (czyli rozpraszanie fal); wtórne fale świetlne rozproszone dają wrażenie świecenia ośrodka; rozróżnia się rozpraszanie światła reyleighowskie (rozproszenie bez zmiany długości fali) oraz ramanowskie (połączone ze zmianą długości fali); w mętnych ośrodkach (z zawiesiną) występuje silny efekt rozpraszanie światła (efekt Tyndalla); największemu rozproszeniu ulega niebieskofioletowa (krótkofalowa) część widma, co jest źródłem niebieskiego koloru nieba.
Rozpraszanie fal - zjawisko powstawania w ośrodku, w którym rozchodzi się fala pierwotna niespójnych z nią fal wtórnych, rozchodzących się w różnych kierunkach; rozpraszanie fal jest spowodowane niejednorodnością ośrodka (np. fluktuacjami gęstości) oraz różnego rodzaju przeszkodami (zawiesiny, granice z innymi ośrodkami), powstawanie tego zjawiska można wyjaśnić przy pomocy zasady Huygensa; jeżeli niejednorodności ośrodka są rozmieszczone w sposób stały w czasie i regularny to występujące w nim rozproszenie fal ma charakter selektywny - na skutek interferencji fali pierwotnej i fal wtórnych w pewnych kierunkach następuje wzmocnienie, w innych wygaszenie)
Dlaczego pewne reakcje są wybuchowe?
Reakcją wybuchową nazywamy reakcję chemiczną, której towarzyszy wydzielenie znacznej ilości ciepła i powstanie znacznych ilości gazowych produktów. Wiele reakcji typu reakcji spalania przebiega w odpowiednich warunkach bardzo gwałtownie w sposób wybuchowy. W warunkach wybuchu szybkość reakcji wzrasta ustawicznie i maleje dopiero na skutek wyczerpania w krótkim czasie reagujących substratów. Według teorii reakcji wybuchowych podanej przez van`t Hoffa przyczyną wybuchu byłby ciągły wzrost temperatury reagującej mieszaniny spowodowany tym, że reakcja jest silnie egzotermiczna, a odprowadzenie ciepła niedostateczne. Jednak okazało się, że ta teoria nie obejmowała całości zjawisk reakcji wybuchowych, ponieważ reakcje mogą zachodzić wybuchowo nawet w warunkach izotermicznych. Później wskazywano na łańcuchowy przebieg reakcji, a szczególnie ten w którym dochodzi do rozgałęzienia łańcuchów reakcyjnych. Dodatkowo przy tym mamy do czynienia ze wzrostem stężenia nośników reakcji (szybkość powstawania nowych nośników jest większa od szybkości ich ubywania na skutek przerywania łańcuchów). Co z kolei pociąga za sobą wzrost szybkości reakcji, a to jest powodem jej wybuchowego przebiegu. Najczęściej mamy do czynienia z reakcjami o rozgałęzionych łańcuchach, w których szybkość powstawania nowych nośników jest proporcjonalna do chwilowego ich stężenia. Szybkość zaniku nośników również w sposób liniowy zależy od stężenia, czyli przerwanie łańcuchów zachodzi przez oddziaływanie nośników ze ściankami reaktora, lub z cząsteczkami fazy gazowej, pomija się natomiast reakcję między nośnikami.
Na reakcje wybuchowe mogą mieć wpływ takie czynniki jak: zmiany ciśnienia, temperatury, powierzchni wewnętrznej reaktora, które to mogą spowodować nagły wybuch lub uniemożliwić wybuchowy przebieg reakcji..
Jeżeli rozpatruje się wpływ ciśnienia na zachodzenie reakcji wybuchowej istnieją charakterystyczne trzy granice ciśnieniowe; o wybuchu mówi się w przypadku ciśnienia o wartości pośredniej między dwoma pierwszymi granicami oraz po przekroczeniu trzeciej. Istnienie dolnej i górnej granicy wybuchu oraz zależność ich od temperatury tworząca tzw. półwysep zapłonu są charakterystyczne dla rozgałęzionych reakcji.
Pierwsza graniczna wartość zmniejsza się ze wzrostem rozmiarów reaktora oraz po dodaniu obojętnych gazów. Druga wartość graniczna rośnie ze wzrostem temperatury, zmniejsza się po dodaniu obojętnych gazów i w mniejszym stopniu zależy od rozmiarów i stanu powierzchni ścianek reaktora. Trzecia granica zmniejsza się ze wzrostem średnicy reaktora i przy dodawaniu obojętnych gazów.
Ciśnieniowe granice wybuchu i ich położenie wiążą się z procesami przerywania łańcuchów. Pod ciśnieniami niższymi od dolnej granicy szybkość przerywania jest większa niż szybkość rozgałęziania łańcuchów wynika to z łatwości z jaką nośniki docierają do ścianek. Przy wyższych ciśnieniach szybkość przerywania łańcuchów na skutek zderzeń międzycząsteczkowych w objętości gazu przewyższa rozgałęzienia. Istnienie trzeciej granicy związane jest ze zwiększeniem prawdopodobieństwa rozgałęzień w innych reakcjach niż zachodzące w niskich ciśnieniach. Oprócz tego bardzo duże szybkości reakcji w tym obszarze mogą doprowadzić do wybuchu termicznego.
Czym się różni bomba klasyczna od atomowej?
Klasyczna - grupę materiałów wybuchowych kruszących stanowią dynamity, zawierają powyżej 10% nitrogliceryny i innych ciekłych azotanów organicznych zastępujących częściowo nitroglicerynę w celu obniżenia temperatury krzepnięcia. Ładunki wybuchowe uzyskuje się przez nasączenie tymi substancjami tzw. absorbentów: ziemi okrzemkowej lub innych substancji mineralnych, bawełny kolodionowej, mączki drzewnej, węgla drzewnego. W celu ułatwienia spalania absorbenta dodaje się nośniki tlenu, azotany: sodu, potasu, amonu. Dynamity wrażliwe są na uderzenie, tarcie i podwyższoną temperaturę. Do zainicjowania eksplozji stosuje się spłonki lub detonatory.
Atomowa (jądrowa) - bron wykorzystująca energię uzyskaną podczas łańcuchowej reakcji rozszczepienia jąder ciężkich pierwiastków (izotopy uranu i plutonu) lub reakcji termojądrowej. Reakcje łańcuchowe, przebiegające bardzo szybko i prowadzące do gwałtownego wybuchu uwalniającego ilości energii miliony razy większe niż to ma miejsce w eksplozjach zwykłych materiałów wybuchowych. Łańcuchowy wybuch atomowy może odbyć się tylko w preparacie czystego uranu ![]()
. W zbyt małych próbkach czystego uranu eksplozja nie występuje, gdyż powstające neutrony wybiegają poza obręb metalu zanim zdążą trafić na jakieś jądro atomowe. Do wywołania eksplozji konieczne jest przekroczenie określonej masy użytej próbki uranu. Jeżeli ten warunek zostanie spełniony wybuch następuje natychmiastowo. Wybuch następuje po zbliżeniu do siebie małych kawałków czystego uranu, których wspólna masa przekracza masę krytyczną. Reakcja łańcuchowa może być zapoczątkowana przez neutrony wyzwolone w atmosferze działaniem promieniowania kosmicznego. Istnieje możliwość przeprowadzenia reakcji łańcuchowej uranu w sposób powolny i kontrolowany w reaktorze atomowym i tym samym wykorzystania wydzielonej energii do celów przemysłowych.
W trakcie reakcji jądrowych wyzwalane są neutrony, z których część jest pochłaniana przez jądra nierozszczepialne atomów domieszek, część może uciec z materiału rozszczepialnego, a pozostałe inicjują kolejne akty rozszczepienia. Ucieczce neutronów zapobiega się przez zastosowanie odpowiednio dużej masy materiału rozszczepialnego oraz osłanianie obszaru reakcji reflektorem odbijającym neutrony. W reaktorach jądrowych w celu zmniejszenia niebezpiecznie dużej liczby neutronów stosuje się pręty kontrolne, pochłaniające neutrony (pręty z kadmu, boru, hafnu)
Jak powinno wyglądać ekonomiczne palenia w piecu węglowym?
Ekonomiczne palenie w piecu węglowym powinno polegać na wystarczającym dopływie tlenu i odpływie spalin.
Dlaczego mokre drewno trudno się pali?
Nadmiar wody utrudnia palenie
Dlaczego temperatura ciała utrzymywana jest na stałym poziomie?
Przemiany energetyczne w komórkach powodują, że temperatura organizmu może być wyższa od temperatury otoczenia. Różnica temperatur między otoczeniem a powierzchnią ciała powoduje ubytek ciepła i konieczność jego ciągłego wytwarzania. tylko niektóre zwierzęta potrafią stale utrzymywać znacznie wyższą temperaturę wnętrza ciała bez względu na temperaturę otoczenia, czyli potrafią regulować ciepłotę ciała. Cykl zwierząt zmiennocieplnych zwykle ogranicza się do jednego sezonu albo wykazuje okresowe wahania i wtedy aktywność życiowa ogranicza się do pór roku o korzystnej temperaturze.
Gady i ptaki zdolne są do utrzymywania stałej i stosunkowo wysokiej temperatury wnętrza ciała bez względu na zmiany temperatury otoczenia. Stałocieplnośc uwarunkowana jest zdolnością do zmiany ilości ciepła wytwarzanego przez organizm i ilości ciepła rozpraszanego. Regulacja fizjologiczna pozwala na zachowanie wysokiej temperatury wewnętrznej i ciągłej aktywności, która z kolei gwarantuje zwierzętom wysokie tempo metabolizmu. Podstawą utrzymania stałej temperatury ciała jest zachowanie równowagi pomiędzy ciepłem traconym a wytwarzanym. Wytwarzanie ciepła odbywa się głównie w procesach metabolicznych gł. oddychanie. Dużo ciepła produkują tez niektóre organy jak wątroba i mózg. W ten sposób powstaje ok. 40% ciepła. Reszta przypada na pracę mięśni. Ciepło tracone jest głównie przez powierzchnię ciała oraz parowanie powierzchni błon śluzowych układu oddechowego i jamy gębowej. Gdy temperatura skóry jest wyższa od temperatury otoczenia, ciepło tracone gł. przez promieniowanie i przewodzenie(u człowieka utrata ok. 4/5 całej ilości ciepła. Ogrzana powierzchnia oddaje ciepło w postaci promieni podczerwonych. Utrata ciepła przez przewodzenie polega na jego oddawaniu cząsteczkom otaczającego środowiska. Regulacja oddawania ciepła przez promieniowanie i przewodzenie polega na zmianie ukrwienia skóry. Ważna jest izolacja w postaci tkanki tłuszczowej i struktur takich jak: sierść, włosy. Pocenie się jest u wielu zwierząt ważnym mechanizmem regulującym bilans cieplny organizmu. Wysokie ciepło parowania wody powoduje silne ochłodzenie skóry i odbiera ciepło z krwi. Intensywność parowania zależy od wilgotności i ruch utaczającego powietrza. Im mniejsza wilgotność tym większe parowanie, a ruch powietrza sprzyja oddawaniu ciepła.
Dlaczego w czasie choroby gorączkujemy i czy zawsze musimy obniżać gorączkę?
Gorączkę stwierdza się w momencie podwyższenia temperatury ciała powyżej 38![]()
. Stany gorączkowe mogą sygnalizować lekkie zaburzenai czynności organizmu (przeziębienie, przegrzanie, reakcja alergiczna) albo poważniejsze choroby poszczególnych narządów czy układów albo zakażenia ogólnoustrojowe. Podwyższona temperatura jest zazwyczaj reakcją organizmu na wzmożoną przemianę materii, uszkodzenie tkanek lub pojawienie się substancji wyzwalających odczyn gorączkowy (pirogennych) w wyniku podrażnienia ośrodka termoregulacyjnego w podwzgórzu mózgowia. długotrwała gorączka jest szkodliwa dla organizmu. Człowiek wyrzymuje temperaturę podwyższoną do 42 -43![]()
, powyżej następuje denaturacja białek w komórkach. Długotrwała gorączka wyniszcza organizm i może doprowadzić do niewydolności układu krążenia.
Stan zapalny jest na ogół reakcją miejscową, to zdarza się, że cały organizm objęty jest zapaleniem. Gorączka jest częstym objawem klinicznym rozległego stanu zapalnego. Białe krwinki uwalniają pewne cytokiny( białka regulatorowe) zwane pirogenami, które sterują działaniem „termostatu ustrojowego” w podwzgórzu, co w efekcie powoduje gorączkę. Najsilniejszym białkiem z tej grupy jest interleukina - 1, uwalniany przez makrofagi. W regulacji temperatury ciała biorą udział również prostaglandyny. Podwyższona temperatura ciała zakłóca aktywność wirusową i zmniejsza ilość żelaza krążącego we krwi. W ten sposób zapotrzebowanie mikroorganizmów chorobotwórczych na żelazo nie jest zaspokajane, a na tle niedoboru żelaza metabolizm ich może ulec zaburzeniom. Gorączka stymuluje produkcję niektórych limfocytów (T) i przeciwciał. Krótkotrwałe stany gorączkowe mogą więc przyspieszyć remisję choroby wywołanej inwazją patogenów. Jedną z zasadniczych funkcji reakcji zapalnej jest wzmożona fagocytoza (trawienie bakterii innych organizmów patogennych).
U ssaków zmiany temperatury rejestrowane są przez wolne zakończenia nerwowe i wyspecjalizowane receptory w skórze i w języku. Termoreceptory podwzgórza wykrywają wewnętrzne zmiany temperatury oraz otrzymują i integrują informacje docierające do termoreceptorów na powierzchni ciała. W podwzgórzu inicjowane są homeostatyczne procesy regulacyjne, które zapewniają utrzymanie stałej temperatury ciała
Podwyższenie temperatury o 1![]()
zmniejsza lepkość około 2%. Lepkość cieczy, a zwłaszcza płynów fizjologicznych ma duże znaczenie w wielu procesach zachodzących w organizmach żywych.
Przepływ krwi przez naczynia włosowate uzależniony jest od lepkości a ta z kolei zmienia się wraz z temperaturą, dlatego w stanie gorączkowym lepkość krwi obniża się około 2% na każdy stopień przyrostu temperatury
Dlaczego latarka świeci - procesy w ogniwie.
Jako źródła światła stosuje się przeważnie żarówki, świetlówki (lampy fluorescencyjne), rtęcówki, (lampy rtęciowe) i sodówki.
Żarnik żarówki jest wykonany ze skręconego śrubowo w pojedyńczą lub podwójną skrętkę drutu wolframowego. Przepływający prąd przez żarnik rozgrzewa go. Skuteczność świetlna żarówki wzrasta wraz ze wrostem mocy, a przy jednakowych mocach maleje nieco ze wzrostem napięcia. Trwałość żarówki zależy w dużym stopniu od wartości napięcia zasilającego. Podwyższenie lub obniżenie napięcia o 5% w stosunku do napięcia znamionowego odpowiednio zmniejsza lub zwiększa dwukrotnie trwałość żarówki. Jednocześnie strumień świetlny emitowany przez żarówkę zwiększa się lub zmniejsza o kilkanaście procent.
Dlaczego dachy blaszane ulegają dziurawieniu?
Rdzewienie konstrukcji stalowych w warunkach wilgotnej atmosfery jest spowodowane obecnością kropel skondensowanej pary wodnej lub roztworu soli na powierzchni żelaza, które są bardziej napowietrzane na końcach niż w środku. Na obwodzie takich kropel powstają obszary katodowe, w środku obszary anodowe, w których żelazo rozpuszcza się. Produkt reakcji (rdza) osadza się pierścieniowo w obszarze katodowym.
Dlaczego w zimie są problemy z uruchomieniem samochodu?
W niskiej temperaturze zwiększa się tarcie elementów. Niska temperatura wpływa również na gorszą jakość mieszanki powietrznej.
Dlaczego przewód elektryczny kopie?
Dlaczego zwarcie bateryjki powoduje jej zniszczenie?
Ogniwa te działają zamieniając energię wiązań chemicznych na energię prądu elektrycznego. Elektrolit to substancja, której część cząsteczek dysocjuje tworząc grupy naładowanych atomów - jonów. Jony są przyciągane przez elektrody. Gdy elektrody połączy się w obwodzie popłynie prąd elektryczny.
Łączenie ogniw: ogniwa galwaniczne to źródła energii jednorazowego użytku. Ogniwa wtórne to akumulatory - w celu naładowania przez wyczerpane ogniwo przepuszcza się prąd elektryczny, który powoduje zmiany właściwości chemicznych substancji. Energia elektryczna dostarczana ogniwu podczas ładowania jest w nim akumulowana w postaci energii chemicznej.
Ogniwo Leclanchego zbudowane jest z cynkowej obudowy, będącej jednocześnie katodą oraz znajdującego się wewnątrz pręta węglowego (anody). Elektrolitem jest pasta - chlorek amonowy (salmiak). Podczas pracy ogniwa na pręcie wydziela się wodór, który należy usunąć aby nie obniżył sprawności urządzenia - dodaje się do elektrolitu depolaryzatora ![]()
, wiążącego wodór.
Szeregowe - (+ z -) - otrzymuje się baterie o napięciu źródłowym poszczególnych ogniw . rezystancja wewnętrzna tej baterii jest równa sumie rezystancji poszczególnych ogniw. W baterii tej łączy się zwykle ogniwa tego samego typu i wielkości; jeżeli jednak zachodzi potrzeba połączenia szeregowego dwóch różnych ogniw(lub baterii) to można to połączenie wykonać, pamiętając, że przy połączeniu szeregowym dopuszczalna obciążalność prądowa jest równa dopuszczalnej obciążalności najsłabszego ogniwa.
Równoległe - ogniwa baterii muszą mieć jednakową wartość napięcia źródłowego, w przeciwnym razie ogniwo o niższym napięciu źródłowym zamiast oddawać do obwodu energię elektryczną będzie ją pobierało z ogniw o wyższym napięciu źródłowym. Przypadkowe pomylenie biegunów jednego z łączonych ogniw lub nawet całej baterii może spowodować zniszczenie całego ogniwa lub nawet całej baterii, podczas gdy taka pomyłka przy łączeniu szeregowym nie pociąga za sobą żadnych szkodliwych następstw. Rezystancja wewnętrzna baterii połączonych równolegle jest mniejsza od rezystancji jednego ogniwa, a obciążalność jest o tyle samo większa.
Dlaczego okręty narażone są na silną korozję?
W zależności od środowiska korozyjnego, w którym znajduje się dany metal lub stop, rozróżnai się następujące rodzaje korozji:
Atmosferyczna
Gazowa - w suchych, przeważnie gorących gazach
Wodna np. w wodzie morskiej lub rzecznej
Ziemna np. w glebie
W zależności od mechanizmu procesów korozyjnych rozróżnia się:
Korozję elektrochemiczną zachodzącą w środowiskach elektrolitów, a więc w wodnych roztworach jakimi są woda słodka i morska, w wilgotnych gazach i glebach
Korozję chemiczną zachodząca w gazach suchych i cieczach nie przewodzących (nieelektrolitach) np. substancje organiczne.
W zależności od charakteru zniszczenia korozyjnego rozróżnia się:
Korozję ogólną, która może być równomierna lub nierównomierna
Korozję miejscową np. plamową, punktową, wżerną (związana z obecnością agresywnych anionów w środowisku korozyjnym, głównie jonów chlorkowych. Zachodzi tutaj proces anodowy - aktywne roztwarzanie - zachodzi na bardzo małych obszarach, natomiast pozostałe części metalu znajdują się w stanie pasywnym. Korozji wżernej ulegaja stopy i metale pasywujące np. Al., Fe) , międzykrystaliczną, szczelinową
Korozja elektrochemiczna - gdy metal ma kontakt z elektrolitem, a więc przede wszystkim w roztworach wodnych. Wody rzeczne oraz jezior zawierają dostateczną ilość związków nieorganicznych, a wody morskie zawierają do 3% rozpuszczonych soli, czyli są dobrymi elektrolitami. W wyniku zetknięcia metalu z elektrolitem powstają lokalne mikroogniwa. Powierzchnia metalu nie jest jednolita w skali mikroskopowej. Metale maja mikrostrukture ziarnistą, krystaliczną, granice ziaren w stosunku do ich wnętrza mają strukturę mniej uporządkowaną. Energia granic ziaren jest wyższa niż samego ziarna, dlatego w zetknięciu z elektrolitem granice ziaren staja się obszarem anodowym, a obszar ziarna mający niższą energię staje się obszarem katodowym. W stopach jednofazowych, będących roztworami stałymi dodatkowym powodem niejednorodności są różnice stężeń składników między sąsiednimi ziarnami lub nawet w obrębie ziarna. W stopach wielofazowych sąsiadujące ze sobą ziarna różnych faz mają różne potencjały elektrodowe, co w zetknięciu z elektrolitem określa miejsca katodowe i anodowe powierzchni metalu. Oprócz niejednorodności mamy też do czynienia z występowaniem w metalu i stopach technicznych wtrąceń niemetalicznych, które mogą wywierać wpływ na przebieg reakcji elektrodowych. Makroogniwa występują, gdy zetkniemy dwa metale(stopy) różniące się stacjonarnym potencjałem elektrodowym i znajdujących się w środowisku elektrolitu - korozja kontaktowa. Makroogniwa różnią się od ogniw galwanicznych tym, że pracują jako krótkozwarte natychmiast po zetknięciu z elektrolitem. Zniszczenie metalu następuje zawsze w obszarze anodowym. Podczas pracy ogniwa korozyjnego w metalu przepływa prąd a bieguny ogniwa ulegają polaryzacji. Polaryzacja elektrod hamuje procesy katodowy i anodowy, czyli zahamowywuje proces korozyjny, czyli korzystne działanie. Jednak w korozji elektrochemicznej działają depolaryzatory (tlen z powietrza lub jony wodorowe). Proces korozji elektrochemicznej jest to elementarny proces anodowego utleniania metalu i katodowej redukcji depolaryzatora. Przepływ elektryczności: w metalu elektrony przemieszczają się z obszarów anodowych do katodowych, w elektrolicie następuje przenoszenieładunków elektrycznych przez jony. Proces anodowy i katodowy są silnie ze sobą związane.
Mikroogniwa stężeniowe powstają przez nierównomierne napowietrzanie elektrolitu. Rozproszony w elektrolicie tlen w miejscach o dużym stężeniu - dobrym napowietrzeniu - tworzy samorzutnie elektrodę tlenową, której potencjał jest dodatni, czyli staje się katodą w pewnym obszarze metalu. Inne obszary powierzchni w zetknięciu z mniej napowietrzonym roztworem mają niższy potencjał i są obszarem anodowym. Z tego typu zjawiskiem mamy do czynienia na powierzchni konstrukcji stalowej w miejscu, gdzie powietrze graniczy z wodnym środowiskiem korozyjnym w wodzie morskiej.
Czy akumulator można naładować takim samym akumulatorem sprawnym?
Akumulator jest to ogniwo galwaniczne lub zespół ogniw galwanicznych połączonych, w których po wyładowaniu tj. po przemianie zmagazynowanej w nich energii chemicznej w pobieraną z nich energię elektryczną; energię elektryczną można ponownie zmagazynować przez naładowanie. Akumulator ma tę własność, że gdy doprowadzić do niego energię elektryczną z zewnętrznego źródła prądu stałego, następuje odwrócenie przebiegu reakcji chemicznych i akumulator się regeneruje (ładowanie akumulatora).
Wyróżniamy akumulatory kwasowe i zasadowe:
Akumulator kwasowy (ołowiowy) - elektrodę (płytę) dodatnią stanowi dwutlenek ołowiu (
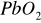
), elektrodę ujemną - czysty ołów w postaci gąbczastej. Płyty są wykonane z krat ołowianych, w których oczka wprasowano masę czynną złożoną z drobnych kryształków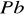
i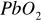
. Takie wykonanie płyt zwiększa ich powierzchnię czynną. Płyty są zanurzone w elektrolicie, którym jest roztwór wodny kwasu siarkowego. Podczas ładowania i wyładowania akumulatora przebiegają reakcje: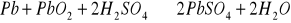
Akumulator zasadowy - niklowo - kadmowy, w którą masę czynną płyty dodatniej stanowi głównie wodorotlenek niklu, ujemną - kadm, a elektrolitem jest roztwór wodny wodorotlenku potasu. Mogą one być dużo mniejsze od ołowiowych. Są źródłem energii elektrycznej dla latarek, małych użądzeń domowych, walkmanów.
Akumulatory kwasowe mają szereg zalet: stosunkowo wysokie napięcie źródłowe ogniwa, znaczna wydajność, mała rezystancja wewnętrzna. Do wad akumulatorów zalicza się: wrażliwość na niewłaściwą eksploatację, na uderzenia napięciowe(np. przy zwarciach), nieodporność na pozostawienie przez dłuższy czas w stanie nie naładowanym, pogorszenie pracy akumulatora w niższych temperaturach. Akumulatory zasadowe z kolei mają niższe napięcie źródłowe, są droższe, mają mniejszą wydajność, ale za to są niewrażliwe na długotrwałe pozostawienie w stanie wyładowanym i mało wrażliwe na niewłaściwe warunki eksploatacji, dodatkowo są odporne na wstrząsy.
Akumulator można naładować drugim akumulatorem (źródło prądu stałego). Podczas ładowania prąd elektryczny płynie w kierunku przeciwnym do siły elektromotorycznej akumulatora. Zachodzą wówczas reakcje odwrotne do tych jakie przebiegają podczas wyładowania. Ważne jest zwrócenie uwagi na rodzaj akumulatora i jego wartości elektryczne. Proces ładowania zachodzić będzie do momentu wyrównania wartości elektrycznych między obydwoma akumulatorami - prąd przestanie przepływać. Akumulatory powinny być ładowane prostownikami prądu stałego przystosowującymi się do typu akumulatora.
W czasie wyładowania akumulatora ![]()
maleje i maleje również wielkość pracy, którą możemy z niego czerpać. Odwrotna sytuacja jest w przypadku ładowania akumulatora. W celu odwrócenia reakcji musimy wymusić proces w przeciwnym kierunku, przykładając różnicę potencjałów i wykonując pracę elektryczną.
Dlaczego rurociągi w ziemi korodują?
Korozja rurociągów wynika z niekorzystnych warunków: wilgotne środowisko + sole mineralne.
Dlaczego w termie elektrycznej tworzą się dziury?
Korozja elektrochemiczna i gazowa.
Jakie materiały i w jaki sposób elektryzują?
Elektryzowanie ciał następuje albo w wyniku tarcia lub indukcji. Przez tarcie się zwykle dielektryki. Aby naelektryzować przewodnik należy go odizolować od innych przewodników. Elektryzowanie przez tarcie polega na przenoszeniu przez pracę tarcia elektronów z cząsteczek powierzchni jednego ciała na powierzchnię drugiego ciała w wyniku czego jedno ciało elektryzuje się dodatnio a drugie ujemnie. W ciałach z materiałów nie przewodzących prądu ładunki elektryczne gromadzą się w miejscach pocieranych, natomiast w ciałach przewodzących ładunki rozchodzą się po całej powierzchni przedmiotu. Elektryzowanie przez tarcie występuje często jako zjawisko niepożądane, a nawet niebezpieczne (elektryzowanie podczas transportu palnych substancji). Ciała przewodzące można również elektryzować przez indukcję. Jeżeli do odizolowanego od ziemi nienaelektryzowanego ciała A zbliżyć ujemne ciało B to w wyniku działania sił pola ładunku B elektrony swobodne w ciele A zostaną odepchnięte na stronę przeciwległą ciału B,
Co zrobić aby odzyskać benzynę do której ktoś wsypał cukier?
Benzynę można oczyścić przeprowadzając proces destylacji. Można również najpierw zastosować ekstrakcję wodą, (wówczas cukier przejdzie do warstwy wodnej), a później destylację.
Czym można usunąć brzydkie zapachy w lodówce?
Brzydkie zapachy z lodówki można usunąć za pomocą różnego rodzaju detergentów lub za pomocą substancji kwaśnych np. octu czy kwasku cytrynowego
.
1
![]()
Wyszukiwarka