40. OTRZYMYWANIE SODY METODĄ SOLVAY'A
Sprzęt laboratoryjny:
- zestaw podany na rysunku 1 szt.
- zestaw do sączenia pod próżnią (ok. 0,5 dm3) 1 szt.
- łopatka szklana 1 szt.
- łopatka szklana do kolb 1 szt.
- szalka 1 szt.
- tygiel mały 1 szt.
- kolby stożkowe 50 cm3 2 szt.
- pipetka z gumką 1-5 cm3 1 szt.
- cylinder miarowy 25 cm3 1 szt.
- cylinder miarowy 250 cm3 1 szt.
- szczypce do tygli 1 szt.
- lejek zwykły 1 szt.
Odczynniki
- Amoniak gazowy
- Dwutlenek węgla gazowy
- solanka r-r nasycony
- NH3 aq.
- kwas solny ok. 10%
- kwas azotowy 10-15%
- azotan srebra r-r mianowany 0,1 n
- chromian potasu - roztwór wodny
- fenoloftaleina
- oranż metylowy
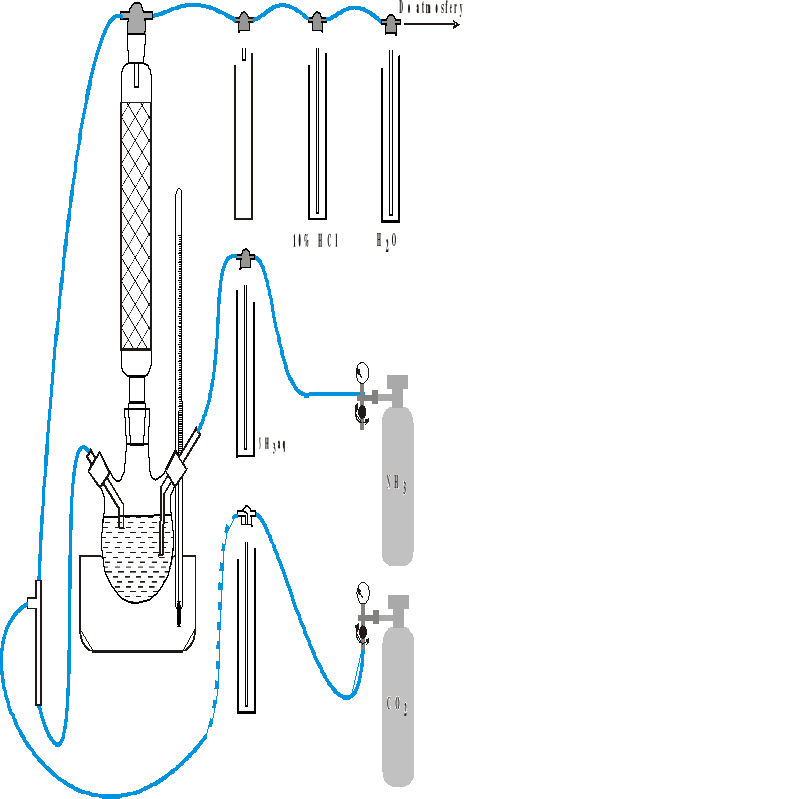
Przygotowanie zestawu do karbonizacji:
Przygotować zestaw do karbonizacji jak na rysunku, bez umieszczania rurek w obu ramionach kolby i bez łaźni wodnej. UWAGA!!! Zwrócić uwagę na sposób połączenia płuczek. Płuczka z roztworem kwasu solnego powinna być zabarwiona oranżem metylowym dla oszacowania stopnia wyczerpania absorbentu w płuczce.
Do kolby wprowadzić 200 cm3 solanki (zanotować jej temperaturę). Zamontować rurkę przelewową (tę z lewej strony kolby). Głowica pompy do transportu cieczy (trójnik) powinna wisieć bezwładnie na zamontowanych wężykach i znajdować się poniżej zestawu w pozycji pionowej, jak na rysunku. Wlot-wylot płuczki przez którą przepływa CO2 musi być powyżej poziomu cieczy w kolbie.
Uruchomienie zestawu i prowadzenie karbonizacji:
Rurkę dopływową od głowicy pompy na szczyt kolumny zamknąć poprzez założenie zaworu (wystarczy również proste zgięcie rurki palcami). Koniec rurki, która łączy zestaw do CO2 i płuczkę (zaznaczony linią przerywaną) odpiąć od płuczki i umieścić powyżej kolby trójszyjnej. Za pomocą gruszki gumowej zassać zdecydowanym ruchem powietrze przez tę rurkę aż do chwili, gdy menisk cieczy w rurce znajdzie się poniżej lustra cieczy w kolbie. Szybko oderwać gruszkę od rurki, aby nie zassać solanki do gruszki. Ciecz samoistnie przepłynie z kolby i wypełni rurki aż do wyrównania poziomów cieczy w kolbie i rurkach. Otworzyć przepływ cieczy w rurce prowadzącej na szczyt kolumny. Luźny koniec węża podłączyć z powrotem do płuczki.
Podobną metodą jak poprzednio zamknąć przepływ cieczy w rurce od rurki przelewowej z kolby trójszyjnej do głowicy pompy. Otworzyć zawór na reduktorze CO2 w taki sposób, aby płynący CO2 spowodował przepompowywanie cieczy zawartych w rurkach na szczyt kolumny absorpcyjnej. Wtedy otworzyć przepływ cieczy z kolby do trójnika i wyregulować przepływ CO2 tak, aby transport cieczy na szczyt kolumny był w miarę równomierny. Niewłaściwe ciśnienie gazu może spowodować przepływ wsteczny i przepompowanie cieczy z trójnika z powrotem do kolby oraz wsteczny przepływ cieczy w płuczkach itp.
Ustawić przepływ NH3 jeszcze przed podłączeniem do układu. Wprowadzić do kolby trójszyjnej końcówkę rurkę do podawania NH3 (w prawą szyję kolby) i umocować ją za pomocą korka. Jeżeli w trakcie procesu spadnie szybkość przepływania NH3 przez płuczkę należy zwiększyć jego przepływ na zaworze. Brak zrównoważenia ciśnienia CO2 z ciśnieniem NH3 powoduje przepompowanie solanki do płuczki z NH3 aq. Na początku NH3 może być podawany dość szybko (szybki przepływ NH3 przez płuczkę). Później amoniak należy dostarczać w takiej ilości aby w płuczce były widać przepływ odrębnych pęcherzyków gazu.
Zamontować łaźnię wg zadanej temperatury procesu karbonizacji. Prowadzić proces absorpcji CO2 w solance w ustalonej temperaturze przez okres niezbędny do wytrącenia się kryształków sody (zwykle ok. 1-1,5 godziny). Stale kontrolować przepływy gazów we wszystkich płuczkach. W przypadku jakichkolwiek problemów z przepływami spowodowanymi np. obrośnięciem rurek kryształami należy pamiętać aby podczas prób rozwiązania problemu natychmiast wyjmować rurkę do absorpcji z kolby jako pierwszą operację. Po zaobserwowaniu wytrącania się kryształków sody w kolumnie absorpcyjnej (wyraźne zmętnienie przepływającej cieczy i osadzanie kryształów na ściankach) należy wyłączyć przepływ solanki na szczyt kolumny (aby zapobiec zatkaniu rurek przepływowych) przez założenie zaworu na tą rurkę. Od tej chwili CO2 jest dostarczany do układu na zasadzie barbotażu. Prowadzić dalej barbotaż gazów w solance przez 30 minut.
Wyodrębnienie produktu:
Wyjąć rurkę barbotażową do NH3. Zamknąć dopływy CO2 i NH3. Zestaw można rozmontować.
Szlam poreakcyjny przenieść z kolby i kolumny karbonizacyjnej do zlewki - nie chłodzić dodatkowo. Uważać na wydzielający się amoniak! Wydzielone kryształy odsączyć pod zmniejszonym ciśnieniem i przepłukać małą ilością lodowatej wody. Przenieść je do zważonej szalki i poddać procesowi suszenia w temperaturze 70-100oC (dla wygody przed sączeniem dobrze jest zważyć wcześniej szalkę wraz z suchym sączkiem). Co jakiś czas przegarniać preparat łopatką. Gdy preparat wygląda na wysuszony wyznaczyć masę preparatu i dalej suszyć. Preparat uznaje się za wysuszony, gdy pomiędzy kolejnymi pomiarami masy preparatu, wykonywanymi co 10 min. nie występuje istotny ubytek masy (tj. powyżej 5%). Wysuszony preparat zważyć.
Kalcynacja:
Z powodu ograniczonego czasu zajęć kalcynacji poddawany będzie produkt innej grupy laboratoryjnej. Rozetrzeć małą ilość preparatu dla ujednolicenia. Do zważonego tygla porcelanowego wprowadzić małą ilość preparatu, rzędu 0,30-1,00 g, zważyć ponownie i umieścić w rozgrzanym piecu. Prażyć w temperaturze 200-250oC przez okres 20-30 minut. Po wystudzeniu zważyć ponownie.
Analiza produktu
Z kalcynowanego produktu, odważyć po 2-3 próbki w ilości 0,0100-0,1000 g do analizy. Do każdej z próbek dodać 10 cm3 wody, fenoloftaleinę i dodawać kroplami kwas azotowy aż do odbarwienia wskaźnika. Następnie próbki poddać analizie argentometrycznej na zawartość chlorków.
Obliczenia:
1. Wyznaczyć ilość NaCl w wykorzystywanym substracie (solance) na podstawie parametrów rozpuszczalności NaCl w wodzie w danej temperaturze.
2. Wyznaczyć zawartość Na2CO3 w uzyskanym produkcie dwiema metodami:
- na podstawie zawartości jonów chlorkowych w produkcie,
- na podstawie ubytku masy podczas kalcynacji
i skomentować uzyskane ewentualne rozbieżności.
3. Wyznaczyć wydajność całego procesu otrzymywania Na2CO3 (uwzględniając czystość produktu) i porównać z praktycznie uzyskiwaną w przemyśle. Skomentować uzyskane ewentualne rozbieżności.
Wszystkie obliczenia, ewentualne wyprowadzenia wzorów itd. mają znaleźć się w sprawozdaniu.
Uwagi:
- Ze względu na możliwość emisji amoniaku do powietrza zaleca się prowadzenie ćwiczenia pod wyciągiem.
Przykładowa literatura:
Kępiński J., Technologia Chemiczna Nieorganiczna, PWN, Warszawa, wszystkie wydania
Zawadzki J., Technologia Chemiczna Nieorganiczna, cz. II, PWN, Warszawa 1952 i nowsze.
Bortel E., Konieczny H., Zarys technologii chemicznej, PWN, Warszawa, wszystkie wydania.
Praca zbiorowa, Technologia sody, PWN, Warszawa 1958
Praca zbiorowa, Soda i produkty towarzyszące, WNT, Warszawa 1978
Muchlenow I.P. i inni, Ogólna technologia Chemiczna, WNT, Warszawa 1974
Mińczewski, Marczenko, Analiza Chemiczna, t.2. analiza ilościowa, PWN, Warszawa, wszystkie wydania.
Tablice fizykochemiczne, Kalendarz chemiczny, Poradnik chemiczny itp.
Prowadzący podaje temperaturę procesu (10, 15, 20, 25 lub 30oC±2).
3
Wyszukiwarka