1.Stan termodynamiczny - jest określany za pomocą jego parametrów termodynamicznych.
Parametr termodynamiczny układu - to taki parametr którego zmiana w istotny sposób wpływa na proces lub zjawisko termodynamiczne.
2.Energia - miara zmian zachodzących w systemach empirycznych.
Energia mechaniczna - energia ruchu mechanicznego i wzajemnego oddziaływania ciał Em=Ek+Ep
Energia wewnętrzna (U) - to ta część systemu (układu) empirycznego, która jest zależna wyłącznie od jego stanu termodynamicznego. Jest jedną z funkcji stanu układu.
Parametr właściwy - parametr na jednostkę kg.
Funkcja stanu układu - jest to funkcja, które zmiana nie zależy od drogi po jakiej zmiana ta zaszła, a zależy jedynie od stanu początkowego i końcowego.
Energia wewnętrzna gazu doskonałego zależy od bezwzględnej temperatury i jest proporcjonalna do G gazu: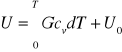
G-masa układu cv-cieplo wlasciwe
3.Entalpia (I) - suma energii wewnętrznej i iloczynu ciśnienia i objętości układu termodynamicznego I=U+pV [J] i=u+pv [m3/kg]
Entalpia gazu doskonałego zależy tylko od jego bezwzględnej temperatury i jest proporcjonalna do G gazu 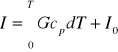
cp-ciepło właściwe pod stałym ciśnieniem
Entalpia powietrza wilgotnego- odniesiona do 1kg powietrza suchego, a więc do masy (1+X) kilogramów powietrza wilgotnego, suma entalpii suchego powietrza oraz entalpii zawartej w nim pary wodnej.
Praca - iloczyn drogi przez rzut siły na kierunek przesunięcia. L12=Fs12=F(s2-s1). Praca wykonana przez układ nad otoczeniem ma znak dodatni, a wykonana przez otoczenie nad układem ma znak ujemny.
Praca bezwzględna (zewnętrzna, absolutna, zmiany objętości) dL=pdV 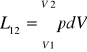
Praca użyteczna Lu12=L12-pot(V2-V1)
Praca techniczna dLt=-Vdp 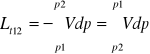
4.Bilans masy jeśli Gd jest masą doprowadzoną do układu, Gw masą wyprowadzoną z układu to zmiana masy w układzie dGu=Gd-Gw.
Strumień masy G'=G/t dGu=dG'ddt-dG'wdt [kg/s]
Bilans energii: Do układu doprowadzona jest energia,czesc akumulowana jest w uklaadzie a czesc wydalana. dEd=dEu+dEw
Strumień energii E'=E/t.
Wykres Sankey'a
4a. Zaleznosc miedzy uniwersalna a indywidualna stala gazowa:
M*R=B=8,314kJ/kmol*K
R-indywidualna stala gazowa
B-uniwersalna stala gazowa
5.Ciepło Q[J] - jeżeli dwa układy zamknięte co do wymiany masy lub układ zamknięty i jego otocznie wymieniają energię wewnętrzną w sytuacji gdy nie towarzyszy temu zmiana kształtu ścianek układu to takie oddziaływanie jednego układu na drugi nosi nazwę wymiany ciepła. A wymieniana energia to ciepło.
signL=-signQ.
dQ=Gc(T)dT
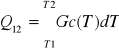
q12=c—(T2-T1)
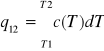
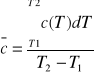
Znak ciepła wymienianego między otoczeniem, a układem jest przeciwny do znaku pracy.
6.Zerowa zasada termodynamiki (Maxwell) - jeśli spośród trzech układów ABC znajdujących się w stanie wewnętrznej równowagi termodynamicznej, każdy z układów AiB jest w równowadze termicznej z układem C to układy AiB są ze sobą w równowadze termicznej (mają tą samą temperaturę)
Pierwsza zasada termodynamiki - dla układu zamkniętego ze względu na wymianę masy i pozostającego w spoczynku
zał.1 energia wewnętrzna U jest odniesiona do środka masy układu
zał.2 nie uwzględnia się energii kinetycznej i potencjalnej układu. To ciepło doprowadzone do układu zostaje zużyte na zwiększenie energii wewnętrznej układu oraz na wykonanie pracy bezwzględnej.
Q12=U2-U1+L12 U2=I2-p2V2 U1=I1-p1V1 L12=Lt12+p2V2-p1V1
Q12=I2-I1+Lt12
dQ=dU+Dl
dQ=dI+dLt
dq=du+dl
dq=di+dlt
dq=du+pdv
dq=di-vdp
Dla gazu doskonałego:
du=cvdT
di=cpdT
dq=cvdT+pdv
dq=cpdT-vdp
7.Gaz doskonały - to gaz, którego cząsteczki to idealnie sprężyste kulki o nieskończenie małej objętości stanowią zatem pkt. Materialne. Odległości miedzy nimi są bardzo duże w stosunku do ich średnic, pomiędzy nimi nie występują siły wzajemnego oddziaływania. Każdy gaz rzeczywisty może spełnić warunki gazu doskonałego gdy p→0 lub V→∞ gaz doskonały=limp→0(gaz rzeczywisty)
Gazem doskonałym nazywamy gaz spełniający rówanie Clapeyrona, prawo Avogadra i odznaczający się stałą wartością ciepła właściwego.
Gaz półdoskonały- gaz spełniający równanie gazu doskonałego lecz jego ciepła właściwe zależą od temperatury.
Parametr stanu - to wielkość od której zalezy stan układu.
Parametry stanu dla gazu doskonałego -
Cisnienie, objętość wlasciwa, temperatura.
Parametr intensywny-to taki parametr, którego wielkość nie zalezy od masy układu - temperatura.
Parametr ekstensywny - to taki parametr którego wielkość zalezy od masy układu - P i V.
7a.Ciecz doskonała- pozbawiona lepkości, nieściśliwa oraz nie zmieniająca swojej objętości pod wpływem zmian temp., co oznacza, że ma stałą gęstość; między cząsteczkami nie działają żadne siły (cząstki doskonale ruchliwe), a więc nie ma tarcia.
8.Prawa gazowe:
Prawo Boyle'a - Mariotte'a p1V1=p2V2 - przy stałej masie i temperaturze
Prawo Gay - Lussaca p=p0(1+άT) - przy stałej masie i objętości właściwej układu
Prawo Clapeyrona pV=RT
dla G masy: Gpv=GRT => pV=GRT
dla 1kmol pvM=MRT MR=B
dla n kmol npvM=nBT vMn=V => pV=nBT
dla G=const pV/T=const
Prawo Avogadra - liczby cząstek zawartych w jednakowej objętości różnych gazów są w tych samych warunkach termicznych równe. 1kmol=22,42m3
Wyznaczanie gęstości: pv=RT pV/G=RT g=G/V => p/g=RT =>g=p/RT
Ciepło właściwe: c=dq/dT cv=dgv/dT cp=dgp/dT dla gazu doskonałego cp/cv=K cp-cv=R
Mcp-Mcv=MR=B
9.Przemiany gazów doskonałych:
-Izoterma T=const pv=RT pv=const
-Izochora V=const pV=GRT => p/T=GR => p/T=const
-Izobara p=const pV=GRT => V/T=GR => V/T=const
10.-Adiabata (nie ma wymiany ciepła z otoczeniem) Wyprowadzenia wzorów:
Z1:dq=0 Z2:dq=du+pdv=cvdT+pdv=0 Z3:cp/cv=K Z4:cp-cv=R Z5:pv=RT
(Z5): d(pv)=Rdt=pdv+vdp
dT=(pdv+vdp)/R (1)
(Z3): cp=Kcv (2)
(Z4) i (2): Kcv-cv=R => cv(K-1)=R (3)
(Z2) i (1) i (3): (pdv+vdp)+pdv=0
Pdv+vdp+Kpdv-pdv=0
Vdp+Kpdv=0
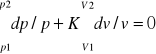
ln(p2/p1)+Kln(v2/v1)=0
Kln(v2/v1)=- ln(p2/p1)
Kln(v2/v1)=ln(p1/p2)
ln(v2/v1)K=ln(p1/p2)
(v2/v1)K=(p1/p2)
p1V1K=p2V2K
pvK=const (4)
(Z5): p=RT/v
(Z5) i (4): (RT/v)*vK=const
(T/v)*vK=const
Tv(K-1)=const (5)
(Z5): v=RT/p
(Z5) i (4): p(RT/p)K=const
p(RKTK/pK)=const
pTK/pK=const
p(1-K)TK=const
p(1-K)/KT=const
Tp-(K-1)/K=const (6)
11.-Politropa (ciepło właściwe jest stałe) Wyprowadzenie wzorów.
Z1:c=const Z2:dq=cdT Z3:dq=du+pdv=cvdT+pdv Z4:R=cp-cV Z5:pv=RT Z6:(c-cp)/(c-cv)=m - wykładnik politropy
(Z2) i (Z3): cdT=cvdT+pdv
(c-cv)dT-pdv=0 (1)
(Z5): dT=(pdv+vdp)/R
(1) i (2): ((c-cv)/R)(pdv+vdp)-pdv=0 (3)
(Z4): (c-cv)/R=(c-cv)/(cp-cv)=(c-cv)/(c-cv+cp-c)=(c-cv)/((c-cv)-(c-cp))=1/(1-(c-cp)/(c-cv)) (4)
(4) i (Z6): (c-cv)/R=1/(1-m) (5)
(3) i (5) (1/(1-m))(pdv+vdp)-pdv=0
Vdp+mpdv=0
(dp/p)+(mdv/v)=0
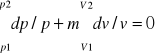
ln(p2/p1)+mln(v2/v1)=0
mln(v2/v1)=- ln(p2/p1)
ln(v2/v1)m= ln(p1/p2)
(v2/v1)m=(p1/p2)
v2mp2=p1v1m
pvm=const
TV(m-1)=const
Tp-((m-1)/m)=const
12.Obiegi termodynamiczne.
-Obieg prawobieżny - jest obiegiem silnika. Silnik pobiera ciepło Qd ze źródła o temp. T1 wykonuje pracę co jest jego zadaniem i oddaje ciepło Qw do źródła o temp. T2 niższej od T1 (zwykle od otoczenia)
Sprawność: ntob=Lob/Q1=(Q1-|Q2|)/Q1=1-|Q2|/Q1 <1
-Obieg lewobieżny - jest obiegiem ziębiarki i pompy cieplnej.
Obieg chłodziarki - chłodziarka pobiera ciepło Qd ze źródła o temp. niższej od temp. otoczenia co jest jej zadaniem pobiera pracę i oddaje ciepło Qw do źródła o temp. wyższej od otoczenia.
Sprawność: Ech=Qd/|Lob|=Q1/(|Q2|-Q1) ><1
Obieg pompy cieplnej - pompa pobiera ciepło Qd z otoczenia, pobiera pracę napędową i oddaje ciepło Qw do źródła o temp. wyższej od temp. otoczenia
Sprawność: Ep=|Qw|/|Lob|=|Q2|/|Lob|=|Q2|/(|Q2|-Q1) >1
Działanie pompy cieplnej.
W zamkniętym układzie: parownik, sprężarka, skraplacz, zawór rozprężny, krąży czynnik roboczy pośredniczący w przenoszeniu ciepła. Czynnikiem tym jest najczęściej amoniak. W parowniku czynnik roboczy pobiera ciepło ze źródła o temp. niższej, w wyniku czego odparowuje. Pary czynnika zostają następnie sprężone w sprężarce, ze sprężarki pary mające wysokie ciśnienie, wysoką temp. dochodzą do skraplacza, tu rozprężają się w wyniku czego skraplają się i oddają ciepło do źródła o temp. wyższej. Ciecz czynnika roboczego wraca do parownika poprzez zawór dławiący i zaczyna się od początku nowy cykl pracy pompy cieplnej.
13.Druga zasada termodynamiki:
-Ciepło nie może przejść samorzutnie od ciała o niższej temp. do ciała o temp. wyższej.
-Nie jest możliwe skonstruowanie cyklicznie działającej maszyny, której działanie polegałoby tylko na podnoszeniu ciężarów i równoczesnym ochładzaniu jednego źródła ciepła.
-Entropia układu zamkniętego i izolowanego nie może maleć podczas dowolnej przemiany i wzrastać podczas przemian nieodwracalnych.
14.Entropia (S) - funkcja stanu układu, której różniczka w elementarnym procesie odwracalnym równa jest stosunkowi nieskończenie małej ilości ciepła dostarczonego układowi do bezwzględnej temperatury układu.
Wzory: dS=dQ/T [J/K] ds.=dq/T [J/kg*K] dq=Tds dQ=TdS
Przyrost entropii w dowolnej przemianie termodynamicznej:
Założenia: 1.pv=RT 2.dq=du+pdv dq=cvdT+pdv 3.dq=di-vdp dq=cpdT-vdp 4.ds=dq/T
ds=du/T+pdv/T
ds=di/T-vdp/T
ds=cvdT/T+Rdv/v
ds=cpdT/T-Rdp/p
s2-s1=cvln(T2/T1)+Rln(v2/v1)
s2-s1=cpln(T2/T1)+Rln(p2/p1)
15.Przyrost entropii w przemianie: wyprowadzenie wzorów:
-Izotermicznej
ds=cvdT/T+Rdv/v
dT=O => ds.=Rdv/v
s2-s1=Rln(v2/v1)
ds=cpdT/T-Rdp/p
ds=-Rdp/p
s2-s1=Rln(p1/p2)
-Izochorycznej
ds=cvdT/T+Rdv/v
dv=0 => ds=cvdT/T
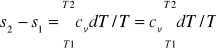
s2-s1=cvln(T2/T1)
T1=T0 i T2=T => s2=s i s1=s0
s=cvln(T/T0)+s0=s(T)
-Izobarycznej
ds=cpdT/T-Rdp/p
dp=0 => ds=cpdT/T
s2-s1=cpln(T2/T1)
s=cpln(T/T0)+s0=s(T)
-Adiabatycznej
dq=Tds=0 =>ds=0 i s=const
-Politropowej
ds=dq/T=cdT/T
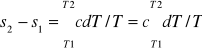
s2-s1=cln(T2/T1)
s=cln(T/T0)+s0=((cv(m-K))/(m-1))(ln(T/T0)+s0
16.Przemiany gazów w układzie T-s
-Izoterma
ds=dq/T
dq=Tds
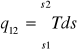
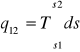
q12=T(s2-s1)
-Izochora
s-s0=cvln(T/T0)
T/T0=e(s-s0)/cv
T= T0e(s-s0)/cv
dq=du+pdv=du
q12=u2-u1
ds=cvdT/T+Rdv/v
-Izobara
s-s0=cpln(T/T0)
T=T0e(s-s0)/cp
dq=di-vdp=di
q12=cpdT/T-Rdp/p
17.Para nasycona mokra-1kg pary nasyconej mokrej zawiera xkg pary nasyconej suchej o objętości właściwej v'' oraz 1-x kg cieczy o objętości v'
Para nasycona mokra jest to mieszanina cieczy wrzącej o x=0 i jej pary nasyconej suchej o x=1.
Vx=v'+x(v''-v') x=Gp/G
Przemiany charakterystyczne pary mokrej.
Stopień suchości punktu nr 2.
X2=X1[(v1''-v1')/(v2''-v2')]
Para przegrzana-substancja o temp. wyższej od temp. punktu rosy.
Para nasycona sucha o x=1 wraz z cieczą wrzącą o x=0 stanowi mieszaninę tworzącą parę nasyconą mokrą.
Powietrze nasycone- zawiera maksymalną ilość pary wodnej w danych warunkach ciśnienia i temp.
Powietrze nienasycone- w tych samych warunkach powietrze zawierające mniej pary wodnej od wartości maksymalnej; para wodna występuje jako para przegrzana.
Stan przesycenia powietrza- stan nietrwały związany z obniżeniem temperatury poniżej Tr lub ze wzrostem ciśnienia całkowitego.
Wilgotne powietrze-mieszanina powietrza suchego i pary wodnej.
Temp. mokrego termometru-temperatura równoważna osiągana przez małą ilość cieczy odparowującej do dużej masy nienasyconej mieszaniny powietrza z parą wodną.
Temp. suchego termometru-temperatura mieszaniny parowo-gazowej wyznaczona przez zanurzenie w niej termometru którego czujnik nie jest zwilżony.
Temp. punktu rosy-temp. w której mieszanina powietrza i pary wodnej osiągnie stan nasycenia podczas ochładzania pod stałym ciśnieniem bez kontaktu z fazą ciekłą.
Wilgotność bezwzględna-ilość kg pary wodnej w 1m3 powietrza suchego, przy temp. tego powietrza i pod ciśnieniem pary.
Wilgotność względna-stosunek wilgotności rzeczywistej do maksymalnej wyrażona w %.
Φ=p*pw/ps
Φ=100(pw/ps) p-ciśnienie wilgotnego powietrza pw-ciśnienie przegrzanej pary wodnej ps-ciśnienie pary wodnej nasyconej
Wilgotność bezwzględna masowa X- masa pary wodnej na 1kg suchego powietrza X=mpw/msp .
Wilgotność bezwzględna objętościowa- masa pary wodnej na jedn. objętości pow. wilgotnego ρpw=mpw/V .
Stopień zwilżenia X-udział wagowy pary wodnej w powietrzu suchym.
Entalpia parowania-przyrost entalpii 1kg substancji przy przejściu od punktu pęcherzyków do punktu rosy.
Temp. punktu krytycznego-temp. w której entalpia jest równa zero.
17a.Parowanie- proces zmiany stanu skupienia, przechodzenia z fazy ciekłej danej substancji w faze gazową ( parę) zachodzacy z reguły na całej powierzchni cieczy
Skraplanie- proces zmiany stanu skupienia, przechodzenia z fazy gazowej danej substancji w faze ciekłą (ciecz).
17b. Stopień suchości pary (x)- parametr określający zawartośc pary nasyconej w parze mokrej (mieszaninie cieczy nasyconej i pary nasyconej suchej) x=Mp/Mp+Mc gdzie Mp- masa pary nasyconej suchej, Mc- masa cieczy nasyconej w parze mokrej.
17c.Gaz wilgotny- to mieszanina gazów, z których jeden może podlegac procesom zmiany stanu skupienia w danym przedziale zmian temperatury i ciśnienia. Najczęściej spotykany gaz wilgotny to powietrze atmosferyczne nawilzone para wodna, w zakresie parametrow otoczenia.
17d.Stopień przegrzania- różnica między temp. pary przegrzanej a temp. nasycenia.
Stopień suchości x- wyraża zawartość pary nasyconej suchej w 1kg pary nasyconej mokrej.
Ciepło parowania- ilość ciepła doprowadzona do 1kg wrzącej cieczy aby otrzymać z niej przy stałej temp. i ciśnieniu 1kg pary nasyconej suchej.
17e.Parowanie (ewaporacja) - proces zmiany stanu skupienia, przechodzenia z fazy ciekłej danej substancji w fazę gazową (parę) zachodzący z reguły na powierzchni cieczy. Może odbywać się w całym zakresie ciśnień i temperatur, w których mogą współistnieć z sobą obie fazy. Szybkość procesu parowania zależy od temperatury oraz ciśnienia parcjalnego pary nad cieczą. Gdy ciśnienie pary jest równe ciśnieniu pary nasyconej w danej temperaturze, to parowanie nie zachodzi. Stan też określa się jako równowagę między parowaniem a skraplaniem. Obniżenie ciśnienia oraz napływ gazu o mniejszym stężeniu pary, zwiększa szybkość parowania. Gdy ciśnienie pary nasyconej zrówna się z ciśnieniem otoczenia, wówczas proces parowania - zwany wówczas wrzeniem - zaczyna zachodzić również w całej objętości cieczy. Parowanie zachodzi wtedy, gdy cząsteczka ma dostatecznie wysoką energię kinetyczną, by wykonać pracę przeciwko siłom przyciągania między cząsteczkami cieczy.
17f. Izobaryczny proces parowania.
1 punkt pęcherzyków, punkt cieczy nasyconej
1-2 para nasycona (mokra), para mokra
2 punkt rosy, para sucha
18.Psychometr Augusta:
-składa się z 2 termometrów suchego i mokrego. Zbiornik z rtęcią mokrego termometru jest owinięty nawilżoną tkaniną.
-ma prostą budowę dlatego wykorzystywany jest tam gdzie występuje naturalna konwekcja powietrza.
-prędkość przepływu powietrza w pobliżu tkaniny termometru mokrego zależy tu od warunków lokalnych wskazania przyrządu są mało dokładne.
Psychometr Assmana:
- składa się z 2 termometrów suchego i mokrego. Zbiornik z rtęcią mokrego termometru jest owinięty nawilżoną tkaniną.
-wentylator promieniowy napędzany sprężyną lub silnikiem elektrycznym powoduje przepływ powietrza wokół termometrów.
-wykorzystywany jest do dokładnych pomiarów wilgotności względnej oraz do wzorowania innych przyrządów.
Higrometr włosowy- W XVIII wieku De Sassure wykorzystał pomysł użycia do pomiaru włosa ludzkiego lub zwierzęcego (np. koński), który zmienia swoją długość w zależności do pochłoniętej wilgoci - im bardziej mokre, tym dłuższe.
Higrometr kondensacyjny- Inna grupa higrometrów opiera się na zjawisku kondensacji pary wodnej na szklanych lub z polerowanego metalu powierzchniach ochładzanych od wnętrza.
Manometr - przyrząd do pomiaru ciśnienia. Ze względu na wskazywane ciśnienie dzieli się je na:
* względne - wskazujące różnicę ciśnień,
bezwzględne - wskazujące ciśnienie w odniesieniu do próżni.
Wakuometr- przyrząd do pomiaru ciśnienia niższego od cisnienia atmosferycznego
Barometr- przyrząd do pomiaru ciśnienia atmosferycznego. W zależności od zasady działania, barometry dzielą się na cieczowe i sprężynowe.
19.Dławienie izentalpowe-zjawisko wykorzystuje się w tak zwanym kalorymetrze dławiącym do wyznaczania stopnia suchości pary wodnej jeżeli bowiem po zdławieniu otrzyma się parę przegrzaną to poprzez pomiar temp i ciśnienia tej pary można ustalić entalpię.
Prawo Daltona:
![]()
pi-ciśnienie cząstkowe i-tego gazu p-cisnienie pod jakim znajduje się mieszanina gazowa
Ciśnienie cząstkowe pi i-tego gazu w mieszaninie jest to ciśnienie jakie panowałoby w zbiorniku gdyby usunięto z tego zbiornika wszystkie składniki mieszaniniy oprócz składnika rozważanego (i-tego) przy niezmienionej temp.
Prawo objetosci czastkowych:
"Objętość zajmowana przez mieszaninę gazów jest równa sumie objętości, które byłyby zajmowane przez składniki mieszaniny, gdyby każdy z nich był umieszczony osobno w tych samych warunkach ciśnienia i temperatury, czyli jest równa sumie objętości cząstkowych."
![]()
gdzie:
* V - objętość mieszaniny k-składnikowej przy ciśnieniu p i temperaturze T,
Vi - objętość cząstkowa składnika "i" w tej samej temperaturze i ciśnieniu.
20.Przepływ płynów:
-Lepkość-zdolność przyczepiania się do ścian przewodów płynów rzeczywistych, które przez nie przepływają lub do przedmiotów które opływają. W wyniku lepkości definiowanej jako tarcie o ścianki przewodu i tarcie wewnętrzne, rozkład prędkości płynu nie jest jednakowy w całym przekroju poprzecznym przewodu, lecz zmienia się od 0 przy ściankach do max w osi przewodu. Do pomiaru lepkości służy wiskozymetr.
Współ. lepkości dynamicznej- μ- współczynnik tarcia wewnętrznego. zależny od rodzaju cieczy i gazu odraz od ich temp. [Pa*s].zależy od rodzaju płynu i jego temp. μ[Pa*s]
Współ. lepkości kinematycznej wyraża stosunek lepkości dynamicznej do gęstości płynu ν=μ/ρ [m2/s].
20a.Średnia prędkość płynu- stosunek strumienia objętości do powierzchni poprzecznego tego strumienia. cśr=
/F= 1/F(ʃ0Rcr2πdr
21.Równanie Bernoulliego (bilans energii przepływającego płynu)-Wzrost prędkości przepływu, a tym samym energii kinetycznej cząstek gazu może odbywać się tylko kosztem energii potencjalnej. Całkowita energia przepływającego gazu składa się z energii cieplnej gazu, energii kinetycznej oraz energii potencjalnej.
h1+p1/gς+c12/2gα1=h2+p2/gς+c22/2g α1+Δpstr/gς
c1,c2-średnia prędkości liniowe strumieniu płynu w przekrojach 1i2
α1,α1-współczynniki Coriolisa
Δpstr-opory przepływu, czyli straty ciśnienia na drodze od przekroju 1 do 2
Rodzaje przepływu:
-laminarny(uwarstwiony) siły lepkości/siły bezwładności>1 Re<2100
cśr=cmax/2 cśr=V'/F
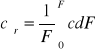
-burzliwy(turbulentny) siły lepkości/siły bezwładności<1 R>3100
cśr=0,8cmax
-przejściowy 2100<Re<3100
Średnica zastępcza(hydrauliczna) de=dh=4F/U F-pole U-obwód
21a. Termopara (termoogniwo, termoelement, ogniwo termoelektryczne) -to czujnik temperatury wykorzystujący zjawisko Seebecka, będący połączeniem dwóch różnych metali.
Składa się z pary (dwóch) różnych metali zwykle w postaci przewodów, spojonych na dwóch końcach. Jedno złącze umieszczane jest w miejscu pomiaru, podczas gdy drugie utrzymywane jest w stałej temperaturze odniesienia. Pod wpływem różnicy temperatury między miejscami złączy (pomiarowego i "odniesienia") powstaje różnica potencjałów (siła elektromotoryczna), zwana w tym przypadku siłą termoelektryczną, proporcjonalna do różnicy tych temperatur. Spoina pomiarowa może znajdować się w obudowie o dużym przewodnictwie cieplnym. Instaluje się ją w miejscu pomiaru temperatury. Złącze odniesienia może umieszczane w ściśle określonej temperaturze odniesienia, np. topniejącym lodzie. Złącze to może nie być złączem bezpośrednim a zamkniecie obwodu odbywa się poprzez zaciski miernika.
22.Liczby podobieństwa:
-Reynolds: Re=cl/V
c-średnia prędkość przepływu[m/s]
l-wymiar charakterystyczny[m]
V(ni)-współczynnik lepkości kinematycznej[m2/s]
Przedstawia stosunek sił bezwładności do sił lepkości przepływającego płynu.
-Prandtl: Pr=V/a
a-współ. dyfuzji cieplnej(wyrównania temp.)
-Nusselt: Nu=αl/λ
α-współ. wnikania ciepła
23.Opory liniowe równanie Darcy'ego-Weisbacha:
Δp=λ(l/d)(c2ς/2) [Pa]
λ -współ. oporu liniowego
l-dł. Przewodu[m]
d-wewnętrzna średnica przewodu[m]
c-średnia prędkość przepływu płynów[m/s]
ς-ęstość płynu[kg/m3]
Wsp. liniowego oporu przepływu λ- jest funkcją liczby Reynoldsa i chropowatości przewodu.
Wsp. miejscowego oporu przepływu ξ- dla dużych liczb Reynoldsa zależy tylko od kształtu danego elementu rurociągu.
Opór warstwy ziarna przedmuchiwanego powietrzem(wzór Erguna):
Δp/H=150(cμ/dz2)(1-E)2/E3+1,75(c2ς/dz)(1-E)/E
H-wysokość wypełnienia[m]
c-pozioma prędkość przepływu[m/s]
μ-współ. lepkości dynamicznej[Ns/m2]
dz-średnica zastępcza
E-porowatość warstwy ziarna
Porowatość warstwy ziarna-stosunek objętości miedzyzairnowej(obj. porów) do całkowitej obj. warstwy.
E=(V-Vz)/V
24.Wyznaczanie współ. lepkości dynamicznej cieczy metodą Stokesa:
![]()
Metoda Stokesa pomiaru współ. lepkości dynamicznej cieczy polega na pomiarze prędkości opadania kulki w badanej cieczy. Na kulkę opadającą w cieczy działają 3 siły: siła ciężkości Fg(pionowo w dół),siła wyporu hydrostatycznego Fa i oporu opływu kulki FR(pionowo w górę)
Fg=mg=(πd3/6)gς (1)
Fa=Vgςc= (πd3/6)gςc (2) ςc-gęstość cieczy
FR=λDF0(c2ςc/2) (3) λD-współ. oporu czołowego F0-powierzchnia bryły
λD=24/Re (4)
Re=cdςc/μc μc-współ. lepkości dynamicznej cieczy
F0=πd2/4 (6)
(3) i (4) i (5) i (6)
FR=3π μcdc (7)
Fg=Fa+FR (8)
(1) i (2) i (7) i (8)
(πd3/6)g ς=(πd3/6)gςc+3π μcdc
μc=d2g(ς-ςc)/18c (9)
Δ μc=+-[|δ μc/ δd|*| Δd|+|δ μc/ δςc|*| Δ ςc|+|δ μc/ δdc|*| Δc|]
Δ μc=+-[|2dg(ς-ςc)/18c|*| Δd|+|-d2g/18c|*| Δ ςc|+|-d2g(ς-ςc)/18c|*| Δc|] (10)
(9) i (10)
Δ μc/ μc=+-[2| Δd/d|+| Δ ςc/( ς-ςc)|+| Δc/c|]
Δc/c= Δt/t
25.Wymiana ciepła:
Przepływ(wymiana/przekazywanie)energii cielnej może być wytłumaczony przekazywaniem energii kinetycznej między cząsteczkami. Cząsteczki o wyższej temp. posiadając większą energie kinetyczną przekazują je cząsteczkom o niższej temp. co prowadzi do wyrównania się średnich energii kinetycznych wszystkich cząstek układu.
Rodzaje wymiany ciepła:
1.Przewodzenie ciepła-zachodzi w ciałach stałych oraz w warstwie granicznej(przyściennej)laminarnego przepływu cieczy i gazów.
2.Unoszenie(konwekcyjna wymiana)ciepła-zachodzi w cieczach i gazach w wyniku zderzeń cząsteczek, które przekazują sobie energię kinetyczną, a tym samym ciepło.
3.Promieniowanie cieplne-polega na zamianie energii kinetycznej drgań na energię promieniowania ta zaś po zetknięciu z cząsteczkami materii zmienia się na energie kinetyczną tych cząstek.
26.Przewodzenie ciepła w stanie ustalonym-jeżeli w przypadku przewodzenia ciepła temp. ośrodka przez jaki ciepło jes przewodzone nie zależy od czasu trwania procesu a zależy tylko o zmiennej nie będącej miarą kierunku ruchu ciepła to taki proces nazywamy jednowymiarowym ustalonym przewodzeniem ciepła. Temperatura jest potencjałem przewodzenia.
Def.Przewodzenie ciepła- przekazywanie energii cieplnej bezpośrednio przez stykające się drobiny ciała innym drobinom o temp. niższej przy czym nie ma większych zmian położenia cząstek.
Współ. przewodzenia ciepła λ- charakteryzuje dany ośrodek; to ilość ciepła przepływającego w jednostce czasu przez jedn. powierzchni przy spadku temp. o 1K na jedn. długości.
-Prawo Fouriera
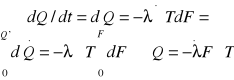
-ścianka płaska jednowarstwowa
Zał. Q' ><f(x) λ,F><f(T)
Q'dx=-λFdT
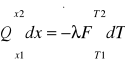
Q'(x2-x1)=-λ(T2-T1)
Q'=λF/δ(T1-T2)
Rλ=δ/λF Rλ-opór przewodzenia przez scianke płaską
Q'=(T1-T2)/ Rλ
-ścianka płaska wielowarstwowa
T1-T2=Q'Rλ1 Rλ1=δ1/Fλ1
T2-T3=Q'Rλ2 Rλ2=δ2/Fλ2
T3-T4=Q'Rλ3 Rλ3=δ3/Fλ3
Rλi=δi/Fλi
T1-T4=Q'(Rλ1+ Rλ2+ Rλ3)
Q'=F(T1-T4)/(δ1/λ1+ δ2/λ2+ δ3/λ3)
Q'=(T1-T4)/∑Rλi
-ścianka cylindryczna
Q'=- λFdT/dr
F=f(r)=2πrldT/dr
Q=-2λπrldT/dr
dT=-(Q'/2πλl)(dr/r)
T2-T1=-(Q'/2πλl)(ln(r2/r1))
T1-T2=(Q'/2πλl)(ln(r2/r1))
Q'=(T1-T2)/Rλ Rλln(r2/r1)/2πλl
-Liczba Biota Bi=αl/λs
α-współ. wnikania ciepła
l-wymiar charakterystyczny
λs-współ. przewodzenia ciepła w ciele stałym
-Liczba Fouriera Fu=at/l2
t-czas
l-wymiar charakterystyczny
a-współ. wyrównywania temp.
26a.Przewodzenie ciepła- proces wymiany ciepła między ciałami o różnej temperaturze pozostającymi ze sobą w bezpośrednim kontakcie. Polega on na przekazywaniu energii kinetycznej bezładnego ruchu cząsteczek w wyniku ich zderzeń. Proces prowadzi do wyrównania temperatury między ciałami.
Cieplo plynie tylko wtedy gdy wystepuje roznica temperatur w kierunku od temperatury wyższej do temperatury niższej. Z dobrym przybliżeniem dla większości substancji ilość energii przekazanej przez jednostkę powierzchni w jednostce czasu jest proporcjonalna do różnicy temperatur, co opisuje równanie Fouriera.
Wzór ten dla jednorodnego przewodzenia ciepła przez cienką ściankę prostopadle do jej powierzchni w kierunku x przyjmuje postać:
Q- natezenie przeplywu ciepla
λ - wspolczynnik przewodzenia ciepla
A- powierzchnia wymiany ciepla
T- temperatura
![]()
Dla ustalonego przepływu ciepła przez ścianę płaską, po scałkowaniu, równanie Fouriera przyjmuje postać:
∆T - róznica temperatur po obu stronach przewodnika ciepła
d- grubosc ścianki przewodnika ciepla
![]()
Dla ustalonego przepływu ciepła przez ściankę cylindryczną rury, przyjmuje postać:
d2,d1- srednica po stronie choldniejszej, cieplejszej
L- dlugosc rury
27.Unoszenie ciepła (wnikanie,przejmowanie,konwekcja,wymiana)-jesto to wymiana ciepła między powierzchnią ciała stałego a przepływającym wzdłuż niej płynem(ciecza,gazem)
Konwekcja ciepła- poszczególne cząstki ciała zmieniają swoje położenie, występuje więc ruch ośrodka
Rodzaje konwekcyjnej wymiany ciepła:
-konwekcja swobodna(naturalna)-gdy o ruchu płyny decyduje jedynie różnica temp. ruch wywołany różnicą gęstości ośrodka lub różnicą temp
-konwekcja wymuszona-gdy ruch płynu wywołany jest przez urządzenie mechaniczne(wentylator, pompa)
Konwekcja swobodna zwykle nakłada się na konwekcję wymuszoną gdyż siły wyporu powstają zawsze gdy gęstość płynu jest inna w warstwie przyściennej niż w masie strugi, jeżeli jednak prędkość przepływu strugi jest przy konwekcji wymuszonej duża to wpływ działania sił wyporu można pominąć.
28.Przenikanie ciepła-proces przenikania ciepła przez ściankę obejmuje wnikanie ciepła do ścianki od jednego ośrodka przewodzenie ciepła przez ściankę wnikanie ciepła od ścianki do drugiego ośrodka.
Wzory:
Q'=Fα1(Tf1-Tw1)=>Tf1-Tw1=Q'/ Fα1
Q'=(Fλ/δ)(Tw1-Tw2)=>Tw1-Tw2=Q'δ/Fλ
Q'=Fα2(Tw2-Tf2)=>Tw2-Tf2=Q'/F α2
Tf1-Tf2= Q'/ Fα1+ Q'δ/Fλ+ Q'/F α2
Q'=(Tf1-Tf2)/(Rα1+ Rλ+ Rα2)
Dla ścianki wielowarstwowej o dowolnym kształcie:
Q'=(Tf1-Tf2)/R
R=(1/F1α1)+(∑Rλi)+( 1/F2α2)
28a.Wspóczynnik przewodzenia ciepła zalezy od:
substancji
jest proporcjonalny do przekroju ciała
różnicy temperatur
czasu przepływu ciepła
28a.Współczynnik wnikania ciepła zalezy od:
natezenia przeplywu
powierzchni scianki( rozpatrywanego ciala)
temperatur: scianki i plynu
29.Wymiana ciepła przez promieniowanie-Energia promieniowania jest przenoszona przez drgania elektromagnetyczne o rożnych długościach fali. Zależnie od długości fali promieniowanie ma różne właściwości i jest odmiennie interpretowane.
Promieniowanie cieplne jest rodzajem drgań elektromagnetycznych a więc polega tym samym co one prawom ogólnym. Promieniowanie padające na pewne ciało może zostać przez nie pochłonięte, przepuszczone lub odbite. Energia promieniowania pochłonięta przez ciało zwiększa jego energie wewnętrzną i może być z kolei znowu wypromieniowana. Każde ciało nie tylko pochłania promieniowanie padające lecz i samo je wysyła i dopiero różnica energii wysyłanej i pochłanianej decyduje o wymianie energii w otoczeniu.
Q'A+Q'R+Q'P=Q'=> Q'A/Q'+Q'R/Q'+Q'P/Q'=1=>A+R+P=1
Q'A/Q'=A-absorpcja Q'R/Q'-odbijanie Q'P/Q'-przepuszczalność
R=1-ciało doskonale białe
A=1-ciało doskonale czarne
30.Prawo Stefana-Boltzmanna-ilość energii cieplnej emitowanej przez ciało doskonale czarne Qcz=FtC(T/100)4 C-stała promieniowania C=5,67W/m2K4
Dla ciała szarego Qsz=FtCE(T/100)4 E-emisyjność 0<E<1
Prawo Kirchhoffa A=E absorpcyjność=emisyjność
31.Krzywa przejść fazowych
K-punkt krytyczny
1-2-izobaryczne ogrzewanie ciała pod ciśnienie wyższym od punktu Tr
1'-2'-izobaryczne ogrzewanie ciała pod ciśnieniem niższym od punktu Tr
3-4-izobaryczne ochładzanie gazu pod ciśnieniem niższym od K
5-6-izobaryczne ochładzanie gazu pod ciśnieniem wyższym od K
7-8-izotermiczne sprężanie gazu w temp. niższej od temp. K
9-10-izotermiczne sprężanie gazu w temp. wyższej od temp. K
32. Punkt potrójny - to stan w jakim dana substancja może istnieć w trzech stanach skupienia równocześnie w równowadze termodynamicznej. Na wykresie stanów równowagi jest to punkt przecięcia krzywych równowagi fazowej substancji odpowiadający stanowi równowagi trwałej trzech stanów skupienia (ciało stałe, ciecz, gaz).
Punkt potrójny jest wielkością charakterystyczną dla danej substancji, podawany jest w opisach substancji. Punkty potrójne niektórych substancji są używane jako wzorce skali temperatur.
Punkt krytyczny - definiuje stan układu fizycznego oddzielajy stany o odmiennych właściwościach (ciecz - gaz), w którym nie można rozróżnić obu stanów (cieczy i gazu).
Dla czystych substancji - gazów punkt krytyczny oznacza temperaturę krytyczną (i odpowiadające mu ciśnienie krytyczne), powyżej której nie można skroplić gazu niezależnie od wielkości ciśnienia.
Dla ciekłych układów wieloskładnikowych oznacza stan w którym zanika różnica pomiędzy współistniejącymi fazami ciekłymi - dla wielu mieszanin ciekłych istnieją obszary (określone przede wszystkim przez krytyczne temperatury), w których istnieje całkowita mieszalność oraz obszary, gdzie istnieje ograniczenie rozpuszczalności
Spis:
1.Stan termodynamiczny. Parametr termodynamiczny.
2.Energia. Energia wewnętrzna, energia wewnetrzna gazu doskonalego. Funkcja stanu układu. Parametr właściwy.
3.Entalpia. Praca.
4.Bilans masy(energii). Wykres Sankey'a.
4a. Zaleznosc miedzy uniwersalna a indywidualna stala gazowa.
5.Ciepło. Znak ciepla.
6.Zerowa i Pierwsza zasada termodynamiki.
7.Gaz doskonały. Gaz półdoskonały. Parametry stanu gazu doskonałego.
7a. Ciecz doskonala.
8.Prawa gazowe, Boyle'a, Gay-Lussaca, Prawo Clapeyrona, Avogadra.
9.Przemiany gazów w p-V. Wykresy.
10.Wyprowadzenie wzorów dla adiabaty.
11.Wyprowadzenie wzorów dla politropy.
12.Obiegi termodynamiczne.
13.Druga zasada termodynamiki.
14.Entropia.
15.Wyprowadzenie wzorów na zmianę entropii w każdej przemianie.
16.Przemiany gazów w T-s. Wyprowadzenia wzorów.
17.Para nasycona mokra sucha przegrzana. Temp. suchego i mokrego termometru. Wilgotne powietrze, temperatura punktu rosy, wilgotnośi…, stopien zwilzenia, entalpia parowania, temperatura punktu krytycznego, powietrze nasycone i nienasycone.Stan przesycenia powietrza.
17a.Definicja parowania i skraplania
17b. Definicja stopnia suchosci pary
17c. Definicja gazu wilgotnego
17d. Stopien przegrzania, suchości i cieplo parowania.
17e.Parowanie def.
17f. Izobaryczny proces parowania.Wykres.
18.Psychometr Augusta i Assmana i Higrometry Barometr Manometr Wakuometr.
19.Dławienie Izentalpowe. Prawo Daltona.
20.Przepływ płynów. Lepkość, współczynniki lepkości dyn. I kin.
20a.Średnia prędkość płynu
21.Równanie Bernoulliego. Rodzaje przepływów.
21a. Termopara
22.Liczby Reynoldsa, Prandtla, Nusselta, średnica zastępcza.
23.Opory liniowe. Współczynnik liniowego i miejscowego oporu przepływu. Opór warstwy ziarna. Porowatość ziarna.
24.Wyznaczanie współ. lepkości dynamicznej metodą Stokesa.
25.Wymiana ciepła. Rodzaje wymiany, przewodzenie, promieniowanie, unoszenie.
26.Przewodzenie ciepła w stanie ustalonym. Prawo Fouriera. Współczynnik przewodzenia ciepla. Wyprowadzenie wzorów na przewodzenie przez ścianki.
26a. Definicja przewodzenia ciepla
27.Unoszenie ciepła. Konwekcje.
28.Przenikanie ciepła.
28a. Zaleznosc wspolczynnika przewodzenia i wnikania ciepla
29.Wymiana ciepła przez promieniowanie.
30.Prawo Stefana-Boltmanna, prawo Kirchhoffa.
31.Krzywa przejść fazowych.
32. Punkt potrojny i krytyczny def.
Wyszukiwarka