11. T i o l e i S u l f i d y
Związki organicznie - RSH - zawierające grupę -SH (merkaptanową) związaną z atomem węgla o hybrydyzacji sp3 nazywają się tiolami (dawna nazwa merkaptany obecnie niezalecana). Tiole są siarkowymi analogami alkoholi. Siarkowe analogi eterów - R-S-R - noszą nazwę sulfidów.
11.1 Występowanie
Zarówno tiole jak i sulfidy pełnią ważne funkcje biologiczne. Są to związki znane nie tylko ze względu na ich bardzo nieprzyjemny zapach (np. wydzielina skunksa), ale i na ich rolę w procesach życiowych. Cysteina i metionina to dwa aminokwasy należące do tzw. aminokwasów białkowych kodowanych, z których budowane są białka w pierwszym etapie ich biosyntezy. Grupa -SH cysteiny stanowi często centrum aktywności enzymów, zarówno w reakcjach redoks jak i acylowania. Zaś grupa -CH3 połączona z atomem siarki w metioninie służy do metylowania innych związków w reakcjach biochemicznych.
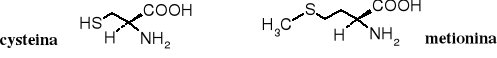
Poprzez utlenienie grup -SH cysteiny powstają mostki disulfidowe łączące fragmenty białek. Po hydrolizie takich białek otrzymuje się L-cystynę.
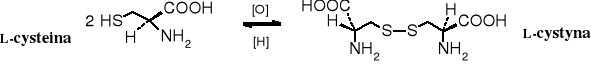
Sulfidami są niektóre witaminy, np. B1 i H.
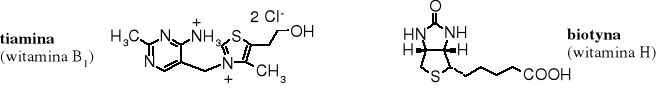
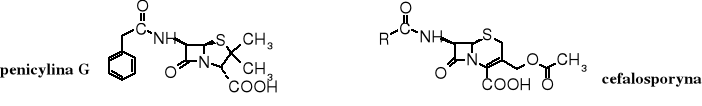
Ugrupowanie sulfidowe występuje w popularnych antybiotykach -laktamowych - w penicylinie i cefalosporynie. Obie te grupy antybiotyków zawierają pierścień -laktamowy, różnią się natomiast wielkością drugiego pierścienia - w penicylinach jest pięcioczłonowy zwany tiazolidynowym, podczas gdy w cefalosporynach występuje sześcioczłonowy - tetrahydrotiazynowy.
Heksan-1-olo-3-tiol i 2-metylo-4-propylo-1,3-oksatian czy heksan-1-olo-6-tiol wchodzą w skład substancji nadających zapach niektórym naturalnym aromatom, np. owoców męczennicy oraz kwiatów guajawy, a (+)-trans-mentan-3-ono-8-tiol, chociaż stanowi jedynie 0,2% olejku liści drzewa buchu (Barosma betulina) stanowi główną nutę zapachową tego olejku; stosowany jest do wyrobu perfum i do aromatyzowania pokarmów (dodawany w bardzo małych ilościach).
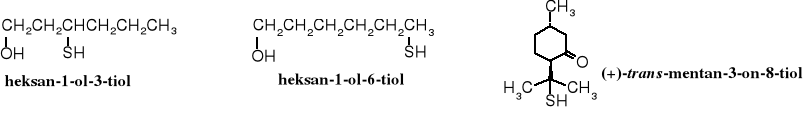
W olejku owoców ciemiężycy znaleziono mieszaninę stereoizomerów 2-metylo-4-propylo-1,3-oksatianu. Są one odpowiedzialne za nietypowy siarkowo-ziołowy zapach tych owoców.

W olejku grejpfrutowym znajduje się (+)-(R)-p-ment-1-en-8-tiol, który stanowi główną nutę zapachową soku tych owoców. Próg wykrywalności jego zapachu wynosi 0,02 ppt dla stereoizomeru (+)-(R) i 0,08 ppt dla stereoizomeru (-)-(S), co oznacza, że związek ten należy do substancji o najniższym progu wykrywalności zapachu.
Głównymi, zapachowymi składnikami wydzieliny skunksa są tiole: (E)-but-2-en-1-tiol, 3-metylobutano-1-tiol i but-2-en-1,4-ditiol oraz ich acetylowe tioestry.
![]()
Ich acetylowe tioestry są przyczyną długo utrzymującego się zapachu (odoru) po kontakcie z wydzieliną skunksa. Jako hydrofobowe trudno wymywają się z sierści czy ubrania, a pod wpływem nawet małych ilości wody (np. wilgoci) wolno hydrolizują uwalniając nieprzyjemny zapach.
Za przykry zapach czosnku odpowiedzialne są między innymi prop-1-en-3-tiol i disulfid allilowy. Powstają one w wyniku rozkładu innych mniej lotnych związków siarki zawartych w czosnku (tioaminokwasów i tioestrów). W cebuli natomiast występuje n-propanotiol.
![]()
Zdarza się, że niewielkie domieszki tioli czynią zapach bardziej atrakcyjny. Tak jest w przypadku aromatu kawy, w którym pośród 800 zidentyfikowanych składników znajdują się takie związki siarki, jak kaweofuran, metional, 2-furylometanotiol, mrówczan 3-merkapto-3-metylobutylu i inne.

Etanotiol stosowany jest do „perfumowania” bezwonnego gazu ziemnego. Niewielka ilość tej przykro pachnącej substancji dodanej do gazu ziemnego używanego w gospodarstwach domowych ma za zadanie alarmować o wycieku gazu z nieszczelnej instalacji. Obecność gazu ziemnego w pomieszczeniach zamkniętych jest groźna ze względu na tworzone z powietrzem mieszaniny wybuchowe.
Do sulfidów należy iperyt (sulfid dichlorodietylowy), gaz bojowy, zwany ze względu na jego zapach gazem musztardowym. Wywołuje na skórze trudno gojące się rany.
![]()
11.2 Nazewnictwo
11.2.1 Nazewnictwo UIPAC
Nazwy tioli tworzy się poprzez dodanie do nazwy węglowodoru o takiej samej ilości atomów węgla końcówki -tiol wraz z poprzedzającym ją łącznikiem -o-.

11.2.2 Nazewnictwo podstawnikowe
Grupę -SH można także traktować jako podstawnik, wówczas nazwy tioli tworzy się przez dodanie do nazwy węglowodoru przedrostka merkapto-.
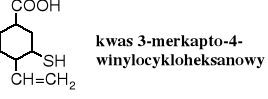
Podstawnikowy sposób nazewnictwa jest bardzo przydatny dla związków o skomplikowanej konstytucji.
11.3 Nomenklatura sulfidów
11.3.1 Nazewnictwo systematyczne
Organiczne pochodne siarkowodoru, w których oba atomy wodoru zostały podstawione resztami organicznymi (siarkowe analogi eterów) tworzą grupę sulfidów, a nazywa się je poprzez dodanie do słowa sulfid nazw (w formie przymiotnikowej) reszt organicznych połączonych z siarką; przedziela się je myślnikiem.
![]()
Podobnie nazywane były etery, np. eter metylowo-propylowy.
11.3.2 Nazewnictwo wymienne
Atomy siarki są traktowane i liczone jak atomy węgla w nazwie węglowodoru macierzystego, a wyróżnia się je przedrostkiem tia podając odpowiednie lokanty, np. 2,5-dimetylo-3,6-ditianonan.
![]()
11.4 Otrzymywanie
Tiole powstają w reakcji alkilowania wodorosiarczków metali alkalicznych. Jest to reakcja SN2.
![]()
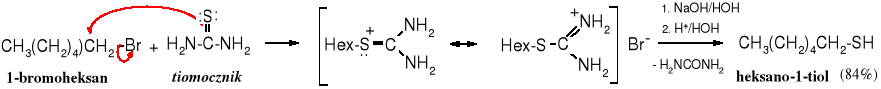
Reakcja ta nie jest często wykorzystywana do otrzymywania tioli, ponieważ tiole ulegają łatwo dalszemu alkilowaniu do sulfidów. Można temu zapobiec stosując duży nadmiar siarczku, ale lepszym, laboratoryjnym sposobem jest metoda wykorzystująca tiomocznik, który poddaje się alkilowaniu, a następnie hydrolizie.
Sulfidy otrzymuje się podobnie jak etery w zmodyfikowanej reakcji Williamsona, polegającej na alkilowaniu tiolanów, zamiast alkoholanów. Tiole są silniejszymi kwasami niż alkohole, zatem tiolany powstają łatwiej, tworzą się pod wpływem wodorotlenków metali alkalicznych.
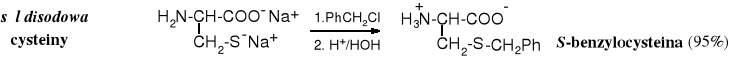
Benzylowaniu ulega głównie atom siarki, ponieważ stanowi on najsilniejsze centrum nukleofilowe w alkilowanej cząsteczce.
Jedna z metod syntezy sulfidów polega na addycji tioli do spolaryzowanego podwójnego wiązania; znalazła ona zastosowanie praktyczne w wytwarzaniu metioniny - aminokwasu służącego do podwyższania wartości odżywczej pasz przemysłowych. Ma ona ugrupowanie sulfidowe i należy do tych nielicznych aminokwasów, które produkuje się na drodze syntezy chemicznej. Większość innych aminokwasów wytwarzana jest biotechnologicznie. Substrat do syntezy metioniny - 3-metylotiopropanal powstaje w reakcji addycji metanotiolu do akroleiny.
![]()
akroleina metanotiol 3-metylotiopropanal
11.5 Właściwości fizyczne i fizjologiczne tioli
Metanotiol jest w temperaturze pokojowej gazem; jego tw. wynosi 5,8oC, etanotiol jest łatwo wrzącą cieczą (tw. = 37oC), a propano-1-tiol i propano-2-tiol wrą odpowiednio w temperaturach 67 i 51oC. Nie trudno zauważyć, że pomimo większej masy molowej są znacznie lotniejsze od alkoholi zawierających tę samą resztę organiczną. Przyczyną tego zjawiska jest brak, a dokładniej, bardzo słabe wiązania wodorowe z atomem siarki: ─H…S…H─. Nie tworzą się agregaty, które tak jak w przypadku alkoholi podwyższają temperaturę wrzenia.
Tiole, nawet te niższe, są trudno rozpuszczalne w wodzie, podczas gdy metanol, etanol, propanol, a nawet t-butanol mieszają się z wodą w każdym stosunku. Tylko 2,4g metanotiolu rozpuszcza się w 100 ml wody i odpowiednio 0,7 g etanotiolu; dobrze rozpuszczają się w rozpuszczalnikach organicznych.
Tiole znane są z bardzo nieprzyjemnego zapachu. Zapach niższych tioli jest wyczuwalny przy stężeniu 1:4.10-8. Tiole należą do silnych trucizn.
11.6 Właściwości chemiczne tioli
11.6.1 Właściwości kwasowe
Tiole są o kilka rzędów silniejszymi kwasami od alkoholi; pod wpływem alkoholanów zostają przekształcone w tiolany:
![]()
11.6.2 Właściwości nukleofilowe
Tiolany łatwo ulegają alkilowaniu do sulfidów:
![]()
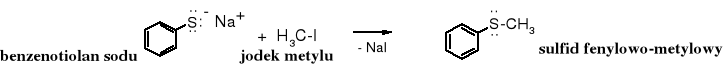
Symetryczne sulfidy łatwiej otrzymywać poprzez alkilowanie siarczku sodu:
![]()
Atom siarki jest lepszym nukleofilem niż atom tlenu, dlatego też alkilowanie siarczków, wodorosiarczków, alkanotiolanów, a nawet sulfidów biegnie łatwo. Tworzą się sole sulfoniowe.
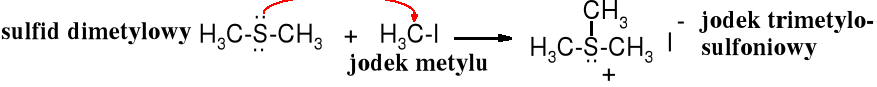
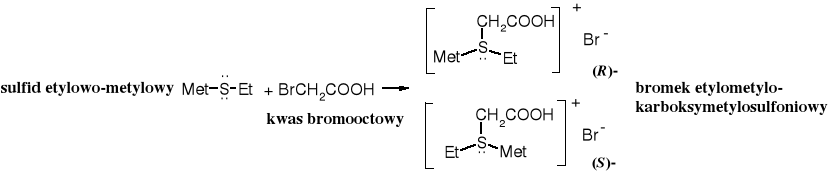
Sole sulfoniowe zawierające trzy różne podstawniki występują w postaci stereoizomerów, które można rozdzielić na enancjomery. Rolę czwartego podstawnika pełni wolna para elektronowa siarki. Podobne właściwości wykazują też 4o sole amoniowe. 3o Aminy są konfiguracyjnie zbyt labilne, żeby można je było rozdzielić na enancjomery.
Kation trimetylosulfoniowy jest bardzo skutecznym środkiem metylującym, ponieważ odchodząca grupa sulfidowa jest pozbawiona ładunku.
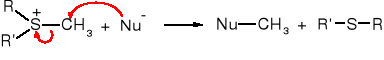
W ten sposób można metylować np. aminy. Pirydyna pod wpływem jodku trimetylosulfoniowego zostaje przekształcona w jodek N-metylopirydyniowy.
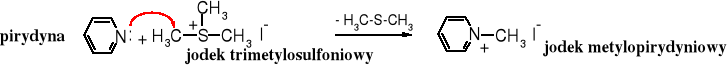
Reakcja metylowania za pomocą soli sulfoniowych służy do przenoszenia grupy metylowej w procesach biochemicznych. Źródłem grupy metylowej jest metionina, występująca w postaci soli sulfoniowej ugrupowania nukleozydowego zwanego S-adenozylometioniną - metionina (aminokwas) + ryboza (cukier) + adenina (zasada).
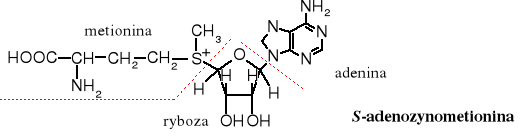
Budowa nukleotydów:
ryboza - cukier; adenina - zasada; cukier + zasada - nukleozyd
nukleozyd + kwas fosforowy - nukleotyd RNA lub DNA - polinukleotydy (kwasy nukleinowe)
11.6.3 Utlenianie tioli i sulfidów
Tiole mogą być utleniane poprzez odwodornienie; powstają wówczas disulfidy lub przez przyłączenie tlenu, co prowadzi do kwasów o różnym stopniu utlenienia.
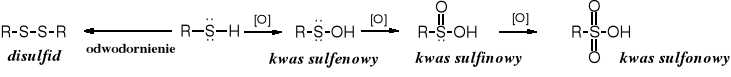
Poprzez utlenianie sulfidów otrzymuje się sulfotlenki i sulfony.
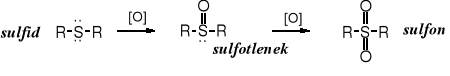
Sulfotlenki powstają w reakcjach z nadtlenkiem wodoru lub kwasem azotowym.
HOOH lub HNO3
sulfid dietylowy (CH3CH2)2S _____→ (CH3CH2)2SO sulfotlenek dietylowy
K2Cr2O7/H2SO4
sulfid dietylowy (CH3CH2)2S _____→ (CH3CH2)2SO2 sulfon dietylowy
lub HOOH/AcOH
Dimetylosulfotlenek (DMSO) - (CH3)2SO - jest bezbarwną cieczą, wrzącą w temperaturze 189oC (tt. 18,5oC), rozpuszczalną w wodzie i w większości rozpuszczalników organicznych. Znalazł zastosowanie jako wysokopolarny, aprotyczny rozpuszczalnik, przydatny w wielu reakcjach.
Niesymetrycznie podstawione sulfotlenki są chiralne, tworzą dające się rozdzielić enancjomery.

Kwasy sulfinowe są słabymi, nietrwałymi, rozpuszczalnymi w wodzie kwasami. Otrzymuje się je nie przez utlenianie tioli, ale w wyniku redukcji chlorków kwasów sulfonowych, np. cynkiem:
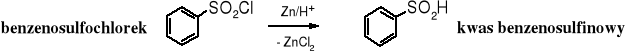
Kwasy sulfonowe są silnymi kwasami, o mocy porównywalnej z mocą kwasów nieorganicznych. Sodowe sole kwasów alifatycznych (mersolany) znalazły zastosowanie jako detergenty. Alifatyczne kwasy sulfonowe otrzymuje się na skalę przemysłową w reakcji sulfonowania alkanów ditlenkiem siarki w obecności tlenu (sulfoutlenianie) lub poprzez hydrolizę sulfochlorków (mersoli), które powstają w reakcji alkanów z ditlenkiem siarki i chlorem (sulfochlorowanie). Alifatyczne kwasy sulfonowe rzadko otrzymuje się laboratoryjnie.
Sulfochlorowanie:
25oC, h
alkany Alk-H + SO2 + Cl2 ___→ Alk-SO2Cl __→ Alk-SO3Na mersolany
- HCl mersole
Sulfoutlenianie:
SO2/O2
CnH2n+1CH2-CH2CmH2m+1 ___→ CnH2n+1CH-CH2CmH2m+1
25oC, h I
SO3H
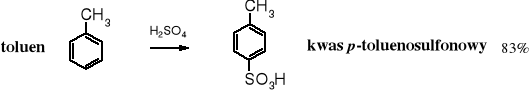
Aromatyczne kwasy sulfonowe wytwarza się zarówno w przemyśle, jak i w laboratorium przez sulfonowanie arenów kwasem siarkowym lub tritlenkiem siarki. Jest to reakcja substytucji elektrofilowej SE.
Wyszukiwarka