9. Magnetyczny Rezonans Jądrowy (NMR)
Temat: Interpretacja widm NMR wysokiej rozdzielczości
1. Wstęp teoretyczny
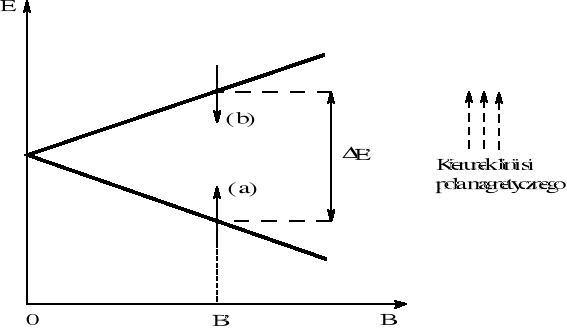
1.1. Jądra atomowe niektórych pierwiastków mają moment pędu, zwany spinem, w związku z czym wykazują właściwości magnetyczne. Poglądowo można przyjąć, że takie jądra wykonują ruch wirowy i wirowanie ładunku odpowiedzialne jest za ich magnetyczność. Jądra te charakteryzują się niezerową wartością liczby spinowej I. Jeśli tego rodzaju jądro umieści się w stałym, jednorodnym polu magnetycznym o indukcji B, wektor spinu przyjmie w przestrzeni tylko określone położenia, a o układzie powiemy, że jest skwantowany. Liczbę tych położeń określa wzór N=2I+1, gdzie I oznacza liczbę spinową. Na przykład proton 1H, a także izotop węgla 13C (jego naturalna zawartość wynosi ok. 1%, natomiast dominującym w przyrodzie izotopem węgla jest 12C), mają liczby spinowe równe ½, więc ich spiny zajmują w stałym zewnętrznym polu magnetycznym dwa różne położenia, ponieważ 2×½+1=2. Położenia te można opisać jako (a) - równoległe, (b) - antyrównoległe do linii sił pola, przy czym różnica energii między położeniami (a) i (b) pojawia się dopiero po przyłożeniu pola i jest proporcjonalna do jego indukcji B (Rys. 1).
Opisane zróżnicowanie energetyczne zwane jest rozszczepieniem zeemanowskim. Jądro izotopu węgla 12C ma liczbę spinową równą zeru, a więc jest niemagnetyczne i nie może być badane metodą NMR (Nuclear Magnetic Resonance - magnetyczny rezonans jądrowy).
Z reguł mechaniki kwantowej wynika, że zawsze występuje niewielki nadmiar jąder w niższym stanie energetycznym, a więc po zorientowaniu spinów w polu powstaje wypadkowy makroskopowy moment magnetyczny układu badanych jąder, który można opisać wektorem magnetyzacji, równoległym do linii sił pola B. Wektor ten wykonuje ruch wirowy wokół kierunku linii sił pola B z częstością proporcjonalną do wartości wektora indukcji B. W celu przeprowadzenia pomiaru metodą NMR impulsowo przykłada się dodatkowe, zmienne pole elektromagnetyczne, którego częstość g zrównuje się z częstością wirowania wektora magnetyzacji, reprezentującego badany rodzaj jąder. Gdy te częstości są równe, ma miejsce zjawisko rezonansu, i wtedy spełnione są równania
hg = ΔE' = Eb - Ea [1]
g = γB·h/2Π [2]
gdzie h oznacza stałą Plancka, a γ jest współczynnikiem magnetogirycznym. Ponieważ pasmo impulsowe jest wystarczająco szerokie (rzędu kiloherców), jednoczesnemu wzbudzeniu ulegną wszystkie jądra analizowanego pierwiastka, znajdujące się w różnych otoczeniach, a więc wchodzące w rezonans przy nieco różnych natężeniach pola. Częstość generatora zmiennego pola elektromagnetycznego sięga kilkuset megaherców, np. w nowoczesnych aparatach przy badaniu protonów stosuje się częstości 500-800 MHz.
W wyniku przyłożonego impulsu zmiennego pola elektromagnetycznego wektor magnetyzacji ulega wychyleniu, a następnie powraca do stanu równowagi dzięki procesom relaksacji, polegającym na bezemisyjnym oddawaniu przez jądra nadmiaru energii do otoczenia. Tzw. relaksacja podłużna, charakteryzowana przez czas T1, polega na wymianie energii spin-sieć, natomiast relaksacja poprzeczna, opisana czasem T2, dotyczy transferu energii między spinami pobliskich jąder. Procesy relaksacji odtwarzają pewien nadmiar jąder na niższym poziomie, co umożliwia pomiar metodą NMR. Detektor wykrywa emisję energii jąder po ustaniu wzbudzającego impulsu, wyrażoną przez zmniejszanie się wychylenia wektora magnetyzacji w płaszczyźnie xy, a rejestrowany zanikający sygnał zwany jest sygnałem swobodnej precesji (FID). Ten sygnał zawiera informację dotyczącą wszystkich badanych jąder układu, a jego analizę pod kątem wyodrębnienia danych o jądrach znajdujących się w różnych otoczeniach magnetycznych, czyli uzyskania widma NMR, przeprowadza się metodą transformacji Fouriera.
1.2. Efekt przesłaniania i przesunięcie chemiczne
W cząsteczce chemicznej poszczególne jądra atomowe znajdują się w różnych otoczeniach, co zasadniczo sprowadza się do wpływu odmiennych pól magnetycznych (oddziaływanie przez przestrzeń) oraz różnej gęstości elektronowej wokół atomów (oddziaływanie przez wiązania). Na przykład w przypadku kwasu propionowego CH3CH2COOH można zaobserwować trzy grupy równocennych protonów: metylowych CH3, metylenowych CH2 i kwasowych, jeśli widmo wykonywane jest w roztworze w temperaturze pokojowej. Chmury elektronowe w wyniku działania zewnętrznego stałego pola magnetycznego wprawiane są w ruch wirowy i, zgodnie z regułą przekory, wytwarzają pole przeciwnie skierowane względem pola przyłożonego, co wymaga z kolei większego natężenia przyłożonego pola B do przezwyciężenia tego efektu i do wywołania rezonansu. W takim przypadku na jądra atomowe oddziałuje pole Bef , słabsze od pola B. Zależność opisuje poniższy wzór, w którym σ oznacza stałą ekranowania.
Bef = B - σB [3]
W wyniku tego zjawiska protony z nierównocennych grup o różnych lokalnych gęstościach elektronowych będą wchodziły w rezonans przy odmiennych wartościach pola B dla stałej szybkości wirowania wektora M, czyli częstości oscylatora νg. Protony, wokół których gęstość elektronowa jest większa, będą wchodziły w rezonans przy wyższym natężeniu pola (będą „przesłaniane” i ich sygnał pojawi się bliżej prawego skraju widma), natomiast te, wokół których gęstość elektronowa jest mniejsza, np. usytuowane w pobliżu atomów elektronoakceptorowych, jak O lub Cl, dadzą sygnał rezonansowy przy mniejszym natężeniu pola. Sygnał ten pojawi się w lewej części widma i protony te określa się mianem „odsłanianych”.
Położenie sygnału na widmie wyznacza się za pomocą tzw. przesunięcia chemicznego. Definiuje się je następująco:
δ= Δν · 106/νg [4]
gdzie Δν oznacza różnicę między częstością rezonansową badanej próbki a częstością rezonansową wzorca (w Hz), a νg jest częstością generatora zmiennego pola elektromagnetycznego (w Hz). Współczynnik 106 wprowadzono w celu uzyskania wygodnych wartości liczbowych, a bezwymiarową jednostką jest ppm (part pro million, czyli część na milion).
Powszechnie stosowanym wzorcem jest tetrametylosilan (TMS), którego przesunięcie chemiczne przyjmuje się za 0 (wtedy skalę definiuje się jako skalę δ). Jego sygnał pojawia się zwykle na prawym skraju widma, a skala δ (w ppm) rozciąga się w lewo, przybierając dodatnie wartości. Większość sygnałów rezonansowych protonów mieści się w zakresie 0-10 ppm (δ), a wyjątkowo pojawia się poza zakresem 0-15 ppm. Typowe wartości przesunięć chemicznych dla protonów w różnych otoczeniach podano w Tablicy 1.
Tablica 1. Wartości przesunięć chemicznych dla protonów w różnych otoczeniach. Warunki pomiarów: roztwory 5-10% w obojętnym rozpuszczalniku, temperatura pokojowa.
Grupa funkcyjna |
δ, ppm |
Grupa funkcyjna |
δ, ppm |
CH2 cyklopropan |
0,2-0,3 |
CH3-O |
3,3-4,0 |
CH3-C nasycony |
0,8-1,1 |
NH1-2-Aryl |
3,3-4,2 |
R2NH |
0,4-1,6 |
ROH** |
3,0-5,2 |
CH2 nasycony |
1,2-1,4 |
CH2=C |
4,6-5,0 |
RSH |
1,1-1,5 |
RCH=C |
5,2-5,7 |
RNH2 |
1,1-1,7 |
Aryl-OH ** |
4,5-7,7 |
CH nasycony |
1,3-1,7 |
NH-C=O** |
5,5-8,5 |
CH3-C-X* |
1,1-2,0 |
Aryl-H |
6,5-8,5 |
CH3-C=C |
1,6-1,9 |
RNH3+ |
7,1-7,7 |
CH3-C=O |
1,9-2,7 |
HCOO - |
8,0-8,2 |
CH3-Aryl |
2,1-2,5 |
RCHO |
9,5-9,7 |
CH3-S |
2,1-2,8 |
Aryl-CHO |
9,5-10,2 |
CH3-N |
2,1-3,0 |
Aryl-OH *** |
10,5-14,0 |
H-C≡C |
2,4-2,7 |
RCOOH** |
10,0-13,0 |
W przypadku mniej typowych struktur wartości δ mogą nieco wykraczać poza podane zakresy. Wartości δ dla grup CH2 są większe o ok. 0,1-0,5 ppm od wartości dla CH3, podobna relacja zachodzi dla grup CH względem CH2.
R oznacza podstawnik alkilowy.
* X oznacza F, Cl, Br, I, OH, OR, OAryl, N.
** Gdy występują wiązania wodorowe międzycząsteczkowe.
*** Gdy występują wiązania wodorowe wewnątrzcząsteczkowe.
1.3. Rozszczepienie spinowo-spinowe
Dla widm 1H NMR charakterystyczna jest struktura subtelna, która polega na rozszczepieniu sygnałów na kilka składowych, pojawiających się w regularnych odstępach. Zjawisko to spowodowane jest obecnością sąsiednich jąder atomowych, wykazujących właściwości magnetyczne. Rozszczepienie tłumaczy się zakłócaniem zewnętrznego pola magnetycznego, oddziaływującego na protony jednej grupy, przez układy spinowe protonów grupy sąsiedniej. Tego rodzaju efekt przenosi się zwykle poprzez wiązania chemiczne.
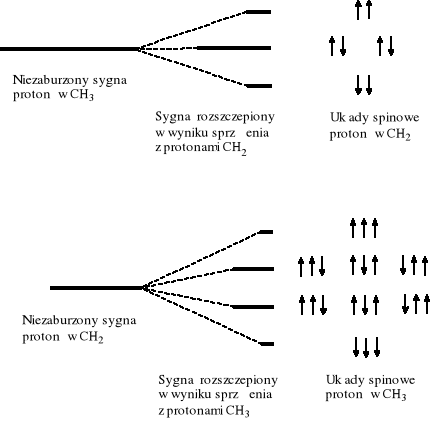
W celu zilustrowania zjawiska przykładem, analizie poddano układy spinowe grupy etylowej (Rys. 2). Dla dwóch protonów metylenowych CH2 istnieją trzy możliwe kombinacje orientacji spinowych, mogących wpływać na częstość rezonansową protonów grupy metylowej CH3. W takiej sytuacji sygnał protonów metylowych ulega rozszczepieniu na trzy składowe (tryplet), których powierzchnie mają się do siebie jak 1:2:1. Podobnie cztery kombinacje układów spinowych grupy metylowej wykazują wpływ na protony grupy metylenowej, która ulegnie rozszczepieniu na kwartet o stosunku powierzchni składowych jak 1:3:3:1. Intensywności składowych niezakłóconego multipletu określają współczynniki przy kolejnych wyrazach rozwiniętego dwumianu (a+b)n, gdzie n oznacza liczbę sąsiednich równocennych atomów wodoru, ulegających sprzężeniu. Odległości (w Hz) między składnikami multipletu są identyczne i noszą nazwę stałej sprzężenia (oznaczanej jako J). Stała sprzężenia mierzona w obu multipletach sprzęgających się jąder jest oczywiście taka sama.
Zgodnie z przeprowadzoną wyżej analizą rozszczepień spinowo-spinowych grupy etylowej, na widmie kwasu propionowego widoczny jest tryplet od grupy CH3 i kwartet od grupy CH2. Krotność multipletu dla układów protonowych można obliczyć ze wzoru (n+1), gdzie n jest liczbą równocennych protonów przy sąsiednim węglu (ogólny wzór dla magnetycznych jąder to (2nI+1)). W myśl tej reguły protony grupy CH3 mają 2 sąsiadów w grupie CH2, czyli krotność multipletu metylowego wyniesie (2+1)=3, natomiast grupa CH2 ma 3 sąsiadów (CH3), czyli jej sygnał zostanie rozszczepiony na (3+1)=4 części składowe.
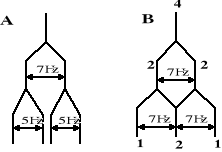
Wzór (n+1), określający krotność multipletu, można w pewnych przypadkach stosować do przybliżonych rozwiązań układów np. typu -CH2CH2CH3. Według tego wzoru środkowa grupa CH2 wystąpi w postaci sekstetu (układu o sześciu składowych), ponieważ ma w sumie 5 sąsiadów, a więc (5+1)=6. Warunkiem takiego stosowania wzoru (n+1) jest identyczność lub bardzo zbliżona wartość stałych sprzężeń badanych protonów z obydwiema sąsiednimi grupami. Jeśli warunek ten nie jest spełniony, krotność multipletu środkowej grupy CH2 wyniesie (n1+1)(n2+1), gdzie n1 i n2 oznaczają liczby protonów przy każdym z sąsiednich atomów węgla. Przykładem układu, który spełnia powyższą zależność, jest =CH-CH-NH-, w którym, JCH-CH=7 Hz, a JNH-CH=5 Hz. Wtedy krotność sygnału środkowego protonu CH wyniesie (1+1)(1+1)=4, lecz kształt tego multipletu, zwanego dubletem dubletów, będzie inny niż kwartetu, pokazanego na Rys. 2. Graficzne rozwiązanie problemu przedstawiono na Rys. 3 (A). Niezaburzony sygnał protonu CH rozszczepiany jest ze stałą sprzężenia 7 Hz przez proton CH przy sąsiednim węglu, a następnie każda składowa powstałego dubletu dodatkowo rozszczepiana jest przez proton NH ze stałą sprzężenia JNH-CH=5 Hz. Rys. 3 (B) pokazuje graficzne rozwiązanie multipletu grupy CH3 w podstawniku etylowym. W ten sposób można projektować także multiplety wynikające z bardziej złożonych sprzężeń, przy czym intensywności poszczególnych składowych sumują się, dając ostateczną proporcję składników multipletu.
Dotychczas rozważane były sprzężenia przez trzy wiązania H-C-C-H, zwane wicynalnymi. Takie sprzężenie przy swobodnej rotacji wokół wszystkich wiązań ma wartość ok. 7 Hz. W układach sztywnych (pierścienie), silnie niesymetrycznych i wykazujących zahamowaną rotację obserwuje się także sprzężenia geminalne przez dwa wiązania H-C-H, którego typowa wielkość wynosi 12-15 Hz (lecz dla układu =CH2 tylko ok. 1-2 Hz). Również silne jest sprzężenie przez 3 wiązania protonów olefinowych H-C=C-H (ok. 17 Hz dla izomeru trans, 10 Hz dla cis). W pierścieniu benzenowym sprzężenia są następujące: między protonami orto 9 Hz, meta 3 Hz, para 0 Hz. W układzie HC-HC=O stała sprzężenia wynosi ok. 2 Hz, a w =CH-CH 7 Hz. Sprzężenia dalekiego zasięgu, przez więcej niż 3 wiązania, występują głównie w układach nienasyconych, np. allilowych H-C=C-C-H (ok. 2 Hz) lub H-C-C=C-C-H (0-1,5 Hz). Ogólnie można stwierdzić, że wartości stałych sprzężeń między protonami zasadniczo mieszczą się w zakresie od 0 do 20 Hz i zależą zarówno od rodzaju atomów, przy których znajdują się protony, jaki i od geometrii sztywnych układów w cząsteczce.
1.4. Efekt indukcyjny, wymiana chemiczna i wartości całkowe - na przykładzie widma kwasu propionowego
Rys. 4. Efekty indukcyjne w cząsteczce kwasu propionowego.
W cząsteczce kwasu propionowego elektronoakceptorowy efekt indukcyjny, wywierany przez grupę karbonylową, przenosi się wzdłuż łańcucha węglowego. Silnie oddziaływuje na atom węgla α, a poprzez ten atom na protony α, znacznie słabiej na atom węgla β i protony β (Rys. 4). Wynika stąd wniosek, że elektrony są „odsysane” silniej z otoczenia protonów α niż β, czyli protony α będą silniej odsłaniane i ich sygnał pojawi się przy mniejszych wartościach natężenia pola (na lewo od sygnału protonów β). Protony β dadzą sygnał przy 1,1 ppm, natomiast α przy 2,4 ppm (widmo kwasu propionowego pokazane jest na Rys. 5).
Proton kwasowy COOH odsłaniany będzie najbardziej, ponieważ w wyniku silnego efektu indukcyjnego jest on częściowo zjonizowany (nosi ładunek cząstkowy δ+). Jego sygnał wystąpi więc w lewej części widma przy ok. 11,2 ppm.
Sygnał protonu kwasowego jest silnie poszerzony ze względu na wymianę międzycząsteczkową. Proces tego rodzaju, tzw. wymiana chemiczna, może powodować poszerzenie sygnałów ruchliwych protonów, jak np. OH, NH i COOH. Zwykle także jest przyczyną zaniku sprzężenia spinowo-spinowego tych protonów z protonami przy sąsiednich atomach węgla.
Pole pod każdym sygnałem rezonansowym jest proporcjonalne do liczby protonów, jakie ten sygnał reprezentuje. Spektrometr NMR dokonuje całkowania, czyli obliczania pola pod krzywą, automatycznie dla wszystkich sygnałów, podając wyniki liczbowo lub w postaci wznoszącej krzywej schodkowej, której wysokości „schodków” są proporcjonalne do wartości całkowej (integracyjnej). Dane te są wykorzystywane przy określaniu składu związku, a także przy pomiarach ilościowych.
1.5. Widma węglowe
Magnetyczny izotop węgla 13C, który można analizować metodą NMR, to tylko 1% węgla, występującego w przyrodzie - resztę głównie stanowi nieaktywny magnetycznie izotop 12C. Ten fakt, a także 4-krotnie mniejszy współczynnik magnetogiryczny oraz długie czasy relaksacji węgla w porównaniu z protonem powodują, że do zapisu widm 13C NMR potrzebna jest aparatura czulsza o 3 rzędy wielkości niż w przypadku 1H NMR.
Węgiel 13C ma liczbę spinową I równą ½ (podobnie jak 1H) i sprzęga się z protonami znajdującymi się bezpośrednio przy nim, a także - ze względu na duże stałe sprzężenia - z dalszymi, nawet przez kilka wiązań. W takiej sytuacji powstaje bardzo złożony obraz widmowy, więc w celu jego uproszczenia pomiary 13C NMR wykonuje się zwykle przy całkowitym rozprzęganiu spinów, a więc sprzężenia z protonami w ogóle nie są widoczne. W rezultacie sygnały odmiennych magnetycznie atomów węgla występują w postaci pojedynczych ostrych sygnałów, których przesunięcia chemiczne zależą od lokalnego rozkładu gęstości elektronowej, podobnie jak w przypadku protonów. Przypisań dokonuje się więc zasadniczo w oparciu o wielkości przesunięć chemicznych sygnałów. Wartości całkowych w standardowych widmach 13C nie da się wykorzystać ze względu na długie czasy relaksacji niektórych atomów, np. IV-rzędowych, a więc intensywności sygnałów nie muszą być proporcjonalne do zawartości odpowiadających im atomów. Zwykle największą intensywność wykazują sygnały tych atomów węgla, przy których znajduje się najwięcej protonów.
W Tablicy 2 podano wybrane przesunięcia chemiczne dla 13C w różnych otoczeniach. Korzystając z tych danych można zaprojektować widmo węglowe kwasu propionowego i zapisać zakresy przesunięć chemicznych w następujący sposób (w ppm, δ):
5-35 (CH3); 15-55 (CH2); 165-190 (COOH).
Dokładne przesunięcia chemiczne dla tego związku wynoszą:
8,90 (CH3); 27,60 (CH2); 181,00 (COOH).
Tablica 2. Orientacyjne wartości przesunięć chemicznych dla atomów węgla 13C w różnych otoczeniach. Widma wykonano w roztworach 5-10% w rozpuszczalniku o słabych oddziaływniach międzymolekularnych w temperaturze pokojowej.
Grupa funkcyjna |
δ, ppm |
Grupa funkcyjna |
δ, ppm |
CH3 |
5-35 |
C-O-C etery |
55-90 |
CH2 |
12-55 |
C-F1-3 |
7-135 |
CH |
25-60 |
C-Cl1-4 |
20-100 |
C |
30-40 |
C-Br1-4 |
(-30)-35 |
CH2= |
105-122 |
C-I1-4 |
(-293)-43 |
=CH-R |
110-150 |
C-NR2 aminy |
20-70 |
=CH-X* |
80-170 |
C-NO2 nitrozwiązki |
60-80 |
C=C=C skrajne |
70-95 |
RCHO aldehydy |
195-220 |
C=C=C środkowy |
200-215 |
R2C=O ketony |
193-220 |
HC≡C-R skrajny |
62-75 |
RCOOH kwasy |
165-190 |
HC≡C-R środkowy |
70-90 |
RCOO - sole |
175-195 |
C≡C-X* |
20-95 |
RCOOR' estry |
156-177 |
C aromatyczne |
95-160 |
RCONH2 amidy |
150-176 |
C-OH alkohole |
45-90 |
RC≡N nitryle |
108-125 |
R oznacza H lub podstawnik alkilowy.
* X oznacza polarne podstawniki, jak np. OH, OR, OAryl, N.
2. Wykonanie ćwiczenia
Celem ćwiczenia jest interpretacja widm NMR wysokiej rozdzielczości: projektowanie widm znanych związków oraz identyfikacja związków o nieznanej budowie.
2.1. Należy zaprojektować widma 1H i 13C NMR para-metoksytoluenu:
Kolejność czynności:
Na podstawie danych tablicowych określa się:
przesunięcia chemiczne dla poszczególnych grup protonów i atomów węgla;
stałe sprzężenia między grupami protonów.
Przy szkicowaniu widm należy uwzględnić:
położenia sygnałów na skali przesunięć chemicznych δ (od TMS);
krotność multipletów wg wzoru (n+1) dla protonów; przy wyznaczaniu krotności zaleca się zastosowanie także metody graficznej;
wartości integracyjne sygnałów, proporcjonalne do liczby protonów.
2.2. Postępując jak w p. 1, należy zaprojektować widma 1H i 13C NMR dla alkoholu izobutylowego:
w następujących rozpuszczalnikach:
a) deuterochloroform,
b) d6-dimetylosulfotlenek,
c) D2O.
Komentarz. Deuterochloroform (CDCl3) jest rozpuszczalnikiem o słabych oddziaływaniach z substancją rozpuszczoną, zasadniczo powodującym tylko rozcieńczenie próbki. D6-dimetylosulfotlenek (CH3)2S=O tworzy silne wiązanie wodorowe z atomem wodoru alkoholowej grupy OH, w wyniku czego wymiana chemiczna tego wodoru zostaje znacznie spowolniona. Nadmiar ciężkiej wody (tlenku deuteru D2O) powoduje podstawienie ruchliwego atomu wodoru OH przez deuter, którego sygnał nie jest widoczny w badanym zakresie widmowym.
2.3. Należy zidentyfikować związki I i II na podstawie widm 1H i 13C NMR, pokazanych na Rys. 6 i Rys. 7. Wartości integracyjne dla protonów odczytuje się z krzywej całkowania.
Sposób postępowania:
wyznacza się liczbę grup równocennych protonów, równą liczbie sygnałów (singletów lub multipletów) na widmie, i na podstawie przesunięć chemicznych określa się wchodzące w rachubę grupy funkcyjne;
na podstawie kształtu multipletów, liczby sygnałów wchodzących w ich skład oraz wielkości stałych sprzężeń wyznacza się liczby protonów w poszczególnych grupach funkcyjnych przy zastosowaniu wzoru (n+1);
należy naszkicować sprzężone układy w uprzednio zidentyfikowanych grupach funkcyjnych, a następnie połączyć uzyskane fragmenty w cząsteczkę zgodnie z podanym wzorem sumarycznym.
Komentarz do uzyskanych wyników powinien zawierać opis toku rozumowania i sposobu postępowania.
3. Opracowanie wyników.
3.1. Sprawozdanie powinno zawierać dyskusję wyników, uzyskanych podczas wykonywania ćwiczenia.
3.2. Ponadto na podstawie niżej opisanych widm należy zidentyfikować związki A i B:
A: Wzór sumaryczny C6H14O.
1H NMR: dublet przy 1,05 ppm (J=6,1 Hz, 12H); heptet (7 składników) przy 3,56 ppm (J=6,1 Hz, 2H).
13C NMR: sygnały przy ppm 22,7 (intensywność 100%) i 68,4 (int. 40%).
B: Wzór sumaryczny C3H6O.
1H NMR: tryplet przy 1,13 ppm (3H, J=7,3 Hz), kwartet dubletów przy 2,45 ppm (2H, J1=7,3 Hz; J2=2,1 Hz), tryplet przy 9,72 (J=2,1 Hz, 1H). Występujący na widmie kwartet dubletów pokazany jest na rysunku poniżej.
13C NMR: sygnały przy ppm 6,0 (int. 100%), 37,3 (80%), 202,8 (50%).
Sposób postępowania. Na podstawie powyższych danych należy narysować widma, a następnie zinterpretować je w sposób podany w części Wykonanie ćwiczenia, p. 3. Wyniki trzeba uzasadnić i opisać sposób postępowania.
.
Rys. 7. Widma protonowe i węglowe związku II o wzorze sumarycznym C8H12O4.
4. Zagadnienia do opracowania
Podstawy teorii magnetycznego rezonansu jądrowego (m. in. pojęcie spinu, warunku rezonansu, relaksacji, przesunięcia chemicznego, struktury subtelnej, wartości całkowych, wymiany chemicznej, zależności stałych sprzężenia od struktury).
Metodyka interpretacji widma 1H i 13C NMR.
Projektowanie widm NMR. Metoda arytmetyczna i graficzna przy analizie multipletów.
Zastosowania metody NMR (w chemii: identyfikacja związków, badania strukturalne, analiza jakościowa i ilościowa, badania dynamiki molekuł, rodzaje badanych jąder; w medycynie: tomografia, spektroskopia in vivo).
Rachunek błędów: określenie błędów całkowania i pomiarów stałych sprzężeń na widmach NMR.
5. Piśmiennictwo
Metody spektroskopowe i ich zastosowanie do identyfikacji związków organicznych, praca zbior. pod red. W. Zielińskiego i A. Rajcy, W.N.T., wyd. II, Warszawa 2000.
Farmacja fizyczna, praca zbior. pod red. T.W. Hermanna, PZWL, Warszawa 1999.
Z. Kęcki, Podstawy spektroskopii molekularnej, P.W.N., Warszawa 1992.
H. Gunther, Spektroskopia magnetycznego rezonansu jądrowego, P.W.N., Warszawa 1983.
7
120
TWÓJ BIOTECHNOLOG https://www.facebook.com/twoj.biotechnolog
106
Rys. 1. Rozszczepienie poziomów energetycznych jądra o spinie ½ w stałym polu magnetycznym.
Rys. 2. Orientacje spinowe i schemat rozszczepień protonów grupy etylowej CH3CH2-.
Rys. 3. Graficzne rozwiązania: A) multipletu protonu =CH-CH-NH- przy stałych sprzężenia JCH-CH=7Hz i JNH-CH=5Hz, B) multipletu protonów -CH2CH3 - podano intensywności składowych: 4 - niezaburzonego sygnału, 1:2:1 - w końcowym tryplecie.
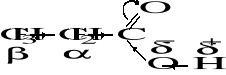
CH3CH2COOH
CH3
CH2C:O
COOH
Rys. 5. Widmo 1H NMR kwasu propionowego, 5% roztwór w obojętnym rozpuszczalniku
7
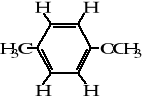
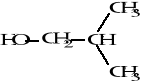
I: 1H NMR
I: 13C NMR
Rys. 6. Widma protonowe i węglowe związku I o wzorze sumarycznym C5H10O2
II: 1H NMR
II: 13C NMR
Wyszukiwarka