WfiTJ |
1.Urszula Jeleń 2.Marcin Sikora
|
Rok 2 |
Grupa |
Zespół: |
|
Pracownia Fizyczna 2 |
Temat: Kriogenika.
|
Nr ćw. 113 |
|||
Data wykonania: 13.10.1998
|
Data oddania:
|
Zwrot do poprawy: |
Data oddania: |
Data zaliczenia: |
OCENA: |
Wprowadzenie
Ciekły azot jest najpowszechniej używaną cieczą kriogeniczną. Azot został skroplony po raz pierwszy w Krakowie w 1883 r. przez profesorów Uniwersytetu Jagiellońskiego Z. Wróblewskiego i K. Olszewskiego. Obecnie znajduje szerokie zastosowanie w nauce i technice. W Polsce produkcja ciekłego azotu wynosi wiele tysięcy ton rocznie.
Diagram fazowy azotu, czyli obszar występowania faz : stałej, ciekłej i gazowej w funkcji ciśnienia i temperatury, przedstawia rys. 1. Pod ciśnieniem atmosferycznym azot wrze w temperaturze Tw =77,3 K, a krystalizuje w ciało stałe w temperaturze topnienia Tt=63,1 K. Wzrost ciśnienia powoduje wzrost temperatury aż do osiągnięcia punktu krytycznego K, przy którym zanika różnica między cieczą i gazem..
Obniżanie ciśnienia przez odpompowanie par powoduje obniżenie temperatury wrzenia aż do osiągnięcia punktu potrójnego P, w którym wszystkie stany skupienia mogą koegzystować w stanie równowagi. Pewną osobliwością stałego azotu jest występowanie dwóch faz krystalicznych, różniących się rodzajem struktury. Zarówno gazowy azot, jak ciekły i obie fazy stałe zbudowane są z cząsteczek N2. Podstawowe własności fizyczne azotu zostały zebrane w tabeli 1.
Wszystkie przemiany fazowe zachodzące na linii granic fazowych (wrzenie, topnienie, sublimacja, zmiana struktury) stanowią przykład nieciągłych przejść fazowych, zwanych też przejściami I rodzaju.
Nieciągłe przejście fazowe charakteryzuje się tym, że podstawowe funkcje termodynamiczne: energia wewnętrzna i entropia zmieniają się skokowo przy przejściu od fazy do fazy. Różnica energii wewnętrznych obydwu faz stanowi utajone ciepło przemiany (np. ciepło topnienia, parowanie itp.).
Przeciwieństwem nieciągłych przemian fazowych są przemiany ciągłe, których przykładami mogą być przejścia: ferromagnetyk - paramagnetyk, względnie: metal normalny - nadprzewodnik. W przypadku przejść ciągłych utajone ciepło przemiany nie występuje.
Zastosowanie praw termodynamiki do przejścia nieciągłego prowadzi do ważnego równania Clausiusa- Clapeyrona
gdzie: dT/dp - nachylenie stycznej do granicy między fazowej na wykresie,
T - temperatura przejścia,
ΔV= V1-V2 - różnica objętości obydwu faz,
Q - utajone ciepło przemiany
Własności fizyczne azotu
1. |
Temperatura wrzenia |
Tw=77,3 K |
2. |
Temperatura topnienia |
Tt=63,1 K |
3. |
Temperatura zmiany struktury z heksagonalnej na kubiczną |
Ts=35,7 K
|
4. |
Ciepło parowania |
Qp=199 J/g |
5. |
Ciepło topnienia |
Qt=25,5 J/g |
6. |
Gęstość w stanie ciekłym |
ρ=0,808 g/cm3 |
7. |
Ciepło właściwe w stanie ciekłym |
Cp=2,0 J/g*K |
8. |
Parametry punktu potrójnego |
Tp=63,1 K pp=2,73*103 Pa |
9. |
Parametry punktu krytycznego |
Tk=126 K pk=33,9*105 Pa ρk=0,31 g/cm3 |
Równanie Clausiusa- Clapeyron pozwala wyznaczyć ciepło przemiany bez potrzeby wykonywania pomiarów kalorymetrycznych. Wartości dT/dp, T, ΔV należy oczywiście ustalić dla konkretnego punktu na granicy fazowej, np. dla temperatury wrzenia pod ciśnieniem atmosferycznym.
Sumaryczny dopływ ciepła do kriostatu wypełnionego skroplonym gazem nosi nazwę mocy strat cieplnych PS. Pod wpływem mocy strat PS następuje ciągły ubytek cieczy z kriostatu na skutek parowania. Ubytek masy m1 w czasie t1 wynika z równości:
m1*Q=PS*t1
Jeżeli za pomocą opornika doprowadzimy do kriostatu dodatkową moc cieplną PZ, np. przez podgrzewanie prądem niewielkiego opornika, to szybkość ulatniania się azotu wzrośnie:
m2*Q=(PS+PZ)t2
Z układu tych równań można wyznaczyć niewiadome ciepło parowania Q i moc strat cieplnych. Wystarczy w tym celu zmierzyć czasy potrzebne do wyparowania określonej masy m azotu bez grzejnika t1 i z włączonym grzejnikiem t2.
Przebieg doświadczenia i opracowanie wyników
Wyznaczenie zależności temperatury wrzenia od ciśnienia.Po podłączeniu układu pomiarowego przystąpiliśmy do wykonywania pomiarów oporu.
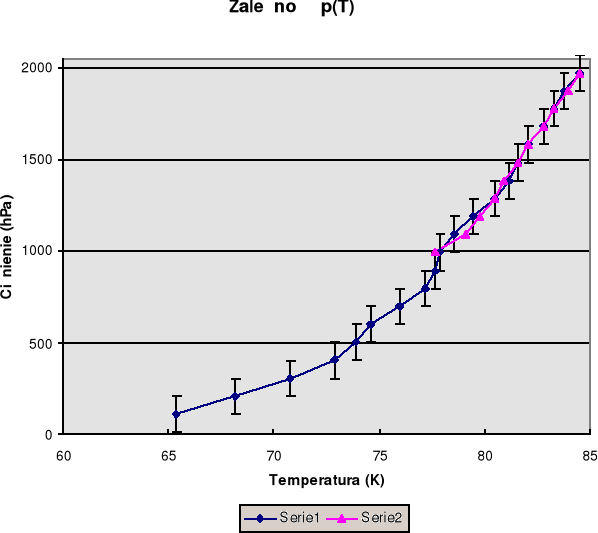
Korzystając z tabeli cechowania termopary wyrażono uzyskane odczyty woltomierza w kelwinach [K]. Poniższa tabelka zawiera wartości temperatur zależne od ciśnienia. Zależność tą przedstawia dołączony wykres p(T). Seria 1 przedstawia temperaturę wrzenia przy obniżaniu ciśnienia od 1973 do 109,1 hPa. Natomiast seria druga przedstawia temperaturę wrzenia przy podwyższaniu ciśnienia od panującego w pracowni 992 hPa do 1972 hPa. Ponieważ seria 1 i 2 prawie się pokrywają więc można sądzić, że doświadczenie zostało wykonane prawidłowo.
Ciśnienie [hPa] |
Temperatura Wrzenia [K] Seria 1 |
Temperatura Wrzenia [K] Seria 2 |
109,1 |
65,3 |
|
207,2 |
68,2 |
|
305,3 |
70,8 |
|
403,4 |
72,9 |
|
501,5 |
73,9 |
|
599,6 |
74,6 |
|
697,7 |
76 |
|
795,8 |
77,2 |
|
893,9 |
77,7 |
|
992 |
77,9 |
77,7 |
1090,1 |
78,6 |
79,1 |
1188,2 |
79,5 |
79,8 |
1286,3 |
80,5 |
80,5 |
1384,4 |
81,2 |
80,9 |
1482,5 |
81,6 |
81,6 |
1580,6 |
82,1 |
82,1 |
1678,7 |
82,8 |
82,8 |
1776,8 |
83,3 |
83,3 |
1874,9 |
83,8 |
84 |
1973 |
84,5 |
84,5 |
Cisnienie zmienialiśmy co 0,1 kG/cm2 otrzymane wyniki w [hPa] znajdują się w tabelce Zależność między jednostkami ciśnień :
1[kG/cm2] = 981[hPa]
Ciśnienie atmosferyczne panujące w pracowni odczytaliśmy jako 992 [hPa]
Rachunek błędów
Ciśnienie odczytywaliśmy na manometrze mechanicznym, którego błąd przyjeliśmy z dokładnością do jego podziałki tj. ± 0,1 kG/cm2 . Jak wspomnialiśmy wyżej : 1[kG/cm2] = 981[hPa] to błąd względny ciśnienia wynosi:
δp=0,1*981=98,1≈98 [hPa]
Jak widzimy na wykresie zależności p(T) wyniki serii pierwszej i drugiej pokrywają się w granicach błędów ( błędów serii 2 nie zaznaczaliśmy na wykresie dla przejrzystości ) co pozwala nam twierdzić, że wyniki są wiarygodne.
Błędu temperatury nie potrafimy określić ponieważ odczytując opór z omomierza i odczytując wartość temperatury z tabelki nie wiemy jakie jest przenoszenie błędu. Należy jednak sądzić, że odczytana temperatura jest na tyle dokładna, że można ich nie uwzględniać.
Obliczamy ciepło parowania:
Z równania gazu doskonałego pV = nRT
i korzystając ze wzoru n = m/M = 35,7 ± 0,1 [mol]
gdzie n - liczba moli [mol]
m - masa substancji przyjmujemy 1000 [g]
M - masa molowa dla azotu N2 = 28 [g mol-1]
R -stała gazowa = 8,3144 [J mol-1 K-1]
T- temperatura azotu pod ciśnieniem atmosferycznym = 77,8 ± 1 [K] (dok. termometru )
p- ciśnienie panujące w pracowni =992 ± 1 [hPa] (dokładność barometru )
q - gęstość azotu w stanie ciekłym = 808 [kg/m3]
dp/dT - nachylenie stycznej do wykresu p(T) w granicy między fazowej
Wartość dp/dT odczytana z wykresu dla p = 992 hPa wynosi 0,0001 Pa/T
Z równania Clausiusa- Clapeyrona --> [Author:S]
gdzie:
dp/dT - nachylenie stycznej do wykresu p(T) w granicy między fazowej
Wartość dp/dT odczytana z wykresu dla p = 992 hPa wynosi 0,0001 Pa/T
ΔV = Vg - Vc
Vg=(nRT)/p =0,2328 m3 - objętość azotu w stanie gazowym
Vc=m/q=1/808=0,0012 m3 - objętość azotu w stanie ciekłym
otrzymujemy wartość ciepła parowania równą Qpar= 180 J/g
Wartość tablicowa wynosi 199 [J/g], więc wynik przez nas uzyskany jest o 9,5% mniejszy od wartości tablicowej.
Bezpośredni pomiar ciepła parowania
Przy bezpośrednim pomiarze ciepła parowania wykorzystując dodatkowe źródło ciepła otrzymaliśmy korzystając z układu równań:
(1) m1Q = Ps* t1
(2) m2Q = ( Ps +Pz )* t2
I=60 ± 10 mA m1 = m2 = Πr2qΔh = 6,4 g
U=12,5 ± 0,1V gdzie : r = 6,5 mm
Δh = 6 cm q = 808 kg/m3 -gęstość azotu w stanie ciekłym
Ps = 1,25 [W]
Pz = I*U=0,75 [W]
t1 = 16 ±1[min]
t2 = 10 ±1[min]
Qpar = 187,5 J/g
Rachunek błędów:
Wszystkie wartości są niezależne więc możemy je obliczyc ze wzorów :
δt1/ t1 =0,06
δt2/ t2 = 0,1
(δ(t1-t2))2 = (δt1)2 + (δt2)2 ⇒δ(t1-t2) = 0,12 ⇒δ(t1-t2) / (t1-t2) = 0,02
Qpar obliczyliśmy ze wzoru (1): Q = (Ps*t1) / m .
Z prawa przenoszenia błędów obliczamy błąd δQ par :
(δQ par/Q par)2 = (δPs/Ps)2 + (δΔh/Δh)2 + (δm/m.)2
W tym celu obliczamy błąd δPs/Ps :
(δPz/ Pz)2 = (δI/ I)2 + (δU/ U)2 ⇒ δPz/ Pz = 0,17
(δPzt2 / Pzt2)2 = (δPz/ Pz)2 + (δt2/ t2)2 ⇒ δPzt2 / Pzt2=0,19
(δPs/Ps)2= (δPzt2 / Pzt2)2+ (δ(t1-t2) / (t1-t2) )2 ⇒ δPs/Ps = 0,2
oraz błąd δm.:
m = Πr2qΔh
δr = 2 mm
Δh = 1 cm
Przyjeliśmy takie duże błędy ponieważ były duże trudności z wyznaczeniem średnicy naczynia w którym odparowywaliśmy azot i położenia powierzchni wrzącego azotu..
(δm/m.)2 = 2(δr/r)2 +(δΔh/Δh)2 ⇒ δm/m. = 0,2
Teraz możemy obliczyć błąd δQpar korzystając z zależności (3) : δQpar = 56 J/g
Qpar= 188 ± 56 J/g
Wnioski:
Kilkakrotnie próbowaliśmy wyznaczyć ciśnienie punktu potrójnego. Jednak kolejne serie dla ciśnień niższych od atmosferycznego nie zwracały zbliżonych wartości.
W doświadczeniu uzyskaliśmy zadowalające wyniki porównywalne z tablicowymi dla ciepła parowania z wykresu p(T) Qpar= 180 J/g a z metody bezpośredniej Qpar= 188 ± 56 J/g.
p
pK
K
Ciecz
Ciało stałe
p0
Gaz
pP
TK
TW
TT ≈TP
TS
T
Wyszukiwarka