Kurs przygotowawczy do egzaminu maturalnego z chemii
MODUŁ 4P
Stechiometria
poziom podstawowy
Liceum Ogólnokształcące i Liceum Profilowane w Resku
OBLICZENIA DOTYCZĄCE MOLA DROBIN SUBSTANCJI CHEMICZNEJ
Mol - stanowi porcję drobin (atomów, jonów, cząsteczek, cząstek elementarnych) każdej substancji chemicznej zawierającą 6,023 · 1023 drobin tej substancji
Liczba drobin zawarta w n molach substancji wynosi:
liczba drobin = N = n · 6,023 1023 drobin/mol
Gdzie n to liczba moli.
Liczba Avogadro - NA, to właśnie liczba 6,023 · 1023. Można zatem zapisać, że
N = n · NA
Przedstawiona zależność umożliwia obliczenie liczby moli drobin substancji, jeśli znana jest drobin tej substancji:
![]()
Przykład
Do spalenia 4 moli atomów glinu potrzeba 3 mole cząsteczek tlenu. Oblicz, ile:
a) atomów glinu, b)cząsteczek tlenu bierze udział w tej reakcji.
Rozwiązanie:
Dane: n1 = 4 mole atomów Al. n2 = 3 mole cząsteczek tlenu.
Szukane: liczba atomów Al. = NAl, liczba cząsteczek tlenu = NO2
NAl = n1 · NA = 4 mol · 6,02 1023 atomów/mol = 24,08 · 1023 atomów glinu =
= 2,4 · 1024 atomów glinu
NO2 = n2 · NA = 3 mol · 6,02 · 1032 cząsteczek/mol = 18,06 · 1023 cząsteczek =
= 1,8 · 1024 cząsteczek tlenu
Odpowiedź: W reakcji bierze udział 2,4 · 1024 atomów glinu i 1,8 · 1024 cząsteczek tlenu.
Zadania:
W pewnej reakcji chemicznej wzięło udział 1,5 mola cząsteczek substancji. Oblicz, jaka liczba cząsteczek tej substancji wzięła udział w reakcji.
Pewna ilość substancji zawiera 1,505 · 1023 cząsteczek. Oblicz, jaką część mola tej substancji stanowi wymieniona liczba cząsteczek.
W wyniku spalenia 1 mola węglowodoru powstały 3 mole CO2 i 4 mole H2O. Oblicz sumaryczną liczbę cząsteczek otrzymanych w tej reakcji.
W pewnej reakcji otrzymano 0,75 mola amoniaku NH3. Oblicz, ile atomów azotu i ile atomów wodoru zawiera te 0,75 mola NH3.
1 mol atomów siarki ma masę 32 g. Jaką masę ma pojedynczy atom siarki?
Jeden gram to jeden mol jednostek masy atomowej [ NA · 1 u = 1 g]. Oblicz na tej podstawie , ile gramów i ile kilogramów ma jednostka masy atomowej.
OBLICZENIA DOTYCZĄCE MASY MOLOWEJ SUBSTANCJI
Masa jednego mola drobin Mmol każdej substancji chemicznej, wyrażona
w g/mol, nosi nazwę masy molowej. Jest ona liczbowo równa masie atomowej mat lub masie cząsteczkowej mcz.Zależność miedzy masą substancji m a jej masą molową Mmol jest następująca:
M = n · Mmol, [g], gdzie
m - masa substancji, [g]
n - liczba moli substancji, [mol]
Mmol - masa molowa, [g/mol]
Przykład:
Oblicz mase molową substancji, której 3,01 · 1023 cząsteczek ma masę równą 22 g.
Dane: m = 22 g N = 3,01 · 1023 drobin
Szukane: Mmol = ?
Obliczamy liczbę moli:
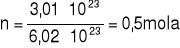
Obliczamy masę molowa:
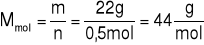
Odpowiedź: Masa molowa tej substancji wynosi 44 g/mol.
Zadania:
Oblicz masę 3,5 mola cząsteczek substancji chemicznej o wzorze
C6 H12O6.
Oblicz, jaką część mola cząsteczek substancji o wzorze C3H8O3 stanowi 9,2 g tej substancji.
Oblicz, jaką masę molową ma substancja, skoro masa 9,8 g stanowi 0,1 mola cząsteczek tej substancji.
W reakcji wzięło udział 8 g cząsteczek tlenu. Oblicz, ile to
moli cząsteczek tlenu,
atomów tlenu.
Każdy atom miedzi posiada 2 elektrony swobodne, biorące udział w przewodzeniu prądu elektrycznego. Oblicz, ile elektronów swobodnych znajduje się w przewodzie miedzianym o masie 100 g.
6. Ile atomów sodu znajduje się w próbce węglanu sodu Na2CO3 o masie m = 10,6 g.
OBLICZENIA DOTYCZĄCE OBJĘTOŚCI MOLOWEJ
Objętość jednego mola drobin substancji gazowej, wyrażona w dm3/ mol, nosi nazwę objętości molowej Vmol
Vmol = 22,4 ![]()
Objętość 22,4 dm3/mol odnosi się wyłącznie do warunków normalnych, tzn. temperatury 00C i ciśnieniu 1013 hPa.
Liczba moli drobin n, zawartych w danej objętości gazu v, może być obliczona na podstawie następującej zależności:
![]()
, mol
n - liczba moli drobin, [mol]
V - objętość substancji gazowej, [dm3]
Vmol - objętość molowa [dm3/mol]
Zastąpienie liczby moli n wyrażeniem
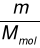
prowadzi do utworzenia zależności umożliwiającej obliczanie zarówno masy, jak i objętości substancji gazowej:
![]()
[g]
Przykład:
Oblicz, jaką objętość zajmują w warunkach normalnych 64 g metanu.
Dane: m = 64 g Mmol = 16 g/mol Vmol = 22,4 dm3/mol
Szukane: V
Rozwiązanie: 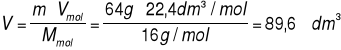
Odpowiedź: 64 g metanu zajmują objętość 89,6 dm3.
Zadania:
Oblicz, jaką liczbę moli cząsteczek tlenu (O2) zawiera butla mieszcząca 44,8 dm3 tego gazu w warunkach normalnych.
Oblicz, jaką objętość w warunkach normalnych zajmuje 2,5 mola cząsteczek ozonu (O3).
Oblicz masę odmierzonej w warunkach normalnych objętości 100 dm3 tlenku węgla(IV).
Jaką objętość zajmie w warunkach normalnych 85 g amoniaku NH3?
Ile cząsteczek tlenku węgla(II) zawiera pojemnik o objętości 5 m3 zmierzonych w warunkach normalnych?
W pewnej reakcji otrzymano 5,6 dm3 chloru w warunkach normalnych. Jaka była masa otrzymanego chloru?
OBLICZENIA NA PODSTAWIE WZORÓW CHEMICZNYCH
Wzór chemiczny każdego związku, np. AxBy, interpretuje się jako 1 mol drobin tego związku, a występujące we wzorze indeksy stechiometryczne x i y jako liczby moli drobin pierwiastków A i B.
Na przykład:
Wskazanym liczbom moli drobin odpowiadają określone masy substancji.
Powyższa interpretacja umożliwia obliczanie zarówno liczby moli drobin, jak też liczby gramów każdego pierwiastka składowego w podanej liczbie moli lub gramów związku chemicznego. Potrzebne jest do tego ułożenie zależności (proporcji) między wielkościami odczytanymi ze wzoru chemicznego a wielkościami danymi i szukanymi występującymi w zadaniu.
Oblicz, ile gramów siarki znajduje się w 3,42 g siarczanu(VI) glinu.
Oblicz, ile moli atomów tlenu znajduje się w 3,1 g fosforanu(V) wapnia.
Oblicz, w ilu gramach tlenku azotu(V) znajduje się 0,5 mola atomów azotu.
Oblicz, ile gramów wody znajduje się w 25 g pięciowodnego siarczanu(VI) miedzi(II).
Równanie reakcji chemicznej informuje o rodzaju i ilości reagujących ze sobą substancji. Liczbę moli drobin tych substancji oraz odpowiadające im masy i objętości określają współczynniki stechiometryczne występujące w równaniu reakcji.
Przykładowe zależności:
Taka interpretacja równania reakcji pozwala na obliczenie:
Liczby moli reagentów,
Masy reagentów
Objętości ragentów gazowych
Liczby drobin reagentów
W prowadzonych obliczeniach wygodnie jest zapisywać dane i szukane ilości reagentów (zawarte w zadaniu) nad równaniem reakcji natomiast ilości wynikające z równania - pod równaniem. (Z powodzeniem można stosować odwrotny sposób). Należy przy tym pamiętać, że w zapisie nad i pod reakcją muszą występować zgodne jednostki (te same).
Oblicz, ile moli atomów siarki przereaguje z 3,6 g glinu.
Oblicz, jaka objętość tlenku azotu(IV) powstanie w wyniku reakcji 6,4 g miedzi z siarką.
Oblicz, jaka objętość tlenku węgla(IV) powstanie w wyniku reakcji tlenku węgla(II) z 2,8 dm3 tlenu.
Oblicz, ile gramów kwasu fosforowego(V) potrzeba na zobojętnienie 6 g wodorotlenku sodu.
Oblicz, ile cząsteczek chloru przereaguje z 2,3 gramami sodu podczas otrzymywania chlorku sodu.
0,1 mola tlenu,
32 gramów tlenu,
6,02 · 1023 cząsteczek tlenu,.
5,6 dm3 tlenu (w warunkach normalnych)
Wiórki magnezu o masie 2,4 g spalono w tlenie i otrzymano 4 g tlenku magnezu. Zapisz równanie reakcji i oblicz masę tlenu, który przereagował z magnezem.
Oblicz skład procentowy tlenku magnezu.
Oblicz, ile gramów tlenku węgla(IV) powstanie, jeśli w reakcji bierze udział 31 g węglanu wapnia.
Oblicz, ile to stanowi moli cząsteczek tlenku węgla(IV).
Oblicz, jaką objętość zajmie powstały tlenek węgla(IV) w warunkach normalnych.
0,1 mola sodu.
56 g żelaza.
3,01 · 1024 cząsteczek azotu.
0,1 mola wody.
Ułóż równanie reakcji termicznego rozkładu manganianu(VII) potasu.
Oblicz, ile dm3 tlenu powstanie w warunkach normalnych z rozkładu 10 g tej soli, jeśli wydajność reakcji wynosi 70%.
Opisz, w jaki sposób identyfikuje się tlen.
masy atomowe pierwiastków są obliczane na podstawie tzw. Średniej ważonej izotopów,
jednostką masy atomowej jest 1 u równy 1,66 ·10-23 g,
masa 22,4 dm3argonu w warunkach normalnych wynosi 80 g,
0,5 mola cząsteczek azotu waży 14 g.
masę jednej cząsteczki azotu,
masę cząsteczkową CO2, wiedząc, że jedna cząsteczka tego tlenku ma masę 7,3 · 10-23 g.
Zidentyfikuj ten pierwiastek
Oblicz procentową zawartość tlenu w tej soli.
Masa 1 dm3 tlenu w warunkach normalnych wynosi .................. ; w tej porcji gazu znajduje się ................................. cząsteczek, czyli .................... mola cząsteczek.
Objętość 8,8 g CO2 w warunkach normalnych wynosi .................... . Ta porcja gazu zawiera .................. cząsteczek, czyli ................. mola cząsteczek.
N2O3 |
|
1 mol, czyli 76 g tlenku azotu(III) |
|
2 mole atomów azotu |
3 mole atomów tlenu |
28 g azotu |
48 g tlenu |
Przykład:
Oblicz, w ilu gramach siarczku miedzi(I) zawarte jest 1,28 g miedzi.
a) Wzór substancji: Cu2S
b) Dane i szukane odczytane ze wzoru:
1 mol cząsteczek Cu2S zawiera 2 mole atomów miedzi
c) Wyrażenie odczytanych danych w jednostkach występujących w zadaniu
160 g Cu2S zawiera 128 g miedzi
d) Zapisanie danych i szukanych z zadania:
m g Cu2S zawiera 1,28 g miedzi
e) Zapisanie zależności w postaci, np. proporcji i rozwiązanie jej:
![]()
![]()
![]()
Odpowiedź: 1, 28 g miedzi zawarte jest w 1,6 g siarczku miedzi(I).
Zadania:
OBLICZENIA NA PODSTAWIE RÓWAŃ CHEMICZNYCH
równanie reakcji |
3 H2 + N2 → 2 NH3 |
||
współczynniki stechiometryczne |
3 |
1 |
2 |
liczby moli reagentów |
3 |
1 |
2 |
masy reagentów |
3 · 2 g = 6 g |
28 g |
2 · 17 g = 34 g |
objętości reagentów |
3 · 22,4 dm3 = 67,2 dm3 |
22,4 dm3 |
2 · 22,4 dm3 = 44,8 dm3 |
liczba drobin reagentów |
3 · 6,02 · 1023 = 18,06 · 1023 drobin |
6,02 · 1023 drobin |
2 · 6,02 · 1023 = 12,04 · 1023 drobin |
jeśli dane są ilości (liczba moli, masy, objętości, drobin) jednego z reagentów. Wymaga to ułożenia zależności między wielkościami odczytanymi z reakcji a wielkościami danymi i szukanymi zawartymi w zadaniu.
Przykład:
Oblicz, jaka objętość tlenu jest potrzebna do spalenia 2,7 g glinu.
nr |
etap rozwiązania |
wykonanie |
1. |
Napisanie równania reakcji |
4 Al. + 3 O2 → 2 Al2O3 |
2. |
Zapisanie danych i szukanych |
2,7 g V 4 Al. + 3 O2 → 2 Al2O3 |
3. |
Zapisanie liczby moli substancji na podstawie równania |
2,7 g V 4 Al. + 3 O2 → 2 Al2O3 4 mole 3 mole |
4. |
Wyrażenie 4 moli glinu w gramach i 3 moli tlenu w dm3 |
2,7 g V 4 Al. + 3 O2 → 2 Al2O3 4·27g/mol 3·22,4 dm3/mol |
5. |
Ułożenie i rozwiązanie proporcji |
|
6. |
Podanie odpowiedzi |
Do spalenia 1,8 g glinu potrzeba 1,68 dm3tlenu w warunkach normalnych |
Zadania:
ZADANIA MATURALNE
Informacja do zadania 1.
W pracowni chemicznej otrzymuje się chlor w wyniku utleniania kwasu solnego. Reakcja przebiega według równania 2 KMnO4 + 16 HCl → 2 MnCl2 + 5 Cl2↑ + 8 H2O.
Zadanie 1. (3 pkt)
Oblicz, ile gramów manganianu(VII) potasu wzięło udział w reakcji z kwasem solnym, jeśli powstało 5,6 dm3 chloru odmierzonego w warunkach normalnych.
Zadanie 2. (3 pkt)
7,5 g sodu wrzucono do zlewki zawierającej 50 g wody. Oblicz stężenie procentowe otrzymanego roztworu wodorotlenku sodu.
Zadanie 3. (1 pkt)
Utlenianie 0,5 mola SO2 do SO3 wymaga użycia:
Zadanie 4. (3 pkt)
Reakcja rozkładu tlenku azotu(V) przebiega według równania:
2 N2O5(g) → 4 NO2(g) + O2(g)
Przedstaw interpretację ilościową powyższego równania, uzupełniając wolne miejsca w tabelce:
|
ilość reagentów |
||
nazwa reagenta |
tlenek azotu(V) |
tlenek azotu(IV) |
tlen |
liczba moli |
|
|
|
masa |
|
|
|
objętość |
|
|
|
Uwaga: objętości przedstawionych w tabeli gazów mierzono w warunkach normalnych.
Zadanie 5. (3 pkt)
Tlenek siarki(IV) można otrzymać na skalę przemysłową w wyniku spalania pirytu (FeS2):
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
oblicz, jaka objętość tlenku siarki(IV), zmierzona w warunkach normalnych, powstanie w wyniku spalania 30 gramów pirytu.
Zadanie 6. (3 pkt)
Na podstawie równania reakcji zapisanego w formie cząsteczkowej podaj, w jakim stosunku molowym i masowym reaguje wodorotlenek sodu z kwasem ortofosforowym(V), jeżeli jedynymi produktami są sól obojętna i woda.
Zadanie 7. (3 pkt)
Zadanie 8. (1 pkt)
Wskaż błędną interpretację równania C(s) + CO2(g) → 2CO(g).
A. 1 mol węgla + 1 mol tlenku węgla(IV) → 2 mole tlenku węgla(II)
B. 1 atom węgla + 1 cząsteczka tlenku węgla(IV) → 2 cząsteczki tlenku węgla(II)
C. 22,4 dm3 węgla + 22,4 dm3 tlenku węgla(IV) → 44,8 dm3 tlenku węgla(II)
D. 12 g węgla + 44 g tlenku węgla(IV) → 56 g tlenku węgla(II)
Zadanie 9. (3 pkt)
Ile atomów azotu znajduje się w 6,72 dm3 tlenku azotu(III) w warunkach normalnych?
Zadanie 10. (2 pkt.)
Oblicz, ile dm3 tlenu odmierzonego w warunkach normalnych potrzeba do spalenia 3,01·1023 atomów magnezu.
Zadanie 11. (1 pkt)
Amoniak otrzymuje się przemysłowo z azotu i w wodoru w reakcji danej równaniem:
N2 + 3 H2 ![]()
2 NH3
Podaj w jakim stosunku objętościowym reagują azot i wodór.
|
|
A |
2:3 |
B |
1:2 |
C |
2:1 |
D |
1:3 |
Zadanie 12. (3 pkt)
Amoniak spalono w tlenie. Produktami reakcji były tlenek azotu(II) i woda
w postaci gazowej. Oblicz liczbę moli tlenu, która nie uległa reakcji spalania, jeżeli użyto 7 moli tlenu i 3 mole amoniaku.
Zadanie 13. (2 pkt)
Oblicz, jaki procent masowy stanowi azot w azotanie(V) amonu (NH4NO3).
Zadanie 14. (4 pkt)
Węglan wapnia może ulec rozkładowi według równania:
CaCO3(s) → CaO(s) + CO2(g)
Zadanie 15. (2 pkt.)
Oblicz skład procentowy związku chemicznego o wzorze Fe2O3.
Zadanie 16. (1 pkt.)
Najwiecej atomów znajduje się w …
Zadanie 17. (3 pkt.)
Oblicz, ile gramów tlenku żelaza(III) potrzeba do otrzymania 10 g żelaza w reakcji redukcji wodorem.
Zadanie 18. (4 pkt)
Zadanie 19. (4 pkt).
Do 100 cm3 wody destylowanej wrzucono próbkę tlenku fosforu(V) zawierającą
3,01 · 1022 cząsteczek tego tlenku. Oblicz stężenie procentowe otrzymanego roztworu kwasu fosforowego(V).
Zadanie 20. (3 pkt)
Jeden krzew pochłania dziennie 5 g CO2 na każdy metr kwadratowy liści. Łączna powierzchnia liści krzewu średniej wielkości wynosi 2 m2. Oblicz, ile krzewów potrzeba do przyswojenia tlenku węgla(IV) powstałego ze spalania 100 kg węgla zawierającego 3% zanieczyszczeń, jeśli wydajność procesu spalania wynosi 85%.
Zadanie 21. (2 pkt)
Zmieszano 3,6 g żelaza i 7,4 g siarki. Oblicz, ile gramów siarczku żelaza(II) otrzymano.
Zadanie 22. (3 pkt)
Oblicz, ile centymetrów sześciennych 0,2-molowego roztworu HCl należy użyć, aby rozpuścić główny składnik starej zaprawy murarskiej zawarty w 10 g tej zaprawy, stanowiąc 40% jej masy.
Zadanie 23. ( 2 pkt)
Do 100 g wody wrzucono 2 g tlenku litu. Oblicz stężenie procentowe otrzymanego roztworu wodorotlenku.
Zadanie 24. ( 1 pkt)
Spośród poniższych zdań wybierz prawdziwe:
Zadanie 25. (2 pkt)
Jeden unit to wzorzec mas atomowych i cząsteczkowych równy 1,66 · 10-24 g. Oblicz:
Zadanie 26. (5 pkt)
Chlor na skalę laboratoryjną można otrzymywać m. in. w wyniku reakcji tlenku manganu(II) z kwasem solnym. Pozostałymi produktami tej reakcji są chlorek manganu(II) i woda. Oblicz objętość, jaką zajmie w warunkach normalnych chlor powstały w reakcji
4 g MnO2 z nadmiarem kwasu solnego.
Zadanie 27. (2 pkt)
Pewien pierwiastek o wartościowości IV tworzy tlenek zawierający 50% tlenu. Tlenek ten reaguje z KOH, tworząc pewną sól.
Zadanie 28. (2 pkt)
Przeprowadzono reakcję żelaza z tlenem. Wykres przedstawia zależność masy otrzymanego tlenku żelaza od masy żelaza, które weszło w reakcję. Wyznacz na tej podstawie wzór empiryczny tlenku. Masy molowe, w czasie obliczeń zaokrąglaj do wartości całkowitych.
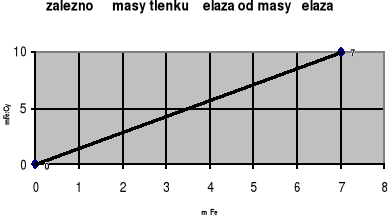
Zadanie 29. (2 pkt)
Uzupełnij następujące zdania:
Zadanie 30. (2 pkt)
Jak nazywa się związek chemiczny, którego cząsteczka składa się z chloru, węgla i wodoru, przy czy wiadomo, że jej masa cząsteczkowa wynosi 50,5 u? Przedstaw tok rozumowania.
Zadanie 31. (2 pkt)
Do 1 dm3 wody wprowadzono 2 g metalicznego litu. Zapisz równanie reakcji, która zaszła w naczyniu oraz oblicz stężenie procentowe powstałego roztworu.
Zadanie 32. (2 pkt)
W wyniku katalitycznego spalania amoniaku otrzymano wodę i pewien tlenek azotu. Wykres przedstawia zależność objętości tlenu zużywanego podczas reakcji, od objętości powstającej pary wodnej. Objętości obu gazów odmierzano w tych samych warunkach ciśnienia i temperatury. Wyznacz na tej podstawie wzór elementarny tlenku azotu.
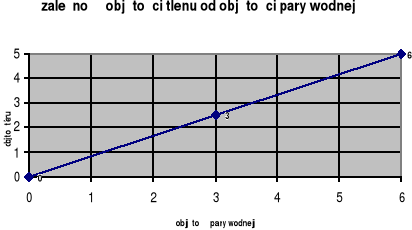
Zadanie 33. (2 pkt)
Uzupełnij zdania:
1.Objętość 12,04 · 1023 cząsteczek wody w warunkach normalnych wynosi ............ cm3. Aby otrzymać taką liczbę cząsteczek wody należy użyć ................ cząsteczek wodoru i ............. cząsteczek tlenu.
2. Objętość 3,01 · 1024 cząsteczek ozonu w warunkach normalnych jest równa .......... dm3. w tych samych warunkach objętość
3,03 · 1024 zwykłego tlenu cząsteczkowego wynosi ........... dm3.
Zadanie 34. (2 pkt)
Wpisz po prawej stronie prawidłową odpowiedź, wyrażając ją w podanych jednostkach.
1. |
Masa molowa gazu, którego gęstość w warunkach normalnych wynosi 0,893 g/dm3 jest równa |
g/mol |
2. |
Masa azotu zawartego w 10 g alaniny wynosi |
kg |
3. |
Stężenie procentowe roztworu utworzonego przez zmieszanie 0,1 mola chlorku potasu i 100 cm3 wody, jest równe |
% |
4. |
pH roztworu słabego kwasu i mocnej zasady nie może być mniejsze niż |
|
Zadanie 35. (2 pkt)
Dane są porcje gazów: NO, CO, CH4, NH3, SO2, O2 o jednakowej masie. Uporządkuj je ze względu na rosnącą objętość, przyjmując, że temperatura i ciśnienie tych gazów są takie same.
Zadanie 36. (2 pkt)
CO2jest gazem cieplarnianym. Powstaje, między innymi, w procesie spalania tradycyjnych paliw organicznych. Oblicz, jaka objętość dwutlenku węgla zostanie utworzona w wyniku spalenia benzyny, mieszczącej się w baku samochodowym o objętości 40 l. Przyjmij, że benzyna jest czystym oktanem o gęstości 0,7 g/cm3, a objętość CO2 oblicz dla warunków normalnych.
Zadanie 37. (2 pkt.)
Przeprowadzono reakcję chemiczną, która teoretycznie przebiegała ze 100% wydajnością, według poniższego równania reakcji:
3 H2(g) + N2(g) ![]()
2 NH3(g)
do reakcji użyto 0,5 mola cząsteczek azotu i otrzymano 24,7 dm3 amoniaku. Odpowiedz i wyjaśnij, czy reakcja przebiegała w warunkach normalnych?
Zadanie 38. (3 pkt)
Wykres przedstawia zależność masy pewnego dwuwartościowego metalu Me od masy jego tlenku MeO. Ustal stosunek masowy pierwiastków w tym tlenku oraz jego wzór.
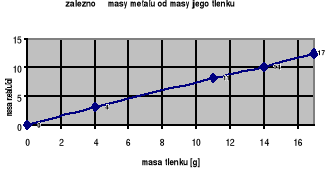
Zadanie 39. (3 pkt)
Rozkładowi termicznemu poddano 50 g CaCO3. oblicz, ile gramów substancji stałej pozostało po prażeniu i ile decymetrów sześciennych gazu (odmierzonego w warunkach normalnych) wydzieliło się w trakcie tego procesu przy jego 100% wydajności.
Stechiometria - poziom podstawowy - odpowiedzi
Zad. 1. 64,96 g
Zad. 2. 22,81%
Zad. 3. D
Zad. 4.
|
ilość reagentów |
||
reagent |
N2O5 |
NO2 |
O2 |
liczba moli |
2 |
4 |
1 |
masa |
216 g |
184 g |
32 g |
objętość |
44,8 dm3 |
89,6 dm3 |
22,4 dm3 |
Zad. 5. 11,2 dm3
Zad. 6. : 3 NaOH + H3PO4 → Na3PO4 + 3 H2O, stosunek molowy 3:1, masowy 60:49
Zad. 7. a) 1,6 g tlenu; b) 60% Mg, 40% O.
Zad. 8. C
Zad. 9. 3,612 . 1023 atomów azotu
Zad. 10. 5,6 dm3 tlenu
Zad. 11. D
Zad. 12. 4,25 mola tlenu
Zad. 13. 35%
Zad. 14. 13,64 g, 0,31 mola, 6,94 dm3
Zad. 15. 70% Fe, 30% O
Zad. 16. C
Zad. 17. 14,29 g tlenku żelaza(III
Zad. 18. C
Zad. 19. a) 2 KMnO4 → K2MnO4 + MnO2 + O2, b) 0,492 dm3 tlenu,
c) tlen identyfikujemy używając żarzącego się łuczywa, które w jego obecności zapala się jasnym płomieniem.
Zad. 20 30.230 krzewów.
Zad. 21. 5,632 b
Zad. 22. 400 cm3
Zad. 23. 3,14%
Zad. 24. A i D
Zad. 25. 4,648 . 10-23 g, 43,98 u
Zad. 26. 1,03 dm3
Zad. 27. S, 30,38%
Zad. 28. Fe2O3
Zad. 29. 1) 1,429 g, 2,688 · 1022 cząsteczek, 0,0446 mola,
2) 4,48 dm3, 1,204 · 1023 cząsteczek, 0,2 mola
Zad. 30. chlorometan
Zad. 31. 0,685%
Zad. 32. NO
Zad. 33. 1) objętość H2O - 36 cm3, liczba cząsteczek H2 - 12,04 · 1023, liczba cząsteczek O2 - 6,02 · 1023.
2) 112 dm3 dla obu gazów
Zad. 34. 1) 20 g/mol, 2) 1,573 · 10-3 kg, 3) 6,93%, 4) 7
Zad. 35. SO2 < O2 < NO < NH3 < CH4
Zad. 36. 44,014 m3
Zad. 37. Reakcja nie przebiegała w warunkach normalnych (w tych warunkach powinno powstać 22,4 dm3 amoniaku)
Zad. 38. CaO
Zad. 39. 28 g, 11,2 dm3
12
Wyszukiwarka