PCDD/Fs W PRODUKTACH CODZIENNEGO UŻYTKU
I DROGA DO ORGANIZMU CZŁOWIEKA
M.R. Dudzińska (na podstawie Dudzińska i Kozak, 200, uaktualnione)
Źródła PCDD/Fs w środowisku są bardzo różnorodne - procesy spalania, przemysł chemiczny, celulozowo-papierniczy oraz hutnictwo i metalurgia. Są one emitowane przede wszystkim do atmosfery, ale także zrzucane ze ściekami. To jednak nie tylko problem wielkich spalarni i wielkich fabryk chemicznych. Jako zanieczyszczenia śladowe znajdują się w wielu organicznych związkach chemicznych, a z procesów spalania, w wyniku depozycji atmosferycznej znajdują się w glebach i wodach powierzchniowych. Obecność PCDD/Fs w ściekach komunalnych, w tym ściekach bytowych oznacza, że jest to problem naszego najbliższego środowiska, w tym środowiska domowego. Żyjemy w ekosystemie, w którym występowało w przeszłości i występuje nadal “tło” dioksyn, co oznacza, że PCDD/Fs występują także w organizmie człowieka - pobierane drogą kontaktową (przez skórę), oddechową oraz pokarmową (woda, żywność). Szacuje się, że połowiczny czas życia w organizmie ludzkim wynosi dla PCDD/Fs około 8 lat (Sullivan i in. 1991).
Wyniki pomiarów populacji ludzkiej wykazują zawartość PCDD/Fs w tkance ludzkiej na poziomie 5-20 ng- TEQ/kg tłuszczu. Wartość ta oczywiście może się różnić, zależnie od ekspozycji na PCDD/Fs (typowej, zawodowej, powypadkowej), co przedstawiono w tabeli 1.
Tabela 1. Przykładowe zawartości PCDD/Fs populacji ludzkiej, na podstawie danych literaturowych
Krew (tłuszcz) |
I-TEQ ng/kg |
Źródło |
Populacja nienarażona, USA |
40 |
Schecter i in., 1992 |
Mieszkańcy Wietnamu, 1987-91 |
12 - 77 |
Schecter i in., 1992 |
Krew po “przypadku Yusho” po 25 latach, Japonia |
184,57 - 440,58 |
Masuda i in., 1998 |
Krew kontrolna - Japonia |
31,58 |
Masuda i in., 1998 |
RFN - populacja nienarażona, 1981 |
43,7 |
Wittsiepe i in., 2000 |
RFN - populacja nienarażona, 1998 |
20,7 |
Wittsiepe i in., 2000 |
Droga oddechowa
Człowiek do oddychania potrzebuje powietrza. Jeśli powietrze atmosferyczne jest zanieczyszczone, to drogą tą zanieczyszczenia przenikają do organizmu.
Stężenia PCDD/Fs w atmosferze zależy od kraju, zurbanizowania terenu, potencjalnych źródeł emisji. Jeśli przyjmie się średnie wartości, można oszacować, że przeciętny człowiek w kraju uprzemysłowionym w strefie umiarkowanej, wdycha powietrze zawierające około 0,001-7 pg I-TEQ/m3. Średni okres wydalania PCDD/Fs z organizmu człowieka wynosi od 6 do 10 lat (zależnie od kongeneru). Na podstawie zawartości PCDD/Fs w tkance tłuszczowej człowieka i zawartości hipotetycznej, wyłącznie w wyniku inhalacji bezpośredniej, Grochowalski (2000) szacuje, że tylko 1-4% PCDD/Fs pobieranego przez organizm człowieka przedostaje się tą drogą.
Wraz z rozwojem cywilizacji człowiek coraz więcej swego czasu spędza w pomieszczeniach zamkniętych. W niektórych regionach świata ze względu na styl życia - dom, praca, centra handlowe i rozrywkowe, sale fitness, środki transportu, człowiek spędza w pomieszczeniach, często wyposażonych w klimatyzację ponad 90% czasu. Zatem jakość powietrza wewnętrznego jest ważniejsza dla jakości naszego życia i zdrowia niż jakość powietrza zewnętrznego.
PCDD/Fs emitowane są ze wszystkich procesów spalania, zatem do potencjalnych źródeł w pomieszczeniach możemy zaliczyć: dym papierosowy, emisje z kominków lub pieców, emisje z piecyków i kuchenek gazowych, procesy obróbki termicznej żywności (smażenie, przypalenie), świece, kadzidełka, lampki olejowe i inne otwarte źródła ognia, a także wypadki - pożary, zwłaszcza palenie się tworzyw sztucznych, impregnowanego drewna, tkanin, itp. Wśród potencjalnych źródeł zagrożenia można także rozważać emisje z materiałów wykończeniowych - lakiery, apretury, meble, tkaniny.
Ponieważ emisja PCDD/Fs towarzyszy wszystkim źródłom spalania, szczególnie niepełnego, ewentualne zagrożenie ze strony piecyków i kuchenek jest wypadkową jakości tych urządzeń i efektywności wyciągów kominowych. Zagrożenie z tej strony wydaje się jednak wątpliwe - urządzenia te ze względów bezpieczeństwa, powinny być tak skonstruowane, aby gwarantować całkowite spalanie (bez CO). Spalanie gazu jest także “najczystsze” ekologicznie. Większym, problemem mogą być procesy spalania w piecach opałowych i kominkach, jakkolwiek tu także znaczenie ma jakość wyciągów oraz to czy spalaniu poddaje się czyste drewno, czy materiały odpadowe. Także spalanie czystego drewna może być źródłem emisji PCDD/Fs. Mimo szacunkowych danych z niektórych krajów na temat udziału spalania drewna w ogólnej emisji PCDD/Fs i bilansie krajowym, brak jest danych na temat imisji w pomieszczeniach zamkniętych z tego źródła.
Badania zawartości dioksyn w popiołach z palenisk i pieców domowych, w których spalano różne gatunki drewna, węgiel a także papier (specjalny eksperyment z paleniem ilustrowanymi tygodnikami) wykazały, że praktycznie dla każdego rodzaju paliwa w popiele (i zapewne w emisji) znajdują się dioksyny i furany, jakkolwiek najniższe stężenia (w przeliczeniu na TEQ) w popiele po spalaniu drewna (Czerwiński i in., 2006). Natomiast palenie papierem, szczególnie z kolorowymi nadrukami (metale zawarte w barwnikach mogą działać jak katalizatory) powinno być zakazane.
Tabela 2. Stężenia PCDDs i PCDFs (ng/kg) w popiołach z pieców domowych, zależnie od stosowanego opału (Czerwiński I in., 2006)
|
Węgiel “Bogdanka” |
Drewno brzozy |
Papier |
Wiklina |
PCDDs |
59 |
2 |
151.5 |
48.2 |
PCDFs |
222 |
88 |
277.2 |
262.8 |
WHO-TEQ |
71,56 |
17,4 |
119,97 |
46,06 |
PCDD/Fs znaleziono także w dymie papierosowym, jakkolwiek nie stwierdzono czy wynika to ze spalania suszonych liści tytoniowych, czy bielonej bibułki. Sokołowski (1994) podaje zawartość I-TEQ w smole papierosowej na poziomie 1-10 ng/kg próbki. Thomas i Spiro (1996) podają I-TEQ w emisji z palenia papierosów jako równe 4 ng/kg.
Brak danych literaturowych na temat poziomu imisji w pomieszczeniach zamkniętych. Istnieją jednak doniesienia o potencjalnych źródłach emisji, typowych tylko dla pomieszczeń zamkniętych. Dostępne są na przykład dane kanadyjskie i niemieckie dotyczące emisji PCDD/Fs w wyniku spalania świec, chociaż zagrożenia te wiąże się nie tyle z samym procesem spalania wosku lub parafiny, ile z barwnikami, używanymi do wyrobu świec kolorowych.
Tuż przed świętami Bożego Narodzenia 1992, prasa ogólnokrajowa w Niemczech doniosła o możliwości ekspozycji na dioksyny w wyniku palenia purpurowych świec. Oficjalne dane z Hamburga mówiły o stężeniu na poziomie 33,1 ng I-TEQ/kg i 31,53 mg OCDDs/kg barwnika “Violet 23” użytym do barwienia jednej z partii świec obecnych na rynku. W trzech innych próbkach stężenia były znacznie niższe (w zakresie 1,2-1,4 ng I-TEQ/kg i 0,25-0,52 mg OCDD /kg). Spalanie zanieczyszczonej świecy w pokoju mogło prowadzić do emisji nawet na poziomie 40 pg TEQ/m3. (Staatliche Pressestelle der Freien und Hansestadt Hamburg, Pressemitteilung vom 21. August 1992 “Dioxinhaltiger Farbstoff in Kerzen und Malfarben nachgewiesen”). Violet 23 jest otrzymywany z chloranilu. Obecnośc PCDDs i PCDFs w barwnikach: Violet 23 i Direct Blue 106 potwierdzono także
w badaniach kanadyjskich. Williams i in. (1992) stwierdzili, że barwniki Violet 23 i Direct Blue 106 zawierają OCDDs i OCDFs na poziomie mg/g, a hepta- heksa-
i penta- kongenery na poziomie ng/g. Remmers i in. (1992) w czterech próbkach chloranilu i jednej Carbazole Violet, stwierdzili zawartość kongenerów hepta- na poziomie ppb, a kongenerów okta- na poziomie ppm. Według pomiarów niemieckich prowadzonych na różnych etapach produkcji barwników, w p-chloranilu stwierdzono 233 mg I-TEQ/kg, a w fiolecie karbazolowym (Carbazole Violet) 210 mg I-TEQ/kg.
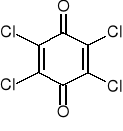
Rys. 1. Cząsteczka chloranilu
Malisch (1994), który zbadał 30 świec, w tym 24 purpurowe, 3 czerwone,
2 niebieskie i 1 zieloną, z partii dostępnych na rynku w grudniu 1992 w okręgu Freiburskim, stwierdził, że tylko trzy świece miały wysoką zawartość PCDF/Ds - odpowiednio 1,8; 1,4 i 0,8 ng I-TEQ/kg wosku. Pozostałe 83% próbek zawierało dioksyny na poziomie poniżej 0,5 ng I-TEQ/kg, a 57% poniżej 0,2 ng I-TEQ/kg. Najwyższe były zawartości OCDDs oraz HpCDFs i OCDFs. Wszystkie dwadzieścia cztery “purpurowe” świece miały ten sam odcień, ale producenci użyli różnych mieszanek barwników, żeby go osiągnąć. Wyniki wskazują zatem, że możliwa jest minimalizacja zagrożenia, czyli produkcja odpowiednich odcieni przy ograniczaniu zanieczyszczenia “dioksynami”.
Kolejnym źródłem emisji, typowym dla pomieszczeń zamkniętych, mogą być rozpuszczalniki stosowane przy wykańczaniu wnętrz - kleje, rozpuszczalniki, lakiery i impregnaty. Obecnie używanie rozpuszczalników chloroorganicznych jest
w większości krajów zabronione lub ograniczone, tym bardziej więc nie są one stosowane w materiałach wykończeniowych. Były jednak stosowane w latach 70-tych i 80-tych. W Polsce w konserwacji drewna budowlanego były stosowane preparaty, zawierające pentachlorofenol jako aktywny czynnik grzybobójczy, pod ogólną nazwą “Xylamity”. Pomiary Grochowalskiego i in. (1990) wykazały obecność dioksyn nawet na poziomie 1g/kg (!) tego preparatu. Nie stwierdzono wprawdzie najgroźniejszej 2,3,7,8-TCDD, ale i tak wartość ta była niezwykle wysoka. Jednak podobne wartości stwierdzano w latach 70-tych i 80-tych w pentachlorofelnolach produkowanych w krajach zachodnich. Było to przyczyną wycofania się z preparatów opartych na związkach chloroorganicznych.
Czy “dioksyny” mogą zatem stanowić obecnie poważny problem w powietrzu w naszych mieszkaniach? Na pewno należy kontrolować materiały używane do wykańczania pomieszczeń, co jest w większości krajów regulowane prawnie. Ciekawe byłyby także pomiary w mieszkaniu nałogowych palaczy.
Wchłanianie poprzez skórę
Dioksyny, jak wiele substancji organicznych, szczególnie chloropochodnych, mogą przenikać przez skórę ludzką, jeśli zostanie zanieczyszczona jej powierzchnia. Kontakt tego typu może nastąpić:
- przy nieumiejętnym obchodzeniu się z chemikaliami, zanieczyszczonymi PCDD/Fs,
- poprzez kontakt skóry z pyłem atmosferycznym i sadzą, zawierającymi ślady “dioksyn”,
- kontakt skóry z odzieżą zanieczyszczoną dioksynami np. PCP w bawełnie, barwnikach,
- kontakt skóry z innymi produktami, zawierającymi ślady PCDD/Fs - głównie papierowymi.
Przy obecnym stanie wiedzy kontakt z chemikaliami może wystąpić wyjątkowo, przy lekceważeniu zasad BHP, albo w czasie wypadków w fabrykach chemicznych lub pożarów. Ponieważ w tych przypadkach stężenia dioksyn będą wyższe niż “normalne tło” środowiskowe, może to stanowić zagrożenie, np. wystąpienie trądziku chlorowatego lub spowodować skutki długofalowe. Szczególnie niebezpieczny może być kontakt z sadzą przy pożarach substancji chemicznych - sadza posiada zarówno wysokie powinowactwo do PCDD/Fs jak i do skóry ludzkiej.
Mechanizmy absorpcji przez skórę nie są ostatecznie rozpoznane. Z oczywistych powodów nie prowadzi się eksperymentów oceniających przenikanie PCDD/Fs drogą kontaktową na ludziach. Początkowo prowadzono eksperymenty symulujące na szczurach i obliczano, że około 14,1-14,8% TCDD naniesionej bezpośrednio na skórę przeniknęło do organizmu i znalazło się w wątrobie, co może oznaczać, że skóra jest zdolna zaadsorbować około 40% TCDD, z którą się kontaktuje. Określenie na tej podstawie pobierania przez skórę człowieka nie jest w pełni uzasadnione. Badania in vitro na skórze ludzkiej (Marpie i in., 1992) wykazały, że około 86-90% TCDD jest zatrzymywane przez zewnętrzną zrogowaciałą warstwę naskórka, sam naskórek jest mniej efektywną barierą, a tylko 2,2-3,8% kumuluje się w skórze właściwej, która działa jak ostateczne zapadlisko.
Pobieranie PCDD/Fs przez skórę z powietrza atmosferycznego wydaje się minimalne, jakkolwiek Horstman i McLachlan (1995) stwierdzili zawartość 12 do 210 pg I-TEQ w badanych odpływach prysznicowych (w przeliczeniu na jedno całkowite mycie). Ilości są zróżnicowane, ale mogą świadczyć o obecności PCDD/Fs na skórze ludzkiej w wyniku depozycji z atmosfery oraz ewentualnie z odzieży.
Wśród produktów zawierających PCDD/Fs, z którymi organizm człowieka ma kontakt poprzez skórę, szczególną uwagę badaczy przyciągał papier. Ekspozycja na PCDD/Fs zawarte w papierze jest związana z dwoma procesami - migracją PCDD/Fs z papieru na skórę i absorpcją poprzez skórę. Przemieszczanie PCDD/Fs z papieru do skóry może odbywać się za pomocą medium pośredniego - np. cieczy - pampersy, ręczniki papierowe, papier higieniczny, albo bezpośrednio drogą kontaktową - serwetki papierowe, papierowe nośniki informacji - gazety, książki, notatki.
Babich i in. (1991), starali się oszacować ryzyko zachorowania na nowotwory związane z używaniem wyżej wymienionych produktów papierowych, zakładając zawartość 2,3,7,8-TCDD w papierowych produktach higienicznych równą 8,6 ppt (oprócz pieluszek, gdzie na podstawie badań w USA stwierdzono 3 ppt) i szybkość absorpcji przez skórę równą 0,012 h-1, a współczynnik absorpcji około 0,25. Obliczenia uwzględniające różny czas i powierzchnię kontaktu, różny sposób kontaktu, a nawet zróżnicowane użytkowanie ze względu na płeć były dość skomplikowane, uwzględniały jednak tylko najbardziej toksyczną 23,7,8-TCDD.
Z obliczeń Babich'a wynikało, że największe ryzyko związane jest z ręcznikami papierowymi, o ile używa się ich także w domu (kuchnia) i wynosi 2x10-9. Jest to ryzyko minimalne. Za akceptowalne ryzyko powodowane przez czynniki środowiskowe przyjmuje się zwykle 1x10-6. Stosując przyjęte przez Babich'a założenia, takie ryzyko wymagałaby zawartości TCDD w papierze na poziomie 5600 ppt, czyli absurdalnie wysokiej. Ryzyko związane z używaniem wszystkich rodzajów produktów papierowych wynosiło według Babich'a 5x10-9 (średnia dla populacji męskiej i damskiej), czyli odpowiadało 0,02 dodatkowych zachorowań na nowotwory rocznie (dla całej populacji USA). Wydaje się, że w krajach rozwiniętych, mimo rosnącego zużycia papierowych materiałów higienicznych, szacunkowe ryzyko z tym związane nie będzie wyższe niż w USA. Ze względu na dużą ilość założeń, obliczenia Babich'a i in. (1991) mogą być obarczone błędami i, co przyznawali sami autorzy, przeszacowane.
Obecnie badacze uważają, że około 0,5-2% masy PCDD/Fs zawartych w organizmie człowieka może pochodzić z wchłaniania poprzez skórę. Należy także uwzględnić niższe zawartości w papierze, wynikające z nowych technologii produkcji.
Tabela 3. Ryzyko wchłonięcia PCDD/Fs z produktów papierowych
(Babich i in., 1991)
Produkt |
Stosowanie |
Ryzyko (x10-10) |
Pieluszki jednorazowe |
zwykłe |
1,5 |
Ręczniki papierowe |
do rąk w gospodarstwie dom. |
6,3 21 |
Chusteczki kosmetyczne |
do zmywania makijażu |
6,4 |
Chusteczki toaletowe |
do użytku codziennego |
12 |
Serwetki śniadaniowe |
do użytku codziennego |
2,1 |
Papierowe nośniki informacji |
Dorośli - w domu Dzieci - w szkole |
5,1 6,1 |
Wszystkie produkty |
|
61 |
Droga pokarmowa
Za najbardziej niebezpieczną dla człowieka uważa się drogę pokarmową. Nawet przyjmując wartości maksymalne dla pobierania drogą oddechową i kontaktową - około 95% PCDD/Fs przenika do organizmu ludzkiego z żywnością.
Ze względu na zawartość PCDD/Fs w organizmie dorosłego człowieka i ich powinowactwo do tłuszczu, PCDD/Fs występują w mleku matki karmiącej. Szacuje się, że około 5% dioksyn pobieranych przez organizm ludzki w ciągu średnio 70 lat życia jest pobieranych w ciągu pierwszych sześciu miesięcy z mlekiem matki (Kello i Yrjanheikki, 1992). Jednak poziom PCDD/Fs w mleku tej samej matki spada z każdym kolejnym dzieckiem - od 32,9 ng I-TEQ/kg tłuszczu dla pierwszego dziecka do 18,7 ng I-TEQ/kg tłuszczu dla trzeciego (Beck i in., 1992a). Oznacza to znaczny stopień usuwania PCDD/Fs z mlekiem z organizmu kobiety, ale wzrost zagrożenia dla niemowląt.
Ponieważ ogólne stężenie PCDD/Fs od lat 80-tych spada, dane literaturowe odnośnie dziennego pobierania z pożywieniem różnią się - zależnie do roku badania oraz uwzględnianej diety. I tak o ile w roku 1992 w Niemczech wskazywano na 164 pg I-TEQ/osobę /dzień (Beck i in., 1992), to w roku 1995 badając rzeczywistą dietę kontrolnej grupy osób, stwierdzono jedynie 23-96 pg I-TEQ/dzień (Schery i in. 1998). Badania brytyjskie wskazują na około 81pg I-TEQ/dzień (Eduljee i Gair, 1996). Dane mogą się różnić zależnie od kraju na świecie może to być od poniżej 100 do nawet 200 pg I-TEQ/ dzień dla osoby o masie ciała około 80 kg. Pobieranie drogą pokarmową wiąże się z kilkoma potencjalnymi drogami przenikania PCDD/Fs do żywności:
1/ zanieczyszczone są bezpośrednio produkty żywnościowe,
2/ nastąpiło zanieczyszczenie pośrednie w wyniku obróbki - obróbka termiczna (smażenie) lub np. parzenie kawy przez filtr papierowy, herbaty ekspresowej w torebkach, itp.,
3/ zanieczyszczenie może być wynikiem przenikania z opakowań, głównie papierowych.
PCDD/Fs w produktach surowych - biokumulacja w łańcuchu troficznym
Bezpośrednie skażenie żywności może być skutkiem przedostania się PCDD/Fs do łańcucha troficznego - w wyniku ogólnego skażenia śladowego środowiska, albo skażenia świadomego - gdy wprowadzi się w łańcuch pokarmowy produkty odpadowe, zanieczyszczone (np. przypadek “belgijskich” kurczaków).
Zakładając, że ekspozycja ludzi zachodzi głównie drogą pokarmową, wzrost ryzyka dla populacji ludzkiej mógłby być związany z rosnącym stężeniem PCDD/Fs w glebie i wchodzeniem w łańcuch pokarmowy. Najprostszy mechanizm byłby związany z zanieczyszczeniem roślin przeznaczonych do bezpośredniej konsumpcji przez człowieka. Jednakże PCDD/Fs są immobilizowane w glebie i nie są pobierane przez korzenie roślin i transportowane w organizmie roślinnym, ze względu na swoją hydrofobowość. Jedynym opisanym w literaturze wyjątkiem są cukinia i dynia, których owoce zawierały 2-krotnie wyższe stężenia PCDD/Fs niż innych warzyw z tych samych terenów. Wydaje się, że właśnie pobieranie korzeniowe ma największy udział w zanieczyszczaniu owoców cukinii i dyni, ale już nie ogórka, mimo że należy do tej samej rodziny (Hulster i in., 1994). Ogórek jest zanieczyszczany w wyniku depozycji atmosferycznej i wykazuje znacznie niższe poziomy PCDD/Fs.
Tabela 4. Zawartość PCDD/Fs (jako I-TEQ) w próbkach warzyw i owoców, wg. danych literaturowych.
Produkt |
I-TEQ (ng/kg świeżej masy) |
Źródło |
Ziemniak / warzywa korzeniowe |
0,2 - 0,5 ng/kg 3,62 - 39,6 pg/ kg |
Lovett, 1997 Malish ,1998 |
owoce / jabłka |
0,1-0,9 ng/kg; 2,25-7,0 pg/kg |
Lovett i in., 1997 Malish, 1998 |
Sałata / warzywa liściaste |
0,1-0,3 ng/kg 1,94 -54, 4 pg/kg |
Lovett, 1997 Malish ,1998 |
cukinia
|
0,1-0,6 ng/kg |
Lovett i in. ,1997 |
ziarno zbóż
|
0,05 ng/kg świeżej masy |
Eduljee i Gair, 1996 |
olej roślinny |
0,02 - 0,1 ng/kg tłuszczu |
Grochowalski i Chrząszcz, 2000 |
olej po smażeniu |
0,15 - 0,8 ng/kg tłusczu |
Grochowalski i Chrząszcz, 2000 |
Zanieczyszczenie może zatem powstawać raczej w wyniku adsorpcji do powierzchni korzeni warzyw oraz obecności cząstek gleby na powierzchni warzyw liściastych (Hulster i Marschner, 1993). W obu przypadkach PCDD/Fs są usuwane w procesach obróbki - mycie, skrobanie, obieranie. Nawet, jeśli w glebie będzie rósł poziom PCDD/Fs, nie będzie to miało szczególnego znaczenia, jako że warzywa stanowią tylko znikome źródło PCDD/Fs w naszej diecie. Zresztą osady ściekowe nie są używane do nawożenia gleb przeznaczonych pod uprawę warzyw ze względów sanitarnych.
Równie istotnym źródłem może być bezpośrednia depozycja atmosferyczna
na liście i owoce. Jest to jednak depozycja powierzchniowa - o ile stężenie PCDDs w skórce jabłek, gruszek czy brzoskwiń wynosi do 100 ng PCDDs/kg, to w miąższu owoców przy poziomie detekcji 1 ng/kg, nie stwierdzono PCDDs (Wipf i in., 1982).
Tabela 5. Zawartość PCDD/Fs (jako ng I-TEQ/kg tłuszczu) w mięsie, jajach i przetworach mlecznych, wg. danych literaturowych
Produkt |
USA |
UK |
RFN |
Rosja |
Polska |
Mleko |
0,42-0,81 |
2,0 |
0,24-3,13 |
0,28 |
0,1-4,0 |
Masło |
0,69-0,97 |
|
0,19-2,0 |
0,43 |
0,6-6,5 |
ser biały |
0,42-1,1 |
0,75 |
|
|
|
Jogurt |
|
|
|
|
0,1-1,8 |
ser żółty |
0,74-0,86 |
|
|
1,13 |
0,2-7,7 |
wołowina |
0,53-1,1 |
|
0,37-1,25 |
0,90 |
2,4-8,5 |
cielęcina |
|
|
0,35-2,76 |
|
0,05-1,3 |
wieprzowina |
0,56-0,87 |
|
0,09-2,29 |
0.98 |
|
drób |
0,61-0,78 |
1,7 |
0,24-2,30 |
1,54 |
0,6-12,8 |
jaja (żółtko) |
0,18-0,33 |
1,8 |
0,17-22,79 |
|
0,6-7,4 |
RFN - Malish, 1998
USA - Fiedler i in., 1997 ,
UK - Harrison i in., 1998 (dane z 1992 r.)
Rosja -Maystrenko i in., 1998
Polska - Grochowalski i Chrząszcz, 2000
Większe znaczenie ma możliwość kumulacji w zwierzętach hodowlanych, gdyż szacuje się, że 2/3 PCDD/Fs jest pobieranych do organizmu ludzkiego z tłuszczów zwierzęcych, głównie nabiału, wołowiny i cielęciny. Ze względu na czas oraz sposób tuczu mięso wieprzowe zawiera niższe poziomy PCDD/Fs niż wołowe (patrz tabela 3.). Drób w tkance tłuszczowej może zawierać wyższe poziomy, przy czym może to być związane z jednej strony z karmą zawierającą np. dioksyny pochodzenia naturalnego w kredzie i wapieniu dodawanym do paszy dla kurcząt (jako źródło wapnia) na dużych famach hodowlanych (Ferrario. i Byrne, 2000), z drugiej strony “naturalnym” poborem pokarmu - na podwórku, w gospodarstwach rodzinnych. Ocenia się, że u ptaków grzebiących karma będzie zanieczyszczana glebą w ilości od 2 do 10% (Lovett i in., 1998).
Również cielęta i bydło pobierają trwałe hydrofobowe związki organiczne głównie z pożywieniem. Zanieczyszczona gleba (w wyniku depozycji atmosferycznej, albo nawożenia osadami ściekowymi) może powodować wzrost poboru z tego źródła albo poprzez zanieczyszczenie paszy, albo poprzez bezpośrednie spożywanie cząstek gleby w czasie wypasu na pastwiskach.
Zanieczyszczenie pasz wynika z obecności cząstek gleby w pokłosie traw
i zbóż oraz w warzywach korzeniowych używanych jako pasza dla zwierząt, np. buraku pastewnym. Zawartość cząstek gleby w buraku zależy od rodzaju gleby, sposobu wykopywania oraz czyszczenia, w trawie i sianie - od pogody, metody koszenia, stanu łąki. Berenge (1990) na podstawie badań na pastwiskach w Holandii stwierdził, że w czasie zimy, krowy karmione sianem na farmach pobierały około 400 g gleby dziennie. Pobór ziemi z paszy takiej jak kukurydza i ziarno był zaniedbywalny. Ilość ziemi pobieranej drogą pokarmową przez bydło wypasane na pastwiskach różni się znacznie. W badaniach w Nowej Zelandii stwierdzono, że w tamtejszych warunkach klimatycznych, gdzie bydło wypasane jest przez cały rok na otwartych pastwiskach, gleba może stanowić od 1 do 18% suchej karmy dziennie. Wartością typową dla Europy Północnej, gdzie wypas jest tylko sezonowy i zwykle podaje się karmę uzupełniającą, może być poziom oszacowany przez Berebdal'a (1990) dla Holandii czyli 1-2%, tzn. około 150-300 g dziennie. Podobne wartości można przyjąć dla USA, gdzie podaje się paszę uzupełniającą, głównie kukurydzę. Pobieranie gleby zanieczyszczonej PCDD/Fs przez bydło może być zatem istotnym punktem zanieczyszczania łańcucha pokarmowego człowieka.
Tylko niewielka część PCDD/Fs pobieranego droga pokarmową przez zwierzęta, jest pochłaniana (absorbowana) w procesie trawienia. Szacuje się, że krowy mleczne absorbują około 1/3 pobranych niżej chlorowanych PCDD/Fs, a tylko do 5% wyżej chlorowanych (McLachlan, i in., 1990). Znaczna część PCDD/Fs ulega metabolizmowi w organizmie bydła, ale większość szczególnie toksycznych kongenerów podstawionych w pozycjach 2,3,7,8 jest trwała i ulega kumulacji w tkance tłuszczowej, a w przypadku bydła mlecznego jest wydalana z organizmu w tłuszczu mleka. Stąd może wchodzić w łańcuch pokarmowy człowieka poprzez mięso lub nabiał (produkty mleczne).
Potwierdzono wzrost stężenia PCDD/Fs w produktach zwierzęcych w wyniku stosowania nawożenia łąk osadami ściekowymi. Jednak zależy to od intensywności oraz metody nawożenia.
Ponieważ zachodzą znaczne różnice w przemieszczaniu się i kumulowaniu poszczególnych kongenerów w łańcuchu pokarmowym, należy z ostrożnością podchodzić do kolektywnych parametrów toksyczności, jak TEQ, przy określaniu ryzyka wykorzystania osadów ściekowych w rolnictwie. Osady ściekowe zawierają znacznie wyższy ułamek kongenerów wyżej chlorowanych w stosunku do tła w glebach. Te wyżej chlorowane kongenery są jednak gorzej przyswajane i powodują mniejsze zagrożenie dla łańcucha troficznego. Czyli dla takiej samej wartości TE, mieszanina kongenerów w osadzie powoduje mniejsze ryzyko niż mieszanina kongenerów w glebie. Zatem stosowanie TE przy ocenie ryzyka związanego z nawożeniem osadami zawyża oceniane ryzyko. Lepszym podejściem do oceny zagrożenia wydają się środowiskowe współczynniki toksyczności (ETE), współczynniki, w których do TE włącza się zachowanie danego kongeneru w środowisku (McLachlan, 1993).
Tabela 6. Zawartość PCDD/Fs w rybach i owocach morza z różnych akwenów, wg. danych literaturowych
Produkt |
I-TEQ (ng/kg tłuszczu) |
Źródło |
ryby słodkowodne polskie |
1,2-9,4 |
Grochowalski i Chrząszcz, 2000 |
ryby bałtyckie |
7,0- 40 |
Grochowalski i Chrząszcz, 2000 |
olej rybny z ryb bałtyckich |
11,2-50 |
Grochowalski i Chrząszcz, 2000 |
homar (Missisipi, USA) |
20,6 - 31,5 |
Fiedler i in., 1997 |
krab (Missisipi) |
31,4 - 40,1 |
Fiedler i in., 1997 |
makrela (Hiszpania) |
27,8 |
Fiedler i in., 1997 |
ryby oceaniczne USA |
0,25 |
Schecter i in., 1997 |
sum hodowlany, USA |
10,2 - 23,5 |
Fiedler i in., 1997 |
ryby hodowlane (stawy, RFN) |
3,38 - 1174 |
Malish, 1998 |
ryby morskie, RFN |
0,27 - 60,4 |
Malish, 1998 |
ryby słodkowodne - Ren |
2,47 - 107,5 |
Malish, 1998 |
Łańcuch troficzny: woda - rośliny wodne - skorupiaki - ryby, ptaki odżywiające się rybami, jest od dawna dobrze opisany, szczególnie jeśli chodzi o metale ciężkie i pochodne chloroorganiczne. Kumulacja w tłuszczu ryb jest znacznie wyższa (wyrażona w I-TEQ) niż w tłuszczu zwierząt lądowych. Jest to spowodowane głównie wyższą kumulacją kongenerów o wyższej toksyczności. Jednak ryby w większości krajów mają znacznie niższy udział w diecie. Znacznie wyższe są stężenia PCDD/Fs w rybach morskich (kilka - kilkadziesiąt ng TEQ/kg tkanki tłuszczowej) niż w rybach słodkowodnych (kilka ng I-TEQ/kg). Jednak dla ryb słodkowodnych trudniej o uogólnienia ze względu na możliwość zanieczyszczeń lokalnych stawów hodowlanych.
Szacunki modelowe, oparte na typowej diecie, oraz prawdopodobnych poziomach PCDD/Fs w różnych rodzajach produktów żywnościowych wskazują, że około 40% “dioksyn” pobieranych droga pokarmową pochodzi z mleka i przetworów mlecznych, około 35% z tzn. “ukrytych” tłuszczów, 12% z mięsa i jego przetworów. Natomiast brak jest znaczącego udziału warzyw i owoców (Eduljee i Gair, 1996).
Szacunki te mogą być jednak niedoszacowane lub przeszacowane, ponieważ
w modelach najczęściej posługuje się zawartościami w produktach surowych, nieprzetworzonych. PCDD/Fs mogą także dostać się do żywności w wyniku obróbki lub poprzez migrację z opakowań.
PCDD/Fs w żywności przetworzonej
Przygotowanie żywności do spożycia obejmuje zazwyczaj wiele procesów. Jedne z nich - np. mycie i obieranie, jak pisaliśmy, powodują obniżenie PCDD/Fs pobieranych z konsumpcji owoców i warzyw. Inne, jak obróbka termiczna, mogą wpływać na zwiększenie poziomu PCDD/Fs. Żywność jest przechowywana w opakowaniach nie tylko szklanych, ale i plastikowych oraz papierowych. Papier uczestniczy także w procesach parzenia kawy (filtry) oraz herbaty - torebki herbaty ekpresowej. Biorąc pod uwagę rolę reakcji termicznych w powstawaniu “dioksyn” oraz zawartość PCDD/Fs w papierze, należałoby uwzględnić także te źródła.
Wpływ obróbki termicznej na poziom PCDD/Fs w żywności
Badania mięsa surowego i mięsa po smażeniu, a zwłaszcza grilowaniu
na otwartym ogniu, wskazują, że obróbka żywności może stanowić dodatkowe źródło PCDD/Fs pobieranych drogą pokarmową. Schecter i in. (1998), badając poziom PCDD/Fs w surowym i poddanym smażeniu, stwierdził, że o ile całkowite sumaryczne stężenie PCDDs, PCDFs i koplanarnych PCBs (w pg/kg) wzrasta o 14% w hamburgerach wołowych, o 29% w bekonie, a maleje o 33% w rybach (sum), to sumaryczne współczynniki I-TEQ dla hamburgerów pozostają na podobnym poziomie, jak przed smażeniem, wzrastają o 83% dla bekonu i spadają o 34% dla suma. Należy jednak uwzględnić, że w czasie smażenia zmienia się masa produktu (powinno się porównywać raczej porcje niż masę produktu) oraz zmienia się zawartość tłuszczu. Schester i in. (1998) zauważyli, ze w bekonie i hamburgerach w wyniku smażenia zawartość tłuszczu wzrasta, a w rybach maleje.
Także poziomy stwierdzone w tzn. “fast-food” nie muszą wynikać z zanieczyszczenia w produktach surowych, a wysokotemperaturowej obróbki na kilkakrotnie przesmażanym tłuszczu. Schecter i Li (1997) stwierdzili, że jeden “Big Mac” podawany w USA w roku 1995 zawierał od 0,03 do 0,28 ng TEQ/kg (całej masy), a Pizza Supreme od 0,03 do 0,29 ng TEQ/kg, a kurczak (Kentucky Fried Chicken) od 0,01 do 0,031 ng TEQ/kg. Dla człowieka dorosłego o masie około 65 kg mogło to stanowić pobór jednorazowy 0,15-5,05 pg/kg, a dla dziecka o masie 20 kg nawet 0,58-9,31 pg/kg.
Wzrost I-TEQ w mięsie w wyniku obróbki termicznej potwierdzają także badania Grochowalskiego i Chrząszcza (2000). Badając żywność na polskim rynku stwierdzili oni 0,05-1,3 ng TEQ/kg tłuszczu w wieprzowinie surowej a 20-25 ng/kg w wieprzowinie poddanej grilowaniu na węglu drzewnym i otwartym ogniu.
Zatem zamiana porcji smażonego mięsa na jarzyny (obrane), oprócz innych dodatnich efektów zdrowotnych, oznacza także obniżenie poboru “dioksyn” droga pokarmową.
Wpływ przechowywania i podawania na poziom PCDD/Fs w żywności
Harward i in. (1991) stwierdzili, że rozkład kongenerów w mleku dostarczanym konsumentom w opakowaniach kartonowych jest inny niż w mleku “prosto od krowy”. W mleku pozyskiwanym bezpośrednio od krowy wyższy jest poziom izomerów wyżej chlorowanych - heksa i hepta dioksyn. W mleku na rynku stwierdzono wyższe poziomy TCDFs, co jest charakterystyczne dla profili PCDD/Fs w papierze.
Możliwość przechodzenia PCDD/Fs z papieru do żywności, z którą się kontaktuje, została potwierdzona przez Tiernan'a i in. oraz pierwsze badania papierowych filtrów do kawy prowadzone przez NCASI (Cramer i in., 1991). Już w 1988 Ryan i in. stwierdzili, że źródłem PCDD/Fs w mleku mogą być także dioksyny migrujące z opakowań kartonowych.
Ponieważ w USA opakowania papierowe są bardzo szeroko wykorzystywane nie tylko do przechowywania żywności - karton na mleko, soki, produkty mleczarskie, ale także przygotowywania i podawania żywności - jednorazowe opakowania na gotowe posiłki przystosowane po kuchenek mikrofalowych, papierowe kubeczki, w tym do napojów gorących, amerykańskie agencje rządowe - Food and Drug Administration, Center for Food Safety and Applied Nutrition oraz EPA i National Council of the Paper Industry for Air and Stream, przeprowadziły szerokie badania na możliwością migracji PCDD/Fs do żywności i oceną ryzyka z tym związaną. Przebadano kawę z papierowych kubeczków i filtry do kawy, tacki z daniami gotowymi do mikrofalówek, kukurydzę do mikrofalówek, talerze papierowe - czyli te produkty, które mają kontakt z żywnością często w ekstremalnych warunkach (wysoka temperatura) oraz opakowania do żywności, w których produkty mogą być przechowywane przez długi czas - kartony na mleko (mleko zawierało różny procent tłuszczu) oraz kartony na sok pomarańczowy (sok nie zawiera tłuszczu, ale ze względu na wysokie spożycie może w USA stanowić potencjalną drogę zagrożenia). Uwzględniono czas kontaktu z produktem, pozycję w diecie człowieka, warunki kontaktu - temperatura, inne, oraz to czy opakowania papierowe były pokrywane powłoką polietylenowa czy nie (Cramer i in., 1991). Przy ocenie ryzyka należało oczywiście uwzględnić czas kontaktu, długotrwałość, procent w diecie danego produktu. Niektóre z wyników Cramer'a i in. (1991) przedstawiamy w Tabeli 7.
Tabela 7. Ekspozycja na PCDD/Fs w wyniku kontaktu żywności z bielonym papierem,
wg. Cramer i in., 1991.
Żywność / produkt papierowy |
TEQ w papierze ppt |
TEQ w żywności ppq |
Spożycie dzienne g/osobę |
Pobór dobowy TEQ pg/osobę |
mleko / karton |
2 |
5 |
124 |
0,62 |
kawa / filtr |
8,8 |
1,5 |
136 |
0,20 |
kawa / papierowy kubek |
10,1 |
0,8 |
136 |
0,11 |
sok / karton |
2 |
15 |
36 |
0,54 |
gotowa porcja obiadowa / tacka do mikrofali |
10,6 |
35 |
61 |
2,1 |
talerze papierowe |
7,9 |
140 |
37 |
5,2 |
kukurydza prażona w mikrofalówce |
5,9 |
45 |
1,6 |
0,072 |
ciastka, drożdżówki / opakowanie kartonowe |
17 |
50 |
7,7 |
0,39 |
herbata / torebka |
17 |
8 |
22 |
0,12 |
margaryna / opakowanie |
17 |
82 |
7,3 |
0,60 |
Wpływ zawartości tłuszczu w mleku na stopień przenikania PCDD/Fs z opakowania do mleka nie został potwierdzony (La Fleur i in., 1991). Badania potwierdziły natomiast (Hayward i in., 1991), znaczny wpływ rodzaju opakowania (producent kartonu - czyli prawdopodobnie technologia pakowania lub przygotowywania kartonu na mleko). Procent migracji PCDD/Fs do mleka zależał także od wielkości opakowania - tzn. dla małych opakowań, gdzie stosunek powierzchni kontaktu z produktem do objętości produktu jest większy - migracja była większa, chociaż nie dotyczyło to opakowań wszystkich producentów.
Większość produktów papierowych, które mają kontakt z żywnością jest zwykle zabezpieczona folią polietylenową i to zarówno po stronie zewnętrznej - ze względów marketingowych - napisy, błyszcząca powierzchnia, jak i wewnętrznej, jako bariera pomiędzy papierem a produktem. Typowe opakowanie kartonowe, obecne na przykład na rynku fińskim, wykonane jest z kartonu o gęstości 295g/m2, przy czym powierzchnia zewnętrzna pokryta jest warstwą polietylenu 14 g PE /m2, a wewnętrzna trochę grubszą - 26 g PE/m2 (Kitunen i Salkinoja-Salonenm, 1992). Pomiary wykazały, że jakkolwiek mleko w opakowaniach całkowicie z tworzywa sztucznego nie zawiera PCDD/Fs na poziomie detekcji, o tyle mleko i inne produkty w opakowaniach z nie powlekanego kartonu oraz z kartonu powlekanego zawierają dioksyny, ale ich poziom zależy od producenta kartonu, a nie od rodzaju mleka (Hayward i in., 1991). Co ciekawe, o ile czysty granulowany polietylen nie zawierał PCDD/Fs na poziomie detekcji, to warstwy polietylenu zarówno na wewnętrznej, jak i na zewnętrznej powłoce kartonów zawierały PCDD/Fs, podobnie jak i karton (Kitunen i Salkinoja-Salonenm, 1992). Zatem PE był zanieczyszczany dioksynami w procesach foliowania na gorąco, a folie PE nie stanowią bariery dla PCDD/Fs - wręcz przeciwnie, ułatwiają ich migrację z papieru do żywności. Wydaje się nawet, że migracja PCDD/Fs z folii polietylenowej jest łatwiejsza niż z samego kartonu, gdzie są one silnie zadsorbowane na powierzchni włókien celulozowych i immobilizowane. Foliowanie samo w sobie nie generuje nowych PCDD/Fs, ale folia PE działa jak rezerwuar PCDD/Fs gotowych do migracji.
Mleko zawiera tłuszcze i jest produktem często spożywanym. Przyjmuje się,
że do 10% PCDD/Fs zawartych w opakowaniach może przeniknąć do mleka
(w przeliczeniu na I-TEQ). Przy typowym poziomie PCDD/Fs w kartonowych opakowaniach może to dawać 4 pg 2,3,7,8-TCDD/osobę/dzień lub 29 pg I-TEQ/osobę /dzień w wyniku picia mleka w kartonach (8,9 g tłuszczu z mleka dziennie - według danych statystycznych RFN w 1991) (Beck i in., 1992).
Inną drogą zanieczyszczania żywności przez PCDD/Fs jest wymywanie z papierowych filtrów w czasie parzenia kawy w maszynkach przelewowych (ewentualnie picie kawy z papierowych kubków). W niektórych krajach Europy zachodniej i USA w taki sposób przygotowywanej kawy spożywa się kilka filiżanek dziennie. Także w Polsce tego typu automaty do kawy są coraz popularniejsze. Według badań niemieckich z tego źródła do organizmu może trafić około 5 pg 2,3,7,8-TCDD/osoba/ dzień albo 8,2 pg I-TEQ/osoba/dzień (Beck i in., 1992).
Do ciekawych wniosków doszedł także Hashimoto i in. (1992), który badał proces wymywania dioksyn i furanów z filtrów do kawy. Stwierdził, że filtry papierowe dostępne na rynku japońskim, zawierają 1,2,7,8-TCDF, 2,3,7,8-TCDF oraz 2,3,7,8-TCDD, na poziomie od 0,00038 do 3,6 pg/g w przeliczeniu na I-TEQ. W czasie eksperymentalnych procesów parzenia kawy 1/3 dioksyn zawartych w papierze przechodziła do napoju, ale taka sama ilość przechodziła także przy przemywaniu filtrów gorącą wodą. Biorąc pod uwagę znikome stężenia, ryzyko jest minimalne, ale można je zredukować przemywając filtry papierowe gorącą wodą przed parzeniem kawy.
Po doniesieniach o możliwości przechodzenia PCDD/Fs z papierowych opakowań do żywności, w wielu krajach uregulowano prawnie dopuszczalną zawartość PCDD/Fs w papierze mającym kontakt z żywnością na poziomie poniżej 1 pg I-TEQ/g papieru. Na przykład w RFN norma taka obowiązuje już od 1989 roku.
Pomiary Beck'a i in. (1992b), przeprowadzone po wprowadzeniu tego zalecenia wykazały, że obecnie na rynku niemieckim norma ta jest spełniona, jeśli chodzi
o opakowania kartonowe. Trochę wyższe stężenie (do 1,4 pg I-TEQ/g) znaleziono
w papierowych kubkach do kawy. Przebadane filtry do kawy zawierały od 0,4
do 11 pg I-TEQ/g (średnia 4,4), przy czym stężenia powyżej 1 pg/g stwierdzono także w filtrach z nie bielonego papieru (od 4,2 do 0,4). Jest to o tyle interesujące,
że w niektórych krajach w latach 90-tych zapanowała moda na brązowe, nie bielone filtry do kawy, bowiem bielenie chlorem uważano za główne źródło dioksyn w produktach papierowych.
Literatura
Babich M.A., Ulsamer A.G., Cohn, M.,S., 1991, Risk assessment of 2,3,7,8-TCDD in paper consumer products, Chemosphere 23, 1527-1535.
Beck H., Dross A., Mathar W., 1992a, Devidence of PCDD and PCDF levels in human milk on various parameters in Germany, II, Chemosphere 25, 1015-1020.
Beck H., Dross A., Mathar W., 1992b, PCDD and PCDF in paper with food contact, Chemosphere 25, 1533-1538.
Cramer G., Bolger M., Henry S., Lorentzen R., 1991, USFDA assessment of exposure to 2,3,7,8-TCDD and 2,3,7,8-TCDF from foods contacting bleached paper products, Chemosphere 23, 1537-1550.
Czerwiński J., Dudzińska M.R., Rut B., Concentration of PCDDs, PCDFs and PCDTs in bottom ash from domestic heating systems as an effect of fuel composition, Organohalogen Compounds, 68, 2006, 139.
Dudzińska M.R., Kozak Z., 2001, Polichlorowane dibenzo-p-dioksyny i dibenzofurany - właściwości i oddziaływanie na środowisko, Monografie Komitetu Inżynierii Środowiska PAN, vol. 6, Lublin, str. 159.
Eduljee G.H., Gair, A.J., 1996, Validation of a methodology for modeling PCDD and PCDF intake via foodchain, Sci. Total Environ., 187, 211-229.
Ferrario, J., Byrne, C., 2000, The concnetration and distribution of 2,3,7,8-PCDDs/PCDFs in chickens, Chemosphere 40, 221-224.
Fiedler H., Cooper K.R., Bergek S., Hjelt M., Rappe C., 1997, PCDDs and PCDFs in fod samples collected in Southern Mississippi, USA, Chemosphere 34, 1411-1419.
Grochowalski A., Chrząszcz R., 2000, The result of the large scale determination of PCDDs, PCDFs and coplanar PCBs in Polishc food product samples using GC-MS/MS technique, Organohal. Comp. 47, 310-313.
Harrison, N., Wearne S., de M.Gem M.G., Gleadle A., Startin J., Thorpe S., Wright C., Kelly M., Robinson C., White S., Hardy D., Edinburgh V., 1998, Time trends in human dietary exposure to PCDDs, PCDFs and PCBs in the UK, Chemosphere 37, 1657-1670.
Hashimoto S., Ito H., Morita M., 1992, Elution of polychlorinated dibenzo-p-dioksyn and dibenzofurans form coffee filter papers, Chemosphere 25, 297-305.
Hayward D.G., Petreas M.X., Goldman L.R., Stephens R.D., 1991, Assessing the risk from 2,3,7,8, TCDD and TCDF in milk packaged in paper, Chemosphere 23, 1551-1559.
Hulster A., Marschner H., 1993, Transfer of PCDD/PCDF from contaminated soils into food and fodder crop plants, Chemosphere 27, 439-446.
Hulster A., Muller J.F., Marschner H., 1994, Soil-plant transfer of PCDDs and PCDFs to vegetables of the cucumber family (cucurbitaceae), Environ. Sci. Technol., 28, 1110-1115.
Kao A., Venkataraman C., 1995, Estimating the contribution of reentrainment to the atmospheric deposition of dioxin, Chemosphere 31, 4317-4331.
Kello D., Yrjanheikki E., 1992, Assessment of health hazards associated with exposure to dioxins, Chemosphere 25, 1067-1070.
Kitunen V.H., Salkinoja-Salonen M.S., 1992, Distribution of PCDD/PXCDFs in PE-coated paperboards, an explanation for migration of PCDD/PCDFs from board products, Chemopshere 23, 1561-1568.
LaFleur L., Bousquet T., Ramage K., Davis T., Mark M., Lorusso D, Woodrow D., Saldana T., 1991, Migration of 2,3,7,8-TCDD/2,3,7,8-TCDF from paper based food packaging and food contact products, Chemosphere 23, 1575-1579.
Lovett A.A., Foxall C.D., Creaser C.S., Chewe D., 1997, PCB and PCDD/DF congeners in locally grown fruit and vegetable samples in Wales and England, Chemosphere 34, 1421-1436.
Lovett A.A., Foxall C.D., Creaser C.S., Chewe D., 1998, PCB and PCDD/DF concentrations in egg and poultry meat samples from known urban and rural locations in Wales and England, Chemosphere 37, 1671-1685.
Malish, R., 1998, Update of PCDD/PCDF-intake from food in Germany, Chemosphere 37, 1687-1698, 1998.
Marpie L., Wasierski T., Throop L., 1992, In vitro penetration of 2,3,7,8-TCDD through intact human skin, Chemosphere 25, 1077-1084.
Masuda Y., Schecter A., Papke O., 1998, Concnetrations of PCBs, PCDFs and PVDDs in the blood of Yusho patients and their toxic equivalent contribution, Chemosphere, 37, 1773-1780.
Maystrenko V., Kruglov E., Amirova Z., Khamitov R., 1998, PCDD and PCDF levels in the environment and food form the republic of Bashkortostan, Russia, Chemosphere 37, 1699-1708.
McLachlan M.S., 1993, Exposure Toxicity Equivalents (ETEs): a plea for more environmental chemistry in dioxin risk assessment, Chemosphere 27, 483-490.
McLachlan, M.S., Thoma H., Reissinger M., Hutzinger O., 1990, PCDD/F in agricultural food chain. Part I: PCDD/F mass balance of lactating cow, Chemosphere, 20, 1013-1020.
McLachlan M.S., Horstmann M., Hinkel M., 1996, Polychlorinated dibenzo-p-dioxins and dibenzofurans in sewage sludge: sources and fate following sludge application to land, Sci. Total Environ. 185, 109-123.
Ryan, J.J., Panopio L.G., Lewis D., 1988, Bleached pulp and paper as a source PCDDs and PCDFs in foods, 8th International Symposium on Chlorinated Dioxins and related Compounds, Umea, Sweden.
Schecter A., Cramer P., Boggess K., Stanley J., Olson J.R., 1997, Levles of dioxins, dibenzofurans, PCB and DDE congeners in pooled food samples collected in 1995 at supermarkets across the United States, Chemosphere 34, 1437-1447.
Schecter A., Dellarco M., Papke O., Olson J., 1998, A comparison of dioxins, dibenzofurans abd coplanar PCBs in uncooked and broiled ground beef, catfish and bacon, Chemosphere, 37, 1723-1730.
Schecter A., Li L.J., 1997, Dioxins, dibenzofurans, dioxin-like PCBs and DDE in US fast-food, 1995, Chemosphere 34, 1449-1457.
Schecter A., Papke O., Ball M., Cau H.D., Dai L.C., Ming N.Q., Quynh H.T., Phuong N.N.T., Phiet P.H., Chi H.K., Vo D.T., 1992, Constable J.D., Spencer J., Dioxin and dibenzofuran lvels in blood and adipose tissue of Vietnamese from various location in Vietnam in proximity to Agent Orange spraying, Chemosphere 25, 1123-1128.
Schecter A., Ryan J., J., 1991, Brominated and chlorinated dioxin blood levels in a chemist 34 years after exposure to 2,3,7,8-TCDD and 2,3,7,8-TBDD, Chemosphere 23, 1921-1924.
Schrey P., Wittsiepe J., Mackrodt P., Selenka F., 1998, Human fecal PCDD/F-extrection exceeds the dietary intake, Chemosphere 37, 1825-1831.
Sullivan, M.J., Custance, S.R., Miller, C.J., 1991, Infant exposure to dioxin in mother's milk resulting from maternal ingestion of contaminated fish, Chemosphere 23, 1387-1396.
Wipf H.K., Homberger E., Neimer N., Ranalder U.B., Vetter W., Vuilleumeir J.P., 1982, TCDD levels in soil and plant samples from the Seveso Area, in: Hutzinger i in., Eds., Chlorinated Dioxin and related Compounds: Impact on the Environment, Pergamon Press, N.York, 115-126.
Wittsiepe J., Screy P., Ewers U., Selenka F., Wilhelm M., 2000, Decrease of PCDD/F levels in human blood from Germany over the past ten years (1989-1998), Chemosphere 40, 1103-1109.
1
Wyszukiwarka