Wstęp teoretyczny.
1.Cel ćwiczenia.
Celem ćwiczenia jest wyznaczenie stosunku Cp/Cv metodą Clementa - Desormesa, czyli wyznaczenie współczynnika ℵ(czyt. kappa). W tym przypadku wyznaczamy współczynnik ℵ dla powietrza.
2.Teoria pojemności cieplnej gazów
Przyjęcie metody statystycznej w fizyce cząsteczkowej doprowadziło do powstania kinetyczno - molekularnej teorii gazów. Specjalne miejsce zajmuje w niej prawo równomiernego rozkładu energii pomiędzy stopnie swobody cząsteczki gazu. Liczbą stopni swobody ciała nazywamy najmniejszą liczbę współrzędnych (tzw. współrzędnych niezależnych), które należy koniecznie podać, aby dokładnie określić położenia ciała w przestrzeni.
Cząsteczkę gazu jednoatomowego możemy rozpatrywać jako punkt materialny, gdyż cała jej masa jest skupiona w bardzo małym jądrze. Ma ona tylko trzy stopnie swobody związane z ruchem po-stępowym (trzy współrzędne kartezjańskie ). Dla cząsteczek dwu i więcej atomowych nie jest wszystko jedno, jak są ułożone w przestrzeni. Traktując je jako obiekty sztywne możemy stwierdzić, że mogą wykonywać ruchy obrotowe, co zwiększa liczbę współrzędnych koniecznych do dokładnego określenia położenia cząsteczki. I tak np. dla cząsteczki dwuatomowej trzeba już ich pięciu (dodatkowo dwa kąty sferyczne określające jej orientację), natomiast cząsteczka gazu o trzech lub więcej atomach wymaga trzech stopni swobody ruchu postępowego i trzech stopni swobody ruchu obrotowego (razem sześć). Jeżeli cząsteczka nie jest bezwzględnie sztywna, poszczególne jej części mogą przemieszczać się względem siebie i wówczas dla pełnego opisu jest konieczne wprowadzenie jeszcze dodatkowych stopni swobody związanych z jej ruchem drgającym.
Zasada równomiernego rozkładu energii między stopnie swobody ( tzw. zasada ekwipartycji energii) mówi, że na każdy stopień swobody cząsteczki średnio przypada jednakowa energia kinetyczna równa . Jeżeli cząsteczka jest obdarzona i-toma stopniami swobody, to jej średnia energia kinetyczna Ek wynosi
gdzie: k - stała Boltzmanna, T - temperatura w skali bezwzględnej.
W gazie doskonałym nie ma sił wzajemnego przyciągania międzycząsteczkowego (powietrze możemy traktować jako gaz doskonały), a więc energia potencjalna cząsteczek jest równa zeru. Dlatego energia wewnętrzna mola gazu doskonałego równa się sumie energii kinetycznych NA (liczba Avogadra) cząsteczek
gdzie: R = k NA oznacza uniwersalną stałą gazową.
Jednym z głównych osiągnięć kinetyczno-molekularnej teorii gazów jest możliwość teoretycznego obliczenia ich pojemności cieplnej. Wielkościami fizycznymi opisującymi pojemność cieplną gazów są: ciepło właściwe wyznaczone przy zachowaniu stałej objętości gazu (w przemianie izochorycznej) oznaczane przez cv oraz ciepło właściwe cp wyznaczane podczas przemiany izobarycznej gazu (przy stałym ciśnieniu).
3.Wyznaczanie współczynnika ℵ metodą Clementa-Desormesa.
Współczynnik κ związany jest z przemianą adiabatyczną gazu (przemianę zachodzącą bez wymiany ciepła między gazem a otoczeniem) opisywaną równaniem Poissona:
p Vκ = const
Stanowi to punkt wyjścia metody Clementa-Desormesa: aby wyznaczyć ℵ należy koniecznie przeprowadzić przemianę adiabatyczną. W omawianej metodzie korzysta się ze szczególnego związku zachodzącego między trzema przemianami gazowymi, a mianowicie adiabatyczną, izochoryczną i izotermiczną przedstawionego na rysunku poniżej.
Rys.1 Cykl przemian gazowych wykorzystywany przy wyznaczaniu metodą ℵ
Clementa-Desormesa
Punktem początkowym doświadczenia jest stan I gazu zdefiniowanego parametrami:
V = V1 p = p0 + ρ g h1 T = T1
gdzie: T1 - temperatura otoczenia, p0 - aktualne ciśnienie atmosferyczne.
Ciśnienie gazu jest większe od atmosferycznego. Stan I uzyskujemy przez sprężenie pewnej ilości gazu do objętości V1, a o wielkości uzyskanego ciśnienia możemy wnioskować ze wskazań mano-metru cieczowego różnicowego:
h1 - różnica poziomów cieczy manometrycznej;
ρ - gęstość cieczy manometrycznej.
Manometr różnicowy mierzy różnicę między ciśnieniem sprężonego gazu a ciśnieniem atmosferycznym.
Na początku doświadczenia musimy zbadać, czy badany gaz uzyskał temperaturę otoczenia. W tym celu po wstępnym sprężeniu gazu należy odpowiednio długo zaczekać, aby zdążył się on ochłodzić do temperatury otoczenia. W tym samym czasie na manometrze różnicowym obserwujemy zmniejszanie się ciśnienia gazu. Ustalenie się stałego ciśnienia jest znakiem, że wymagane warunki (stan I gazu) zostały osiągnięte. Teraz możemy przeprowadzić przemianę adiabatyczną przez szybkie jego rozprężenie do ciśnienia atmosferycznego i przejście do stanu II gazu określanego następującymi parametrami:
V = V2 > V1
p = p0
T = T2 < T1
Krzywa łącząca stany I i II na rys.10.1. jest adiabatą. Między parametrami gazu zachodzi więc zależność:
p0 + ρ g h1)V1κ = p0 V2κ
Podczas rozprężania adiabatycznego gaz się oziębił do temperatury T2. Możemy go teraz ogrzać do temperatury otoczenia T1 w przemianie izochorycznej (prosta łącząca stany II i III). Ciśnienie gazu rośnie aż do osiągnięcia stanu III gazu o parametrach:
V = V2
p = p0 + ρ g h2 < p0 + ρ g h1 ( h2 < h1 )
T = T1
Stany I i III posiadają tę samą temperaturę (otoczenia), a więc leżą na jednej izotermie (hiperbole łączące stany I i III na rys. 1).
Ze stanu I można również przejść do stanu III przeprowadzając przemianą izotermiczną.
Aby wyznaczyć ℵ należy skorzystać ze wzoru:
![]()
Ze wzoru tego wynika, że w opisanej metodzie wystarczy zmierzyć przyrosty ciśnień h1, i h2 (mierzone przyrostem słupa cieczy w manometrze ) w stosunku do ciśnienia atmosferycznego, aby z dobrą dokładnością wyznaczyć wartość szukanego stosunku Cp / Cv.
4.Opis przebiegu ćwiczenia.
Zestaw wykorzystany w tym ćwiczeniu składa się balonu szklanego B o pojemności kilkudziesięciu litrów wypełnionego powietrzem. Balon połączony jest z manometrem wodnym M na którym zaznaczona jest podziałka pozwalająca mierzyć różnicę ciśnień atmosferycznego i ciśnienia powietrza w balonie. Oprócz tego rurka łączy balon z pompką P i na niej też umiejscowiony jest kran K2, natomiast na drugiej rurce jest kran K1.
Rys. 2 Schemat budowy zestawu do pomiaru ℵ.
Stan I gazu osiągneliśmy poprzez wtłoczenie do butli B (o objętości kilkudziesięciu litrów) odpowiedniej ilości powietrza za pomocą niewielkiej ręcznej pompki P. Operację tę przeprowadza się przy otwartym kranie K2 i zamkniętym K1. Po zamknięciu kranu K2 i wyrównaniu temperatury powietrza wewnątrz butli z temperaturą otoczenia T1, różnicę ciśnień ρ g h1 pomiędzy ciśnieniem atmosferycznym p0 i ciśnieniem w butli można wyznaczyć za pomocą manometru M po odczytaniu wartości h1 na jego skali. Stan II osiąga się poprzez krótkotrwałe otwarcie kranu K1 w celu umożliwienia rozprężenia powietrza zawartego w butli do ciśnienia p0. Po zamknięciu kranu temperatura w butli, która przy rozprężeniu adiabatycznym spadła do T2. Ciśnienie wzrośnie wtedy do
p + ρ g h2. Wartość h2 zostanie odczytana na skali manometru napełnionego denaturatem. Czynność opisaną powtórzyliśmy 10-krotnie.
Obliczenia.
Wartość stosunku Cp/Cv można zapisać w postaci : ℵ=Cp/Cv , gdzie Cp to ciepło molowe przy stałym ciśnieniu (przemiana izobaryczna), a Cv to ciepło molowe wyznaczane podczas izochorycznego ogrzewania gazu.
Do obliczenia ℵ korzystamy ze wzoru
![]()
Po obliczeniu ℵ dla każdego pomiaru (wyniki podajemy w tabeli pomiarów) obliczamy wartość średnią ℵ, ze wzoru
![]()
ℵśr=![]()
która wynosi :
ℵśr=1.313
Wyliczyliśmy także średni błąd kwadratowy i średni błąd kwadratowy wartości średniej.
![]()
=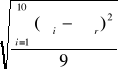
= 0.025 -średni błąd kwadratowy
![]()
=7.935x10![]()
- średni błąd kwadratowy wartości średniej
Tabela pomiarów.
Lp |
h1[m] |
h2[m] |
h1 - h2[m] |
ℵ |
1 |
0.108 |
0.025 |
0.083 |
1.301 |
2 |
0.185 |
0.045 |
0.140 |
1.321 |
3 |
0.206 |
0.049 |
0.147 |
1.312 |
4 |
0.146 |
0.037 |
0.109 |
1.339 |
5 |
0.056 |
0.012 |
0.044 |
1.273 |
6 |
0.073 |
0.017 |
0.056 |
1.304 |
7 |
0.136 |
0.030 |
0.106 |
1.283 |
8 |
0.151 |
0.037 |
0.114 |
1.325 |
9 |
0.174 |
0.042 |
0.132 |
1.318 |
10 |
0.224 |
0.059 |
0.165 |
1.358 |
Wnioski.
Celem ćwiczenia było wyznaczenie stosunku Cp/Cv dla powietrza
metodą Clementa-Desormesa.
Z pomiarów oraz obliczeń wynika, że wartość średnia tego współczynnika wynosi:
ℵśr=1.313±0.025
Wartość ta różni się od wartości teoretycznej, która przy 18![]()
C wynosi 1,403.
Miało na to wpływ szereg błędów pomiarowych. Głównym z nich było niedoskonałe przeprowadzenie przemiany izotermicznej, w której wzrost ciśnienia oraz spadek objętości powinny zachodzić przy zachowaniu stałej temperatury. Także podczas rozprężania adiabatycznego, był popełniany błąd, gdyż czas poświęcony na tą przemianę powinien być za każdym razem jednakowy. Na wartości pomiarów miały wpływ również niedokładności wynikające z pomiarów h1 i h2 oraz nieszczelność naczynia pomiarowego, a także różna od 18![]()
C temperatura otoczenia.
Wyszukiwarka