Chromatografia jest fizykochemiczną metodą rozdzielania składników jednorodnych
mieszanin w wyniku ich różnego podziału między fazę ruchomą i nieruchomą układu
chromatograficznego.
Fazą ruchomą może być gaz, ciecz lub płyn w stanie nadkrytycznym, a fazą nieruchomą
(stacjonarną) ciało stałe lub ciecz.
Chromatografia, początkowo niedoceniana, należy obecnie do najbardziej rozpowszechnionych
metod instrumentalnych w chemii analitycznej, znajduje.liczne zastosowania w dziedzinie biologii i w analizie związków organicznychzajmuje pozycję lidera (minimum 100 000 związków organicznych). Jest szeroko stosowana w badaniach biochemicznych jako metoda służąca do separacji i identyfikacjizwiązków chemicznych pochodzenia biologicznego.
Znanych jest wiele jej wariantów, a bardzo istotne jest to, iż jako nieliczna metoda, umożliwia uzyskanie wyników jakościowych i ilościowych dla wielu oznaczanych substancji w jednym cyklu pomiarowym, nawet przy niskich stężeniach i w obecności innych związków.
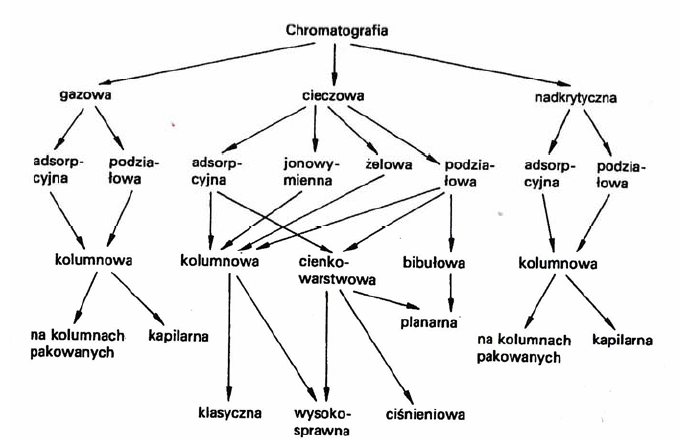
Klasyfikacji metod chromatograficznych można dokonać według kilku kryteriów.
Jednym znich jest:
a) Stan skupienia fazy ruchomej
W ten sposób wyróżnić można chromatografię:
gazową (ang. gas chromatography, GC),
cieczową (ang. liquid chromatography, LC),
w fazie nadkrytycznej (ang. supercritical fluid chromatography, SFC).
b) Stan skupienia fazy stacjonarnej
Fazą stacjonarną może być ciecz na nośniku lub ciało stałe. Stąd otrzymujemy następujące
układy chromatograficzne:
Faza ruchoma faza stacjonarna
gaz ciecz (ang. gas-liquid chromatography, GLC)
ciecz ciecz (ang. liquid-liquid chromatography, LLC)
gaz ciało stałe (ang. gas-solid chromatography, GSC)
ciecz ciało stałe (ang. liquid-solid chromatography, LSC).
Fazy ruchome - nośne
Klasyfikacja w zależności od rodzaju fazy ruchomej
Tabela: Powszechnie stosowane fazy w technikach separacyjnych.
Fazą ruchomą może być gaz, ciecz lub substancja w stanie nadkrytycznym, podczas gdy fazą stacjonarną jest substancja stała albo ciekła. Kinetyczny ruch cząsteczek prowadzi do
nieustannej wymiany substancji pomiędzy obie fazy. Jeżeli, dla danej substancji, podział jest
bardziej korzystny dla poruszającej się fazy stacjonarnej, cząsteczki spędzą większość czasu
migrując ze strumieniem tej fazy i będą oddzielone od innych składników, których cząsteczki
są dłużej zatrzymane przez fazę stacjonarną.
Wybór odpowiedniej fazy ruchomej decyduje o powodzeniu procesu rozdzielania chromatograficznego.
Fazy ruchome w chromatografii cieczowej stanowią pojedyncze rozpuszczalniki lub ich
dwu- lub więcej składnikowe mieszaniny. Faza ruchoma, którą wprowadza się do kolumny, nosi
nazwę eluentu. W kolumnie w skład fazy ruchomej oprócz eluentu mogą wchodzić także składniki rozdzielanej mieszaniny. Po rozdzieleniu składniki te są obecne w wycieku z kolumny, który nosinazwę eluatu.
Faza ruchoma w chromatografii cieczowej jest czynnikiem aktywnym a rodzaj i ilość rozpuszczalników ją stanowiących ma istotny wpływ na proces chromatografowania. Przy wyborze fazy ruchomej należy uwzględnić rodzaj i skład rozdzielanej mieszaniny, rodzaj zastosowanego wypełnienia kolumny oraz rodzaj detektora.
Rozpuszczalnik powinien charakteryzowac się wysoka czystością, powinien być trwały w warunkach procesu chromatograficznego, nie może wchodzić w reakcję ze składnikami próbki jak i z fazą stacjonarną. Musi on również umożliwiać detekcje składnków próbki.
Przy doborze eluentu należy wziąć pod uwagę jego siłę elucyjną, którą można
charakteryzować wielkością siły oddziaływania jego cząsteczek z powierzchnią adsorbentu. Przy chromatografii na adsorbentach polarnych siłę elucji wyznacza polarność i polaryzowalność
cząsteczek eluentu. Siła ta jest tym większa, im większa jest polarność rozpuszczalnika. W
przypadku adsorbentów niepolarnych polarność i polaryzowalność nie mają większego wpływu na siłę elucji rozpuszczalnika. Zależy ona natomiast od niespecyficznych sił van der Waalsa
(oddziaływań dyspersyjnych). W tym przypadku siła elucji wzrasta ze wzrostem rozmiarów
niepolarnych fragmentów cząsteczek rozpuszczalników.
Odpowiedni dobór rozpuszczalników pozwala na efektywne rozdzielanie nawet skomplikowanych mieszanin.W celu ułatwienia wyboru właściwego rozpuszczalnika jako eluentu rozpuszczalniki ułożono w szeregi eluotropowe.
W przypadku polarnych faz stacjonarnych (np. żelukrzemionkowego lub tlenku glinu) rozpuszczalniki ułożone wg rosnącej mocy eluowania (miarą której są indeksy polarności) mają kolejność następującą: n-pentan < n-heksan < cykloheksan <tetrachlorek węgla < toluen <benzen < eter dietylowy < chloroform < dichlorometan <tetrahydrofuran < dichloroetan < aceton < octan etylu < acetonitryl < pirydyna < etanol < metanol<woda < kwas octowy.
Moc elucji przy chromatografowaniu na niepolarnej fazie stacjonarnej (np.węglowej fazie odwróconej) jest odwrotna.
Oprócz polarności ważną cechą eluentów jest ich lepkość. Wpływa ona na wysokość
ciśnienia potrzebnego do wywołania odpowiedniego przepływu rozpuszczalnika przez kolumnę
(należy stosować eluenty o małej lepkości).
Z innych właściwości fizykochemicznych eluentów mających wpływ na ich przydatność w
chromatografii cieczowej wymienić należy współczynnik załamania światła (w przypadku
zastosowania detektora refraktometrycznego) oraz granicę długości fali promieniowania
elektromagnetycznego, przy której rozpuszczalnik staje się nieprzezroczysty dla nadfioletu (w
przypadku stosowania absorpcyjnego detektora UV).
W Tab. 1 zebrano podstawowe właściwości niektórych rozpuszczalników stosowanych jako eluenty w chromatografii adsorpcyjnej.
W chromatografii podziałowej LLC gdzy fazę stacjonarna najczęściej tworzy polarna ciecz, taka jak np. woda, glikol, to fazą ruchoma nie wykazuje polarności, może to być: heksan, chloroform, benzen. W przypadku, gdy faza stacjonarna nie wykazuje polarności, np. jest to węglowodór, faza ruchoma jest polarna, np. jest to woda, tego typu metodę nazywamy chromatografią z odwróconymi fazami.
W chromatografii sitowej eluent powinien być obojętny zarówno w stosunku do substancji
chromatografowanej, jak i do wypełnienia kolumny a jego jedynym zadaniem jest przenoszenie
składników chromatografowanej mieszaniny wzdłuż kolumny.
Gdy wypełnienie stanowią organiczne stacjonarne fazy hydrofobowe, wówczas fazami ruchomymi są rozpuszczalniki średnio polarne: dichlorometan, chloroform, toluen lub tetrahydrofuran. Natomiast, gdy wypełnienie kolumny stanowi polarny związek nieorganiczny, eluentem musi być woda, ewentualnie alkohole.
Wodne fazy ruchome stosuje się także w przypadku faz stacjonarnych takich jak Sepharose i
Sephadex.
Inne zadanie spełnia eluent w chromatografii jonowej. Fazy ruchome zawierają jony
przeciwnego znaku (przeciwjony) względem ładunków elektrycznych na powierzchni wymieniaczy jonowych. Substancje jonowe silnie dysocjujące, chromatografowane słabym eluentem, silnie oddziałują z wymieniaczem i mają długie czasy retencji. Substancje chromatografowane słabo dysocjujące nie mogą wypierać jonów osadzonych na wymieniaczu jonowym z eluentu o silnym charakterze jonowym i mają bardzo krótkie czasy retencji. Siła jonowa jest najważniejszym czynnikiem charakteryzującym eluent w chromatografii jonowymiennej. Na właściwości eluentu wpływa też pH i obecność modyfikatora organicznego.
Do rozdzielania składników niektórych mieszanin (zwłaszcza związków biologicznie
czynnych) stosuje się chromatografowanie z tworzeniem par jonowych. W tym rodzaju
chromatografii do eluentu dodaje się substancję tworzącą jony hydrofobowe (np. C7H15SO3
-) zwane przeciwjonami. Jony te oddziaływując z jonami próbki tworzą neutralne pary jonowe, które podlegają zwykłemu rozdzielaniu chromatograficznemu w odwróconym układzie faz (RP). Wybór przeciwjonów zależy od rodzaju analizowanej próbki. Próbki zasadowe są zwykle analizowane przy zastosowaniu przeciwjonów soli sodowych alkilosulfonianów przy pH około 3. Próbki kwasowe są analizowane przy użyciu np. fosforanu tetrabutyloamoniowego przy pH około 7-8. Dobre wyniki uzyskuje się stosując bromek cetylotrimetyloamoniowy do tworzenia par jonowych z pochodnymi kwasów karboksylowych.
W przypadku stosowania normalnego układu faz, tzn. polarnych faz stacjonarnych, jako
fazy ruchome używane są rozpuszczalniki mające mniejszą od nich polarność. Eluentami w tym
układzie są np.: heksan, izooktan, chloroform i dichlorometan. Jeżeli faza stacjonarna jest słabo
polarna lub niepolarna, to faza ruchoma musi być bardziej polarna. Fazą ruchomą mogą być
tetrahydrofuran, acetonitryl, metanol, woda. Dobierając skład eluentów, należy pamiętać, że wzrost zawartości wody wydłuża czasy retencji chromatografowanych substancji niepolarnych, a wzrost ilości rozpuszczalnika organicznego - skraca ich czasy retencji.
Na koniec należy podkreślić istotne dla chromatografii wymagania stawiane rozpuszczalnikom pod względem czystości. Wszystkie zanieczyszczenia (szczególnie związkami o dużej stałej dielektrycznej) zakłócają przebieg rozwijania chromatogramu. Nielotne pozostałości z rozpuszczalników, wobec ich dużych ilości w porównaniu z ilościami wymywanych związków, zanieczyszczają te ostatnie w istotnym stopniu. Zaleca się więc stosowanie rozpuszczalników oczyszczonych i świeżo destylowanych.
Elucja izokratyczna i elucja gradientowa
W różnych metodach chromatografii cieczowej czas retencji składników próbki można
regulować przez odpowiedni dobór mocy elucyjnej eluentu. Może to być dobór składu mieszaniny rozpuszczalników (chromatografia adsorpcyjna, chromatografia podziałowa z fazami związanymi w układzie NP i RP) lub pH roztworu i siły jonowej roztworu w przypadku chromatografii jonowymiennej.
Wyróżnić można dwa przypadki:
skład eluentu jest jednakowy przez cały czas chromatografowania próbki - jest to tzw.
elucja izokratyczna,
skład eluentu zmienia się podczas chromatografowania próbki - jest to tzw. elucja
gradientowa.
Elucja gradientowa ma szerokie zastosowanie w przypadku chromatografowania mieszanin
złożonych, zawierających składniki różniące się znacznie polarnością. W elucji gradientowej proces chromatografowania rozpoczyna się eluentem o małej mocy elucyjnej, a następnie dodając rozpuszczalnika o dużej mocy elucyjnej, zwiększa się moc elucyjną mieszaniny w czasie. W przypadku chromatografii jonowymiennej moc elucyjną reguluje się przez zmianę pH i siły jonowej eluentu.
Gazy nośne
Gaz nośny stanowi fazę ruchomą. Spełnia on dwie funkcje. Po pierwsze jego zadaniem jest transport próbki gazu badanego do kolumny rozdzielczej, a następnie transport kolejnych składników rozdzielonej mieszaniny, opuszczających kolumnę rozdzielczą. Po drugie stanowi on punkt odniesienia - wyznacza poziom zerowy dla interpretacji wyników analizy.
Strumień gazu nośnego powinien być stabilizowany, natomiast sam gaz powinien swoimi
właściwościami być możliwie zbliżonym do gazu idealnego.
Podstawowe cechy dobrego gazu nośnego to obojętność wobec fazy stacjonarnej,
elementów przyrządu oraz składników badanych mieszanin. Warunki te spełniają: hel, argon, azot oraz wodór i te właśnie gazy stosowane są najczęściej. Gaz nośny jest zwykle dostarczany z butli ciśnieniowych, wyjątkiem jest wodór, który można także dostarczać do chromatografu przy użyciu generatorów elektrolitycznych. Ważny jest również stopień czystości gazu nośnego, gdyż
zanieczyszczenia mogą powodować zakłócenia pracy detektora i dezaktywację faz stacjonarnych. Gaz nośny nie może zawierać zanieczyszczeń, przede wszystkim tlenu, pary wodnej i węglowodorów.
Przed kolumną zwykle znajdują się zatem filtry (różnego rodzaju adsorbenty), służąc do usuwania tlenu ( chemisorpcja na metalach), wody i zanieczyszczeń organicznych ( sorpcja na sitach molekularnych lub na żelu krzemionkowym). Przed wlotem na kolumnę znajdują się również regulatory przepływu, pozwalające na utrzymanie stałego ciśnienia gazu na pożądanym poziomie.
Gaz nośny dobiera się często pod kątem przydatności do pracy w zestawie z konkretnym
detektorem. Dla przykładu w przypadku termokonduktometru istotne znaczenie ma wartość przewodności cieplnej gazu nośnego. Przewodności cieplne kilku gazów wyznaczone wg powietrza ( temp 0°C) przedstawione są w tabeli.
Gaz |
Przewodności cieplne wg powietrza w temp 0°C |
H2 He N2 O2 N2O NO CO CO2 Ar Związki organiczne |
7,1 6,2 1,02 1,04 0,65 0,93 0,96 0,61 0,71 0,4-0,6 |
Z danych zawartych w tabeli wynika, że do wykrycia związków organicznych najodpowiedniejszymi gazami nośnymi są wodór i hel, a np. do wykrycia wodoru - ditlenek węgla lub argon.
Bibliografia:
1. W. Szczepaniak, Metody instrumentalne w analizie chemicznej, PWN, Warszawa 2004
2. Z. Witkiewicz, Podstawy chromatografii, WNT 1995, 2002
3. J. Minczewski, Z. Marczenko, Chemia Analityczna, t. III, PWN,
Internet : http//analiza.ouh.org/wyk/11.pdf ; www.chem.ww.edu.pl/.../w.Augustyniak/IZO2.pdf;
http://www.pg.gda.pl/chem/Dydaktyka/Analityczna/GC/Cz_I_Co_to_jest_chromatografia.pdf
Katedra Chemii
Przedmiot: Analiza instrumentalna
Kierownik przedmiotu - prof. dr hab. Juliusz Perkowski
FAZY NOŚNE W CHROMATOGRAFII
Agata Pietrucka
Wydział Rolniczy
kierunek :Biotechnologia
II rok
Poznań, grudzień 2007
Wyszukiwarka
Podobne podstrony:
Sprawozdanie na ochrone cw5, biotechnologia Sem 5 Olsztyn, III rok, III rok BARDZO DOBRE !!!!
Na seminare z immuny, biotechnologia Sem 5 Olsztyn, III rok, układ immu2009
ściaga na egzamin z surowca, Leśnictwo UP POZNAŃ 2013, Surowce lesne
opracowane zagadnienia na surowiec, Leśnictwo 2009 Up Poznań, rok II, Surowiec drzewny
tesk- fizyko egzam !, fizjoterapia WSEiT poznań, III semestr, egzamin fizyko
Opracowania pytań na analizę instrumentalną
podanie-o-druga-platna-poprawke, fizjoterapia WSEiT poznań, III semestr
13. Miareczkowanie amperometryczne, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metod
podanie-o-druga-platna-poprawke fizjologia, fizjoterapia WSEiT poznań, III semestr
cennik krótki odrobina zdrowia, fizjoterapia WSEiT poznań, III semestr
Pyt 1 kineza, fizjoterapia WSEiT poznań, III semestr, egzamin kineza
Chromatografia, Biotechnologia, III semestr, BKiIG, Instrukcje
Zagadnienia na egzamin z Gutka, ZUT-Energetyka-inżynier, III Semestr, Wytrzymałość materiałów II, Wy
Socjologia dr Prandecki tematy na prace, Studia - resocjalizacja - Tarnów, I,II,III semestr, Sesja
HARMONOGRAM - POPRAWEK, fizjoterapia WSEiT poznań, III semestr
więcej podobnych podstron