SPOIWA MINERALNE
WYDZIAŁ BUDOWNICTWA ARCHITEKTURY I INŻYNIERII ŚRODOWISKA |
|
PONIEDZIAŁEK |
GRUPA VIII |
MGR BOŻENA KARBOWSKA |
11:45 |
1) Przebieg doświadczenia i obserwacje:
1g cementu wsypany został do kolby Erlenmeyera. Do niego dodano 80 cm³ zagotowanej wody destylowanej oraz 40 cm³ 0,5 M kwasu solnego. Zawartość była gotowana przez 3 minuty, by odpędzić dwutlenek węgla. Po 3 minutach gotowania dodane zostały 3 krople 1% roztworu fenoloftaleiny i gorąco miareczkowano 0,5 m roztworem KOH.
Przy pierwszej próbie różowawe zabarwienie zauważalne było po dodaniu 1 cm³ roztworu. Kolor intensywnie różowy uzyskano po 7,5 cm³ w pierwszej próbie, natomiast po 10 cm³ w drugiej.
2) Obliczenia:
Zawartość wolnego CaO w pierwszej próbie:
A- ilość cm³ 0,5M KOH, zużyta na zobojętnienie nadmiaru kwasu solnego, który nie przereagował z wolnym CaO, znajdującym się w 1 g cementu
A=7,5 cm³ dla intensywnie różowego zabarwienia (1 cm³ dla lekko różowego zabarwienia)
%CaO=(40-7,5)∙0,014∙100%= 45,5% [%CaO=(40-1)∙0,014∙100%=54,6%]
Zawartość wolnego CaO w drugiej próbie:
A=10 cm³
%CaO=(40-10) ∙0,014∙100%=42%
MODUŁ HYDRAULICZNY= %CaO: (%SiO2 + %Al2O3+%Fe2O3 )
I PRÓBA = 1,45 (1,75 przy lekkim zabarwieniu)
II PRÓBA = 1,34
MODUŁ KRZEMIANOWY=% SiO2: (%Al2O3+%Fe2O3 )=2,415
MODUŁ GLINOWY=% Al2O3:%Fe2O3 =0,979
Wnioski:
Wartość modułu hydraulicznego powinna być zawarta w granicach 2-2,2 w przeprowadzonym doświadczeniu wartość jednak wyniosła 1,45 (1,75) w pierwszej, a 1,34 w drugiej próbie. Wpływ na tę niezgodność mógł mieć punkt doświadczenia, w którym należało wskazać ilość roztworu KOH ,który potrzebny był do uzyskania różowego zabarwienia- ilość ta determinuje moduł hydrauliczny. Jednakże należałoby sprecyzować jaki jest pożądany stopień nasycenia koloru różowego.
Niezgodna z właściwym była również wartość modułu glinowego, która wynosi 0,979, a powinna zawierać się między 1,7 a 3,5. Spowodował to niewłaściwy dobór surowców chemicznych. Skład procentowy cementu powinien być ustalony z wartościami modułów.
REAKCJE:
podczas dodawania do cementu roztworu HCl
CaCO3 +2HCl → CO2 + H2O + CaCl2
proces miareczkowania:
CaCl2 + 2KOH → Ca(OH)2 + 2KCl
podczas dodawania wody:
Cząsteczki niektórych składników cementu przyłączając wodę ulegają jedynie
hydratacji. Istnieją również takie, których cząsteczki ulegają hydrolizie. Reagowanie
różnych składników cementu z wodą przebiega z różną szybkością. Główny
składnik cementu- alit, reaguje z wodą energicznie, zaraz po zarobieniu cementu
wodą.
HYDROLIZA ALITU
3CaO∙ SiO2 + nH2 O →2CaO∙ SiO2 ∙(n-1) H2 O+ Ca(OH)2
Glinian wapniowy 3CaO∙ Al2O3 na początku reaguje z gipsem zawartym w cemencie:
3CaO∙ Al2O3+3 CaSO4+31 H2 O→3CaO∙ Al2O3∙3 CaSO4∙31 H2 O (produktem tej
reakcji jest sól Candela)
Glinian wapniowy, który nie przereagował z gipsem ulega hydratacji:
3CaO∙ Al2O3+6 H2 O→3CaO∙ Al2O3∙3 CaSO4∙6 H2 O
Glinian wapniowy reaguje też z Ca(OH)2 , który powstaje w wyniku hydrolizy alitu:
3CaO∙ Al2O3+ Ca(OH)2 +12 H2 O→4CaO∙ Al2O3∙13H2 O (w ten sposób powstaje
uwodniny glinian czterowapniowy)
Braunmilleryt 4CaO∙ Al2O3∙ Fe2O3 gdy reaguje z H2 O wytwarza uwodnione
gliniany i żelaziany wapniowe:
4CaO∙ Al2O3∙ Fe2O3+7 H2 O→3CaO∙ Al2O3∙6 H2 O+CaO∙ Fe2O3∙ H2 O
WYDZIAŁ BUDOWNICTWA ARCHITEKTURY I INŻYNIERII ŚRODOWISKA |
|
PONIEDZIAŁEK |
GRUPA VIII |
|
11:45 |
1) Przebieg doświadczenia :
Zmierzyłyśmy pH roztworów HCl w zakresie stężeń 0,1 M do 0,000001M. Rozcieńczałyśmy stopniowo za pomocą wody destylowanej:do kolbki miarowej o pojemności 100ml przeniosłyśmy pipetą 10 ml 0,1 M HCl. Następnie uzupełniłyśmy wodą destylowaną do kreski, zakorkowałyśmy kolbkę wymieszałyśmy. Przygotowując kolejne roztwory postępowałyśmy w ten sam sposób. Roztwory przeniosłyśmy do naczyniek polietylenowych i za pomocą pH-metru zmierzyłyśmy pH.
Zmierzyłyśmy wartości pH dla kwasu solnego,octowego i szczawiowego o stężeniu 0,1M
W naczyńkach polietylenowych rozpuściłysmy sole:
NaCl
Na3PO4
CH3COONa
NH4Cl
NiCl2
NaHCO3
Następnie zmierzyłyśmy wartości pH
WYNIKI:
pH roztworów HCl w zakresie stężeń 0,1M do 0,000001M
0,000001 M |
6,62 |
0,00001 M |
6,06 |
0,0001 M |
5,71 |
0,001 M |
4,03 |
0,01 M |
2,41 |
0,1 M |
1,74 |
HCl |
1,74 |
CH3COOH |
3,34 |
C2H2O4 |
1,96 |
NaHCO3 |
7,99 |
CH3COONa |
7,17 |
Na3PO4 |
10,86 |
NH4Cl |
6,20 |
NaCl |
7 |
NiCl2 |
6,04 |
REAKCJE:
NaCl +H2O→ hydroliza nie zachodzi
Na3PO4+2H2O→ H3PO4+ NaOH
CH3COONa+H2O→CH3COOH +NaOH
NH4Cl+H2O→NH4OH+HCl
NiCl2+H2O→Ni(OH)2+HCl
NaHCO3+H2O→NaOH+H2CO3
Na3PO4→3Na++ PO4-
H2O → OH-+ H+
↓ ↓
nie zachodzi H3PO4
CH3COONa→CH3COO++ Na-
H2O → H+ +OH-
↓ ↓
CH3COOH nie zachodzi
NH4Cl→NH4++ Cl-
H2O →OH- + H+
↓ ↓
NH4OH nie zachodzi
NiCl2→Ni++ 2Cl-
H2O→ OH-+ H+
↓ ↓
NiOH nie zachodzi
NaHCO3→Na++HCO3-
H2O → OH-+ H+
↓ ↓
nie zachodzi H2CO3
WNIOSKI:
Kwas solny jest kwasem bardzo mocnym, jednak jego moc maleje w miarę rozcieńczania. Jest on najmocniejszym z kwasów mierzonych. Kwasy szczawiowy i octowy są słabymi.
Hydroliza nie zaszła dla NaCl. Roztwór przyjął odczyn obojętny=7. Stało się tak dlatego, gdyż kwas i zasada utworzone od tych pierwiastków są mocne, a w takim przypadku hydroliza nie zachodzi. Odczyn zasadowy(>7) przyjęły sole: NaHCO3 ,CH3COONa ,Na3PO4. Są to bowiem sole zawierające Na, którego jon nie wiąże się z jonem OH podczas hydrolizy tworząc wodorotlenek. Powoduje to większe stężenie jonów OH w roztworze, co wpływa na odczyn zasadowy.
Odczyn kwaśny(<7) maja natomiast sole :NiCl2, NH4Cl. HCl jest mocnym kwasem i dlatego podczas hydrolizy nie następuje jego wiązanie. Wpływa to na wzrost stężenia jonów H+ w roztworze i odczyn kwaśny.
Ćwiczenie 6 KOROZJA METALI II
WBAiIS
Budownictwo Lądowe |
|
Poniedziałek NP 29.10.2001 |
Grupa VIII
|
mgr Artur Hasiński |
g. 11:45 |
Wykonanie doświadczenia:
a) Do doświadczenia użyłem dwóch płytek stalowych oczyszczonych papierem ściernym, odtłuszczonych i opłukanych wodą destylowaną. Następnie płytki zostały zanurzone do roztworu HCl na kilka minut. Po wyjęciu z kwasu zostały opłukane wodą destylowaną o osuszone bibułą.
Jedna z płytek została zanurzona do 4% roztworu dwuchromianu K2Cr2O2 o temperaturze 90-950C na czas 15 minut. Po tym czasie płytkę wyjęto z roztworu, opłukano wodą destylowaną a następnie osuszono ją bibułą.
Na każdą z tych płytek nałożono krople roztworu Akimowa (CuSO4).
b) Do doświadczenia użyto oczyszczoną papierem ściernym i odtłuszczoną w metanolu płytkę stalową jak również płytki pokryte powłokami metalicznymi: miedziową, cynkową, niklową oraz te same o porysowanych (uszkodzonych) powłokach. Na każdą z nich naniesiono kroplę roztworu 0,1% K3[Fe(CN)6]. Z jonami Fe tworzy on niebieski osad.
Wyniki i obserwacje doświadczenia:
a) Na płytce, która została poddana procesowi chromowania pojawił się czarny osad. Po naniesieniu na nią kropli roztworu Akimowa ta „rozlała się” po płytce i nie zaobserwowano na płytce żadnych zmian. Gdy na drugą stalową płytkę (która nie została poddana procesowi chromowania) naniesiono krople powyższego roztworu to po upływie około 20 sekund pojawił się wyraźny osad koloru rudobrązowego, który podczas doświadczenia ciemnieje i przyjmuje żelową konsystencje
b) W tym doświadczeniu na płytkach (z powłokami metalicznymi) zaobserwowano następujące zjawiska:
- cynkowa: wytrąca się lekko białawy osad na rysach
- niklowa: wytrąca się czerwonawy osad na rysach
miedziana: wytrącił się niebieskawy osad na rysach, na częściach nieuszkodzonych tych płytek nie zaobserwowano żadnych zmian.
Natomiast na zwykłej stalowej płytce kropla
Zachodzące reakcje:
a) Pierwsza płytka został poddana procesowi chromowania czyli posiadała niemetaliczną powłokę ochronną (ciemny osad). Z tego powodu nie zaobserwowano tu żadnych zmian. Natomiast po nałożeniu kropli roztworu Cu4SO4 na płytkę niechromowaną zaszła następująca reakcja
Fe + CuSO4FeSO4 + Cu (w elektrolicie) Cu- rudobrązowy osad
Zaszły tu następujące reakcje korozyjne:
Fe →Fe ²+ +2e‾ (reakcja anodowa)
Fe +Cu²+→ Fe ²++Cu - reakcja całościowa (proces redukcji i utlenienia)
b) Powłoka cynkowa (-760mV) na płytce stalowej to przykład anodowej powłoki ochronnej. Metal chroniący jest o niższym potencjale niż metal chroniony. Powłoka taka chroni metal nawet jeżeli jest porowata. Co prawda tworzy się ogniwo korozyjne jednak rozpuszczeniu ulega metal chroniący (w tym przypadku cynk). Zachodzą znane reakcje korozyjne:
Zn Zn2+ + 2e- (anoda)
½ O2 + H2O + 2e- 2OH (katoda)
Zn2+ + 2OH- Zn(OH)2 - biały osad (elektrolit)
Płytka pokryta powłoką miedzianą (+340mV) to przykład katodowej powłoki ochronnej. Jest to jedna tylko skuteczne przy idealnej szczelności między metalami. W przypadku nieszczelności tworzy się ogniwo korozyjne i korozji ulega metal chroniony (czyli w tym przypadku żelazo).
Fe →Fe ²+ +2e‾ (anoda)
½ O2 + H2O + 2e- 2OH- (katoda)
Fe2+ + 2OH- Fe(OH)2 (elektrolit)
2Fe(OH)2 + ½ O2 + (n-2)H2O Fe2O3 * nH2O rdza.
Płytka pokryta powłoką niklową (-220mV) działa na tej samej zasadzie co poprzednia czyli katodowej powłoki ochronnej.
Wnioski:
Metale chromowane (posiadające niemetaliczną powłokę ochronną) wykazują odporność na korozje i nie zachodzą na ich powierzchni istotne zmiany. Natomiast metale niechromowane takiej właściwości nie wykazują. Pokazało to nasze doświadczenie. Między miedzią (+340mV),a żelazem (-440mV) istnieje różnica potencjałów i jest dzięki temu możliwa korozja. Stal pod wpływem roztworu soli miedziowej pokryła się cienką warstwą miedzi. Metaliczna miedź, wytrącona z soli, miała barwę rudawobrązową, co można było zaobserwować na zabarwieniu kropli.
Mamy tu do czynienia z metalicznymi powłokami ochronnymi. Powłoką anodową jest powłoka cynkowa ponieważ cynk ma mniejszy potencjał niż żelazo. Zapewnia to dodatkową ochronę katodową przez przesunięcie potencjału blaszki do obszaru odporności nawet w przypadku uszkodzenia powłoki. Powłokami katodowymi są powłoki miedziana i niklowa. Są wykonane z metali szlachetniejszych i powinny być całkowicie szczelne. W innym razie korozji zacznie ulegać żelazo.
Ćwiczenie 5 KOROZJA METALI I
WBAiIS
Budownictwo Lądowe |
|
Poniedziałek NP 15.10.2001 |
Grupa VIII
|
mgr Artur Hasiński |
g. 11:45 |
Rdzewienie metali:
Ćwiczenie to polegało na porównaniu zachowań się dwóch różnych płytek stalowych (zwykłej i nierdzewnej) w roztworze o składzie 3% NaCl i 0,3% H202. Owe płytki zostały umieszczone na okres 45 minut we wcześniej wymienionej cieczy. Przed umieszczeniem ich w rozworach zostały oczyszczone, odtłuszczone, opłukane i osuszone. Zważono je z dokładnością do 0,001g: zwykła płytka miała 9,214g natomiast nierdzewna 14,883g.
Korozja w roztworach elektrolitów obojętnych przebiega z reguły zbyt wolno aby można ją było zaobserwować w ciągu jednego badania . Dlatego też nasze próbki metalu zostały umieszczone w roztworze o 3% stężeniu soli NaCl (odznacza się najwyższą agresywnością korozyjną). Już po kilkunastu minutach na blaszce ze stali zwykłej pojawiają się rdzawe plamy - rozpoczyna się korozja stali. Natomiast płytka ze stali nierdzewnej pozostaje w takim samym stanie jak przy rozpoczęciu doświadczenia, nie zaobserwowano żadnych zmian zewnętrznych. Po upływie 45 minut obydwie płytki zostają wyciągnięte z roztworu, opłukane wodą i osuszone. Ta ze stali zwykłej pokryła się rdzą a na nierdzewnej nie stwierdziłem jakichkolwiek zmian. Co prawda waga tej drugiej zmieniła się o 0,001g jednak tak małą różnice uważam za dopuszczalny błąd wagi czyli przyjmujemy że masa również pozostała niezmienna. Natomiast płytka ze stali zwyczajnej zmieniła swój wygląd - jej powierzchnia pokryła się lekką warstwą rdzy. Po tym doświadczeniu jej ciężar wzrósł o 0,114 grama i ostatecznie wyniósł 9,214g. Na owej próbce zaszły liczne procesy elektrochemiczne:
- anodowa: FeFe2++2e-
- katodowa: 1/2O2+H2O+2e-2OH-
procesy w elektrolicie: CO2+H2O H2CO3 H2CO3H++HCO3-
NaClNa++Cl-
Fe2++2OH-Fe(OH)2
Fe(OH)2+1/2O2+(n-2) H2OFe2O3*n H2O
Związek Fe2O3 jest to rdza powstała po powyższych procesach na blaszce z metalu zwykłego.
2. Wykonanie oksydacyjnego (tlenowego) ogniwa stężeniowego:
Korozja elektrochemiczna żelaza polega na dwóch procesach: powstawaniu jonów Fe2+ w miejscach anodowych, a w miejscach katodowych - zaalkalizowaniu towarzyszącemu redukcji wody lub tlenu. Odczynnik ferroksylowy to bardzo rozcieńczony roztwór K3Fe(CN)6, z dodatkiem fenoloftaleiny doprowadzonej za pomocą bardzo rozcieńczonego roztworu NaOH prawie do początku zmiany barwy, dodatkowo zawierający ok. 2% NaCl - w ok. 0,5-procentowym agarze. W miejscach anodowych (właściwej korozji) powstaje ciemna plama błękitu pruskiego, natomiast miejsca katodowe barwią się na czerwono.
Pojawienie się w środkowej części niebieskiego osadu wskazuje na obecność jonów żelaza (II) które z K3Fe(CN)6 tworzą sześciocyjanożelazian (III) żelaza (II):
3Fe2++2[Fe(CN)6]3- Fe3[Fe(CN)6]2
Przebiega tu reakcja a świadczy o tym obecność jonów Fe2+:
Reakcja anodowa: Fe0 Fe2++2e-
Na zewnętrznej części kropli pojawia się kolor malinowy świadczący o obecności jonów OH-. Powstały one na skutek redukcji tlenu atmosferycznego w środowisku wodnym:
Rekcja katodowa: 2H2O+O2+4e- 4OH-
Rozkład błekitu nietrwałego w środowisku zasadowym:
Fe3[Fe(CN)6]2+6OH- 2[Fe(CN)6]3- + 3Fe(OH)2
Strąca sie wodorotlenek żelaza (III), który ulega stopniowemu utlenieniu do uwodnionego tlenku żelaza (III):
4Fe(OH)2+O2 2 Fe2O3*H20 + 2 H20
Po oczyszczeniu i osuszeniu płytki zauważyłem iż w miejscach gdzie znajdowały się krople wskaźnika ferroksylowego pojawiła się rdza.
Wyznaczenie potencjałów elektrod (Fe, Cu, Ni, Al):
Po mechanicznym oczyszczeniu i odtłuszczeniu płytek Fe, Cu, Ni, Al. Zbudowano z nich koleino i z elektrody kalomelowej (+249mV) ogniwa stężeniowe i podłączono do milivoltomierza. Otrzymaną siłę elektromotoryczną (rożnice potenchjałów między elektrodą kalomelową a elektrodą mierzoną) zapisłem w poniższych tabelach a następnie na wykresach (dane w mV).
|
0s |
15s |
30s |
45s |
60s |
75s |
90s |
105s |
120s |
135s |
150s |
165s |
180s |
195s |
210s |
225s |
240s |
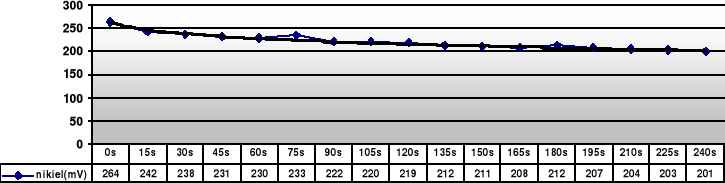
Nikiel |
264 |
242 |
238 |
231 |
230 |
233 |
222 |
220 |
219 |
212 |
211 |
208 |
212 |
207 |
204 |
203 |
201 |
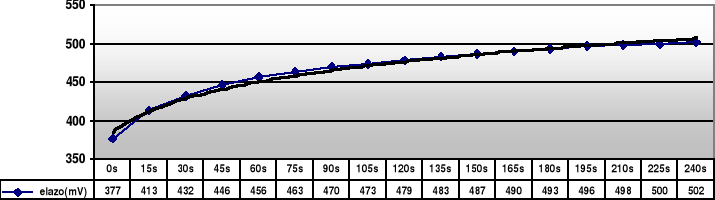
Żelazo |
377 |
413 |
432 |
446 |
456 |
463 |
470 |
473 |
479 |
483 |
487 |
490 |
493 |
496 |
498 |
500 |
502 |
Aluminium |
579 |
582 |
582 |
581 |
582 |
578 |
579 |
579 |
572 |
573 |
573 |
573 |
570 |
573 |
572 |
573 |
569 |
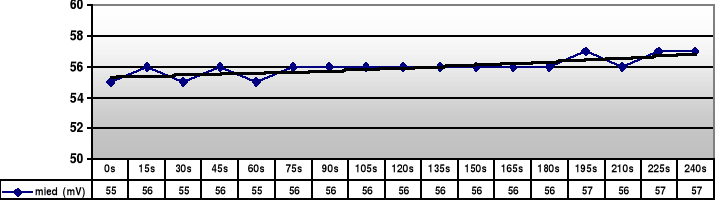
Miedź |
55 |
56 |
55 |
56 |
55 |
56 |
56 |
56 |
56 |
56 |
56 |
56 |
56 |
57 |
56 |
57 |
57 |

dane w milivoltach mV
Przeliczenia potencjałów poszczególnych blaszek metalowych względem normalnej elektrody wodorowej (0V) (wg wzoru E=E1-E2, E1-potencjał elektrody dodatniej, E2-potencjał elektrody ujemnej)
- dla żelaza: elektrodą dodatnią jest elektroda kalomelowa (+249mV), ujemną jest zaś żelazna (wg tablic -440mV)
E = Ekalomelowa - Eżelazna
Eżelazna = Ekalomelowa - E
Podstawiając z tabeli za E otrzymuje wartości od -253mV do -128mV
- dla niklu: elektrodą dodatnią jest elektroda kalomelowa (+249mV), ujemną jest zaś niklowa (wg tablic -220mV)
E = Ekalomelowa - Eniklowa
Eniklowa = Ekalomelowa - E
Podstawiając z tabeli za E otrzymuje wartości od -15mV do -48mV
- dla aluminium: elektrodą dodatnią jest elektroda kalomelowa (+249mV), ujemną jest zaś aluminiowa (wg tablic -166mV)
E = Ekalomelowa - Ealuminiowa
Ealuminiowa = Ekalomelowa - E
Podstawiając z tabeli za E otrzymuje wartości od -334mV do -320mV
- dla miedzi: elektrodą dodatnią jest elektroda miedziana (wg tablic +340mV), ujemną jest zaś kalomelowa (+249mV)
E = Emiedziana - Ekalomelowa
Emiedziana = Ekalomelowa -(-E)
Podstawiając z tabeli za E otrzymuje wartości od +304mV do +306mV
Wnioski:
płytka ze stali nierdzewnej nie zmieniła swojej wagi czyli nie zaszły tu żadne reakcje między roztworem NaCl a tym metalem. Płytka ze stali rdzewnej (zwykła) stała się nieco cięższa niż przed doświadczeniem. Jej waga wrosła o 0,114 grama. Ta różnica polega na tym że pokryła się rdzą czyli żelazo zostało utlenione. Zaszły tam reakcje które są wypisane powyżej w 1 punkcie protokołu.
b) Stężenie tlenu jest większe na obrzeżach kropli niż wewnątrz, gdzie ma miejsce proces utlenienia żelaza czyli typowej korozji. Jest to mikroogniwo gdzie obszar anodowy jest wewnątrz kropli a katodowy na zewnątrz. Pod koniec doświadczenia zaobserwowałem zmiany kolory niebieskiego za brązowo-zielonkawy. Stało się to za sprawą wzrostu jonów OH- w centralnej części. Powoduje to rozkład wcześniej otrzymanego błękitu, który jest nietrwały w środowisku zasadowym.
Powyższe wyniki labolatoryjne nie są zgodne z tymi zestawionymi w tablicach. Jest to spowodowane różnymi czynnikami. Np. zbyt krótkim czasem doświadczenia, niedokładnością milivoltomierza, niedokładnym oczyszczeniem powierzchni blaszek itp.
r.anodowa r. katodowa
Fe=Fe2+ + 2e- Hg2Cl2 +2e-=2Hg + 2Cl-
Al=Al3+ +3e- 3Hg2Cl2+6e-=6Hg +2Cl-
Ni=Ni2+ +2e- Hg2Cl2 +2e-=2Hg +2Cl-
2Hg +2Cl-=Hg2Cl2+2e- Cu2+ +2e-=Cu
WYDZIAŁ BUDOWNICTWA ARCHITEKTURY I INŻYNIERII ŚRODOWISKA |
|
PONIEDZIAŁEK |
GRUPA VIII |
MGR BOŻENA KARBOWSKA |
11:45 |
1) Przebieg doświadczenia i obserwacje:
1g cementu wsypany został do kolby Erlenmeyera. Do niego dodano 80 cm³ zagotowanej wody destylowanej oraz 40 cm³ 0,5 M kwasu solnego. Zawartość była gotowana przez 3 minuty, by odpędzić dwutlenek węgla. Po 3 minutach gotowania dodane zostały 3 krople 1% roztworu fenoloftaleiny i gorąco miareczkowano 0,5 m roztworem KOH.
Przy pierwszej próbie różowawe zabarwienie zauważalne było po dodaniu 1 cm³ roztworu. Kolor intensywnie różowy uzyskano po 7,5 cm³ w pierwszej próbie, natomiast po 10 cm³ w drugiej.
2) Obliczenia:
Zawartość wolnego CaO w pierwszej próbie:
A- ilość cm³ 0,5M KOH, zużyta na zobojętnienie nadmiaru kwasu solnego, który nie przereagował z wolnym CaO, znajdującym się w 1 g cementu
A=7,5 cm³ dla intensywnie różowego zabarwienia (1 cm³ dla lekko różowego zabarwienia)
%CaO=(40-7,5)∙0,014∙100%= 45,5% [%CaO=(40-1)∙0,014∙100%=54,6%]
Zawartość wolnego CaO w drugiej próbie:
A=10 cm³
%CaO=(40-10) ∙0,014∙100%=42%
MODUŁ HYDRAULICZNY= %CaO: (%SiO2 + %Al2O3+%Fe2O3 )
I PRÓBA = 1,45 (1,75 przy lekkim zabarwieniu)
II PRÓBA = 1,34
MODUŁ KRZEMIANOWY=% SiO2: (%Al2O3+%Fe2O3 )=2,415
MODUŁ GLINOWY=% Al2O3:%Fe2O3 =0,979
Wnioski:
Wartość modułu hydraulicznego powinna być zawarta w granicach 2-2,2 w przeprowadzonym doświadczeniu wartość jednak wyniosła 1,45 (1,75) w pierwszej, a 1,34 w drugiej próbie.Wpływ na tę niezgodność mógł mieć punkt doświadczenia, w którym należało wskazać ilość roztworu KOH ,który potrzebny był do uzyskania różowego zabarwienia- ilość ta determinuje moduł hydrauliczny. Jednakże należałoby sprecyzować jaki jest pożądany stopień nasycenia koloru różowego.
Niezgodna z właściwym była również wartość modułu glinowego, która wynosi 0,979, a powinna zawierać się między 1,7 a 3,5. Spowodował to niewłaściwy dobór surowców chemicznych. Skład procentowy cementu powinien być ustalony z wartościami modułów.
REAKCJE:
podczas dodawania do cementu roztworu HCl
CaCO3 +2HCl → CO2 + H2O + CaCl2
proces miareczkowania:
CaCl2 + 2KOH → Ca(OH)2 + 2KCl
podczas dodawania wody:
Cząsteczki niektórych składników cementu przyłączając wodę ulegają jedynie
hydratacji. Istnieją również takie, których cząsteczki ulegają hydrolizie. Reagowanie
różnych składników cementu z wodą przebiega z różną szybkością. Główny
składnik cementu- alit, reaguje z wodą energicznie, zaraz po zarobieniu cementu
wodą.
HYDROLIZA ALITU
3CaO∙ SiO2 + nH2 O →2CaO∙ SiO2 ∙(n-1) H2 O+ Ca(OH)2
Glinian wapniowy 3CaO∙ Al2O3 na początku reaguje z gipsem zawartym w cemencie:
3CaO∙ Al2O3+3 CaSO4+31 H2 O→3CaO∙ Al2O3∙3 CaSO4∙31 H2 O (produktem tej
reakcji jest sól Candela)
Glinian wapniowy, który nie przereagował z gipsem ulega hydratacji:
3CaO∙ Al2O3+6 H2 O→3CaO∙ Al2O3∙3 CaSO4∙6 H2 O
Glinian wapniowy reaguje też z Ca(OH)2 , który powstaje w wyniku hydrolizy alitu:
3CaO∙ Al2O3+ Ca(OH)2 +12 H2 O→4CaO∙ Al2O3∙13H2 O (w ten sposób powstaje
uwodniny glinian czterowapniowy)
Braunmilleryt 4CaO∙ Al2O3∙ Fe2O3 gdy reaguje z H2 O wytwarza uwodnione
gliniany i żelaziany wapniowe:
4CaO∙ Al2O3∙ Fe2O3+7 H2 O→3CaO∙ Al2O3∙6 H2 O+CaO∙ Fe2O3∙ H2 O
SUBSTANCJE BŁONOTWÓRCZE
WYDZIAŁ BUDOWNICTWA ARCHITEKTURY I INŻYNIERII ŚRODOWISKA |
|
PONIEDZIAŁEK |
GRUPA VIII |
MGR BOŻENA KARBOWSKA |
11:45 |
Przebieg doświadczenia i obserwacje:
W zlewce o pojemności 50 ml umieszczono 5 ml gliceryny.
Zlewkę z gliceryną podgrzewano do temperatury 125˚C. Utrzymując tę temperaturę dodawano stopniowo 15 g bezwodnika ftalowego mieszając, aby uniknąć zbrylenia w gęstą masę. Następnie zawartość zlewki podgrzewano do 180˚C w celu odparowania H2O .
Utrzymując temperaturę natej wysokości po 30 minutach masa zaczęła gęstnieć. Wtedy, za pomocą bagietki naniesiono kroplę na płytkę stalową. Żywica stała się twarda i nie-lepka po upływie 4 minut.
Zawartość zlewki była dalej ogrzewana. Następna kropla( przy temperaturze 190˚C)zgęstniała po 2 minutach, następna (przy T=200˚C) po 1,5 minuty.
Wnioski:
Polimer ten powstał w reakcji polikondensacji. W odróżnieniu do reakcji polimeryzacji , podczas polikondensacji, powstaje druga niespolimeryzowana cząsteczka( tu H2O) będąca produktem ubocznym.. Wiązanie merów powstało w wyniku kondensacji dwóch grup funkcyjnych zdolnych do reagowania ze sobą.
Im dłużej gotujemy- odparowujemy H2O- tym żywica naniesiona na płytkę szybciej gęstnieje.
REAKCJE:
H2 O
O O
CH2─CH─CH2 + ║ ║
│ │ │ ――C C ―C ―O― CH2― CH―CH2 ―O―
OH OH OH │ │ │ │ │
O═C C═O OH
│ │
O n
TWARDOSC WODY
WYDZIAŁ BUDOWNICTWA ARCHITEKTURY I INŻYNIERII ŚRODOWISKA |
|
PONIEDZIAŁEK |
GRUPA VIII |
MGR SYLWIA SANOCKA |
11:45 |
Przebieg doświadczenia i obserwacje:
a) Do kolbki stożkowej o pojemności 250 ml wprowadzone zostało 50 ml wody wodociągowej, 2ml amoniaku, 1 ml roztworu buforowego oraz odrobina wskażnika- czerni eriochromowej. Roztwór ten miareczkowany był 0,005 M roztworem wersenianiu sodowego do zmiany barwy z fiołkowego na niebieski(18 ml).
b) Do kolbki wprowadzono 50 ml wody przegotowanej. Postepowano jak w poprzednim punkcie. Roztwór zmienił zabarwienie po użyciu12 ml roztworu wersenianu sodowego.
Przez kolumnę z kationitem sodowym (Rna) przepuszczono ok. 100 ml wody wodociągowej. Z Uzyskanego wycieku przeniesiono 50 ml do kolby stożkowej . Dalej postępowano jak w poprzednim punkcie. Zmiana zabarwienia po 3 ml.
Wodę wodociągową przepuszczono przez kationit sodowy (RNa), a następnie przez ROH. Dalsze postępowanie jak w punkcie a). Zmiana zabarwienia po 1,5 ml.
2) Obliczenia:
Wzór do obliczenia twardości wody x=V*0,56 V-objętość wersenianu w mililitrach
Woda |
V |
X |
Wodociągowa |
18 ml |
10,08 |
Przegotowana |
12 ml |
6,72 |
Przepuszczona przez Rna |
3 ml |
1,68 |
Przep. Przez RNa i ROH |
1,5 ml |
0,84 |
Wnioski:
Najtwardszą z wód jest woda wodociągowa- zawiera ona najwięcej związków powodujących przemijającą twardość wody( wodorowęglanów wapnia i magnezu) . Można ją usunąć przez gotowanie- woda staje się bardziej miękka, co dowiodło przeprowadzone doświadczenie. Woda przegotowana pozbawiona jest wodorowęglanów Ca i Mg, dlatego też obliczona wartość twardości ma mniejszą wartość.
Inną metodą na pozbycie się twardości jest przepuszczenie wody przez kolumny jonitowe , jak to zostało zrobione w dalszej części doświadczenia. Cząsteczki jonitu to wieloatomowe molekuły, które nie rozpuszczają się w wodzie. Część takiej cząsteczki podlega wymianie, gdyż ma charakterystyczne grupy, które wiążą kationy ( w przypadku kationitów) lub aniony ( w przypadku anionitów)
Przykładowa reakcja wymiany kationów wapniowych na sodowe:
2RNa + CaCl2→R2Ca +2NaCl
Po przepuszczeniu przez kationit woda pozbyła się twardości powodowanej przez kationy.
W punkcie d) wodę tę przepuszczono jeszcze przez anionit, co pozbawiło wodę twardości powodowanej przez aniony poprzez ich wymianę na jony OH-
ROH+HCl→ RCl+H2O
Woda przepuszczona przez anionit i kationit została uwolniona od zawartych w niej soli- otrzymano wodę zdejonizowaną o odczynie obojętnym.
→ —H2O
Wyszukiwarka
Podobne podstrony:
CHEMIA - WZORY, I semstr moje materiały, Semestr I, Chemia
ZADANKA Z POPRAWY W ZESZŁYM ROKU, I semstr moje materiały, Semestr I, Informatyka stosowana, zadanka
Zakres teorii, I semstr moje materiały, Semestr I, Mechanika ogólna
zadanka1, I semstr moje materiały, Semestr I, Informatyka stosowana, zadanka
Pytania na egzam z infy, I semstr moje materiały, Semestr I, Informatyka stosowana, wyklady i pytani
egzamin informa, I semstr moje materiały, Semestr I, Informatyka stosowana, wyklady i pytania
zadanka, I semstr moje materiały, Semestr I, Informatyka stosowana, zadanka
korozja metali i, I semstr moje materiały, chemia materialow budowlanych, laborki
Sprawozdanie 0, I semstr moje materiały, fizyka laborki, fizyka lab sprawka, MOJE
labolatoria302, I semstr moje materiały, fizyka laborki, fizyka lab sprawka, fizyka - labolatoria, O
38 moje, STUDIA, V semestr, SIP3, SPRAWOZDANIA, 38
fizyka 201 sprawko, I semstr moje materiały, fizyka, 201
18 moje, STUDIA, V semestr, SIP3, SPRAWOZDANIA, 18
więcej podobnych podstron