Laboratorium
Technologii Uzdatniania Wody
Ćwiczenie nr 1
Temat ADSORPCYJNE ODBARWIANIE ROZTWORÓW WODNYCH NA WĘGLU AKTYWNYM
|
Data |
Ocena |
Podpis |
Kolokwium |
|
|
|
Oddanie |
|
|
|
Sprawdzenie |
|
|
|
Zaliczenie |
|
|
|
|
|
|
|
Nazwisko i imię |
Termin (dzień tygodnia, godz.) |
Nr grupy laboratoryjnej |
|
Gralak Aleksandra |
Wtorek, 12.15-16.00 |
1 |
|
Rok studiów: III Rok akademicki 2015/2016
Semestr: V
Grupa dziekańska
Cel i zakres ćwiczenia.
Proces zastosowano do odbarwiania wodnych roztworów barwnika spożywczego przy użyciu granulowanego węgla aktywnego AG 5.
Zakres ćwiczenia:
Doświadczalne wyznaczenie przebiegu izotermy adsorpcji barwnika z roztworu wodnego na węglu aktywnym.
Doświadczalne wyznaczenie krzywej kinetycznej adsorpcji barwnika z roztworu wodnego na węglu aktywnym.
Cel ćwiczenia:
Poznanie możliwości wykorzystania procesu sorpcji na węglach aktywnych w technologii uzdatniania i odnowy wody.
Opisanie wyznaczonej krzywej równowagi adsorpcji za pomocą równań izotermy: równania Freundlicha i równania Langmuira.
Określenie wpływu dawki węgla aktywnego na skuteczność odbarwiania roztworów wodnych.
Określenie wpływu czasu kontaktu roztworu z węglem aktywnym na skuteczność odbarwiania.
Metodyka badań
Do kolbek rozlano 50ml roztworu barwnika zaczynając od numeru 1 kolejno do nr 16. Zanotowano czas zalania kolbki nr 16. Wszystkie kolbki umieszczono w uchwytach wytrząsarki z łaźnią wodną. Po włączeniu wytrząsarki, po czasach przypisanych numerom kolbek wyjmowano kolejno odpowiednie kolbki i zlewano roztwór znad węgla do przygotowanych zlewek z zachowaniem takiej numeracji jak oznaczenie kolbek.
Skuteczność odbarwiania była oceniana przez pomiar stężenia barwnika w wodzie przed procesem i po jego zakończeniu. Pomiar stężenia wykonano metodą spektrofotometryczną, przy długości fali charakterystycznej dla danego barwnika. Długość fali, równanie krzywej skalowania dla danego barwnika oraz zakres jej stosowania:
Cs = a*A ± b dla Amax = 1,2
λ = 456 nm
a = 0,0684
b = 0,00008
A - absorbancja roztworu odczytana na skali spektrometru
Cs - stężenie barwnika w wodzie z krzywej skalowania [g/dm3]
Przygotowano rozcieńczenie 1:100 wyjściowego roztworu barwnika i zmierzono jego absorbancję. Następnie zmierzono absorbancję roztworów zlewanych znad węgla.
Tabelaryczne zestawienie wyników w tabelach 1 i 2.
Tabela 1
Wpływ dawki węgla aktywnego na proces adsorpcji barwnika z roztworu wodnego.
Nr |
Masa |
Czas |
Rozcieńczenie |
Absorbancja |
Stężenie |
Chłonność |
Skuteczność |
Ck |
0 |
0 |
- |
20 |
1,677 |
0,1147868 |
0 |
0 |
2,295736 |
1 |
1,1746 |
120 |
20 |
0,158 |
0,0108872 |
0,0884553 |
90,51528573 |
0,217744 |
2 |
1,0045 |
120 |
20 |
0,290 |
0,019916 |
0,09444579 |
82,64957295 |
0,39832 |
3 |
0,8165 |
120 |
20 |
0,482 |
0,0330488 |
0,10010778 |
71,20853617 |
0,660976 |
4 |
0,6234 |
120 |
20 |
0,689 |
0,0472076 |
0,10840423 |
58,8736684 |
0,944152 |
5 |
0,4052 |
120 |
20 |
0,878 |
0,0601352 |
0,13487562 |
47,61139783 |
1,202704 |
6 |
0,2005 |
120 |
20 |
1,213 |
0,0830492 |
0,15829227 |
27,6491722 |
1,660984 |
7 |
0,1548 |
120 |
20 |
1,339 |
0,0916676 |
0,14934884 |
20,14099182 |
1,833352 |
8 |
0,1002 |
120 |
20 |
1,445 |
0,098918 |
0,15837126 |
13,8245861 |
1,97836 |
9 |
0,0509 |
120 |
20 |
1,685 |
0,115334 |
-0,0107505 |
-0,47670987 |
2,30668 |
Tabela 2
Wpływ czasu kontaktu z węglem aktywnym na proces adsorpcji barwnika z roztworu wodnego.
Nr |
Masa |
Czas |
Rozcieńczenie |
Absorbancja |
Stężenie |
Chłonność |
Skuteczność |
Ck |
0 |
0 |
0 |
20 |
1,677 |
0,114787 |
0 |
0 |
2,295736 |
16 |
0,2010 |
1 |
20 |
1,648 |
0,112803 |
0,009869 |
1,728073 |
2,256064 |
15 |
0,1999 |
2 |
20 |
1,62 |
0,110888 |
0,019504 |
3,396558 |
2,21776 |
14 |
0,2009 |
5 |
20 |
1,568 |
0,107331 |
0,037111 |
6,495172 |
2,146624 |
13 |
0,2009 |
10 |
20 |
1,473 |
0,100833 |
0,069455 |
12,1561 |
2,016664 |
12 |
0,2010 |
20 |
20 |
1,421 |
0,097276 |
0,087116 |
15,25472 |
1,945528 |
11 |
0,2007 |
40 |
20 |
1,395 |
0,095498 |
0,096108 |
16,80402 |
1,90996 |
10 |
0,2000 |
60 |
20 |
1,335 |
0,091394 |
0,116964 |
20,37935 |
1,82788 |
6 |
0,2005 |
120 |
20 |
1,213 |
0,083049 |
0,158292 |
27,64917 |
1,660984 |
Przykładowe obliczenia dla kolbki 8:
Stężenie roztworu Cs [g/dm3]
Cs = 0,0684*A+0,00008 = 0,0684*1,445+0,00008 = 0,098918 [g/dm3]
Stężenie barwnika w roztworze wodnym z uwzględnieniem rozcieńczenia
Ck = Cs * R = 0,098918 * 20 = 1,97836 [g/dm3]
Chłonność węgla aktywnego
![]()
Procentowa skuteczność odbarwiania
![]()
Podanie równania Freundlicha i równania Langmuira dla wyznaczonej izotermy adsorpcji (wyznaczenie parametrów równań i współczynników korelacji średniokwadratowej)
równanie Freundlicha
![]()
K=0,12509501
n=0,288385
![]()
współczynniki K i n, wyznaczone metodą regresji liniowej przy wykorzystaniu funkcji REGLINP w programie MS Excel
równanie Langmuira
![]()
a=0,095617767
b=1,18809647
![]()
współczynniki a i b, wyznaczone metodą regresji liniowej przy wykorzystaniu funkcji REGLINP w programie MS Excel
Graficzne przedstawienie wyników
Zmiana stężenia barwnika w roztworze względem czasu kontaktu wg wyników z tabeli 2. Ck = f(t).
Zmiana chłonności węgla względem czasu kontaktu z roztworem wg wyników z tabeli 2. q = f(t).
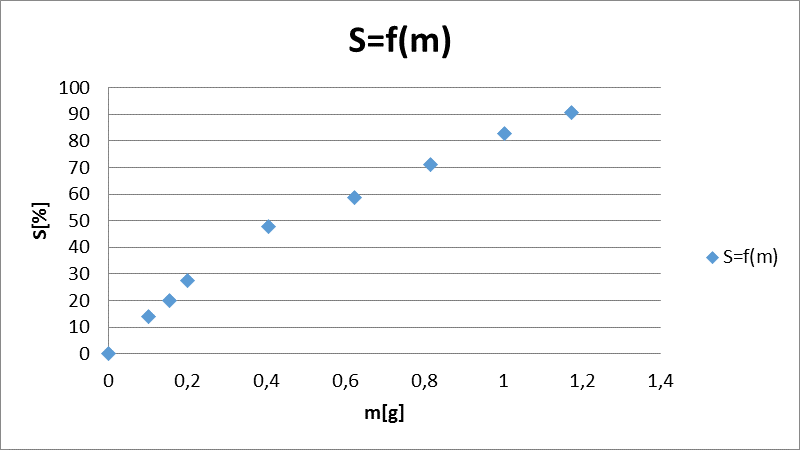
Skuteczność odbarwiania w funkcji dawki węgla aktywnego wg wyników z tabeli 1. S = f(m).
Skuteczność odbarwiania w funkcji czasu kontaktu roztworu z węglem wg wyników z tabeli 2. S = f(t).
Izoterma adsorpcji barwnika z naniesionymi punktami doświadczalnymi wg danych z tabeli 1, przebiegiem równania Freundlicha i równania Langmuira.
Wnioski końcowe.
Czas kontaktu t[min] |
Ck[g/dm3] |
0 |
2,295736 |
1 |
2,256064 |
2 |
2,21776 |
5 |
2,146624 |
10 |
2,016664 |
20 |
1,945528 |
40 |
1,90996 |
60 |
1,82788 |
120 |
1,660984 |
Czas kontaktu t[min] |
Chłonność węgla q[g/g] |
0 |
0 |
1 |
0,0098687 |
2 |
0,0195038 |
5 |
0,037111 |
10 |
0,0694555 |
20 |
0,0871164 |
40 |
0,0961076 |
60 |
0,116964 |
120 |
0,1582923 |
Masa węgla m [g] |
Skuteczność odbarwiania S[%] |
0 |
0 |
1,1746 |
90,5152857 |
1,0045 |
82,6495729 |
0,8165 |
71,2085362 |
0,6234 |
58,8736684 |
0,4052 |
47,6113978 |
0,2005 |
27,6491722 |
0,1548 |
20,1409918 |
0,1002 |
13,8245861 |
|
|
Czas |
Skuteczność |
0 |
0 |
1 |
1,728073263 |
2 |
3,396557792 |
5 |
6,495171919 |
10 |
12,15610157 |
20 |
15,2547157 |
40 |
16,80402276 |
60 |
20,37934675 |
120 |
27,6491722 |
qF [g/g] |
qL [g/g] |
|
|
0,158973378 |
0,069966168 |
|
|
0,080596048 |
0,019652326 |
|
|
0,095929685 |
0,030714833 |
|
|
0,111015671 |
0,04205949 |
|
|
0,123038908 |
0,050552112 |
|
|
0,13193395 |
0,056251531 |
|
|
0,144807163 |
0,063460146 |
|
|
0,148989651 |
0,065532248 |
|
|
0,15229651 |
0,067079261 |
|
|
równanie Freundlicha:
K=0,12509501 n=0,288385
|
równanie Langmuira:
a=0,095617767 b=1,18809647
|
q=f(C) - wykres dla punktów doświadczalnych
qF=f(C) - wykres dla równania Freundlicha
qL=f(C) - wykres dla równania Langmuira
Wykres logq = f(logCk)
log(Ck) |
log(q) |
0,360921945 |
|
-0,6620538 |
-1,053276121 |
-0,39976789 |
-1,024817378 |
-0,17981431 |
-0,999532182 |
-0,02495808 |
-0,964953752 |
0,080158755 |
-0,870066556 |
0,220365449 |
-0,800540295 |
0,263245857 |
-0,825798154 |
0,296305323 |
-0,800323635 |
Wykres Ck/q = f(Ck)
Z analizy sporządzonych na podstawie przeprowadzonego ćwiczenia wykresów wynika, że stężenie barwnika w roztworze maleje w czasie przy tej samej ilości węgla aktywnego. Analizując przebieg krzywej na wykresie można wnioskować, że nie jest możliwe całkowite usunięcie barwnika z roztworu lecz tylko do pewnego określonego poziomu. Wynika to również z ograniczonej chłonności węgla, co widać na wykresie q=f(t). Z analizy wyników dotyczących skuteczności odbarwiania wynika, że zależy ona zarówno od czasu trwania odbarwiania, jak i od dawki węgla aktywnego. Skuteczność odbarwiania rośnie zarówno ze wzrostem czasu odbarwiania, jak i ze wzrostem dawki węgla, przy czym w obu wypadkach skuteczność odbarwiania rośnie asymptotycznie do pewnej określonej wartości, lecz zawsze poniżej 100%. Punkty, które wyznacza izoterma Freundlicha są zbliżone do danych doświadczalnych, więc to ta izoterma lepiej opisuje przebieg procesu adsorbcji.
2
|
|
Wydział Inżynierii Procesowej i Ochrony Środowiska |
|
||
Wyszukiwarka
Podobne podstrony:
Sprawozdanie - Uklady Kombinacyjne, Studia, semestr 4, Elektronika II, Elektr(lab)
sprawozdaniedhnfdgnfgnfgngfngfh, Politechnika Lubelska, Studia, semestr 5, Sem V, protokoly i spr, p
3z3, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wykłady, opracow
Sprawozdanie nr.3 - SiS, Studia, Semestr 1, Sygnały i Systemy, Sprawozdanie 3
Wasowski wykłady, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wyk
III rok sprawozdanie, Politechnika Lubelska, Studia, Semestr 6, sem VI
Was2, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wykłady, opraco
Was1, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wykłady, opraco
Egzamin-Woda-2006, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wy
ELEKTRONIKA 3 -- SPRAWOZDANIE, Politechnika Lubelska, Studia, semestr 5, Semest V, od grzechu, mój
Robert sprawozdanie1, Politechnika Lubelska, Studia, Semestr 6, sem VI, oświetlenie sprawozdania2007
Robert sprawozdanie, Politechnika Lubelska, Studia, Semestr 6, sem VI, oświetlenie sprawozdania2007-
wymiana sprawozdanie rura w rurze, Studia, semestr 4, WC laborki
więcej podobnych podstron