Tomasz Pajączkowski
6.06.2001
Ćwiczenie nr 20.
Temat: Wyznaczanie stosunku CP/CV dla powietrza metodą Clement-Desermes'a.
Tabela zebranych wartości:
|
wysokość słupa cieczy w rurkach manometrycznych [ cm ] |
Σ |
wartość średnia [ cm ] |
|||||||||
|
|
|
||||||||||
l1 |
185 |
185 |
184,6 |
185 |
185 |
185 |
185 |
185 |
185 |
185 |
1849,6 |
184,9 |
p1 |
168 |
168 |
168,3 |
168 |
168 |
168 |
168 |
168 |
168 |
168 |
1680,3 |
168,0 |
l2 |
178 |
177,7 |
177,7 |
177,5 |
177,7 |
177,6 |
177,6 |
177,6 |
177,6 |
177,6 |
1776,6 |
177,7 |
p2 |
176 |
176,2 |
176,2 |
176,1 |
176,2 |
176,3 |
176,2 |
176,3 |
176,2 |
176,2 |
1761,9 |
176,2 |
Teoria zjawiska:
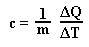
Ciepło właściwe jest liczbowo równe ilości energii w postaci ciepła jaką należy dostarczyć do układu, aby ciało o masie 1 kg zwiększyło swoją temperaturę o 1 K w określonych warunkach.
W zależności od rodzaju przemiany, w której ciepło Q jest pobierane przez układ, rozróżnia się min. ciepło właściwe izobaryczne ( przy stałym ciśnieniu ) i izochoryczne ( przy stałej objętości ).
Doświadczenia wykazują, że różnica między ciepłem właściwym przy stałym ciśnieniu i stałej objętości występuje głównie dla gazów. Dla ciał stałych i w nieco gorszym przybliżeniu dla cieczy różnica ta niema takiego znaczenia i wówczas wystarczy posługiwać się jednym ciepłem właściwym c, określonego powyższym wzorem. Dla gazów możemy zdefiniować ciepło właściwe w stałej objętości cV i ciepło właściwe przy stałej objętości cP.
Jeżeli oznaczymy masę 1 mola przez M, to można zapisać, że ciepło molowe wynosi C = cM.
W gazie doskonałym różnica ciepła molowego przy stałym ciśnieniu i ciepła molowego w stałej objętości jest równa stałej gazowej R.
CP - CV = R
Korzystając z zasady ekwipartycji energii można dowieść, że :
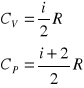
, gdzie i - ilość stopni swobody cząsteczek gazu.
Stąd wyznaczmy stosunek ![]()
. Dla gazów jednoatomowych i=3, zatem ![]()
, dla gazów dwuatomowych i = 5,czyli ![]()
,zaś trój- i więcej- atomowych i = 6, stąd ![]()
.
Reasumując można zapisać, że ciepło właściwe jest jedną z najważniejszych wielkości charakteryzujących układy termodynamiczne. Wartość ciepła właściwego zależy w istotny sposób od rodzaju substancji, a w szczególności od jego stanu skupienia.
Znajomość ciepła właściwego substancji jest potrzebna głównie w chemii fizycznej m.in. do obliczania entropii oraz stałych równowagi chemicznej, a także określania wpływu temperatury na efekt cieplny reakcji.
W układzie SI jednostką ciepła właściwego jest J/kg·K
Opis metody z wyprowadzeniem wzoru roboczego:
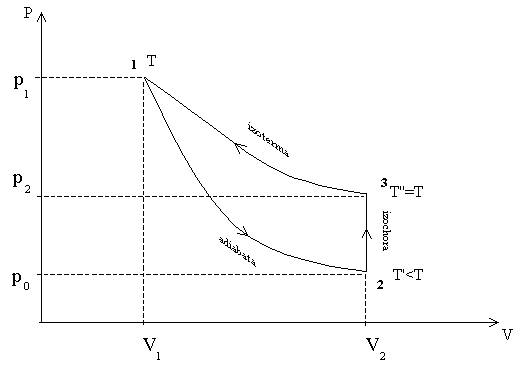
Przyrząd Clement - Desermes'a stanowi duży szklany balon, w którym znajduje się powietrze. Naczynie połączone jest ze szklanym manometrem oraz z pompką. Zawór służy do przełączanie procesów sprężania i rozprężania powietrza. Gaz poddawany jest trzem przemianom ( co obrazuje poniższy wykres ):
I SPRĘŻANIE IZOTERMICZNE - przy stałej temperaturze następuje zmiana ciśnienia od p0 do p0+p1, a objętość maleje od V1 do V2.
II ROZPRĘŻANIE ADIABATYCZNE - ciśnienie powraca do ciśnienia atmosferycznego, a temperatura obniża się. W przemianie tej nie ma wymiany ciepła z otoczeniem. Zgodnie z równaniem adiabaty można zapisać:
![]()
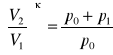
III OGRZEWANIE IZOCHORYCZNE - przy stałej objętości wzrasta ciśnienie do p0+p2, a temperatura wraca do stanu początkowego. Na podstawie prawa Boyle'a - Mariotte'a piszemy równanie:
![]()
![]()
Porównując powyższe wyrażenia i dzieląc przez p0 otrzymujemy:
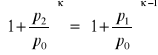
Po rozwinięciu w szeregi potęgowe i pominięciu wyrazów wyższych rzędów dostajemy:
![]()
Wyznaczam ![]()
:
![]()
Wiedząc, że ciśnienie statyczne wyraża się wzorem ![]()
, otrzymujemy ostatecznie:
![]()
, gdzie ![]()
Obliczenia do wykonanego ćwiczenia:
Podstawiając do powyższego wzoru wartości z tabeli otrzymałem:
κ = 1,10
Szacowanie niepewności pomiaru:
Δl = Δp = Δh1 = Δh2 = 0,0001m UB(h) = 5,8·10-5m
UA(h) = [ Σ ε²/(10(10-1)]1/2 = 0,071m
UC(h) = 0,071m
ðκ/ðh1 = -h2/(h1-h2)² = -0,0062
ðκ/ðh2 = h1/(h1-h2)² = 0,071
UC(κ) = [ (ðκ/ðh1)²·UC(h1) + (ðκ/ðh2)²·UC(h2) ]1/2 = 0,0053
dla α = 0,95
U(κ) = 2· UC(κ) U(κ) = 0,011
Ostatecznie: κ = ( 1,10 ± 0,01 )
Wnioski:
Wyznaczony współczynnik κ = ( 1,10 ± 0,01 ).
Współczynnik κ dla powietrza odczytany z tablic wynosi 1,4 w warunkach normalnych. Niedokładność pomiaru wynika z małej dokładności aparatury pomiarowej jaką dysponowałem podczas wykonywanego ćwiczenia i faktu trudności doprowadzenia do dokładnie idealnych przemian opisanych powyżej. Na końcowy wynik wpływ miały również czynniki atmosferyczne.
Errata
Obliczenia do wykonanego ćwiczenia:
κ policzone według poniższego wzoru dla każdej serii pomiarów wynosi:
1,131,10
1,10
1,09
1,10
1,08
1,09
1,08
1,09
1,09
Wartość średnia κ = 1,10
Szacowanie niepewności pomiaru:
Δl = Δp = Δh1 = Δh2 = 0,0001m UC(h) = 5,8·10-5m
ðκ/ðh1 = -h2/(h1-h2)² = [1/m]
ðκ/ðh2 = h1/(h1-h2)² = [1/m]
0,006 |
0,006 |
0,006 |
0,006 |
0,006 |
0,006 |
0,006 |
0,006 |
0,006 |
0,006 |
|
|
|
|
|
|
|
|
|
|
0,076 |
0,071 |
0,074 |
0,070 |
0,071 |
0,069 |
0,070 |
0,069 |
0,070 |
0,070 |
UC(κ) = [ (ðκ/ðh1)²·U²C(h1) + (ðκ/ðh2)²·U²C(h2) ]1/2 =
0,00000017
|
0,00000017 |
0,00000019 |
0,00000017 |
0,00000017 |
0,00000016 |
0,00000017 |
0,00000016 |
0,00000017 |
0,00000017 |
0,00041 |
0,00041 |
0,00043 |
0,00041 |
0,00041 |
0,00040 |
0,00041 |
0,00040 |
0,00041 |
0,00041 |
dla α = 0,95
U(κ) = 2· UC(κ)
0,00082 |
0,00082 |
0,00086 |
0,00082 |
0,00082 |
0,00080 |
0,00082 |
0,00080 |
0,00082 |
0,00082 |
κ = ( 1,100 ± 0,001 )
gdzie: T - temperatura otoczenia
p0 - ciśnienie atmosferyczne
![]()
,gdzie ![]()
Wyszukiwarka
Podobne podstrony:
20 (2), PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 20
wniosek- 70, PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 70
fiza34, PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 34
89, PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 89
CWI89xp, PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 89
8 (2), PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 08
lepkosc cieczy badanie stokes, PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 08
8 (2), PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 08
56-57 1, PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, fizyka-lab, 56 &57. POMIAR INDUK
70 (2), PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 70
tabele, PWR ENERGETYKA sem II, FIZYKA 2 LABORKI, LABORKI NUMERAMI, 70
materialukurwy, PWR ENERGETYKA sem II, Materiałoznawstwo
mikro4 formy rynku, PWR ENERGETYKA sem II, Ekonomia
pytania ekonomia, PWR ENERGETYKA sem II, Ekonomia
więcej podobnych podstron