1 Co jest rozwiązaniem Schrodingera? Do czego ono służy?
Rozwiązaniem są funkcje falowe . Ich znajomość pozwala na obliczenie : energię elektronu , prawdopodobieństwo znalezienia elektronu w danej odległości od jądra , rozmiarów i kształtu orbitalu atomowego o zadanym prawdopodobieństwie 90% , amplitudy fali i innych .
Równanie Schrodingera jest równaniem różniczkowym , jego rozwiązaniem są funkcje ciągłe , skończone mają jedną wartość.
2 w prostokątnym układzie współrzędnych narysuj orbital 3s , 2p , 4d
3s 2p 4d
3. jaka jest maksymalna ilość elektronów mogących obsadzić 4 powłokę
odp. 32elektrony
4. które z podanych oznaczeń orbitali są nieprawidłowe :a)1p,2d b)2s,3p c)2p,3d d)3s,4f
odp. A)
5 dokonaj graficznego opisu poziomów orbitalnych (za pomocą klatek )dla pierwiastków X,Z,Q o liczbach porządkowych odpowiednio 22 37 54 .Określ ile posiadają one elektronów walencyjnych w jakich grupach ukł. Okresowego się znajdują oraz do jakiego bloku pierwiastków należą.
X 22: ![]()
4 elektrony walencyjne, grupa poboczna , blok d
Z 37: ![]()
1elektron walencyjny, grupa główna blok s
Q 54 : ![]()
rys. jak wyżej, 8 elektronów walencyjnych grupa główna blok p
6.Jaką wspólną cechę mają nuklidy(izotopy) ![]()
?Czym się różnią.
Atomy poszczególnych izotopów noszą nazwę nuklidów Mają tą samą masę atomową 26 ale różną liczbę masową
7.W jakich grupach układu okresowego znajdują się : berylowce , wanadowce , siarkowce?
Berylowce 2 grupa główna , wanadowce 5 poboczna , siarkowce 6 główna
8. Które pierwiastki bardziej się różnią pod względem ich własności chem.?
a)arsen i anrymon ; b)potas i wapń -- odpowiedź b
9. które pierwiastki łatwiej odłączają elektrony bardziej elektroujemne czy mniej elektroujemne? Odpowiedź uzasadnij
Mniej elektroujemne czyli pierwiastki gr. 1a, 2a 3a to te które mają na ostatniej powłoce do 5 elektronów walencyjnych. Jest im łatwiej oddać 1, 2, 3, 4 elektrony w celu osiągnięcia oktetu-niż przyjąć odpowiednio 7,6,5,4.
10. Podaj prawo rozcieńczeń Ostwalda . Czy słaby elektrolit może być całkowicie zdysocjowany na jony . Uzasadnij odpowiedz
![]()
K-stala dysocjacji, C-stężenie molowe
α-stopień dysocjscji
Słabe elektrolity nie mogą być zdysocjowane na jony ponieważ posiadają one jeszcze cząsteczki które są niezdysocjowane. Dla bardzo słabych elektrolitów wartość 1-α≈1 dlatego ![]()
11. Napisz reakcję dysocjacji i wzór na stałą K, dla następujących związków.
![]()
w środowisku zasadowym
c)![]()
-
w środowisku kwaśnym.
a)![]()
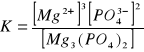
b) ![]()
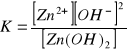
c) ![]()
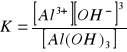
12. Jakie jest stężenie pH roztworu jeżeli stężenie jonów wodorotlenowych wynosi
![]()
.
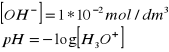
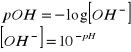
zatem
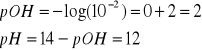
13. Podaj reakcje, w której cząsteczka wody jest:
a)kwasem, b)zasadą (wg Broensteda)
Kwasy: to te które są dawcami protonów, zasady to te które są biorcami protonów.
![]()
woda jest zasadą ponieważ pobrała proton czyli wodór od kwasu octowego.
![]()
woda jest kwasem ponieważ oddała proton
![]()
14. Podaj przykłady hydrolizy soli słabego kwasu i słabej zasady. Jaki odczyn uzyskuje roztwór? Czy zawsze jest tak w przypadku tego typu soli?
![]()
słaby kwas to![]()
słaba zasada to ![]()
![]()
![]()
Odczyn tego roztworu jest praktycznie obojętny. Jednak dla roli słabego kwasu i słabej zasady bierzemy pod uwagę stałe dysocjacji.
15. Jakie wiązanie utworzy się w cząsteczce HBr jeżeli elektroujemność H=2,1 i Br=2,8?
Elekltroujemność jest to zdolność atomów pierwiastków do wiązania własnych i obcych elektronów walencyjnych.
H=2,1 Br=2,8 Gdy różnica elektroujemności wynosi więcej niż 1,5 - mamy wiązanie jonowe gdy mniej - wiązanie kowalencyjne.
2,8 - 2,1 =0,7 wiązanie kowalencyjne
16. Ile wiązań typu sigma i pi znajduje się w cząsteczce azotu
![]()
- wiązanie potrójne
- wiązanie pojedyńcze - δ (utworzone przez orbital cząsteczkowy δ)
wiązanie potrójne - utworzone przez orbital cząsteczkowy δ oraz dwa orbitale cząsteczkowe Π.
18. Który bufor ma niższe pH. a) amonowy, b) octanowy?
Octanowy:
![]()
Amonowy:
![]()
Odp: Octanowy.
19. O obecności jakiego wiązania w cząsteczce swiadczy moment dipolowy równy zero?
μ=δ *l
μ- moment dipolowy
l- odległość między cząsteczkami
δ- ładunek elektryczny
W przypadku cząsteczek heteroatomowych ![]()
,
w przypadku cząsteczek np.:
![]()
20. Uzupełnij współczynniki, napisz równania połówkowe redoks oraz podkreśl utleniacz w poniższych reakcjach?
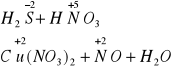
![]()
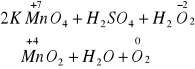
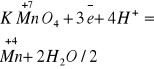
![]()
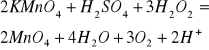
ZESTAW II
1.Co to jest orbital? Podaj przykład.
Orbital jest to funkcja pozwalająca określić części przestrzeni wokół jądrowej największego prawdopodobieństwa napotkania elektronu (Ψ). W każdym orbitalu niezależnie od kształtu może znajdować się 1 max 2elektrony. Przykład:
2. Ile Jest możliwych orbitali dla głównej liczby kwantowej n=5?
Możliwe orbitale to s, p, d, f czyli cztery ???????????????
3. Jaka jest maksymalna ilość elektronów mogących zajmować orbitale: 5s, 3p, 4d?
Ponieważ: 5s-2e 3p-6e 4d-10e
4. Który z podanych oznaczeń orbitali są nieprawidłowe
a)2p, 3d b)2s, 3p c)2p, 3d d)3s, 4f
Wszystkie są błędne.
5. Dokonaj graficznego opisu poziomów orbitalnych (za pomocą klatek) dla pierwiastków. X, Z, Q o liczbach początkowych odpowiednio 20, 30, 35. Określ ile posiadają one elektronów walencyjnych. W jakich grupach układu okresowego się znajdują oraz do jakiego bloku pierwiastku należą?
![]()
2 elektrony walencyjne grupa 2 główna blok energetyczny s
Rysunek(klatki)
![]()
2 elektrony walencyjne grupa 2 poboczna blok p
rysunek 2(klatki)
![]()
7 elektronów walencyjnych grupa 7 główna blok p
Rysunek(klatki)
6. Z jakich cząsteczek elementarnych zbudowany jest nuklid (izotop) ![]()
? Wymień wszystkie
![]()
neutrony=A-Z=118
79-protonów
79-elektronów
7. W której grupie i w którym okresie znajduje się żelazo.
Fe 4 okres VIII grupa poboczna
8- Które pierwiastki wykazują większe podobieństwo chemiczne:
a)Krzem i German b)Krzem i Fosfor?
Si i Ge (krzem i german)
9- Wymień trzy kolejne pierwiastki o najmniejszej elektroujemności.
Frans, Bar, Stront.
10. Co jest dokładniejszym miernikiem dysocjacji: stopień dysocjacji czy stała K? Wyjaśnij dlaczego.
Lepszą miarą mocy słabych elektrolitów jest stała dysocjacji. Im jest ona większa tym elektrolit jest mocniejszy. Natomiast stopień dysocjacji wyraża jedynie procent liczby cząsteczek, które rozpady się na jony w stosunku do liczby cząsteczek wprowadzonych do roztworu.
11Napisz reakcję dysocjacji i wzór na stałą K dla związków:
![]()
![]()
![]()
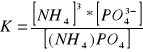
b)![]()
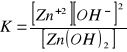
c)![]()
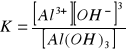
12.Jakie jest stężenie jonów hydroniowych w czystej wodzie w temp. 20°C.
![]()
13. Podaj reakcje, w której cząsteczka wody jest: a)kwasem b)zasadą
(wg. Broensteda).
Kwasy: to te które są dawcami protonów, zasady to te które są biorcami protonów.
![]()
woda jest zasadą ponieważ pobrała proton czyli wodór od kwasu octowego.
![]()
woda jest kwasem ponieważ oddała proton
![]()
14. Podaj po trzy przykłady soli, które po dodaniu do wody:
a) nie zmieniają jej pH b)powoduje wzrost pH
c) powoduje obniżenie ph. Podaj nazwę każdej soli.
a)![]()
- sól słabego kwasu i słabej zasady - mają odczyn obojętny azotanu(III)amonu,
b) ![]()
- sól słabego kwasu i mocnej zasady - odczyn zasadowy octanu sodu,
c)![]()
- sól słabej zasady i mocnego kwasu - odczyn kwaśny
15.Co to jest i o czym decyduje energia aktywacji? Czy można ją zamienić? Jeżeli tak to w jaki sposób?
Energia aktywacji- najmniejsza ilość energii jaka potrzebna jest cząsteczką do zapoczątkowania reakcji chemicznej oznaczamy ją jako EA . W momencie zapoczątkowania reakcji wydziela się duża ilość energii, powoduje ona uaktywnienie kolejnych cząsteczek dostarczając im właśnie energii. Zatem zainicjowana reakcja rozprzestrzenia się. Ponadto teoria kompleksu aktywnego, która ma bardziej ogólny charakter i zakłada iż podczas zderzenia cząsteczek substratów wytwarza się zespół atomów zwanych kompleksem aktywnych atomów.
16. Ile wiązań może utworzyć atom
a)azotu ![]()
odp)- trzy wiązaia
b)fluor :![]()
odp)-1 wiązanie
c)tlen :![]()
-odp)2 wiązania
18. Podaj mechanizm działania buforu mrówczanowego ( HOOOH, HCOONa)?
Ponieważ sole są mocnymi całkowicie zdysocjowanymi elektrolitami, zatem mrówczan sodu występuje w buforze mrówczanowym w postaci kationów ![]()
i anionów mrówczanowych ![]()
natomiast kwas HCOOH jako słaby kwas jest niezdysocjowany. Cząsteczki kwasu mrówczanego zgodnie z teorią Bronsteda np.:w wodzie protonami, natomiast jony ![]()
według tej teorii są zasadami gdyż pobierają proton. Zatem mieszanina złożona z kwasu mrówkowego oraz soli mrówczanu jest buforem ![]()
![]()
wywołują efekt wspólnego jonu →
HCOOH-protonodawca chroni układ przed zmianą pH poprzez dodawanie do zasady wodoru
.![]()
HCOO- protonobiorca chroni układ przed zmianą pH poprzez dodawanie do niego dużej ilości mocnego kwasu
.![]()
ponieważ w tej reakcji powstaje bardzo słaby kwas mrówkowy HCOOH to nie wpływa on na zmianę pH.
19.Wymień wszystkie znane ci rodzaje wiązań chemicznych i dla każdego rodzaju podaj 2 przykłady.
- kowalencyjne (atomowe) ![]()
|N≡N
kowalencyjne spolaryzowane ![]()
:
WIĄZANIA
Wiązanie pojedyńcze: 2 jednowartościowe pierwiaski, np. wodór i fluor tworzą cząsteczkę typu AB, w której atomy są połączone jednym wiązaniem H-F.
Wiązanie podwójne: 2 2-wartościowe pierwiastki np. Zn i O też tworzą cząsteczkę typu AB ale między atomami powstają 2 wiązania Zn = O.
Wiązanie potrójne: istnieją też wiązania potrójne np. w aotku boru B ≅ N.
WIĄZANIE KOWALENCYJNE
Powstaje podczas połączenia pierwiastków o zbliżonych elektroujemnościach. Polega ono na utworzeniu wspólnej pary elektronów (wiązanie pojedyncze), dwóch (wiązanie podwójne) lub trzech (wiązanie potrójne) par elektronów przez 2 atomy, z których każdy dostarcza do wytworzenia dubletu (lub dubletów) taką samą liczbę niesparowanych elektronów. W wyniku powstają cząsteczki kowalencyjne. Warunkiem utworzenia wiązania kowalencyjnego przez dany atom jest obecność przynajmniej 1 niesparowanego elektronu
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE
Polaryzacja wiązania kowalencyjnego polega na tym, że wspólna para elektronów jest przesunięta w kierunku atomu bardziej elektroujemnego. Ma ona miejsce wtedy, gdy różnica między elektroujemnościami pierwiastków nie przekracza 1,7 (w skali Pullinga). Polaryzacja powoduje, że atom bardziej elektroujemny zyskuje pewien ujemny ładunek cząstkowy (δ-), a atom mniej elektroujemny (δ+).
WIĄZANIE METALICZNE
Powstaje podczas połączenia pierwiastków elektrododatnich. Polega na przekształceniu atomów tego samegometalu lub atomów różnych metali w zbiór kationów i swobodnie poruszających się między nimi elektronów, zwanych tekże gazem elektronowym. Wynikiem wzajemnego oddziaływania kationów i ujemnego gazu są właściwości metali i ich stopów -
dobre przewodnictwo elektryczne i cieplne
połysk
plastyczność
zdolność do emisji termo i foto elektrycznej
ujemny temperaturowy współczynnik przewodnictwa elektrycznego
WIĄZANIE KOORDYNACYJNE
Jest to szczególny przypadek wiązania kowalencyjnego, polegający na utworzeniu wspólnej pary elektronowej z udziałem elektronów dostarczonych przez jeden atom (donor). 2 atom (akceptor) uzupełnia własną powłokę walencyjną elektronami donora. Wiązanie to powstaje przy zderzeniu drobinyz wolną parą elektronową z drobiną mającą wolną lukę elektronową. W kreskowych wzorach elektronowych wiązanie koordynacyjne oznacza się strzałką od donora do akceptora O = S → O
WIĄZANIE CHEMICZNE
Jest to wzajemne oddziaływanie rdzeni atomowych i elektronów walencyjnych tworzących cząstkę
Chemiczną lub makroskopowy ukł. Cząstek. Typ wiązania zależy od elektroujemności tworzących go pierwiastków. Atomy pierwiastków elektroujemnych wykazują większą tendencję do przyłączania elektronów niż jonizacji. Atomy pierwiastków elektrododatnich - odwrotnie. W procesie tworzenia wiązań chemicznych atom oddaje, pobiera lub uwspólnia taka liczbę elektronów, aby uzyskać 8 elektronów (reguła oktetu). Atom może utworzyć tyle wiązań kowalencyjnych ile ma niesparowanych elektronów walencyjnych (reguła dubletu).
Pyt 20
6MnO2+2KclO3+KOH+6H2O=6K2MnO4+2KCl+18H+
+3 -2 +6 +2
Cr2(SO4)3+H2O2+KOH=K2SO4+K2SO4+H2O
Cr2=2Cr+6e
O2=2O+2e
Cr2(SO4)3+3H2O2+10KOH=2K2CrO4+3K2SO4+3H2O
ZESTAW IV
1. Podaj równanie Schrodingera dla cząstki poruszającej się w polu o energii potencjalnej. Co jest jego rozwiązaniem ? Rozwiązane.
2. Co to jest orbital ? Ile jest możliwych orbitali dla głównej liczby kwantowej n=4; jaka jest max. ilość elektronów mogących zajmować orbitale 3s 4p 5f?
Dla : 3s= 2e; 4p= 6e; 5f= 14e
3.Wykorzystując regułę Hunda dokonaj graficznego opisu poziomów orbitalidla 7N, 17Cl, 23V. Określ ile ile elektronów posiadają te pierwiastki na powłokach walencyjnych ?
7N 1s² 2s² 2p³; 5e walencyjnych ↑↓ ↑↓ ↑ ↑ ↑ 5A-2okres
1s 2s 2p
17Cl 1s² 2s² 2p6 3s² 3p³ ;5A-3okresy
23V 1s² 2s² 2p6 3s² 3p6 3d³ 4s² ;5B-4okres
4.Pierwiastki jakich grup należą do bloku p?
Pierwiastki grup głównych oprócz IA, IIA i Helu czyli borowce, węglowce, azotowce, tlenowce, fluorowce, helowce
5.W jakiej grupie głównej i w jakim okresie jest ołów?
Pb - IV grupa, VI okres
6.Rozrysuj kofigurację elektronową pierwiastów o liczbie atomowej 53 oraz podaj ile posiada on elektronów walencyjnych?
53I 1s² 2s² 2p6 3s² 3p6 3d10 4s² 4p6 4d10 5s² 5p5
7 e walencyjnych
7.Który atom ma większą elektroujemność? K czy Ca?
Sn czy Pb?
Ca>K Sn=Pb
8.Co to jest elektroujemność? Wymień 3 kolejne pierwiastki o najmniejszej i największej elektroujemności?
Elektroujemność - jest zdolność atomów pierwiastków do wiązania obcych i własnych elektronów walencyjnych. O najmniej: Rb, Cs, Fr
O najwięk: F, O, Cl
9.Jakie wiązanie utworzyło się w cząsteczce Hbr jeżeli elektroujemność H = 2,1 a Br = 2,8?
Utworzyło się wiąznie kowalencyjne spolaryzowane. Wspólne elektrony silnie przyciągane przez atom bromu
10.Jakie jest stężenie jonów hydroniowych H3O+ w czystej wodzie w temp. 20 C?
1*10-7 mol/dm3
11.Roztwór o pOH = 8 jest?
Słabą zasadą
12. W reakcjach protolizy:
1. HBr+H2O↔H3O+ +Br - HBr-kwas, H2O-zasada, H3O+-kwas Br - -zasada
2. NH3+H2O↔NH4 +OH - NH3 -zas. H2O-kwas, NH4 -kwas OH - -zasada
13. Podaj mechanizm działania buforu mrówkowego. Zrobione
14. W jaki sposób hydrolizują sole słabych kwasów i słabych zasad. Jakie jest pH i odczyn roztworu?
Generalnie posiadają odczyn obojętny. Jednak zależy to wówczas od stałych dysocjacji. PH jest zbliżone do 7
15. Na czym polega hybrydyzacja sp². Podaj przykład. Ile zhybrydyzowanych orbitali posiada cząsteczka, jaka jest jej struktura i dlaczego?
Wymienianie się jednego orbitalu s oraz dwóch orbitali p, daje hybrydyzację trygonalną wiązania utworzoną za pomocą tych orbitali. Leżą w jednej płaszczyźnie, a kąty pomiędzy nimi wynoszą 120 stopni. Z orbitali zhybrydyzowanych powstają z reguły orbitale wewnętrzne. Ich wzajemne działanie decyduje o kształcie cząsteczki.
16. Wzbudzony atom węgla ma konfigurację 1s3 2s1 3p3 Jakie wiązania on tworzy?: d-4atomowe.
17. Ile wiązań sigma i pi znajduje się w cząsteczce acetylenu? Zaznacz je na wzorze strukt.?
3 wiązania sigma i 2 pi
H - C ≅ C - h
18. O jakim wiązaniu świadczy moment dipolowy =0 ? Zrobione
19. Na czym polega wiązanie koordynacyjne? Podaj przykład.
Zrobione.
20. Uzupełnij współczynniki, napisz r-nia połówkowe redoks oraz podkreśl reduktor.
+3 +5 +6 +3
a. Cr2O3 + KNO3 + KOH = K2CrO4 + KNO2 + H2O
+5 +3
KNO3 + 2e + 2H+ = KNO2 + H2O /*5
+3 +6
4K+ + Cr2O3 + 5H2O = 2K2CrO4 + OH- /*2 -reduktor
5KNO3 + 6KOH + 2Cr2O3 = 4K2CrO4 + %KNO2 + H2O
+1 +5 +2 +2
b. Cu2O + HNO3 = Cu(NO3)2 + NO + H2O
+1 +2
Cu2 = 2Cu + 2e /*3
+5 +2
HNO3 + 3e + 4H+ = NO + 2H2O /*2 -reduktor
8H+ + 3Cu2 + 2HNO3 = 6Cu(NO3)2 + NO + 4H2O
21. Które z wymienionych oznaczeń orbitali są nieprawidłowe?
a) 2s,4f b)2p,3d c)1p,2d
ZESTAW III
1.Co to jest orbital? Jakiego rodzaju znasz orbitale? Ile jest orbitali dla głównej liczby kwantowej n=5? Które z podanych oznaczeń orbitali są prawidłowe: 5s, 5f, 6s (zadanie zrobione dla I i II zestawu)
2. Na czym polega zjawisko amfoteryzmu?. Wymień 3 pierwiastki tworzące związki o charakterze amfoterycznym. Napisz dla jednego związku reakcję w środowisku kwaśnym i zasadowym
Do amfoterów zaliczamy niektóre wodorotlenki (oraz ich tlenki), które w reakcji z mocnymi kwasami zachowują się jak zasady, a w reakcji z mocnymi zasadami jak kwasy.
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
Al.3+, Sn2+, Zn2+
3.Które z wymienionych związków są kwasami Bronsteda?
CH3COO-, H3O, CO32-, NH3, H2SO4, NH4, HCOOH, H2O, I-, H2S
4.Wiedząc, że stężenie jonów wodorotlenowych wynosi 10 moli/dm3, oblicz pH i odczyn
[OH-]=1*10 mol/dm3, pOH= -log10=1
pH=14-1=13
5.Podaj 2 przykłady wpływu pewnych bodźców na układy znajdujące się w stanie równowagi, których zachowanie się można wyjaśnić regułą Le Chatliera Browna?
Jeżeli na układ znajdujący się w stanie równowagi działa bodziec zewnętrzny, to w układzie tym następują zmiany zmniejszające skutki działania tego bodźca
Np. zmiana ciśnienia, stężenia substratów, temperatury.
6.Energia aktywacji, podczas przebiegu reakcji z udziałem ihibitora: pozostaje bez zmian, ulega obniżeniu, ulega podwyższeniu
Jeżeli tak to powoduje wzrost szybkości reakcji
7.Czy podczas roztwarzania miedzi w kwasie azotowym będzie się wydzielał wodór? Uzasadnij na podst. Szeregu napięciowego metali?
Będzie się wydzielał bo w szeregu napięciowym Cu znajduje się za wodorem.
8.Na podstawie szeregu napięciowego metali można przewidzieć, że :
mosiądze będą ulegać odcynkowaniu, brązu aluminiowe będą ulegały odaluminieniu
9.Reakcje hydrolizy soli, które po rozpuszczeniu w wodzie będą wykazywać odczyn obojętny
NH4NO2 + H2O = NH4OH + HNO2
10. Co to jest bufor mrówczanowy? Za pomocą odpowiednich reakcji
H3O+ i OH- Wyjaśnij mechanizm działania tego buforu. Zrobione
11. Napisz reakcje dysocjacji oraz wzory na stałą K dla następujących związków: (NH4)3PO4=PO43-+3NH4+ K=[PO34][NH+4]3 / [(NH4)3PO4] (Pozostałe zrobione w innych zest.)
12.Słabymi elektrolitami są: Ba(NO3)2, H3PO4, CH3COOH, HJ, H2S, Mg(OH)2, Ca(OH)2, LiOH, H2SO3
13. ?
14. Dokonaj graficznego opisu poziomów orbitalnych dla pierwiastka o liczbie atomowej 56.Określ, w której grupie i okresie się one znajdują.
1s2 2s 22p 6 3s2 3p 6 3d10 4s2 4p6 4p10 5s25p 6 6s2 IIA- okresVI Ba
ZESTAW V
2.Co to są kwarki ? Ile ich jest i jak się
nazywają ? są to najmniejsze cząstki → James Joyc'e
I) u- kwark górny (up) d- kwark dolny (down) s- kwark dziwny II) c- kwark powabny b- kwark piękny t- kwark prawdziwy
3. Co to jest okres połowicznego rozpadu? Jaki jest dla neutronu? Co powstaje w wyniku rozpadu?
Szybkość rozpadu promieniowego jest w każdej chwili wprost proporcjonalna do liczby jeszcze nie rozłożonych atomów N.
-dN/dt=Nλ λ- stała rozpadu promieniotwórczego
N- wyjściowa liczba atomowa
Nt=No*e-λt Nt- liczba atomów w chwili, No-liczba atomów w chwili początkowej
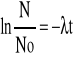
![]()
4W jaki sposób wykorzystując falowe cechy elektronu można uzasadnić I postulat Bohra? ??
5.Co określa kwadrat funkcji ψ będącej rozwiązaniem równania Schrodingera?
Określa prawdopodobieństwo napotkania elektronów w otoczeniu (x,y,z), posługujemy się wartością bezwzględną.
6.Wymień i opisz wszystkie liczby kwantowe?
n- główna liczba kwantowa , okresla nr. powłoki , a max liczba e, jaka może znajdować się w 2n²
np. n=1 → K=2e
n=2→l=8e
l- poboczna liczba kwantowa określa typ podpowłoki, przyjmuje ona wartości 0,1,2 (n-1),. Natomiast max liczba elektronów mna podpowłoce wynosi 2(2l+1)
m- magnetyczna liczba kwantowa przyjmuje wartości (-l, l)
s- spinowa liczba kwantowa przyjmuje wartości +/-0,5
7. Wykorzystując regułę Hunda dokonaj graficznego opisu poziomów orbitalnych dla 7N,17Cl,23V.
Na innym
8. Jakie pierwiastki należa do bloku s?
LITOWCE i BERYLOWCE
9. Liczba masowa jednego z izotopów wodoru wynosi 3. W skład jego jądra wchodzą następujące nukleony.
d)1p+2n
10 Za pomocą odpowiednich reakcji wyjaśnij zjawisko amfoteryzmu dla Al i Zn.
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
ZnO+2HCl=ZnCl2+H2O
ZnO+2NaOH=Na2ZnO2+H2O
11.Kiedy powstają i czym się charakteryzują związki o wiązaniu jonowym?
Na innym.
12. Na czym polega hybrydyzacja sp³. Podaj przykład. Ile zhybrydyzowanych orbitali sp posiada cząsteczka, jaka jest jej struktura i dlaczego.
Hybrydyzacja sp³ -hybrydyzacji sp³ czyli wymieszaniu ulegaja jeden orbital s i3 orbitale p. Wszystkie wiązania są równo cenne , gdyż 4 orbitale są zhybrydyzowane i mają takie same własności.
CH4- wzór strukturalny
Budowa tetrapolarna , kąt 109,mamy 4 wiązania δ, 4 orbitale zhybrydyzowane.
13.W jakiej temperaturze reakcja, która trwa w 100 K 100min może być przeprowadzona w czasie 25 min.???
14. Aby przesunąć równowagę reakcji w kierunku wzrostu wydajności produktu reakcji 4HCl+O2↔2H2O+Cl2+Q należy
b) ↓t i ↑p
15. Ile wiązań „sigma”i „pi” znajduje się w cząsteczce etylenu? Zaznacz je na wzorze strukturalnym.
Na innym teście.
16. Jakie fakty potwierdzają dipolową budowe cząsteczki wody?
Cząsteczka w której można wyróżnic biegun dodatni δ+ i δ- nosi nazwe dipola lub cząsteczki dwubiegunowej
Elektrony O=3,5 H=2,1 ---1.4
Maja przesunięcia w tej cząsteczce ładunku elektrycznego jest moment dipolowy.μ=e*l - iloczyn bezwzgl wartości ładunku elektr e zawartego w jednym z biegunów oraz odl l.
Ponadto w atomie tlenu brakuje dwóch e do trwałej konfiguracji elektronowej najbliższej gazu szlachetnego, a mianowicie neonu, natomiast w atomie wodoru brakuje jednego e do uzyskania trwałej dwójki helowej.Trwałą konfigurację elektronową osiągają atomy wodoru tworząc po jednym wiązaniu z atomem tlenu, która uwspólnia w ten sposób swoje dwa pojedyncze e tworząc cząsteczkę wody.
17. Na czym polega wiązanie kowalencyjne? Podaj 4 przykłady.
Na innym
18.Co to jest półogniwo i ogniwo? Podaj przykład.
Roztwór (elektrolit) wraz z elektrodą nazywamy półogniwem. Ponadto każdą reakcję redoksową możemy przedstawić jako sumę dwóch procesów z których jeden związany jest z oddawaniem, a drógi z pobieraniem e. Właśnie w ogniwie te procesy zachodzą jednocześnie , akażdy z tych procesów zachodzi na innej elektrodzie.
Elektrodami tymi są :
Katoda- tu zawsze zachodzi redukcja jest ona dodatnia
Anoda- tu zawsze zachodzi utlenienie , jest ona ujemna .
Należy również podkreślić ,że procesy w ogniwie zachodzą samożutnie.
Procesy zachodzące
(K+) Cu2++2e=Cu0
(A-) Zu→Zu2++2e
19. Które metale można użyć jako elektrody aktywnej w ochronie protektorowej stalowego kadłuba statku Mg, Pd, Al, Cu, Zn, Sn?Uzasadnij
Do ochrony katodowej nie można uzywać Cu=0,337V, Sn=0,141V, Pb=0,13V
20.Napisz reakcję dysocjacji następujących związków
Mg3(PO4)2↔3Mg2++2PO43-
CaHPO4↔Ca2++HPO42-
H2SO3↔2H++SO32-
21.Podaj po dwa przykłady kwasów i zasad wg Bronsteda
NH4+, H3OH-kwasy
H2O, NH3 - zasady
22.W jaki sposób hydrolizują sole słabych kwasów i słabych zasad?Jaki odczyn uzyskuje roztwór?
Na innym
23.Wskaż fałszywe stwierdzenie:
e) kwas siarkowy(IV) jest utleniaczem
24.Podaj mechanizm działania buforu mrówczanego.
Na innym
25.Uzupełnij współczynniki.Napisz równanie połówkowe redoks oraz podkreśl reduktor w poniższych reakcjach.
H+5NO3 +P= H3P+5O4+N+4O2+H2O
HNO3+e+H+=NO2+H2O /*5
4H2O +P=H3PO4+5e+5H+
5HNO3+P=H3PO4+5NO2+H2O
3Pb2+S2-+6HN+5O3 = 3S+3Pb+2(NO3)2+2N+2O+H2O
S2-=S+2e /*3
H+5NO3+3e +5H+ =N2+O+3H2O /*2
ZESTAW VI.
1.Teoria budowy atomu Bohra wyjaśniła: d) tylko powstawanie widm absorbcyjnych.
2. wymień znane ci trwałe cząstki elementarne: elektron ,proton, neutron.
3.Czy można doprowadzić do zbliżenia i połączenia protonu i elektronu? Odpowiedź uzasadnij. ?
Z uwagi na to że proton i elektron nie mogą połączyć się w jedną całość cząstki te zaczną krążyć wokół swojego środka ciężkości mas. Proton ma 200x większa masę od masy elektronu zatem środek ciężkości masy tych dwóch cząstek będzie pokrywał się niemal ze środkiem masy protonu. Taki układ krążących wokół, w najbardziej trwałej średniej odległości nazywamy atomem.
4. jakie konsekwencje wynikają z zasady Heisenberga?
![]()
Im dokładniej określi się położenie , tym trudniej będzie określić jego prędkość.
Zatem nie jest jednoczesne i dokładne określenie położenia i prędkości, zatem możemy jedynie operować prawdopodobieństwem.
5. Podaj równ. Schrodingera dla cząstki poruszającej się w polu o energi potencjalnej. Co jest jego rozwiązaniem?
Równanie różniczkowe stanowiące podstawę kwantowo-mechanicznego opisu zachowania się elektronu w atomie. Ukazuje ono zależność funkcji falowej od stanu energetycznego i masy elektronu.
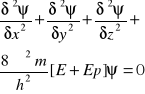
Wynikiem rozwiązania jest określenie kształtów i następstwa energetycznego orbitali, uzależnionego od wartości liczb kwantowych. Rozwiązanie uzyskano dla atomu wodoru i jonów wodoropochodnych.
6. Co to jest orbital? Ile jest możliwych orbitali dla głównej l. kwantowej n=4? Jaka jest max ilość elektronów mogących zajmować orbitale:3s,4p, 5f?
Jednoelektronowa funkcja falowa opisująca stan elektronu w atomie - orbital atomowy lub w cząsteczce - orbital molekularny, cząsteczkowy, drobinowy.
n=4 możliwych orbitali jest 16,
3s to 2, 4p = 6, 5f = 14
7.Wykorzystując regółę Hunda dokonaj graficznego opisu poziomów orbitalnych (za pomocą klatek)dla:
7N, 17Cl, 23V. Określ ile elektronów posiadają te pierwiastki na powłokach walencyjnych?
7N 1s²2s²2p³ --5 el wal
17Cl 1s²2s²2p6 3s²3p5—7 el wal
23V 1s²2s²2p63s²3p6 3d34s²--5 el wal
8.Pierwiastki jakich grup układu okresowego należą do bloku p?
Blok p - pierwiastki grup głównych z wyjątkiem grup IA i IIA i helu.
9.Ile neutronów znajduje się w jądrze
atomu potasu 39 19 K.
n=A-Z=20 neutronów
10. Co to jest elektroujemność? Wymień trzy kolejne pierwiastki o największej i najmniejszej elektroujemności.
-bezwymiarowa wielkość charakteryzująca zdolność atomów do przyciągania elektronów stanowiącą funkcję energii jonizacji i powinowactwa elektronowego.
Najbardziej ujemne: N,O,Fl
Najmniej: Rb, Cs,Fr
11.Jakie wiązanie utworzyło sie w cząsteczce HBr jeżeli elektroujemność H=2.1 Br=2.8?
W cząsteczce HBr utworzyło się wiązanie kowalencyjne spolaryzowane. Wspólne elektrony są silniej przyciągane przez jądra bromu.
12 Któremu orbitalowi molekularnemu odpowiada wyższa energia: wiążącemu czy antywiążącemu?
Energia orbitalu wiążącego molekularnego jest mniejsza , a energia niewiążącego większa, o wartość Δ zwaną energią stabilizacji.
13. Na czym polega hybrydyzacja sp². Podaj przykład. Ile zhybrydyzowanych orbitali sp posiada cząsteczka , jaka jest jej struktura i dlaczego?
Na innym.
14. Wzbudzony atom węgla ma konfigurację:1s² 2s' 2p³jakie wiązania on tworzy? D) 4 atomowe.
15.Ile wiązań „sigma” i „pi” znajduje się w cząsteczce acetylenu? Zaznacz je na wzorze strukturalnym.
Na innym
16.O jakim wiązaniu świadczy moment dipolowy = 0?
17. Na czym polega wiązanie koordynacyjne? Podaj przykład.
Na innym
18.Co sie stanie jeżeli płytkę glinową zanużymy w roztworze Cu SO4?
Na innym
19.Których metali nie można użyć jako elektrody aktywnej w ochronie protektorowej stalowego kadłuba statku: Mg, Pb, Al, Cu, Zn, Sn? Uzasadnij.
Na innym
20. Dodanie których związków spowoduje wzrost pH powyżej 7:
a) FeSO3- nie sól słabego kwasu i sł
zasady
b)(NH4)2CO3- nie sól S-K i S-Z
c)K2S -tak, sól M-Z i S-K
d) H3PO4- nie S-K
e) H3COONH4- nie Sól S-K i S-Z
f)Al2(SO4)3- nie sól S-Z i M-K
20a. Podaj 5 przykładów soli, które dodane do wody nie spowodują zmiany pH: sole słabych kwasów i słabych zasad- (NH4)2CO3, AlPO4, CaS, MgCO3, CH3COONH4.
21. O ile kelwinów należy zwiększyć temp. Układu aby szybkość r-cji zwiększyć 128-krotnie:
Korzystajac z prawa Van Hoffa które mówi że wzrost temp o 10˚ powoduje wzrost szybkości reakćji 2,3-krotnie.
b)
22. Reakcja typu redoks nie zachodzi podczas: pracy ogniwa Daniella
23. Wskaż fałszywe stwierdzenie :
a) jon NH4+ jest zasada
24. Podaj mechanizm działania buforu amonowego.-?
Mieszanina buforowa jak każdy układ zawierający protonodawcę i protonobiorcę. W buforze amonowym mamy układ NH4+ /NH3. Protonodawcą są tu kationy amonowe NH4+ zaś protonobiorcą cząsteczki NH3. Protonodawca reaguje z dodawaną zasadą :
NH4++OH-↔NH3+H2O
NH3+H3O↔NH4++H2O
25.Uzupełnij współczynniki , napisz r-nia połówkowe redoks oraz podkreśl reduktor w poniższych r-cjach:
Na innym
Wyszukiwarka
Podobne podstrony:
ZESTAW III IV1, Szkoła, penek, Przedmioty, Chemia, Zaliczenia, egzaminy, Przykłady zaliczenia z che
ZESTAW III IV, Szkoła, penek, Przedmioty, Chemia, Zaliczenia, egzaminy, Przykłady zaliczenia z chem
Test egzaminacyjny z chemii, Szkoła, penek, Przedmioty, Chemia, Zaliczenia, egzaminy, Przykłady zali
Zestaw II-ok, Szkoła, penek, Przedmioty, Chemia, Zaliczenia, egzaminy, Przykłady zaliczenia z chemii
W rozwiązywanych przykł przy zmi a na aa i odwrotni, Szkoła, penek, Przedmioty, Nawigacja, Zaliczeni
lozowicka egazm, Szkoła, penek, Przedmioty, BISS, Zaliczenia, egzaminy
4x test A4, Szkoła, penek, Przedmioty, BISS, Zaliczenia, egzaminy
Kwit na fize, Szkoła, penek, Przedmioty, Fizyka, Zaliczenie, egzamin
zaliczenie2, Szkoła, penek, Przedmioty, BISS, Zaliczenia, egzaminy
Budowa i Stateczność, Szkoła, penek, Przedmioty, BISS, Zaliczenia, egzaminy
sesja fizyka ITM, Szkoła, penek, Przedmioty, Fizyka, Zaliczenie, egzamin
4x test ściąga kolumny, Szkoła, penek, Przedmioty, BISS, Zaliczenia, egzaminy
Powiększona ściąga, Szkoła, penek, Przedmioty, BISS, Zaliczenia, egzaminy
więcej podobnych podstron