WODA - jest związkiem chemicznym o charakterystycznych właściwościach. Woda przy zamarzaniu zwiększa swoją objętość, ale maksymalną gęstość ma dopiero w temperaturze -4oC. Jest ona najlepszym rozpuszczalnikiem.
Jest zawsze rozcieńczonym roztworem soli, zasad, kwasów i gazów.
![]()
+ domieszki i zanieczyszczenia
Podział domieszek i zanieczyszczeń ze względu na ich stan skupienia:
Kryteria podziału |
Elementy |
ogólny |
fizyczne, chemiczne, bakteriologiczne, radioaktywne |
stan skupienia |
gaz (CO2, O2, N2 ), ciecz (solanka, sól morska), ciało stałe (minerały) |
pochodzenie |
substancje organiczne i nieorganiczne |
naturalność |
naturalne i syntetyczne - nasz projekt |
rozpuszczalność w wodzie |
rozpuszczalność (zdysocjowane i niezdysocjowane) , nierozpuszczalne ( zawiesiny i koloidy) |
działanie na organizmy |
toksyczne (kancerogenne, teratogenne, mutacje nastepnych pokoleń) |
trwałość |
podatne na biodegradację i nie |
obszar pochodzenia |
punktowe (w jednym miejscu zrzut ścieków, obszar fabryki) i obszarowe (spływy z dróg po ziemie) |
WODY PODZIEMNE I POWIERZCHNIOWE
Charakterystyka wód :
Wody podziemne - stały skład fiz- chemiczny, temperatura , przeważnie nie zawierają O ,zachodzą w nich procesy redukcyjne , występuje H2S, CO2 agresywny, duża zawartość żelaza i manganu, mniejsza liczba zanieczyszczeń, w głębszych warstwach są bardzo mineralizowane.
Wody powierzchniowe - zmienny skład fiz- chem. , temperatura waha sie od 0-250C , natlenienie w granicach 100% nasycenia , częste przesycenie tlenem nasyconym , mało zróżnicowany stan mineralny , zależny od stanu zróżnicowania zlewni są dużo bardziej zanieczyszczone niż wody podziemne , zanieczyszczenia antropogeniczne , duża liczba glonów wpływa nie korzystnie na proces uzdatniania takiej wody (im starszy akwen tym jest bardziej zanieczyszczony) , w wodach stojących dużo częściej stwierdza się procesy eutrofizacji.
Cechy fizyczne wody : barwa , mętność , smak , zapach , temperatura ,
Skład wód podziemnych zależy od rodzaju i budowy skał, z którymi się kontaktują, stopnia ich zwietrzenia i uziarnienia, prędkości ruchu wody oraz stopnia kontaktu z wodami powierzchniowymi i opadowymi.
Procesy kształtujące skład wód podziemnych:
- Utlenianie i redukcja ( mają wpływ na zdolności migracyjne pierwiastków)
- Ługowanie i strącanie ( do wody mogą przechodzić różne jony )
- Hydratacja i hydroliza
- Wietrzenie
- Sorpcja (zależy od właściwości sorbentów: stopnia rozdrobnienia ,składu mineralnego frakcji iłowej zawartości substancji organicznej)
- Migracja
- Procesy biochemiczne
Do substancji występujących w wodach podziemnych należą:
tlen rozpuszczony, dwutlenek węgla, siarkowodór, azot, wodorowęglany i węglany, siarczany, chlorki, wapń, magnez, sód, potas, żelazo (Obecność żelaza w wodzie jest skutkiem wietrzenia zasadowych skał magmowych, osadowych a także utleniania i hydrolizy skał siarczkowych)
- mangan ( Jego źródła to: procesy wietrzenia i ługowania skał magmowych i osadowych.)
- związki azotu ( azot amonowy, azotanowy, azotynowy )
- zanieczyszczenia nieorganiczne ( metale ciężkie)
- zanieczyszczenia organiczne ( związki humusowe, produkty przemiany materii organizmów, związki pochodzące z rozkładu organizmów obumarłych )
UKŁADY TECHNOLOGICZNE UZDATNIANIA WÓD POWIERZCHNIOWYCH W ZALEŻNOŚCI OD ICH KLAS.
Rozporządzenia ministra środowiska 2002r. w prawie wymagań jakie powinny odpowiadać wody powierzchniowe.
kategoria A1 - woda wymagająca prostego uzdatniania fizycznego (filtracja i dezynfekcja).
kategoria A2 - typowe uzdatnianie fizyczne i chemiczne ( koagulacja, utlenialność wstępna, flokulacja, dekantacja).
kategoria A3 - napowietrzanie ciśnieniowe ( filtracja I stopnia, filtracja II stopnia przez złoże katalityczne , dezynfekcja).
KLASYFIKACJA WÓD POWIERZCHNIOWYCH I PODZIEMNYCH.
Rozporządzenie ministra środowiska z dnia 11 lutego 2004r. w sprawie klasyfikacji wód podziemnych i powierzchniowych, sposobu prowadzenia monitoringu oraz sposobu interpretacji.
klasa I - wody o bardzo dobrej jakości (kat. A1) - wskaźniki jakości wody są kształtowane jedynie w efekcie naturalnych procesów.
klasa II - wody dobrej jakości (kat. A2) - wskaźniki nie przekraczają dopuszczalnego stężenie przeznaczonej do picia (oprócz żelaza i manganu bo jest go trochę więcej)
klasa III - wody zadowalającej jakości (kat. A2) - naturalne żelazo, mangan, przekroczone wskaźniki dopuszczalne w wodzie
klasa IV - wody niezadowalające (kat. A3) - przekroczone dużo bardziej dopuszczalne stężenia wskaźników w wodzie do picia
klasa V - wody złej jakości , nie nadające się do picia - metale ciężkie, niskie pH, świeży spływ, azot, nie spełnia wymagań wody do picia.
SKŁADNIKI WÓD NATURALNYCH.
MIKROSKŁADNIKI > 10 mg/ dm3 - kationy (sód, potas, wapń, magnez), aniony (chlorki, wodorowęglany, siarczany), gazy (tlen, azot, dwutlenek węgla), inne (krzemionka).
SKŁADNIKI PODRZĘDNE - kationy (żelazo, mangan, NH4+, glin ), aniony (fluorki, bromki, jodki, bromiany), gazy (siarkowodór, amoniak, tlen), koloidy (wodorotlenki metali), zawiesiny (oleje, tłuszcze).
MIKROSKŁADNIKI < 0,1 mg/dm3 - kationy (lit, bar, cynk), aniony (HS-), zawiesiny (piaski, runo).
UZDATNIANIE WÓD PODZIEMNYCH.
* w układzie tym następuje obniżenie stężenia : żelaza, mętności, barwy.
1) NAPOWIETRZANIE - polega na mieszaniu wód podziemnych z powietrzem atmosferycznym.
ciśnieniowe - w urządzeniach zamkniętych, przy wysokim pH i zasadowości.
W procesie tym poprzez wprowadzenie do wody tlenu rozpuszczonego stworzone zostaną warunki do hydrolizy i utleniania związków żelaza oraz manganu. Dodatkowo zapobiegniemy powstawaniu środowiska redukcyjnego, co zapewni nam lepszy smak i zapach wody.
otwarte - wymiana gazów między powietrzem, a gazami z wody, przy niskim pH.
Jest to wymiana gazów między wodą a powietrzem.
+ O2 Me(II) Me(II+x)
Fe i Mn
2) FILTRACJA - jest procesem zapewniającym usuwanie z oczyszczanej cieczy czastek o średnicy > 0,1 ![]()
.Proces ten realizowany jest w urządzeniach nazywanych filtrami.
Może być realizowana jako:
ciśnieniowa - w urządzeniach zamkniętych, do podziemnych.
otwarte - na filtrach otwartych, do powietrza
3) DEZYNFEKCJA - polega na zastosowaniu środka za pomocą którego zabijemy jakieś mikroorganizmy.
metoda chemiczna - dodajemy toksyczny środek chemiczny.
metody fizyczne - promieniowanie ultrafioletowe.
* agresywny CO2:
NAPOWIETRZANIE (zależy od zasadowości < 5mval/dm3)
CHEMICZNE WIAZANIE CO2 (dodanie substancji reagującej na zasadowość NaOH, NaHCO3 , Ca(OH)2 )
FILTRACJA - PIASEK
DEZYNFEKCJA
lub
NAPOWIETRZANIE
FILTRACJA - PIASEK
FILTRACJA II st. - ZŁOŻE Z MASY ODKWASZAJĄCEJ
DEZYNFEKCJA
* mangan:
NAPOWIETRZANIE
CHEMICZNE WIĄZANIE CO2
FILTRACJA - PIASEK
II st. FILTRACJI - złoże z masy wpracowanej
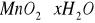
DEZYNFEKCJA
*substancje organiczne: utlenialność, ogólny węgiel organiczny, barwa.
NAPOWIETRZANIE
KOAGULACJA (gdy ChZT powyżej 5)
DEKANTACJA - np. SEDYMENTACJA
FILTRACJA
DEZYNFEKCJA
lub
NAPOWIETRZANIE
UTLENIALNOŚĆ WSTĘPNA (NaOH, H2S, KMnO4)
KOAGULACJA + SEDYMENTACJA
FILRACJA
DEZYNFEKCJA
lub
NAPOWIETRZANIE
ZAKWASZANIE pH do 2
DEKANTACJA
KOREKTA pH do pHs
FILTRACJA
DEZYNFEKCJA
* NNH4
NAPOWIETRZANIE
FILTRACJA - filtry suche - złoże filtracyjne nie jest zatopione w wodzie
FILTRACJA - PIASEK
DEZYNFEKCJA
NAPOWIETRZANIE - ODKWASZANIE WODY.
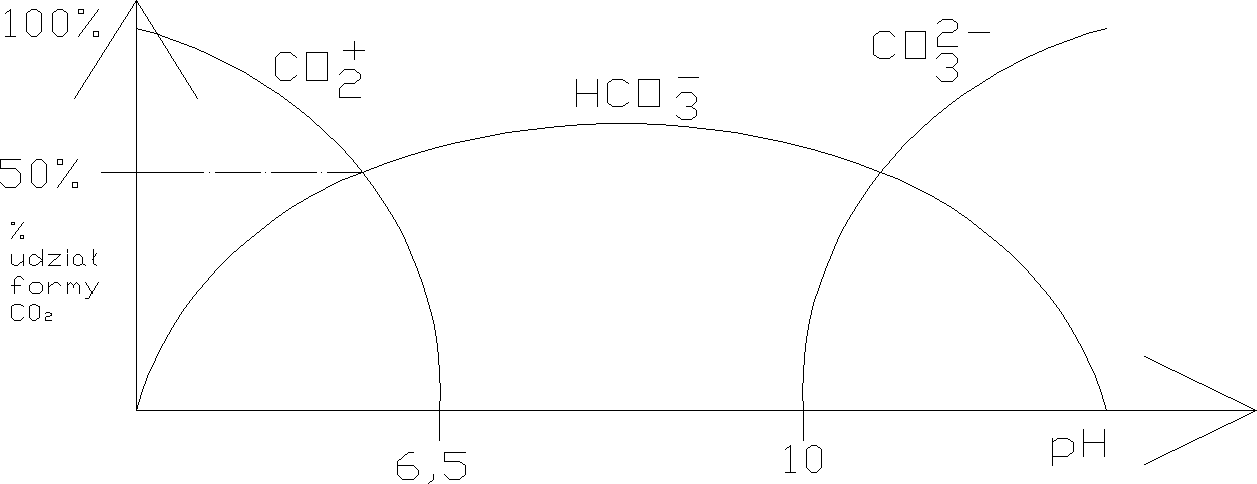
Reakcje CO2 z wodą:
H2O +O2 H2O +O2 - nic się nie dzieje ~ 8-14 g/m3
H2O + CO2 H2CO3 H+ + HCO3- 2H+ + CO32-
Występowanie form CO2 zależeć będzie od pH:
OH-
---------------------------------------------------------------------------- pH
0 H+ H2O 14
Im wyższe pH tym większy jest popyt na jony H+ . Przy niskim pH nie ma zdysocjowania.
1000-1500 g/m3 - tyle rzędów warstw wyższa jest rozpuszczalność.
Cele odkwaszania :
- usunięcie agresywnego dwutlenku węgla z wód podziemnych i infiltracyjnych
- jest pierwszym procesem w układnie technologicznym oczyszczania wód
- powstałego w wyniku koagulacji domieszek wód powierzchniowych
- przy zmiękczaniu i demineralizacji wód kotłowych
- po dekationizacji na kationitach wodorowych ( wymiana innych jonów na H+)
Zmiękczanie usunięcie twardości wody
Demineralizacja zbliżenie składu wody do wody destylowanej , by nie osadzał się kamień kotłowy w urządzeniach grzewczych.
Metody fizyczne:
Przejście dwutlenku węgla obecnego w wodzie do powietrza w wyniku kontaktu obu mediów w urządzeniach otwartych lub ciśnieniowych. Tlen oraz azot przechodzą z powietrza do wody , zaś dwutlenek węgla przechodzi z wody do powietrza.
Proces wymiany gazów opisywany jest prawem Henry'ego:
![]()
[mol gazu/ mol powietrza]
gdzie :
HD - stała Henrego [Pa*dm3/mg] dla CO2 H=6,17 * 10-6 [Pa*dm3/mg]
c - stężenie gazu w wodzie [mg/dm3]
PT - całkowite ciśnienie mieszaniny gazów [Pa]
O skuteczności wymiany gazów decydują:
- temperatura
- zasolenie wody
- rodzaj i stężenie wymienianych gazów
- czas kontaktu wody z powietrzem
- wartość stałej Henry'ego
- pH wody
Im większe są :
- wartość H dla danego gazu
-zasolenie
-temperatura
-stopień rozdeszczenia wody
- czas kontaktu
tym łatwiejsze jest usunięcie tego gazu z wody.
Wpływ pH na odkwaszanie:
W wypadku gazów reagujących z cząsteczkami wody (CO2 i H2S) stopień ich usuwania jest funkcją pH decydującego o formie ich występowania w wodzie.
Podczas napowietrzania z wody usuwana jest tylko ta część która występuje w postaci gazowej, zaś produkty dysocjacji (HS-, S2-…) pozostają w wodzie.
W związku z tym większą sprawność usuwania CO2 i H2S uzyskuje się przy mniejszych wartościach pH.
Wpływ zasadowości na odkwaszanie wody:
Zasadowość wody decyduje o stosowanym sposobie jej napowietrzania.
zasadowość wody ≥ 5 val/m3 stosujemy nap. w urządzeniach ciśnieniowych
zasadowość w zakresie 2-5 val/m3 napowietrzanie otwarte:
*4-5 val/m3 wytryski zwykłe, bądź nap. kaskadowe
*3-4 val/m3 dysze zderzeniowe
*2-3 val/m3 złoża ociekowe
* ≤ 2 val/m3 to po nap. otwartym należy stosować chemiczne wiązanie CO2
Rodzaj napowietrzania |
Obniżenie zawartości wolnego CO2 do gCO2 / m3 |
Zasada równowagi węglanowo-wapniowej gCO2 / m3 |
CIŚNIENIOWE |
30-50 |
240-280 |
OTWARTE, WYTRYSKI |
16-22 |
190-220 |
DYSZE MSTERDAMSKIE |
8-12 |
150-180 |
ZŁOŻA OCIEKOWE |
4-6 |
125-140 |
ZŁOŻA OCIEKOWE Z SZTUCZNYM C |
2-3 |
100-115 |
Urządzenia do napowietrzania:
AERATORY CIŚNIENIOWE (zasadowość wody ≥ 5 val/m3)
są to zbiorniki ciśnieniowe w których odkwaszana woda kontaktuje się z zassanym sprężonym
powietrzem.
ciśnienie powietrza musi być większe o 0,01 MPa od ciśnienia wody
zalecana prędkość przepływu 0,05 - 0,06 m/s
czas kontaktu od 30 do 180 s
KORYTA Z OTWORAMI
woda wypływająca otworami w postaci cienkich strug kontaktuje się z powietrzem.
ZŁOŻA OCIEKOWE
dzielimy je na jedno- i wielowarstwowe, lub z naturalnym bądź sztucznym przepływem powietrza
woda rozdeszczona jest nad złożem, następnie przepływając przez wypełnienie złoża kontaktuje się z powietrzem.
wysokość złóż od 1-4m
DYSZE ZDERZENIOWE
efekt odkwaszania do 80%
zapewniają dobry rozbryzg wody
Metody chemiczne:
Polega ona na dodawaniu reagentów do wody. Stosujemy ją gdy skuteczność metod fizycznych jest niewystarczająca, lub gdy woda zawiera niewielkie ilość agresywnego CO2.
Stosowane reagenty:
WAPNO PALONE lub HYDRATYZOWANE -
CaO + H2O + 2CO2 < Ca(HCO3)2
Wapno do wody może być dawkowane w postaci mleka wapiennego lub wody wapiennej.
SODA KALCYNOWANA (Na2CO3) -
Na2CO3 + CO2 + H2O > 2NaHCO3
WODOROTLENEK SODU (NaOH) -
NaOH + CO2 > NaHCO3
Musi być dawkowane do wody przed filtrami.
MASA DOFILTR -
MgO + 2CO2 +H2O Mg(HCO3)2
CaCO3 + CO2 +H2O Ca(HCO3)2
Otrzymywana w procesie częściowej dekarbonizacji dolomitu w odpowiedniej temperaturze.
Czas kontaktu wody z masą dofiltr wpływa na przyrost twardości ogólnej wody, który maleje wraz z rosnącą prędkością filtracji, a więc ze zmniejszającym się czasem kontaktu.
W czasie eksploatacji masy dofiltr złoże filtracyjne musi być uzupełniane.
ODŻELAZIANIE I ODMANGANIANIE WODY.
Usuwanie żelaza z wody
Istota odżelaziania wody polega na utlenianiu jonów Fe(II) do Fe(III) i usuwanie wytrąconych związków Fe(OH)3 z oczyszczonej wody w procesie sedymentacji i filtracji. Reakcje utlenianie jonów żelaza (II) opóźniają a niekiedy uniemożliwiają związki organiczne tworzące z żelazem (II) rozpuszczone kompleksy.
Formy występowania żelaza:
- Fe(HCO3)2 - stosuje się najprostszy układ uzdatniania wody : napowietrzanie - sedymentacja
przy znacznych ilosciach Fe(OH)3 - odżelazianie (filtracja pospieszna) - dezynfekcja
- FeSO4 - do powyższego układu włączony jest proces alkalizacji
- żelazo może występować również w związkach organicznych - wtedy powyższe procesy są nieskuteczne. Wymagany jest najczęściej proces koagulacji.
Najprościej jest, gdy Fe2+ i Mn2+ tworzy połączenia z
a) Fe2+ Mn2+
sole Fe(HCO3)2 , Mn(HCO3)2
HCO3-
b) Fe2+ Mn2+
sole FeSO4 , MnSO4
SO42-
c) Fe2+ Mn2+
sole Fe(NO3)2, Mn(NO3)2
NO3-
Rodzaj form w jakich żelazo i mangan występują w wodach nie zawierających ligandów organicznych zależą od:
- wartości potencjału oksydacyjno -redukcyjnego Eh
- pH
- temperatury
- zawartości substancji rozpuszczonych w wodzie
Chemizm usuwania żelaza (procesy jednostkowe)
Hydroliza związków żelaza:
Fe(HCO3)2 + 2H2O <->Fe(OH)2 + 2H2CO3
FeSO4 + 2H2O <-> Fe (OH)2 + H2SO4
Utlenianie jonów FeII do FeIII:
4Fe+2 + O2 + 10 H2O <-> 4Fe(OH)3 + 8H+
Szybkość reakcji wzrasta im więcej tlenu w wodzie.
Wytwarzanie i aglomeracja koloidalnych cząstek Fe(OH)2 - flokulacja
Usunięcie wytrąconego wodorotlenku żelazowego.
Usuwanie manganu:
Istota odmanganiania polega na utlenianiu jonów MnII do Mn IV i wytraceniu ich w
postaci MnO2 * x H2O
KMnO4 - silny utleniacz redukuje się do +2 lub +4.
Najpierw zachodzi hydroliza połączeń manganu a następnie proces utleniania. Mangan nie tworzy połączeń z związkami organicznymi.
Do utlenienia manganu możemy zastosować chlor, ozon, KMnO4.
Mn+2 + KMnO4 ,-. MnO2 + K+ + H2O
Inne metody usuwania manganu:
utlenianie w warstwie wodonośnej
wymiana jonowa
sorpcja jonów Mn II na wodorotlenku żelazowym
filtracja przez złoże z minerałów manganowych
Wpływ pH wody na odżelazianie i odmanganianie:
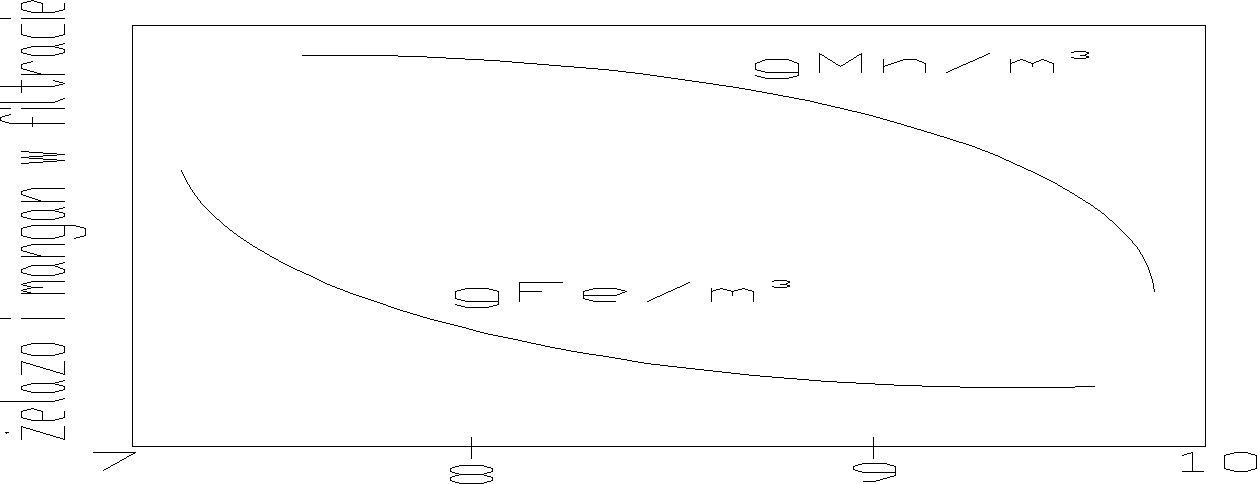
Filtry do usuwania żelaza i manganu:
Prędkość filtracji:
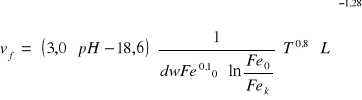
gdzie:
v - prędkość filtracji
pH - pH roztworu wodnego
dw - wew. średnica ziaren
Fe0 - stężenie żelaza w wodzie dopływającej do filtra
Fek - stężenie żelaza w odpływie z filtrów
T - temperatura wody
L - wydajność warstwy filtracyjnej
![]()
Powszechne zastosowanie mają filtry grawitacyjne lub ciśnieniowe ze złożem filtracyjnym wpracowanym , czyli takie którego ziarna pokryte są tlenkami manganu lub żelaza.
Formy żelaza w wodzie:
żelazo całkowite
żelazo II żelazo III
wodne skompleksowane wodne
osad rozpuszczone kompleksy nieorg. komp. org. FeOH3 i
inne osady
FILTRACJA
Filtracja jest procesem zapewniającym usuwanie z oczyszczanej cieczy cząstek o średnicy > 0,1 ![]()
.Proces ten realizowany jest w urządzeniach nazywanych filtrami.
Podział filtrów:
Ze względu na warunki pracy oraz rodzaj złóż filtracyjnych filtry można podzielić na:
Ze względu na rodzaj przepływu:
Grawitacyjne ( otwarte zwierciadło wody )
Ciśnieniowe ( woda napływa i odpływa pod ciśnieniem )
Ze względu na szybkość filtracji:
Powolne ( 5-20cm/h)
Pospieszne ( 5-15m/h)
Superpospieszne ( powyżej 25m/h)
Ze względu na sposób wymuszania przepływu:
Otwarte ( grawitacyjne )
Zamknięte ( ciśnieniowe )
Ze względu na ilość warstw:
Jednowarstwowe
Wielowarstwowe
Ze względu na rodzaj procesu:
Do mechanicznego cedzenia zawiesin
Kontaktowe
Katalityczne
Biologicznie aktywne
Sorpcyjne
Chemicznie aktywne
Jonowymienne
Mechanizm filtracji
Podczas filtracji woda przepływa w określonym kierunku i z odpowiednią prędkością przez złoże filtracyjne, które stanowi materiał porowaty. Podczas przepływu wody przez złoże filtracyjne o nieregularnych kształtach usuwane są cząstki o znacznie mniejszych wymiarach niż pory.
Materiał filtracyjny-rodzaje złóż filtracyjnych:
Najczęściej stosowanymi materiałami filtracyjnymi są;
piasek kwarcowy
węgiel antracytowy
granulowany węgiel aktywny
granit
tworzywa sztuczne o gęstości mniejszej niż gęstość wody
Do odkwaszania wody: grys marmurowy, prażony dolomit.
Materiał filtracyjny spełnia swoje zadanie gdy charakteryzuje się:
właściwym uziarnieniem - uziarnienie kolejnej warstwy powinno być 2 krotnie większe niż warstwy drobniejszej
porowatością - określa pojemność złoża,
gęstością
wytrzymałością mech. na kruszenie i ścieranie
przydatność materiału ocenia się na podstawie średnicy czynnej d10 i współczynnika równomierności złoża WR = d60/d10
Procesy fizyczne zachodzące w złożu filtracyjnym (mechanizm):
CEDZENIE - zatrzymywane są cząsteczki o wymiarach większych od średnicy porów
SEDYMENTACJA - usuwanie cząsteczek o wymiarach 2 - 10 μm i gęstości > albo = gęstości wody.
DYFUZJA - zatrzymywanie w złoży cząsteczek o średnicy <1 μm. Decydują o tym siły lepkości.
WYCHWYTYWANIE - przyciąganie cząstek zawiesiny przez siły elektrokinetyczne występujące na powierzchni ziaren.
ODRYWANIE cząsteczek osadu zatrzymanego w porach złoża przez siły wywołane przepływem wody
FLOKULACJA ORTOKINETYCZNE - prowadzi do agregacji cząsteczek w porach złoża
Procesy chemiczne zachodzące w złożu filtracyjnym:
filtracja przez złoże nieaktywne chemicznie
filtracja przez złoże aktywne chemicznie
Prędkość filtracji:
Jest równa ilorazowi objętości przepływającej wody w czasie do całkowitego przekroju złoża filtracyjnego.
![]()
gdzie:
H - straty ciśnienia
L -głębokość złoża
Długość cyklu filtracji:
To czas pracy złoża filtracyjnego między kolejnym jego płukaniem. Zależy on przede wszystkim od parametrów złoża, prędkości filtracji i poziomu zanieczyszczenia wody dopływającej do filtra. Przyjmuje się że przeciętna długość filtracji wynosi 24 godziny. Koniec cyklu filtracji to osiągnięcie dopuszczalnej straty ciśnienia lub pogorszenia się jakości filtratu.
Płukanie złóż filtracyjnych:
Złoża filtrów pośpiesznych mogą być płukanie wodą lub wodą i powietrzem. Czynniki płuczące podczas płukania przepływają od dołu do góry złoża filtracyjnego wypłukując zatrzymane w złożu zanieczyszczenia. Intensywność płukania wodą zależy od porowatości, gęstości i uziarnienia. Istotnym parametrem jest także czas płukania. Intensywność powinna być tak dobrana, aby ekspansja wahała się w granicach 1,3-1,5 m. Ważnym parametrem jest także temperatura - im wyższa tym tym wyższa intensywność płukania.
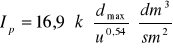
(dmax - max. średnica ziaren mat. filtr., u - lepkość wody, k-współczynnik zależny od śred. ziaren)
Drenaż filtrów:
Zadaniem układu drenażowego jest równomierne rozprowadzenie czynników płuczących złoże filtracyjne. W filtrach pospiesznych stosuje się
- drenaże niskooporowe - należą do nich drenaże kulowe, belkowe, płytowe
- wysokooporowe - rurowy z otworami nawierconymi w rurach lub z wkręconymi dyszami.
Koryta popłuczyn:
Zadaniem ich jest równomierny rozdział dopływającej do filtru wody na całą powierzchnie złoża bez rozmywania górnej warstwy materiału.
Straty ciśnienia filtracyjnego:
Zależy od:
- porowatości złoża - im większa porowatość tym straty mniejsze
- rozkładu uziarnienia
- prędkość filtracji
- wysokość i czas pracy złoża
Filtry powolne:
są również nazywane filtrami biologicznymi
mała prędkość filtracji wody, która najczęściej wynosi ok. 0,1 m/h, (a wyjątkowo przy skutecznym oczyszczaniu wody może być większa niż 0,3)
stosowanie tak małych prędkości filtracji powoduje iż cykle filtracji są długie i w zależności od poziomu zanieczyszczeń wody mogą wynosić od 1 do 6 miesięcy.
oprócz długiej skuteczności usuwania bakterii, zapewnia ok. 95% zmniejszenia mętności i ok. 60% utlenialności.
materiałem porowatym stanowiącym złoże filtracyjne jest piasek kwarcowy, którego warstwa ma wysokość najczęściej około 1,0m
Filtry pośpieszne:
duża wydajność, niższe koszty inwestycji, łatwiejsze oczyszczanie złóż filtracyjnych - płukanie.
konwencjonalne filtry pośpieszne vf = 5-25 m/h, zaś super pospieszne >25 m/h.
są stosowane najczęściej do oczyszczania wody wstępnie oczyszczonej metodami fizycznymi i chemicznymi.
może być stosowana do: zatrzymania obecnych w wodzie zawiesin, usuwanie z wody związków żelaza i manganu
utlenianie azotu amonowego
mogą również zachodzić procesy biologiczne: nitryfikacja, biodegradacja
zanieczyszczeń org. , biologiczne utlenianie jonów Fe(II) i Mn(II)
złoże filtrów stanowi ziarnisty materiał filtracyjny.
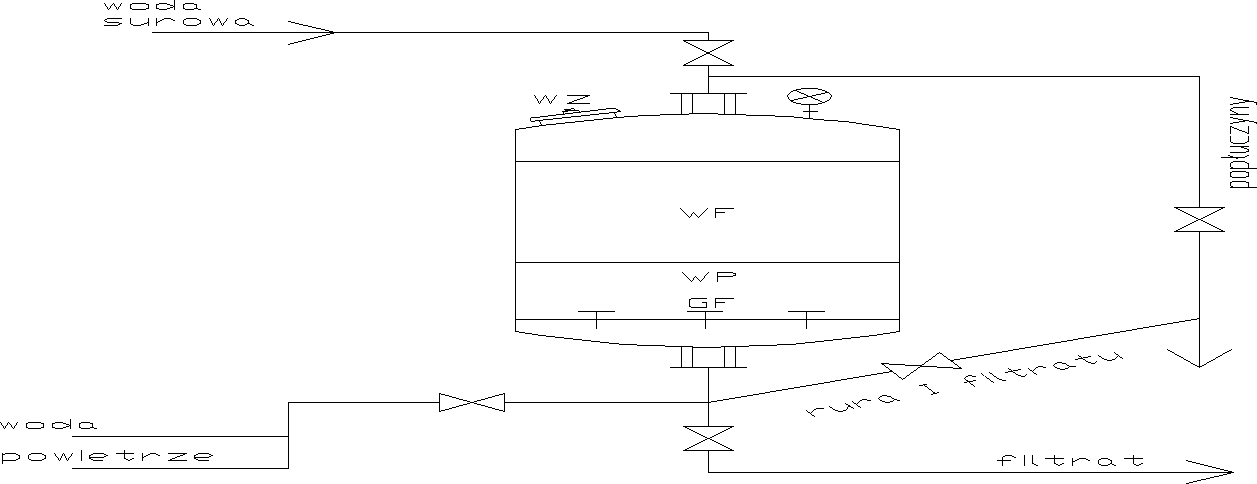
GF - grzybki filtracyjne umieszczone na płycie drenażowej
WP - warstwa podtrzymująca
WF - warstwa filtracyjna
WZ - właz zasypowy
nr zasuwy stan |
1 |
2 |
3 |
4 |
5 |
filtracja |
0 |
x |
x |
0 |
x |
płukanie |
x |
0 |
x |
x |
0 |
spust I filtratu |
0 |
x |
0 |
x |
x |
0 - otwarty
x - zamknięty
FLOTACJA.
Cel flotacji:
Celem flotacji jest rozdział fazy stałej(cząstek zawieszonych) od fazy ciekłej (wody). Flotacja może być stosowana zamiast sedymentacji, a ma to miejsce wówczas, gdy usuwane cząstki stałe mają gęstość mniejszą od wody, lub gdy różnica gęstości zawiesin i wody jest niewielka.
Flotację przeprowadzamy w zbiornikach saturacyjnych lub komorach flotacji.
Flotacja gazowa:
Składa się z 3 zasadniczych faz:
wytworzenie pęcherzyków gazu w objętości oczyszczanej wody
aglomeracja cząstek stałych z pęcherzykami gazu
separacja powstałych aglomeratów
Podział ze względu na sposób wytworzenia pęcherzyków gazu:
flotacja ciśnieniowa
napowietrzanie wody, obniżenie ciśnienia poniżej atmosferycznego, wydzielenie pęcherzyków.
podwyższenie ciśnienia, rozprężenie układu z wydzieleniem pęcherzyków.
flotacja bezciśnieniowa
wprowadzenie pęcherzyków powietrza bez korekty ciśnienia
mikroflotacja - powietrze rozpuszczane przy przepływie przez 10m kolumną z góry na dół pod ciśnieniem hydrostatycznym
elektroflotacja pęcherzyki wytwarzane w wyniku elektrolizy wody (stosowan w oczyszczaniu ścieków)
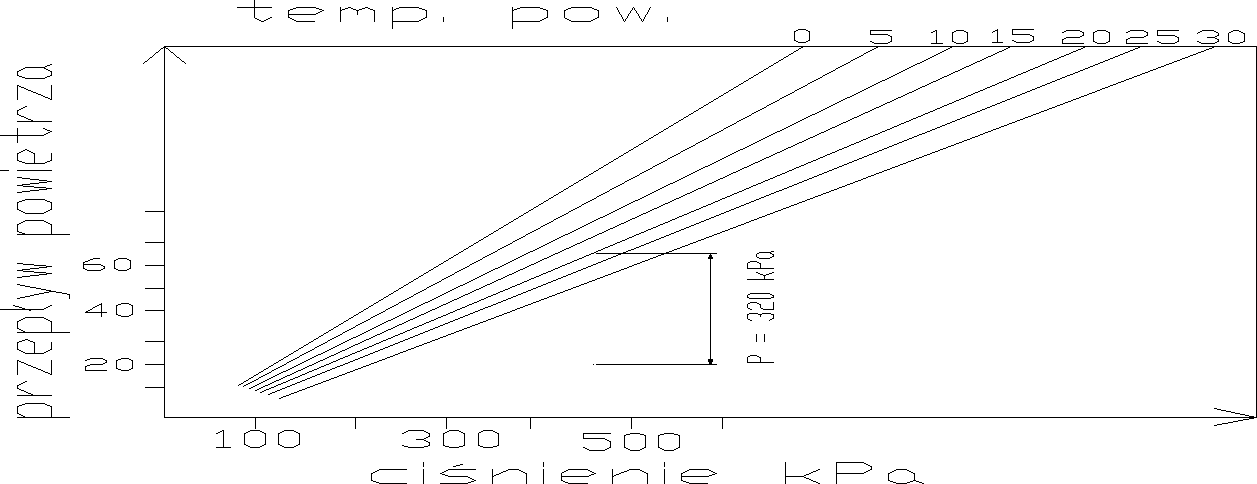
Flotacja ciśnieniowa:
ilość powietrza wydzielonego z wody w czasie rozprężania układu do ciśnienia atmosferycznego:
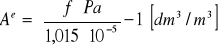
gdzie:
f - współczynnik nasycenia wody tlenem
Pa - ciśnienia absolutne układu sprężonego
minimalna ilość powietrza umożliwiająca flotację:
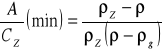
gdzie:
![]()
- gęstość wody
![]()
- gęstość pęcherzyków powietrza
![]()
- gęstość zawiesin w stanie suchym
Komory flotacji:
Proces flotacji realizowany jest w komorach flotacji. W małych zakładach uzdatniania wody można stosować komory o przekroju kołowym, ale coraz częściej stosowane są komory o przekroju prostokątnym. o wymiarach komory flotacji decydują wartość obciążenia hydraulicznego oraz czas przetrzymania wody w komorze.
Maksymalna grubość flotatu = 1cm
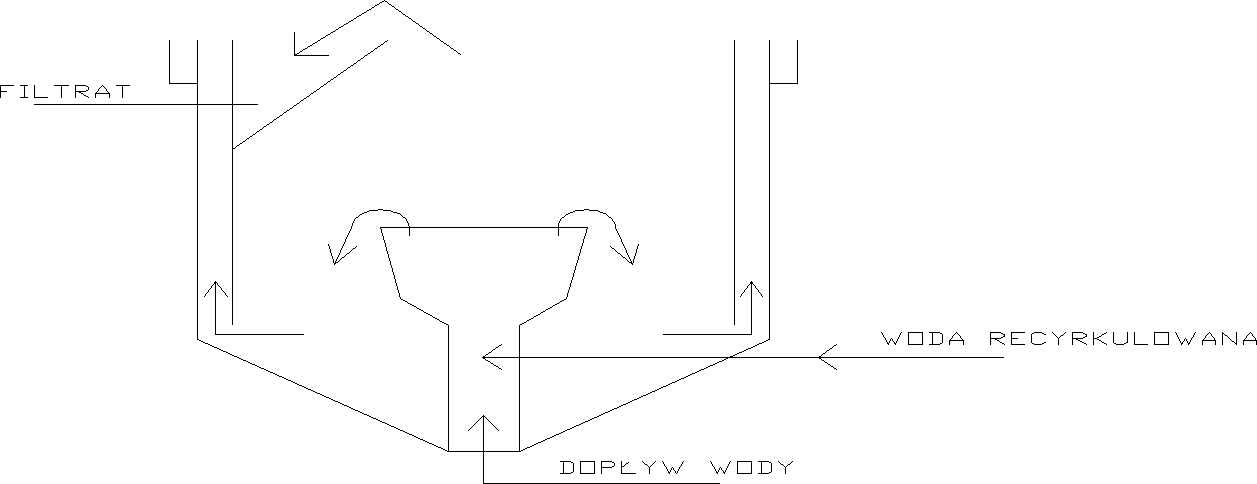
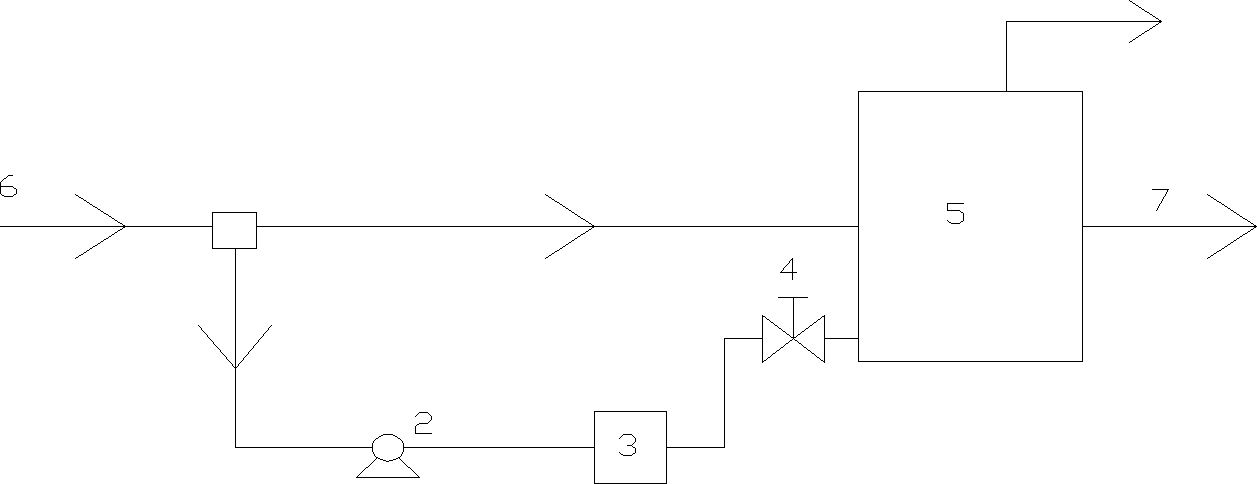
Zbiornik saturacyjny:
Ciśnienie w zbiorniku saturacyjnym zależy od przyjętego sposobu flotacji, proces można prowadzić w układach:
bez recyrkulacji wody
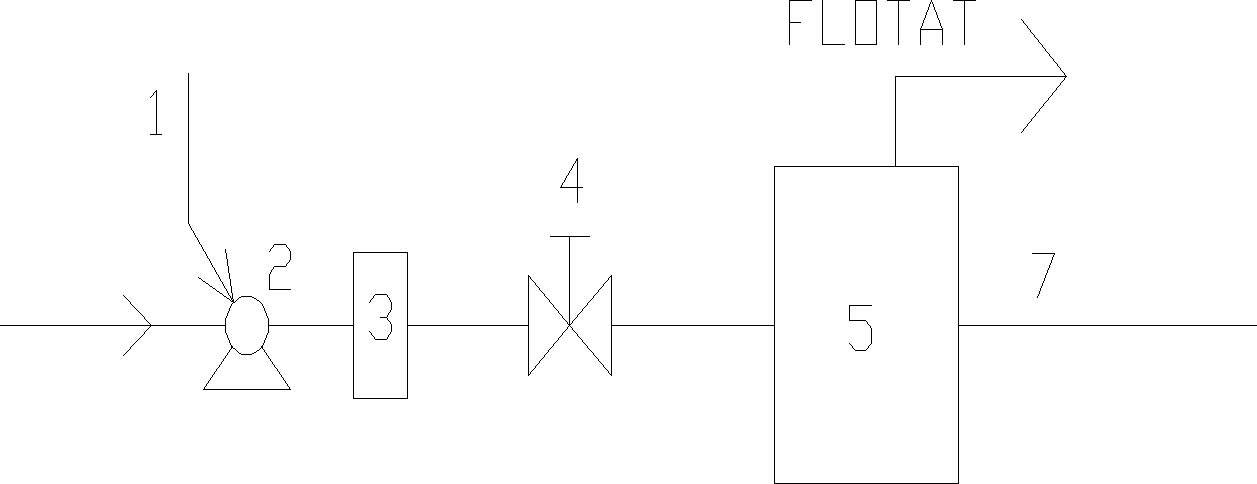
powetrze
pompa
ciśnieniowy zbiornik saturacyjny
zawór redukcyjny
komora flotacji
dopływ wody surowej
odpływ wody po flotacji
z recyrkulacją wody
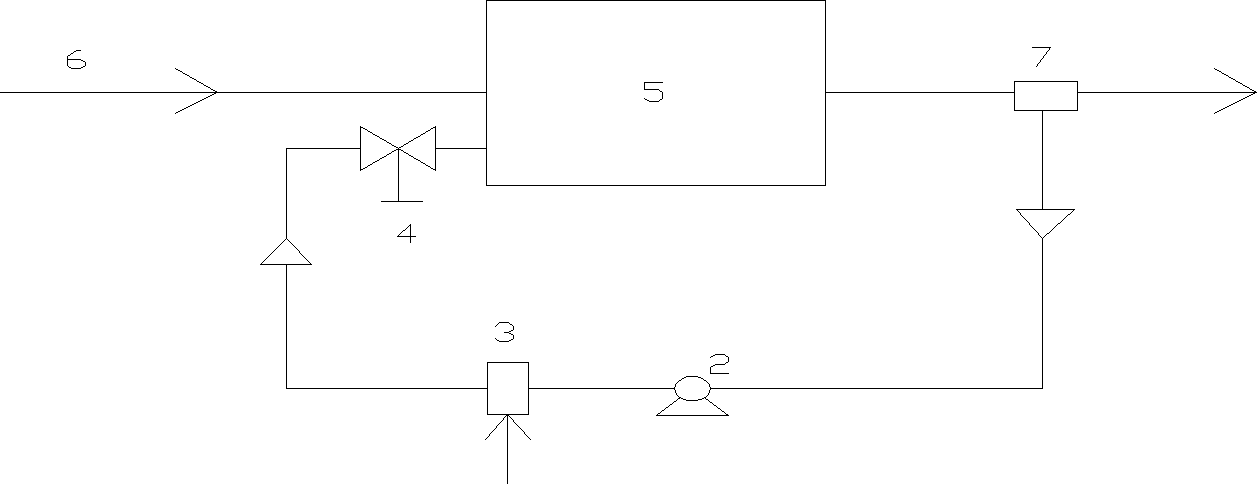
z częściowym napowietrzeniem
KOAGULACJA
Cel koagulacji:
Koagulacja jest procesem powszechnie stosowanym w oczyszczaniu większości wód powierzchniowych, rzadziej infiltracyjnych i podziemnych.
Jest to metoda oczyszczania wód zawierających koloidy oraz zawiesiny trudno opadające.
Istotą procesu jest zmniejszenie stopnia dyspersji układu koloidalnego w wyniku łączenia się pojedynczych cząstek fazy rozproszonej w większe skupiska, które następnie mogą być skutecznie usuwane z wody w procesach sedymentacji, flotacji, i filtracji.
W wyniku koagulacji usuwane są z wody cząstki trudno opadające oraz koloidalne decydujące o mętności wody lub intensywności jej barwy.
Podział koloidów:
koloidy dzielimy na:
hydrofobowe powodują mętność, są to cząstki zawiesin nieorganicznych i bezwodne tlenki metali, (glin, krzemionka koloidalna, iły)
hydrofilowe decydujące o intensywności barwy, cząstki organiczne zawieszone, żywe i martwe mikroorganizmy oraz uwodnione tlenki metali(związki humusowe)
koloidy obce skrobia, białka, celuloza, barwniki organiczne, trafiają do wód np. ze ścieków.
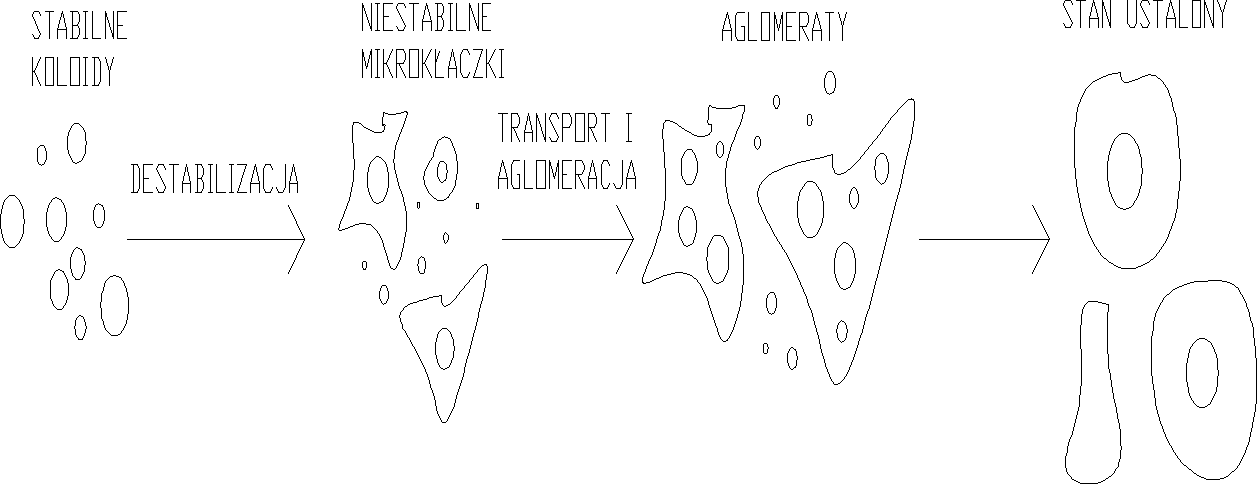
Proces koagulacji:
Koagulacja zachodzi w 2 fazach:
w pierwszej, występującej bezpośrednio po dodaniu koagulanta, a trwającej sekundy przebiegają reakcje chemiczne i fizyczne prowadzące do destabilizacji cząstek koloidalnych.
podczas 2 fazy (trwającej znacznie dłużej), zwanej flokulacją, w wyniku transportu i zderzeń cząstek destabilizowanych powstają kłaczki, które mogą być skutecznie usuwane z wody w procesach sedymentacji, flotacji i filtracji.
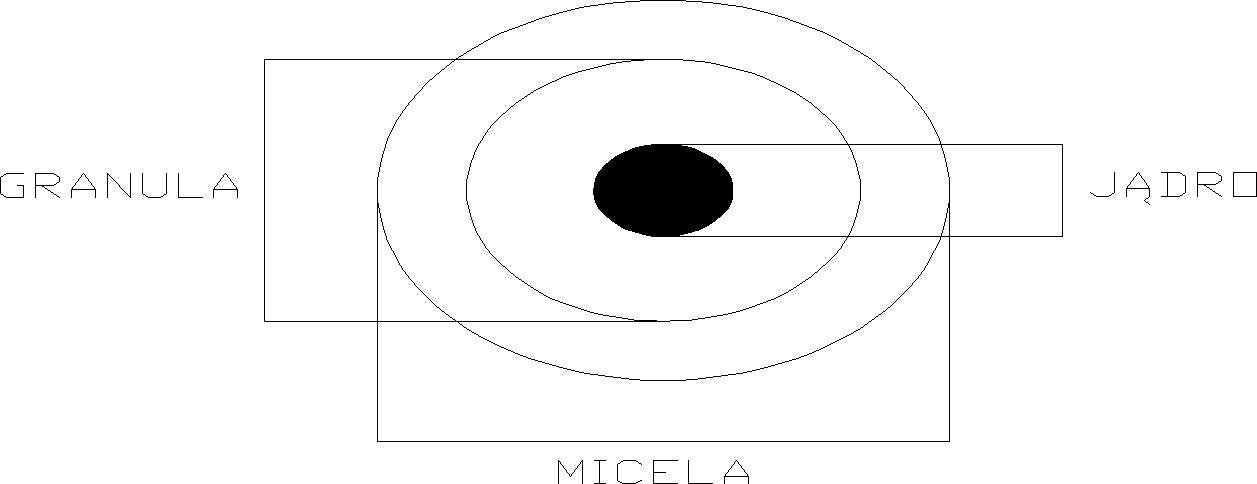
Budowa cząstki koloidalnej:
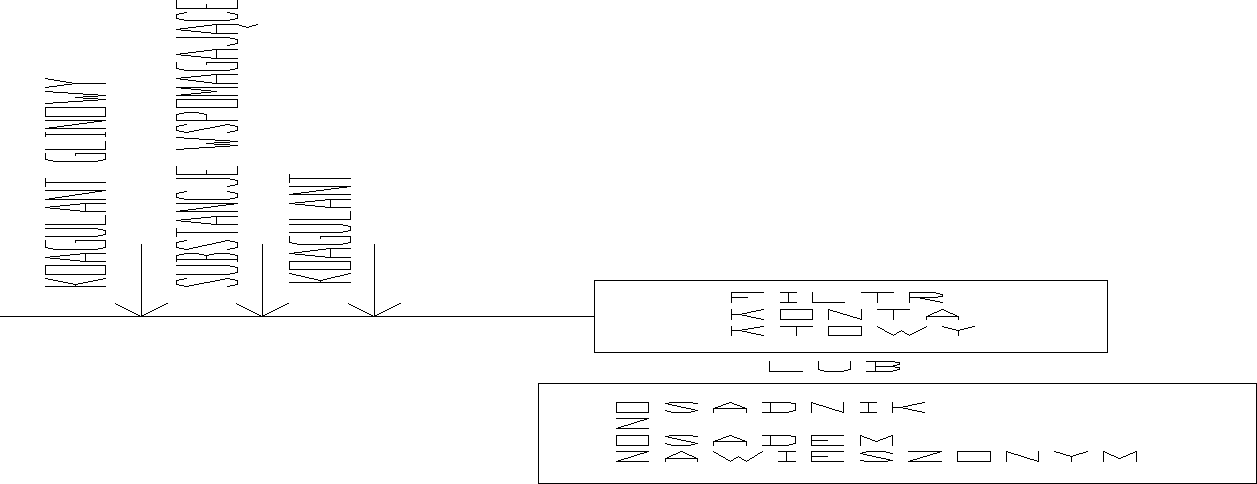
Wpływ zasadowości na przebieg koagulacji:
zmin = 0,009 D + 0,7 < Z
gdzie:
0,009D - zużycie zasadowości przez koagulant
Wraz ze wzrostem dawki koagulantu zasadowość maleje.
Chemizm koagulacji:
reakcje z siarczanem glinu(żelaza):
Al2(SO4)3 2Al3+ + 3SO42- (dysocjacja)
2Al3+ + 2H2O < 2Al(OH)2+ +2H+ (I stopień hydrolizy)
2Al(OH)2+ + 2H2O < 2Al(OH)2+ +2H+ (II stopień hydrolizy)
2Al(OH)2+ + 2H2O < 2Al(OH)3 +2H+ (III stopień hydrolizy)
Al2(SO4)3 + 6H2O < 2Al(OH)3 +6H+ + 3SO42-
Chlorek żelazowy:
FeCl3 +3H2O Fe(OH)3 + 3H+ + 3Cl-
Fe(OH)3 i Al(OH)3 wytrącają się w postaci kłaczków.
Rodzaje koagulacji:
Koagulację można spowodować przez :
- dodanie koloidu o znaku przeciwnym do znaku koloidów obecnych w wodzie
- dodanie elektrolitu
- działanie promieniami β i γ
- ogrzewanie
- działanie mechaniczne
- dehydratację
- wymrażanie
Dawki koagulantówi:
Dawki powinny być wyznaczone dla każdego przypadku doświadczalnie. Orientacyjną wielkość dawek technicznego uwodnionego siarczanu glinowego możemy wyznaczyć ze wzorów:
D=(6-8) √B
D=7√M
Modele koagulacji:
Sposoby realizacji koagulacji:
OBJĘTOŚCIOWA - w układzie technologicznym mamy do czynienia z komorami szybkiego i wolnego mieszania.

KONTAKTOWA - prowadzona jest w osadnikach kontaktowych. Wykorzystuje się w tym procesie działanie katalizujące i sorpcyjne, można zmniejszyć wymaganą dawkę koagulanta.
Woda z koagulantem przepływa z dołu do góry.
POWIERZCHNIOWA - zachodzi na powierzchni złoża filtracyjnego
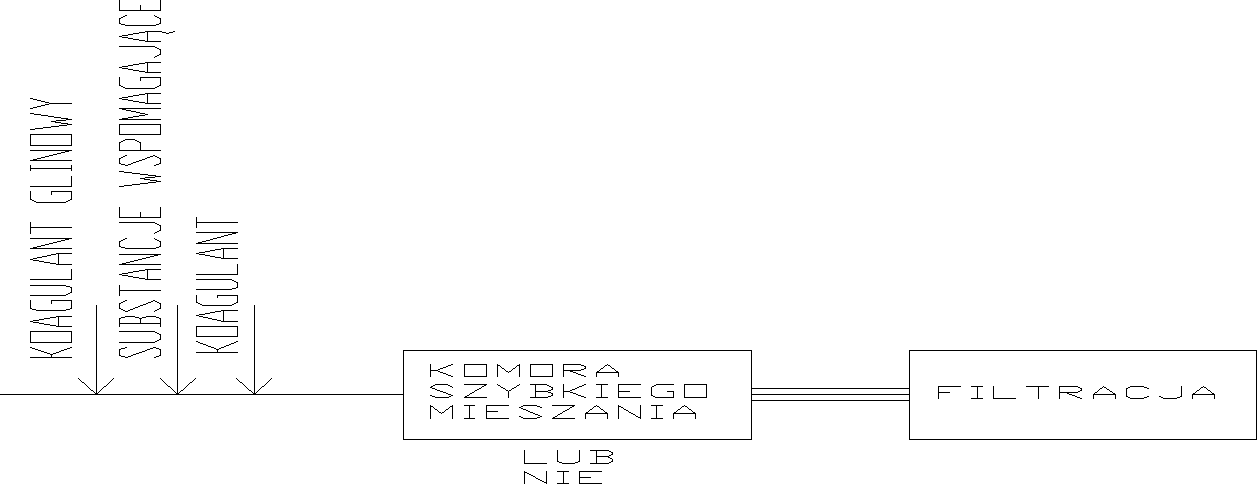
Koagulanty i ich dawki:
Wybór koagulanta:
cena
dostępność na rynku
przydatność
pewność tworzenia trwałych, trudno rozpuszczalnych kłaczków
trwałość chemiczna roztworów
Do koagulantów najczęściej stosowanych należą sole żelaza i glinu tworzące w wyniku hydrolizy dodatnio naładowane hydroksykompleksy skutecznie destabilizujące zanieczyszczenia:
siarczan glinowy Al2(SO4)3 x 18H2O
siarczan glinowo - potasowy Al2(SO4)3 x K2SO4 x 24H2O
siarczan żelazowy Fe2(SO4)3 x 9H2O
siarczan żelazawy FeSO4 x 7H2O
glinian sodowy Na2Al2O4
Substancje wspomagające koagulację:
Celem stosowania ich jest przyspieszenie powstawania kłaczków i ich sedymentacji:
ziemia Fullera
pył granitowy
anhydrytowy
SEDYMENTACJA
Jest jednym z podstawowych procesów wykorzystywanych w oczyszczaniu wody, do usuwania z niej cząstek o gęstości większej od gęstości wody, a więc cząstek opadających.
1.Podział cząstek
-ziarniste - są to cząstki, które w trakcie sedymentacji nie będą zmieniały masy ani objętości np. żwirek, piasek;
-kłaczkowate - w trakcie sedymentacji będą się łączyć oraz zmieniać objętość i kształt;
2.Opadanie cząstek
-swobodne - zachodzi przy małej liczbie cząstek, zazwyczaj w przypadku cząstek ziarnistych;
-skupione - cząstki oddziałują na siebie, tworzą aglomeraty;
-zakłócone - podczas którego wiry powstające przy opadaniu cząstek większych powodują wypieranie cząstek drobniejszych ku górze, zmieniając tym samym, prędkość opadania;
OSADNIKI KONTAKTOWE AKCELATORY
Osadniki - są to urządzenia, w których zachodzi proces usuwania zawiesin z oczyszczanej
wody. Służą do zatrzymywania zawiesin łatwo opadających, naturalnych lub wytworzonych w procesie koagulacji i chemicznego strącania związków trudno-rozpuszczalnych.
Podział osadników za względu na kierunek przepływu wody:
o przepływie poziomym
pionowym
poziomo-pionowym
odśrodkowe
wielostrumieniowe
inne: osadniki kontaktowe z warstwą osadu zawieszonego lub z osadem zawracanym
Osadniki poziome
W osadnikach o przepływie poziomym unoszenie cząstek stałych zależne jest od prędkości przepływu wody w osadniku i prędkości opadania.
Zbiorniki żelbetowe, zakopane w ziemi, o długości kilkudziesięciu metrów, wysokości 2-3 m.
- sprawność osadnika:
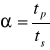
α=1 - osadnik idealny
α=3 - osadnik poziomy
α>1 - osadnik rzeczywisty
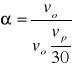
vo - prędkość sedymentacji cząstki
vp - prędkość przepływu wody
Głębokość osadnika przy usuwaniu:
-ręcznym 3-3,5m;
-mechanicznym 2-3m;
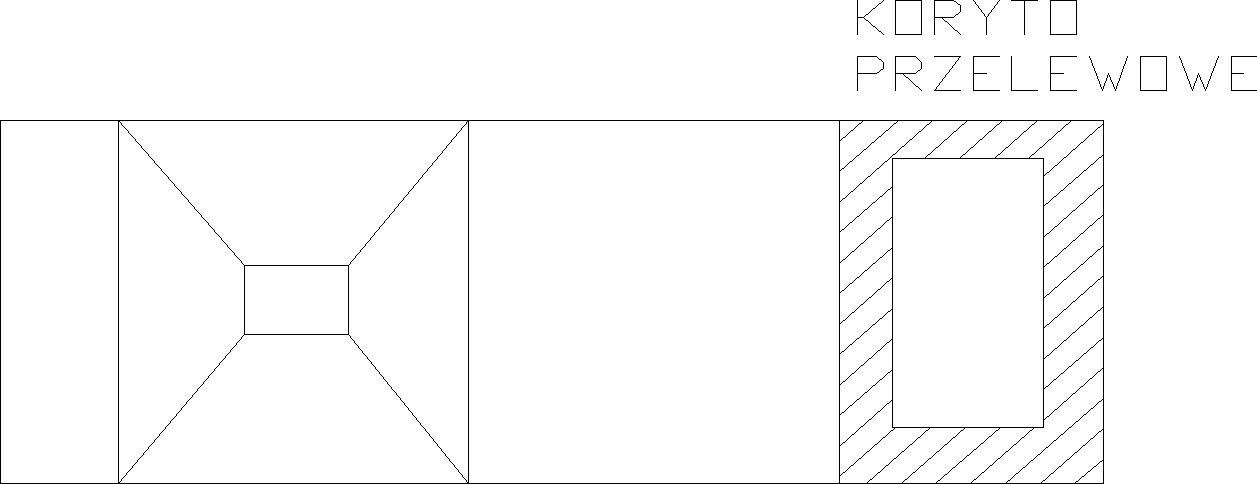
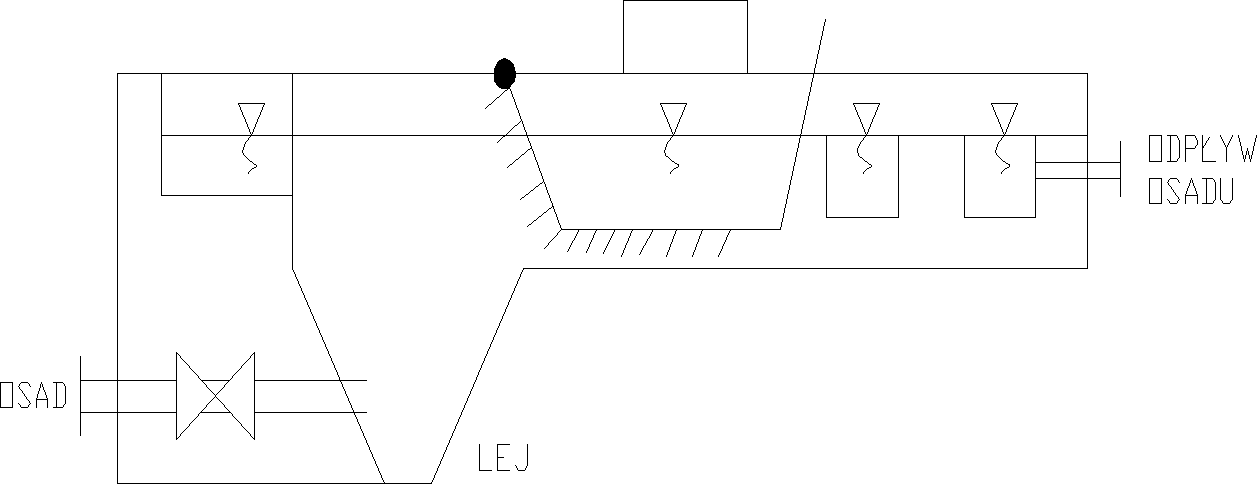
Osadniki pionowe
Budowane są najczęściej jako urządzenia o przekroju kołowym i stosowane zazwyczaj do oczyszczania małej ilości wody. W tych osadnikach woda doprowadzana jest do rury centralnej lub do komory reakcji, skąd wypływa do komory klarowania lub warstwy osadu zawieszonego.
-prędkość pionowego przepływu wody
![]()
;
-powierzchnia strefy klarowania
![]()
- objętość osadnika
![]()
-średnica klarownika Φ≤10m
-czas przetrzymania wody w osadniku 1,5-2h;
-spust osadu z leja osadowego co ok. 8h;
Osadniki poziomo-pionowe
Są to najczęściej osadniki powstałe w wyniku przebudowy starych głębokich osadników o przepływie poziomym, które podzielono na segmenty za pomocą przegród. Osadniki tego typu są dość głębokie.
W przedniej części znajduje się lej do którego zgarniany jest osad.
UTLENIANIE CHEMICZNE
Cel:
Celem jest:
zabezpieczenie sieci wodociągowej przed wtórnym skażeniem
Silne utleniacze:
Utleniacz oddaje elektrony (redukuje). Reduktorem w wodzie są Fe2+ , Mn2+ , wiązki organiczne -4 .
nadmanganian potasu
podchloryn sodu NaClO
dwutlenek chloru
chlor Cl2
Związki chloru:
Zastosowanie: utlenianie, dezynfekcja
Niszczenie zoo- i fitoplanktonu, wspomaganie flokulacji, usuwanie amoniaku poprzez chlorowanie punktu przełamania, w niektórych przypadkach usuwanie z wody smaku i zapachu.
Wady: powstanie UPU np. THM, kwasy halogenooctowe, podwyższenie aktywności mutagennej wody.
Chlor:
cięższy od powietrza 2,5 raza
żółtozielony gaz o charakterystycznym zapachu
temp. wrzenia - 34 oC
wyczuwalny w powietrzu przy stężeniu 0,01 g/m3
wywołuje śmierć człowieka - 2,9 g/m3
rozpuszczalność w wodzie od 14,6 g/m3 przy temp. 0oC , 4,6 g/m3 przy temp. 40oC
Działanie chloru w wodzie:
chlor redukuje się do chlorków
po przereagowaniu z organicznymi substancjami obecnymi w wodzie powstają uboczne produkty utleniania UPU
część chloru zostaje zużyta na utlenianie bromków
pozostała część chloru chlor ogólny pozostały: chlor wolny, chlor związany działanie dezynfekcyjne
Reakcje chemiczne chloru:
z wodą:
pH>2 Cl2+H2O H+ + HClO + Cl-
PH>7,5 HClO H+ + ClO-
HClO + H+ H2ClO-
2HClO Cl2O + H2O
Cl2 + Cl- Cl2-
ze związkami azotowymi:
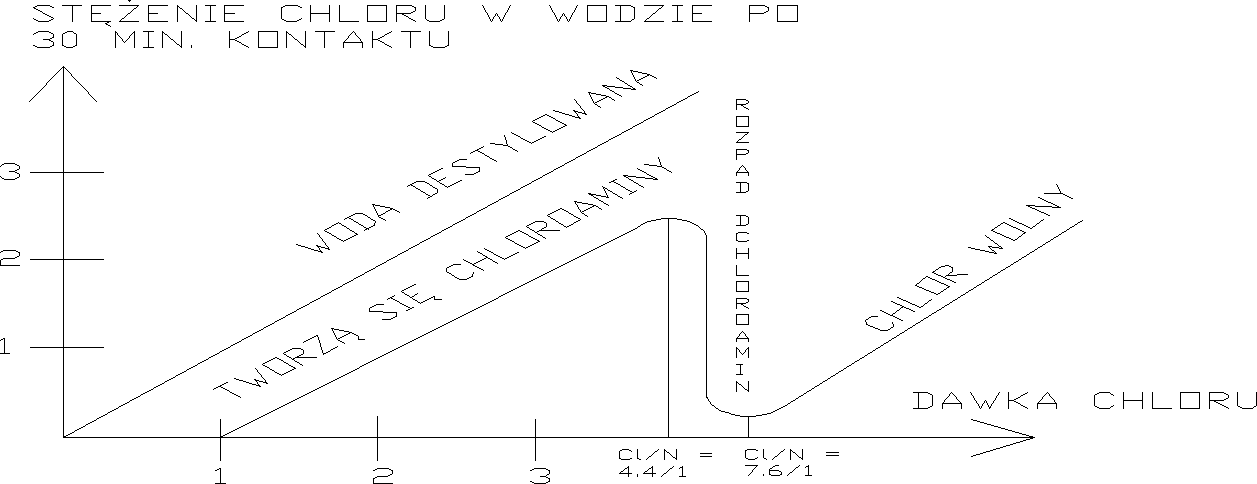
-kwas podchlorawy reaguje ze związkami azotowymi i wynik reakcji zależy od pH i wzajemnego stosunku reagentów:
ph 7,5-8,5 NH3+HClONH2Cl+ H2O
pH 5,0-6,5 NH2Cl+ HClONHCl2+ H2O
pH <4,4 NHCl2+ HClONCl3+ H2O
przy Cl : N >4,4 4NH2Cl+3Cl2+ H2ON2+N2O+10HCl
całkowite usuniecie azotu amonowego przy Cl : N >7,6
z azotem organicznym:
-z kwasem aminooctowym
NH2CH2COOH+Cl2 NHClCH2COOH+HCl
NHClCH2COOH+ Cl2NCl2CH2COOH+HCl
-z mocznikiem
NH2—CO----NH2+HClONHCl---CO---NHCl lub
NH2—CO----NH2+2HClONH2Cl+CO2+H2O
z bromkami Br-:
Chlor utlenia bromki do-
- kwasu podbromowego: HClO + Br HBrO + Cl
- jonu podbrominowego: ClO + Br BrO + Cl
Szybkość reakcji maleje ze wzrostem pH.
Podchloryn sodu NaClO:
w temperaturze pokojowej ciało stałe o barwie bladożółtej.
Krzywa zapotrzebowania na chlor:
Uboczne produkty utleniania(chlorowania):
związki powstające w wyniku reakcji chloru z sub. org. zawartymi w wodzie o charakterze toksycznym, kancerogennym(rakotwórczy) lub mutogennym.
powstają w niewielkich stężeniach i są szkodliwe dla człowieka
nielotne związki halogenoorganiczne NVOX
lotne związki VOX
Najważniejsze grupy chlorowcopochodne UPU:
trichalometany
kwasy haloorganiczne
aldehyd octowy, aldehyd mrówkowy
Mutogenność wody:
mutogenność zdolność związku do wywoływania mutacji
MX - związek odpowiedzialny za 30-70% mut. wody chlorowanej
DEZYNFEKCJA
Celem dezynfekcji
Jest usuwanie niebezpiecznych żywych i przetrwalnikowych form organizmów patogennych oraz zapobieganie ich wtórnemu rozwojowi w sieci wodociągowej.
Stosowanie dezynfekcji powoduje niszczenie organizmów patogennych powodując:
nieodwracalną destrukcję komórek, zakłócenie procesów metabolicznych, zakłócenie biosyntezy i wzrostu.
Metody dezynfekcji wody:
FIZYCZNE - gotowanie ,pasteryzacja, zastosowanie ultradźwięków , promieni ultrafioletowych , lub promieniowanie gamma.
GOTOWANIE - zapewnie odpowiednia temp. wody oraz czas jej ogrzewania w którym można uzyskać odkażenie wody przez niszczenie wszystkich form organizmów patogennych.
CHEMICZNE - Dezynfekcja wody metodami chemicznymi polega na dawkowaniu do niej silnych utleniaczy takich jak chlor ,podchloryn sodowy , dwutlenek chloru , chloraminy, ozon, brom.
Chlorowanie wody:
Wymaga wstępnego określenia dawki chloru i jego czasu kontaktu z wodą.
Zarówno czas kontaktu jak i wielkość dawki zależą od poziomu skażenia bakteriologicznego wody oraz jej składu fizyko-chemicznego.
Chlorowanie wody jest coraz częściej stosowane ze względu na fakt, iż reakcja azotu amonowego z chlorem jest konkurencyjna w stosunku do reakcji chloru ze związkami organicznymi.
Dechloracja wody:
Przy stosowaniu dużych dawek chloru i chlorowaniu do punktu przełamania w wodzie pozostaje nadmiar chloru, który powinien być z niej usunięty.
Można to uzyskać metodami chemicznymi, przez zastosowanie związków redukujących, takich jak siarczyn lub tiosiarczansodowy bądź dwutlenek siarki.
Wyszukiwarka
Podobne podstrony:
Sprawko2, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
ściąga pyt 1, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
Sprawko3, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
Sprawko5, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
sciaga z pytan , Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
oczyszczanie wody pytania egz, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
Ściąga TWiŚ, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
ściąga pyt4, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody
Sprawko1, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
Sprawko2, Inżynieria środowiska, inż, Semestr V, Oczyszczanie wody, laboratorium
Wasowski wykłady, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wyk
3z3, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wykłady, opracow
WYKŁAD 3. Reakcje chemiczne, Inżynieria środowiska, inż, Semestr I, Chemia ogólna
Was2, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wykłady, opraco
Wyklad 2. Roztwory i stezenia, Inżynieria środowiska, inż, Semestr I, Chemia ogólna
Was1, Inżynieria Środowiska, mgr 1 semestr, Uzdatnianie wody do celów przemysłowych, wykłady, opraco
więcej podobnych podstron