Napisz wzór peptydu o sekwencji Ala-Cys-Phe-Gly-Cys-Ser. Wskaż w nim reszty aminokwasów, które mogą pełnić funkcje w centrum aktywnym enzymów.
Alanina-Cysteina-Fenyloalanina -Glicyna-Cysteina-Seryna
koniec C jest na serynie, a koniec N na alaninie
Peptyd mogą hydrolizować:
- egzopeptydazy: serynowa(mdz Cys-Ser) i alaninowa(mdz Ala-Cys)
- endopeptydazy np. glicynowa, cysteinowa, fenyloalaninowa
Przestrzenna architektura białek - podręcznik :)
Sekwencja aminokwasów wywiera największy wpływ na strukturę przestrzenną białka,gdyż determinuje, jakim białkiem ono jest i jakie ma właściwości
1. aminokwasy biorace udzial w centrum aktywnym:
* asparaginian *glutaminian *lizyna *histydyna *seryna *treonina *tyrozyna *cysteina
Przedstaw graficznie, podaj definicję i omów znaczenie Km. Podaj cztery podstawowe sposoby regulacji aktywności enzymów. W jaki sposób można wyrażać aktywność enzymów?
Km to stała Michaelisa-Menten. Definiuje się ja jako takie stężenie substratu (w molach na litr), przy którym szybkość reakcji enzymatycznej osiąga połowę szybkości maksymalnej.
Każdy enzym wykazuje charakterystyczna wartość Km w reakcji z odpowiednim substratem. Stała Km jest wskaźnikiem powinowactwa enzymu do substratu, niska jej wartość oznacza duże powinowactwo i duża szybkość procesu.
Sposoby regulacji aktywności enzymów:
* hamowanie przez stężenie zwrotne A->B->C->D->Z => enzym szczatkujacy jest hamowany przez produkt Z (produkt końcowy lub metabolit wpływa na początek przemian)
* białka regulacyjne np. kalmodulina wiąże się z Ca2+
* modyfikacja kowalencyjna np. ufosforylowanie nieaktywnego enzymu, który staje się aktywny
* aktywacje proteolityczne, enzymogeny potrzebują aktywacji proteolitycznej np.hymotrypsynogen (nieaktywny enzym) musi zostać przyciety przez trypsyne (po 15 argininie) powstaje hymotrypsyna (aktywny enzym)
Model mochaelisa-menten
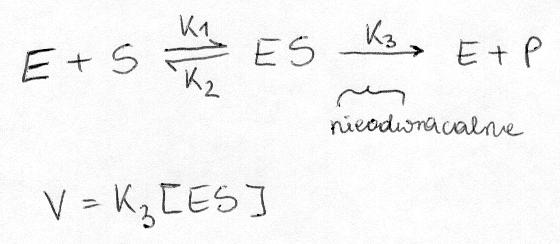
Gdzie k1, k2 i k3 to pewne stale; [ES] to stężenie kompleksu ES
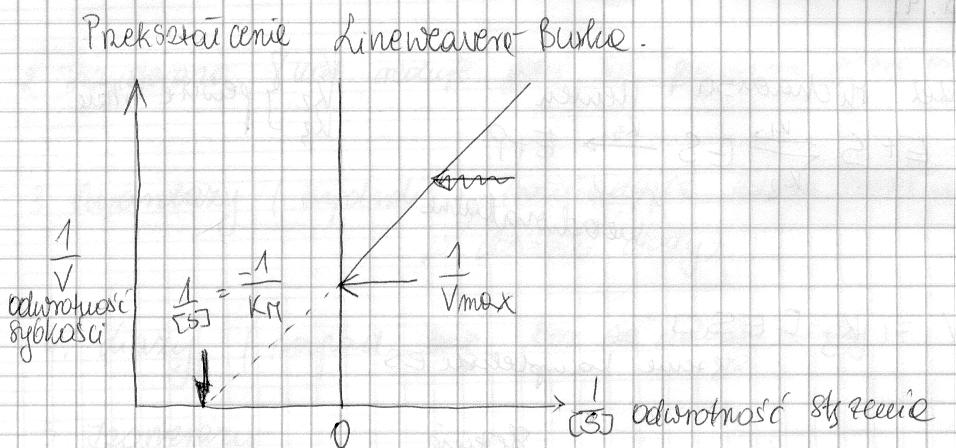
Stała M-M
V max jest wtedy kiedy wszystkie miejsca enzymu są wysycane substratem tj [S]>km czyli [S]/[S]+km ~ 1
Równanie Michaelisa-Menten
Im wyższa km tym powinowactwo enzymu do substratu jest mniejsze; im km mniejsza tym powinowactwo jest większe
Liczba obrotow enzymu oznacza liczbę cząsteczek substratu przekształconego w produkty reakcji na jednostkę czasu, w warunkach pełnego wysycenia enzymu substratu
Anhydraza węglanowa działa w pluchach w procesie oddychania (uwalnia CO2 i HCO-2 ) 600 000 obratow/s
2. Na przykładzie modelu Michaelisa-Menten opisz właściwości kinetyczne enzymów.
2 TYPY INHIBICJI ODWRACALNEJ TO INH.WSPÓŁZAWODNICZĄCA I NIE WSPOŁZAWODNICZACA. WSPÓŁZAWODNICZACA: INH. WSPÓŁZAWODNICZACY Z SUBSTRATEM O CENTRUM AKTYWNE JEST STRUKTURALNIE PODOBNY DO SUBSTR.
NP. HAMOWANIE AKTYWNIOSCUE DEHYDROGENAZY BURSZTYNIANIWEJ WYWOLANE- MALONIANEM, KTÓRY JEST NIŻSZYM HOMOLOGIEM BURSZTYNIANU-SUBST. TEGO ENZ.
COOH-CH2-COOH COOH-(CH2)2-COOH JEŻELI INH.WYSTĘPUJE W DUŻYM STĘŻ. TO MOŻE ON CAŁKOWICIE WYPRZEC Z KOMPLEKSU Z ENZYMEM I W TEN SPOSÓB ZAHAMOWAC REAK. PRZY ZWIEKSZENIU STEZ. SUBSTRATU INH. ZOSTAJE WYPARTY . PODLEGA TO PRAWU DZIAŁANIA MAS. NIEWSPOŁZAWODNICZĄCA- NIE MOŻNA JEJ COFNAC PRZEZ ZWIĘKSZENIE SUBSTR. INH. NIEWSPÓŁZAWODNICZACY MOŻE WIAZAĆ SIĘ BĄDŹ Z WOLNYM ENZYMEM LUB Z KOMPLEKSEM E-S,BĄDŹ JEDNYM I DRUGIM E+I->EI ES+I->ESI
INH. NIEODWRACALNA-POLEGA NA MODYFIKACJI 1 LUB KILKU GR. FUNKCYJNYCH CENTRUM AKT.ENZ. INH. TEGO HAMOWANIA SĄ CZYNNIKI NP. ALLKILUJĄCE TJ JODOACETAMID, KTÓRY NIEODWRACALNIE WIAZE NIEZBEDNE DO AKT.ENZ.GR.-SH
E-SH+ICH2CONH2->E-S-CH2CONH2+HI
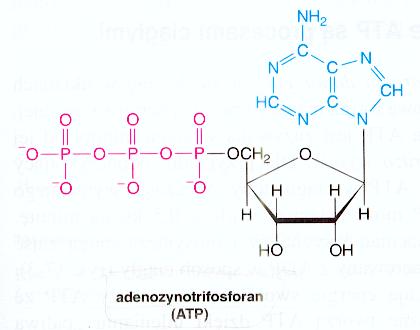
Napisz wzór ATP i podaj jego pełną nazwę. Podaj drogi powstawania ATP w organizmach żywych. Napisz dwie reakcje wymagające udziału ATP, podaj nazwy enzymów i klasę do której należą.
ATP - adenozynotrifosforan
Klasy enzymow, z którymi może wspolpracowac to:
Transferazy (przenoszą) ATP + NAD->ADP + NADP (kinaza NAD)
Ligazy (syntetazy) kosztem energii wysoko energ. Związków wytwarzają nowe wiązania
+ CO2+H2O --(ATP/ADP+P)->
Hydrolazy (rozpad z udziałem H2O) ATP + H2O->AMP + PP (pirofosfohydrolaza ATP)
ATP jest wytwarzany w kom podczas utleniania czasteczek glukozy, kw tluszcz, aminokwasow, podczas cyklu kw cytrynowego, fosforylacji oksydacyjnej, troche powstaje tez podczas glikolizy.
Gradient protonowy wykorzystywany jest np. w fosforylacji oksydacyjnej.
3'.Dlaczego powszechnym srodkiem wymiany energii swobodnej jest ATP?
ATP jest ustawicznie regenerowany, co oznacza ze jest prawie caly czas dostepny dla reakcji. Fosforanowe wiazania w nim wystepujace podczas rozkladu dostarczaja bardzo duza porcje energii. ATP nie wykazuje specjalizacji w kierunku zadnej z reakcji. Inne energodajne zwiazki z „rodziny” ATP (UTP, CTP, GTP) posiadaja specyficzne funkcje, co sprawia, ze nie sa one tak powszechne jak ATP
3”. Napisz w jakiej reakcji glikolizy powstaje NADH. Jaki enzym ja katalizuje? Podaj pełną nazwę i wzór NADH. Omów losy tego związku w warunkach tlenowych i beztlenowych.
W reakcji dehydrogenazy aldehydu 3-fosfoglicerynowego.
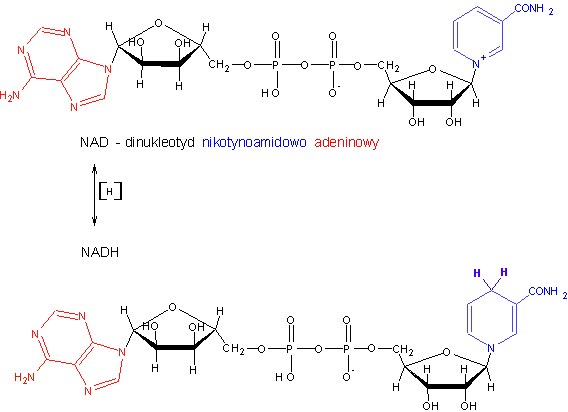
NADH - zredukowany dwunukleotyd nikotynamido-adeninowy (NAD+)
Losy w warunkach beztlenowych: powstają 2 cząsteczki NAD+
Losy w warunkach tlenowych: NADH przekazuje proton i elektrony na mitochondrialny łańcuch oddechowy, gdzie poprzez wiele ogniw pośrednich są one przekazywane na tlen, tworząc H2O. Procesowi temu towarzyszy powstawanie energii magazynowanej w postaci ATP.
NADH- do powstania ATP, nie bierze udziału w reakcjach redukcyjnych (utl. w łańc. oddech.)
3”'. Napisz wzór NAD i NADP. Podaj pełne nazwy tych związków. Jaką funkcję pełni grupa fosforanowa w NADP i jakie są tego konsekwencje? W jakich reakcjach redukowany jest NADP w organizmach zwierzęcych i jaka jest funkcja jego zredukowanej formy?
NADP - fosforan dinukleotydu nikotynamidoadeninowego
a)forma utleniona b)forma zredukowana
NAD - dinukleotyd nikotynamidoadeninowy
a)forma utleniona
b)forma zredukowana
NADP redukowany jest do NADPH podczas:
- szlaku pentozofosforanowego (NADPH wytworzone podczas tej reakcji jest wykorzystywany w reakcjach biosyntetycznych wymagajacych siły redukcyjnej).
- syntezy kw tłuszcz. (powstałe tu NADPH zasila ta synteze)
- fotosyntezy
NADPH jest głównym donorem protonów w biosyntezach redukcyjnych, a także jest akceptorem protonu i elektronów w reakcjach utleniania, lecz powstający NAPH nie przekazuje protonu i elektronów na łańcuch oddechowy. Są one zużytkowywane w różnych reakcjach redukcji, głównie w przebiegu biosyntezy kwasów tłuszczowych i cholesterolu. W organizmach samożywnych NADP powstaje w początkowym etapie fotosyntezy i jest zużywany później w cyklu Calvina.
3””.Co jest glownym donorem elektronow w biosyntezach redukcyjnych?
*Jest to NADPH. Dinukleotyd nikotynoamidoadeninowy
3””'.Jaka jest zasadnicza roznica miedzy podstawowymi procesami przeksztalcania energii: fosforylacja oksydacyjna a fotosyntetyczna? Jaka role odgrywa karboksylaza-1,5-bisfosforybulozy i na czym polega jej katalityczna niedoskonalosc? Podaj ogolny bilans cyklu Calvina.
Fosforylacja fotosyntetyczna jest procesem analogicznym do syntezy ATP napedzanej przez gradient protonowy podczas fosforylacji oksydacyjnej w mitochondriach. Różnica miedzy tymi procesami polega na tym, ze protony (w oksydacyjnej) sa pompowane na zewnatrz mitochondriow, natomiast w chloroplastach - do dodatkowego przedzialu, jakim jest przestrzen wewnatrz tylakoidu.
Karboksylaza-1,5-bisfosforybulozy uczestniczy w reakcjach ciemnych fotosyntezy. Jest ona duzym enzymem katalizujacym kluczowa reakcje wiazania wegla, który jest umieszczony w stromie. W tej reakcji zachodzi kondensacja czasteczki CO2 z rybulozo-1,5 bisfosforanem, w wyniku ktorej tworzy się szescioweglowy produkt posredni, szybko hydrolizujacy do 2 czasteczek 3-fosfoglicerynianu. Ta karboksylaza jest enzymem bardzo powolnym, dlatego kazda roslina potrzebuje duzych jego ilosci. Te czynniki skladaja się na niedoskonalosc katalityczna tego enzymu.
Ogolny bilans cyklu Calvina: 3 CO2 + 6 NADPH + 9 ATP -> aldehyd3-fosfoglicerynowy + 6 NADP+ + 9 ADP + 8 Pi
3*. Omów drogę elektronów z NADH do O2. Który z kompleksów transportu elektronów nie jest pompą protonową?
Elektrony są transportowane z NADH do tlenu przez łańcuch transportu elektronów. NADH przenosi elektrony do dehydrogenazyNADH, dużego kompleksu białkowego zawierającego FMN i dwa typy centrów żelazowo-siarkowych (Fe-S) umieszczonych w białkach żelazowo-siarkowych. FMN przyjmuje elektrony przechodząc w FMNH2 i przekazuje je dalej do centrum Fe-S, gdzie atom żelaza odbiera i oddaje elektrony oscylując między stanem Fe3+ a stanem Fe2+.Z dehydrogenazy NADH elektrony są przenoszone do CoQ, przekształcają go w ubichinol (czyli CoQH2) i przechodzą dalej do kompleksu cytochromów bc1. Ten ostatni obejmuje cytochrom b i cytochrom c1, a także białko Fe-S.Każdy cytochrom zawiera grupę hemową z umieszczonym w centrum atomem żelaza, który w trakcie przyjmowania elektronu przechodzi ze stanu Fe³(+) do stanu Fe²(+). Po oddaniu elektronu do następnego przenośnika atom żelaza powraca do stanu Fe³(+). Kompleks cytochromów bc1 przenosi elektrony do cytochromu c, który z kolei przekazuje je do oksydazy cytochromowej, kompleksu zawierającego dwa cytochromy (cytochrom a i cytochrom a3), związane z dwoma atomami miedzi (odpowiednio Cu A i Cu B). Podczas przenoszenia elektronów atomy miedzi oscylują między stanem Cu²(+) a stanem Cu(+).W końcu oksydaza cytochromowa przenosi cztery elektrony do tlenu cząsteczkowego, z utworzeniem dwóch cząsteczek wody.
Dehydrogenaza bursztynianowa katalizuje w cyklu kwasu cytrynowego utlenianie bursztynianu do furmanu.Dehydrogenaza bursztynianowa zawiera zwiazany FAD,który w tej reakcji ulega redukcji do FADH2.Utlenianie FADH2 przeprowadza REDUKTAZA BURSZTYNIAN-KOENZYM Q-(kompleks II),która jest integralnym białkiem wew. Błony mitochadrialnej. Dehydrogenaza bursztynianowa jest częścią tego kompleksu, który zawiera też centra Fe-S Podczas utleniania FADH2 dwa elektrony przechodzą do centrów Fe-S i dalej do CoQ. Następnie wchodzą one do głównego łańcucha transportu elektronów, co umożliwia wypompowanie jonów H+ z mitochadriów, tak samo jak w przypadku utleniania NADH.Jednakże sama reduktaza bursztynian-CoQ NIE JEST pompą H+ ponieważ zmiana energii swobodnej całkowitej rekcji katalizowanej przez nia jest zbyt mała.
3. Podaj wzór i pełną nazwę ATP. Opisz drogi powstawania ATP w organizmach żywych.
Glikoliza zachodzi w pozamitochondrialnej, rozpuszczalnej frakcji komórkowej - cytoplazmie - wszystkich eukariotów i prokariotów.
podczas glikolizy (ale to małe ilości) a dokładniej w 2 jej etapach: 1,3-bisfosfoglicerynian + ADP -(kinaza fosfoglicerynianowa)-> 3-fosfoglicerynian + ATP i jeszcze fosfoenolopirogronian + ADP -(kinaza pirogronianowa)-> pirogronian + ATP
Z jakiego cukru prostego zbudowany jest glikogen. Podaj jego nazwę i wzór oraz nazwę wiązań występujących w tym polisacharydzie. Wymień nazwy enzymów biorących udział w jego degradacji.
Zbudowany z glukozy.
Wiązania: alfa-D-glukopiranozy połączone ze sobą wiązaniami alfa-1,4-glikozydowymi, a w miejscach rozgałęzień alfa-1,6-glikozydowymi. Rozgałęzienia występują co 8-12 reszt glukozowych.
Enzymy biorące udział w degradacji: fosforylaza glikogenowa (glikozydazy, fosfokinazy?)
Glikogen ma budowę zbliżoną do składnika skrobii - amylopektyny, lecz rozpuszcza się on lepiej w wodzie niż amylopektyna, ponieważ odgałęzienia boczne glikogenu są liczniejsze i krótsze niż amylopektyny. Jako koloid hydrofilowy rozpuszcza się w wodzie na zimno dając opalizujący roztwór. Możliwe jest to dzięki występowaniu w jego cząsteczce licznych grup hydroksylowych, mogących łatwo tworzyć wiązania wodorowe z cząsteczkami wody. W obecności soli nieorganicznych o znacznych stężeniach oraz pod wpływem cieczy organicznych mieszających się z wodą glikogen łatwo ulega wytrąceniu z roztworu.
-W procesie fosforolizy czyli glikogenolizy zachodzi odłączanie cząsteczek glukozy od łańcucha glikogenu. Reakcję katalizuje fosforylaza glikogenowa:
(C6H12O6),, — +Pi—fosforylaza glikogenowa ——> glukozo-1-fosforan — fosfoglukomutaza-—» glukozo-6-fosforan— odjęcie Pi — glukozo-6-fosfataza —> glukoza C6H12O6
4'. Wymień dwie drogi rozpadu polisacharydów, nazwy enzymów i powstających
produktów oraz ich wzory. Która z dróg jest bardziej korzystna energetycznie? Napisz reakcję katalizowaną przez fosfofruktokinazę, klasę, enzym oraz znaczenie dla glikolizy.\
Fosfofruktokinaza katalizuja reakcje przemiany fruktozo-6-fosforanu do fruktozo-1,6-bifosforanu. Moment w którym działa jest najważniejszym punktem kontrolnym glikolizy:
* ATP hamuje ten enzym, a hamowanie to znosi AMP (regulacja względem zapotrzebowania energetycznego komorki)
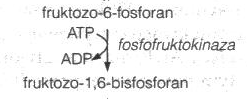
* wysoki poziom cytrynianu hamuje fosfofruktokinaze
* szybkość glikolizy maleje gdy pH znacząco się obniza (fosfofruktokina hamowana przez H+) => to zapobiega nadmiernemu tworzeniu mleczanu.
Fosfofrutkokinaza: klasa - transferaza
fruktozo-6-fosforan ↔fruktozo-1,6-bisfosforan
Przenoszenie grup funkcyjnych między związkami.
Enzymy uczestniczace w rozpadzie polisacharydow:
- w glikogenolizie to fosforylaza glikogenowa (klasa fosforylaz) i enzym usuwajacy rozgalezienia
- hydrolazy glikozydowe
- amylazy (enzymy trawienne) - rozklad skrobii i glikogenu
- celulazy rozkladaja celuloze
4". jakich prekursorów niecukrowych może być syntetyzowana glukoza? Gdzie te reakcje zachodzą? Napisz jedną z nich
Glukoza może być syntetyzowana z niektórych aminokwasów(do pirogronianu i szczawiooctanu), mleczanu (do pirogronianu) i glicerolu w procesie glukoneogenezy.
Cykl Corich`a.
Dehydrogenaza pirogronianowa przekształca odtwarzany kwas pirogronowy w acetylokoenzym A wchodzący do cyklu Krebsa. Kwas mlekowy przenika również do krwi i jest transportowany do wątroby. Tam przechodzi (utlenienie) w kwas pirogronowy a ten z kolei w procesie glukoneogenezy jest przekształcany w glukozę. Glukoza powraca do mięśni. Niewielkie ilości kwasu mlekowego wydalane są z moczem i potem
CYKL CORICHA:
1. Karboksylaza pirogronianowa:
kw pirogronowy + CO2 + ATP ↔ kw szczawiooctowy + ADP + P
2. Karboksykinaza fosfoenolopirogronianowa:
kw szczawiooctowy + GTP ↔ kw fosfoenolopirogronowy +CO2+GDP
3. Fruktozo-1,6-difosfataza:
Fruktozo-1,6-bis-P + H2O ↔ fruktozo-6-P
4,Glukozo-1- fosfataza:
glukozo-6-P + H2O ↔ glukoza
GLUKONEOGENEZA:
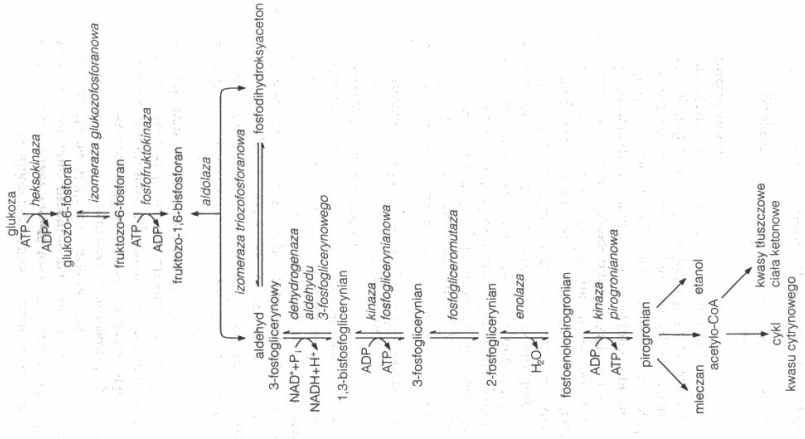
4”'. Napisz ciąg reakcji prowadzacych do przekształcenia glukozy w pirogronian, zaznacz katalizujace enzymy, jakie jest znaczenie tych przemian dla komorki. Jaka reakcje katalizuje fosfofruktokinaza, jakie jest jej znaczenie? Opisz reakcje regeneracji NADH i ich wydajnosc energetyczna.
Glukoza -> (heksokinaza) /ATP/ glukozo-6-fosforan (izomeraza glukozofosforanowa) fruktozo-6-fosforan -> (fosfofruktokinaza) /ATP/ fruktozo-1,6-bifosforan: (aldolaza) fosfodihydroksyaceton = (izomeraza triozofosforanowa) aldehyd 3-fosfoglicerynowy (dehydrogenaza aldehydu 3-fosfoglicerynowego) /NAD + Pi/ 1,3-bifosfoglicerynian (kinaza fosfoglicerynianowa) /ADP/ 3-fosfoglicerynian (fosfogliceromutaza) 2-fosfoglicerynian (enolaza) fosfoenolopirogronian /ADP/ -> (kinaza pirogronianowa) pirogronian
Rola glikolizy polega na dostarczaniu energii bezposrednio lub przez produkty dla cyklu kw cytrynowego i fosforylacjii oksydacyjnej.
4””. Określ metaboliczne losy glukozo-6-fosforanu. W jakich szlakach metabolicznych on powstaje? Dlaczego jego przemiana w pirogronian ma charakter zarówno anaboliczny jak i kataboliczny?
Glukozo-6-fosforan wykorzystywany jest w: *glikolizie; *glukoneogeniezie; *glikogenogeneza; *glikogenoliza; *szlak pentozofosforanowy
Glukozo-6-fosforan powstaje podczas: *glikolizy; *glukoneogenezy; *glikogenolizy
Jego przemiana do pirogronianu nastepuje podczas glikolizy.
Kataboliczny charakter: fruktozo-6-fosforan =>(fosfofruktokinaza) /ATP/ADP/ => fruktozo-1,6-bifosforan.
Anaboliczny: w dalszych procesach w czasie których są wytwarzane czasteczki ATP.
4””' .Dlaczego glukoneogeneza nie jest odwroceniem procesow glikolizy? Odpowiedz uzasadnij reakcjami. Dlaczego glukoza nie może być wytwarzana w mozgu i miesniach?
3 nieodwracalne reakcje z glikolizy omijane w glukoneogenezie:
1. glukozo-6fosforan + h2o -(glukozo6-fosfataza)-> glukoza + Pi
cytozol -------------------------------------------- cytozol
2.fruktozo1,6bisfosforan + h2o—(fosfataza 1,6bisfruktozy)->fruktozo6fosforan + Pi
GLIKOLIZA |
GLUKONEOGENEZA |
Heksokinaza |
Glukozo-6-fosfataza |
Fosfofruktokinaza |
Frukto-1,6-bisfosforan |
Kinaza pirogronianowa |
Karboksylaza PEP Karboksylaza pirogronianowa |
3. pirogronian + co2 + ATP + h2o - (karboksylaza pirogronianowa)szczawiooctan + ADP+Pi + 2h+ + GTP
(||)karboksykinaza PEP
PEP (fosfoenolopirogronian)
Pirogronian + ATP+GTP+H2O->PEP+ADP+GDP+Pi+2H+
Reakcja sumaryczna:
2 cz. Pirogronianu +4ATP+2GTP+2NADH+6H2O->glukoza+2ADP+2GDP+6Pi+2NAD+2H+
Glukoza nie może być wytwarzana w mozgu i miesniach bo:
- w mozgu i miesniach brak glukozo-6-fosfatazy, która jest enzymem katalizujacym powstanie glukozy z glukozo-6-fosforanu.
4”””.Omow losy metaboliczne pirogronianu. Z jakich substratow on powstaje? Napisz odpowiednie reakcje laczace metabolizm aminokwasow z metabolizmem weglowodanow i scharakteryzuj enzymy katalizujace te reakcje. Przedstaw reakcje, dzieki ktorej możliwa jest synteza glukozy z pirogronianu.
Pirogronian powstaje podczas glikolizy.
Jego dalsze losy to:
- wejscie do cyklu kw cytrynowego
pirogronian + NAD+ + CoA ->(dehydrogenaza pirogronianowa) acetylo-CoA + CO2 + NADH
- przemiana w kw tluszcz lub ciala ketonowe (pirogronian uczestniczy w tych reakcjach jako acetylo-CoA)
- przemiana w mleczan - podczas tej reakcji nastepuje regeneracja NAD+ w warunkach beztlenowych (w miesniu podczas energicznego skurczu)
- przemiana w etanol - u drozdzy i pewnych mikroorganizmow glikoliza przebiega w warunkach beztlenowych (na drodze fermentacji alkoholowej)
pirogronian + H+ ->(dekarboksylaza pirogronianowa) aldehyd octowy + CO2
aldehyd octowy + NADH + H+ <->(dehydrogenaza alkoholowa) etanol + NAD+
Glownym substratem, z którego powstaje pirogronian jest glukozo-6-fosforan
Aminokwasy mogą być rozkladane do pirogronianu, alfa-ketoglutaranu, bursztynylo-CoA, fumaranu i szczawiooctanu sa nazywane glukogennymi (mogą brac udzial w syntezie glukozy)(tutaj cos o transaminacji). Metabolito cyklu kw cytrynowego i pirogronian przeksztalcane w fosfoenolopirogronian, a ten w drodze glukoneogenezy w glukoze.
4”””'. Podaj reakcje wiążące szlak pentozofosforanowy z glikolizą. Jakie enzymy je katalizuja , do jakiej klasy należą.
Są to reakcje, przekształcające glukozo-6-fosforan przy udziale transkatalazy i transaldolazy we fruktozo-6-fosforan i aldehyd 3-fosfoglicerynowy, które są intermediatami glikolizy. Gdy jest zapotrzebowanie na NADPH w kom, to produkty szlaku pentozofosforanowego włączają się do glikolizy.
Transketolaza i transaldolaza należa do klasy transferaz
4*. Napisz sumaryczną reakcję przekształcania glukozy w pirogronian oraz reakcje przeniesienia fosforanu występujące podczas tych przemian. Zaznacz enzym ją katalizujący. Które z tych reakcji są nieodwracalne? Napisz reakcje łączącą glikolize z CKT.
Glukoza + 2Pi + 2ADP + 2NAD+-->
-->2 cz. pirogronianu + 2ATP + 2NADH + 2H+ + 2H2O
Przesunięcie fosforanu:
reakcja 7 glikolizy: fosfogliceromutaza zmienia 3-fosfoglicerynian
w 2-fosfoglicerynian
Przeniesienie fosforanu:
r1: heksokinaza, glukoza w glukozo-6-fosforan (nieodwr.)
r3: fosfofruktokinaza, fruktozo-6-fosforan w fruktozo-1,6-bisfosforan (nieodwr.)
r6: kinaza fosfoglicerynianowa, 1,3-bisfosfoglicerynian w 3-fosfoglicerynian
r9: kinaza pirogronianowa, fosfoenolopirogronian w pirogronian (nieodwr.)
Reakcja glikolizy + CKT:
Pirogronian + CoA + NAD+ --> Acetylo-CoA + NADH + CO2
Acetylo-CoA + Szczawiooctan + H2O --> Cytrynian + CoA + H+
4.Napisz reakcję fosforolitycznego rozszczepienia glikogenu. Dlaczego reakcja ta jest korzystna energetycznie? (10 pkt.)
Fosforylaza glikogenu (ang. glycogen phosphorylase) - enzym klasy transferaz (EC 2.4.1.1) katalizujący odłączanie cząsteczek glukozy (w postaci glukozo-1-fosforanu) od łańcucha glikogenu w procesie fosforolizy, czyli pierwszy etap glikogenolizy. To odłączenie glukozo-1-fosforanu nazywa się fosfolitycznym rozszczepieniem glikogenu i jest korystne energetycznie, gdyż związek ten wchodząc w przemiany glikolityczne nie musi być ufosforylowany, tym samym nie zużywa cząsteczki ATP. Fosforylaza glikogenu może usuwać tylko te reszty glukozy, które są oddalone od miejsca rozgałęzienia o więcej niż cztery reszty glukozy. Działa ona do chwili gdy produktem końcowym jest cząsteczka zbudowana z ośmiu glukoz.
5. Wymień różnice występujące w budowie RNA i DNA. Co to jest replikacja, transkrypcja, translacja
Transkrypcja jest pierwszym etapem ekspresji genow, polega na "przepisaniu" kolejno zasad z DNA na RNA. Proces ten jest katalizowany przez polimeraze RNA - enzym, ktory przyczepia sie do DNA na poczatku genu i syntetyzuje RNA komplementarne do jednej z nici. Tak powstaly RNA (po dodatkowej obrobce) w pozniejszym etapie ekspresji materialu genetycznego stanowi matryce, na ktorej syntetyzowane sa bialka. Transkrypcja, obok translacji, jest zatem kluczowym procesem warunkujacym zycie organizmow. Dzieki niej mozliwe jest odczytanie informacji genetycznej, zachowujac jednoczesnie nienaruszalnosc centralnego banku informacji - podwojnej helisy DNA.
Replikacja to proces, w którym podwójna nić DNA ulega skopiowaniu. Replikacja jest semikonserwatywna - w każdej z dwóch uzyskanych podwójnych nici DNA będzie jedna nić macierzysta i jedna nowa. Nie licząc niewielkiej szansy wystąpienia błędu obie cząsteczki DNA będą identyczne.
Enzymy katalizujace replikacje: polimeraza alfa - replikuje chromosomowy DNA i syntetyzuje nic opozniona; polimeraza beta - replikuje chromosomowy DNA i syntetyzuje nic wiodaca; polimerazy alfa i beta - uczestnicza w procesach naprawy DNA; polimeraza beta - replikuje mitochondrialny DNA; telomeraza - synteza koncow telomerowych; helikazy - rozplataja helise DNA.
Translacja - proces zachodzący na rybosomach, polegający na przetłumaczeniu informacji zawartej w mRNA w kolejności ułożenia nukleotydów, tworzących kodon, na kolejność ułożenia aminokwasów w białku. Translacja odbywa się na mRNA w kierunku od 5' do 3', a syntezowane białko powstaje od końca aminowego do karboksylowego. Proces składa się z trzech etapów: inicjacji, elongacji i terminacji.
DNA:
Nukleozyd = cukier + zasada azotowa wiązanie miedzy zasada a cukrem to wiązanie N-glikozydowe
Końce 5' leżą na przeciwległych końcach
Kwas DNA w wyższe temperaturze ulega topnieniu i następuje rozpad II rzędowej struktury DNA (mostki wodorowe zaczynają się rozpadać)
kz - tysiące par zasad lub w mikrometrach
Wydłużanie zawsze zachodzi od 5' 3'
DNA jest jeden
Replikacja - podwojenie ilości DNA w komórce
Transkrypcja
Translacja - tłumaczenie (przepisywanie na białko)
Enzym odwrotna transkryptaza (RNA-DNA polimeraza) u niektórych wirusów Np. zarażenie wirusem HIV
Replikacja DNA
Polimeraza DNA1 - enzym
RNA:
Synteza RNA
Polimeraza RNA zależna od DNA
Polimeraza RNA katalizuje inicjacje syntezy i stopniowe wydłużanie łańcuchów RNA.
Wszystkie 3 rodzaje komórkowego RNA tj. mRNA, tRNA i rRNA syntetyzowane są u E.Coli przez ta sama polimerze DNA, zgodnie z w matrycy DNA
Z |
DNA |
|
Cukier zawarty w RNA to ryboza niepozbawiona gr. hydroksylowej - ryboza zawiera grupę -OH w miejscu atomu wodoru deoksyrybozy |
Cukier - deoksyryboza |
|
Zamiast tyminy jest uracyl |
Zasady: puryny (AG) lub pirymidyny (CT) |
|
RNA ma strukturę łańcuchową - jedna nić |
Struktura alfa-helis - wieloniciowe |
|
RNA jest kilka -> rRNA - rybosomowy tRNA - transportujący mRNA - informacyjny (Messenger)
|
DNA jest jeden |
|
Połączenie nukleotydów: grupa fosforanowa łączy atom węgla 5'-rybozy z atomem 3'-rybozy sąsiedniego nukleotydu. |
||
W odpowiednich warunkach pojedyncze nici RNA i DNA o komplementarnych sekwencjach mogą utworzyć podwójną helisę RNA-DNA. Wtedy uracyle RNA łączą się z adeninami DNA, zaś adeniny RNA z tyminami DNA. |
||
Do syntezy łańcucha RNA potrzeba Wszystkich 4 aktywnych prekursorów 5'-fosforanow rybonukleozydow ATP, GTP, UTP, CTP Dwuwartościowego jonu metalu Mg2+ lub Mn2+ Matrycy - optymalna matryca jest dwuniciowy DNA
|
Do syntezy łańcucha DNA potrzeba: Wszystkich 4 aktywowanych prekursorów 5'trifosforanow deoksyrybonukleozydow dATP, dGTP, dTTP, dCTP Odcinek starterowy (primer) gdyż polimeraza DNA1 dołącza deoksyrybonukloezydy do wolnej grupy 3'-hydroksylowej już istniejącego odcinka DNA Matryce DNA - może być 1 lub 2 niciowy DNA
|
|
Polimeraza RNA nie wymaga odcinka starterowego (primera)
Synteza RNA na matrycy DNA jest w pełni konserwatywna, synteza RNA jest semikonserwatywna
Polimeraza RNA nie ma aktywności nukleazowej, która polimeraza DNA wykorzystuje do usuwania błędów
5”. Podaj wzor jednej z podstawowych jednostek DNA. Opisz molekularny mechanizm replikacji DNA. Omów glowne cechy kodu genetycznego. Wyjasnij dlaczego geny eukariontow sa nieciagle.
Deoksyguanozynomonofosforan:
Helikaza DNA z ATP rozplata DNA i rozrywa w. wodorowe laczace ze soba obie nici. Do zasad przylaczaja się bialka DBP lub SSB (zapobiegaja ponownemu zlaczeniu się nici DNA). W oczkach replikacyjnych zachodzi replikacja w obu kierunkach nici. Dobudowa nowych nukleotydow nastepuje w kierunku 5'->3'. Powstaja 2 nowe nici wiodaca i opozniona (powstala z laczacych się ze soba fragmentow okazaki). Synteza nici opoznionej przez polimeraze DNA , a wiodacej przez polimeraze DNA δ. Uszkodzone lub blednie przylaczone nukleotydy naprawiane dzieki mozliwosci cofniecia się polimerazy DNA δ. Konce 3'OH nici nie ulegaja replikacji, po kazdym procesie DNA jest krotsze, ale przeciwdziala temu telomeraza która dobudowuje brakujacy fragment.
Cechy kodu genetycznego:
- trojkowy - 1 aminokwas kodowany przez 3 nukleotydy
- ciagly - informacje są zapisane bez przerw i wszystkie kolejne trojki koduja okreslone aminokwasy
- uniwersalny - bez względu na rodzaj organizmu jego konstrukcja i mechanizm dzialania są jednakowe
- zdegenerowany - jeśli 1 aminokwas kodowany przez kilka trojek, to najwazniejsze i nie zmieniajace się są 2 pierwsze zasady, a trzecia jest różną. Chroni to organizm przed mutacjami punktowymi.
-niezachodzący
-bezprzecinkowy
-jednoznaczny - jedna trójka - jeden aminokwas
KODON- (trójpeptyd, trójka kodująca), 3 kolejne leżące obok siebie nukleotydy w DNA lub mRNA, stanowiące podstawową jednostkę informacyjną, wyznaczające jeden aminokwas lub sygnał zakończenia translacji
ANTYKODON - pętla II - antykodonowa tRNA zawiera 7 zasad z czego 3 środkowe tworzą antykodon umożliwiający rozpoznawanie kodonów mRNA , są komplementarne do kodonu aminokwasu transportowanego przez tRNA
5”'.Porównaj rozkład z syntezą kwasów tłuszczowych
Synteza kwasów tłuszczowych zachodzi na drodze hydrolizy lipidów, natomiast na ich rozkład na drodze B-utleniania.
Synteza kwasów tłuszczowych zachodzi w cytozolu komórek prokariotycznych i eukariotycznych. Związkiem redukującym jest NADPH, a powstaje NADP+. Podczas syntezy kwasy tłuszczowe są kowalencyjnie związane z nośnikiem grup acylowych (ACP). U wyższych organizmów poszczególne aktywności enzymatyczne występują w pojedynczym łańcuchu polipeptydowym, tworząc kompleks syntazę kwasów tłuszczowych.
Rozpad kwasów tłuszczowych zachodzi w mitochondriach komórek eukariotycznych. Wykorzystywane jest FAD+ oraz NAD+, natomiast powstaje FADH2 oraz NADH. Podczas rozpadu kwasy tłuszczowe wiążą się z CoA. W cyklu B-Oksydacji poszczególne aktywności enzymatyczne są związane z odrębnymi enzymami
6. Scharakteryzuj na wybranym przykładzie zaleznosci wystepujace miedzy struktura, a funkcja bialek.
Zależności te wystepują ze względu na zmienna strukture IV-rzedowa białek, która zależy od różnych warunków. Przykładem może być aktywne białko transportujące tlen - hemoglobina. Działa ona na zasadzie allosterii, czyli odwracalnej modyfikacji struktury wtórnej pod wpływem efektorów allosterycznych.
Hemoglobina ma znaczne powinowactwo do tlenu w płucach, a bardzo małe w tkankach peryferyjnych. Hb składa się z 4 łańcuchów peptydowych otaczajacych 1 grupe hemu (może wiązać 4 cząsteczki tlenu). O2 wiaze się z Fe2+ (który wchodzi w sklad Hb) za pośrednictwem bliskosci histydyny. Histydyna z innego heliksu Hb łączy się bezpośrednio z O2 i ochrania grupę hemową przed utlenieniem Fe2+ do Fe3+ (żeby nie straciły zdolnosci wiązanai O2) => Zmiana w strukturze nastepuje przez przesuniecie się histydyny z jednego heliksu.
6' .Funkcje Ogólne:
- kataliza enzymatyczna
- transport i magazynowanie
# przenoszenie tlenu przez hemoglobine
# transport tlenu w miesniach przez mioglobine
# transport zelaza we krwi przez transferyne
- ruch uporzadkowany
# bialkowe uklady kurczliwe odpowiedzialne za ruch miesni, chromosomow, plemnikow
- funkcje mechaniczno-strukturalne
# kolagen, bialko fibrylarne, zapewniajace elastycznosc miesni i tk kostnej
- ochrona immunologiczna - przeciwciala
- wytwarzanie i przekazywanie impulsow nerwowych
# acetylocholina - przekazywanie impulsow w synapsach
# rodopsyna - fotoreceptorowe bialko wystepujace w kom precikowych siatkowki
- kontrola wzrostu i roznicy
# bialka represorowe (wyciszaja niektóre fragmenty DNA)
# hormony np. insulina czy hormon tyreatropow
6”. Omów hormonalną regulacje metabolizmu - insulina:
>hormon białkowy o masie 6 kDa wydzielany przez kom. trzustki. Wydzielanie jest stymulowane przez glukozę i część przywspólczoną a. u. n.
>sygnalizuje stan nasycenia org. substratami energ. ,stymuluje ich magazynowanie oraz syntezę białek różnymi drogami,
>stymuluje syntezę glikogenu w mięśniach i wątrobie, hamuje glukoneogeneze w wątrobie. Stymuluje glikolize w wątrobie co zwieksza synteze kw.tłuszcz.
>powoduje wnikanie glukozy do kom. miesni i tk. tłuszcz.
- glukagon:
>polipeptydowy hormon o masie 3,5 kDa wydzielany przez kom. -trzustki w odpowiedzi na niewielkie stężenie cukru we krwi i działający na wątrobę,
>stymuluje rozklad glikogenu, hamuje synteze kw. tluszcz, stymuluje glukoneogeneze, hamuje glikolize,
>zwieksza synteze AMP w kom. tłuszcz. czym aktywuje lipaze stymulującą rozklad triacylogliceroli
- adrenalina i noradrenalina:
>hormony katecholaminowe, wydzielane przez rdzeń nadnerczy i zakończenia nerwowe układu współczulnego w odpowiedzi na małe stężenie glukozy we krwi,
>stymulują mobilizację glikogenu i triacylogliceroli
>adrenalina stymuluje wydzielanie glukagonu, hamuje wydzielanie insuliny. Zwiększają ilość glukozy wydzielanej do krwi przez wątrobę, a zmniejszają wykorzystanie jej przez mięśnie
6”'. Scharakteryzuj główne poziomy organizacji łańcucha polipeptydowego. Jakie oddzialywania decyduja o przestrzennej architekturze bialek?
Struktura I-rzedowa: okreslana przez kolejnosc aminokwasow w peptydzie (liniowo ulozone aminokwasy)
Struktura II-rzedowa: zwiniecie lancucha polipeptydowego (struktury I-rzedowej) w formie alfa-helisy (spirali) lub beta-harmonijki (tworzy strukturę płaską)
Struktura III-rzedowa: polipeptyd zwiniety i skrecony w przestrzeni
Struktura IV-rzedowa: złączenie się kilku lancuchow peptydow o strukturze III-rzedowej
Oddzialywania:
- w I-rzedowej: w. peptydowe
- w II-rzedowej: w. wodorowe (b. Slabe)
- w III-rzedowej: w. wodorowe, jonowe, estrowe, tioestrowe, disulfidowe, sily van der Waalsa
- w IV-rzedowej: w. disulfidowe, chelatowe, sily van der Waalsa
Alfa-heliks: (prawoskrętna spirala), `ciasno upakowana'
Na jeden skręt przypada 3,6 reszt aminokwasowych. Łańcuch peptydowy rozwinięty jakby wzdłuż walca, a łańcuchy boczne na zewnątrz. Helisę stabilizują wiązania wodorowe między NH i CO głównego łańcucha. Grupa CO każdego aminokwasu wiąże się wiązaniem wodorowym z grupą NH aminokwasu znajdującego się o 4 reszty aminokwasowe do przodu.
Przeważa w mioglobinie i hemoglobinie.
Beta harmonijka-: `rozciągnięta'
Stabilizowana jest wiązaniami wodorowymi pomiędzy grupami CO i NH, należącymi do odrębnych łańcuchów polipeptydowych.
Tylko w formie jedwabiu.
6””. Scharakteryzuj główne etapy metabolizmu białek.
Biosynteza białek - translacja składa się z 3 etapów: inicjacja, elongacja, terminacja.
Inicjacja - przyłaczenie inicjatorowego tRNA do startowego kodonu mRNA. Inicjatorowy tRNA zajmuje na rybosomei miejsce P (peptydylowe).
Elongacja - aminoacylo tRNA przyłacza się do rybosomu w miejscu A (aminoacylowym). Tworzy się wiazanie peptydowe miedzy grupa aminowa aminoacylo - tRNA a grupa karboksylowa formylometioniny związanej z inicjatorowym tRNA. Dipeptydylo - tRNA przeniesiony z miejsca A na P, a inicjatorowy tRNA z miejsca P na E i opuszcza rybosom. Następuej hydroliza GTP (wytworzenie energii potrzebnej do przyłaczenia tRNA, przeniesienia go i przesuniecia rybosomu na następny kodon mRNA). Cykl elongacji powtarza się.
Terminacja - odczytanie kodonu „stop” na mRNA i uwolnienie ukonczonego polipeptydu z rybosomu.
Synteza oligosacharydu na drodze glikozylacji.
6*.Podaj przykłady enzymów i innych białek ulegających aktywacji w wyniku specyficznej proteolizy. Jakie inne czynniki regulują aktywność enzymów?
Trypsyna - zostaje aktywowana z trypsynogenu po usunięciu z łańcucha pewnych peptydów blokujących jej aktywność;
ogólnie enzymy są zazwyczaj aktywowane z formy proenzymów lub zymogenów w wyniku proteolizy - następuje odblokowanie centrum aktywnego danego enzymu
Czynniki:
- sprzężenie zwrotne
- białka regulatorowe
7.Napisz reakcję zapoczątkowującą cykl Krebsa oraz wzory dwóch produktów pośrednich tego cyklu, które mogą ulec przemianie do aminokwasów. W jakiego typu reakcjach?
Zapoczątkowuje: Syntaza cytrynianowa
Bezpośrednio w aminokwasy mogą przejść szczawiooctan i alfa-ketoglutaran. Odbywa się to na drodze transaminacji glutaminianu.
Szczawiooctan + glutaminian asparaginian + alfa-ketoglutaran
Na drodze kondensacji:
Bursztynylo CoA + glicyna -> parafiny
7'.Napisz reakcję zapoczątkowującą cykl Krebsa oraz wzory dwóch produktów pośrednich tego cyklu, które mogą ulec przemianie do aminokwasów, w jakiego typu reakcjach? Podaj reakcję sumaryczną CKTK oraz dwie funkcje tej przemiany
Glowna funkcja cyklu kw. cytrynowego jest utlenianie pirogronianu (wytwarzanego podczas glikolizy) do CO2 i H2O z jednoczesnym uzyskiwaniem energii. Cykl ten również odgrywa role w wytwarzaniu prekursorow dla szlakow biosyntez.
Dehydrogenazy: izocytrynianowa, alfa-ketoglutaranowa, bursztynianowa, jablczanowa.
Bezpośrednio w aminokwasy mogą przejsc szczawiooctan i alfa-ketoglutaran. Odbywa się to na drodze transaminacji glutaminianu.
R.sumarczyna:
Cykl kwasu cytrynowego zaczyna się od kondensacji związku czterowęglowego , szczawiooctanu z dwuwęglowym fragmentem acetylowym , acetylo-CoA. Szczawiooctan reaguje z acetylo-CoA i H2O, tworząc cytrynian i CoA.
7. Napisz reakcje cyklu kw. cytrynowego kontrolujace szybkosc dzialania tego szlaku i omow ich znaczenie dla metabolizmu organizmu zwierzecego.
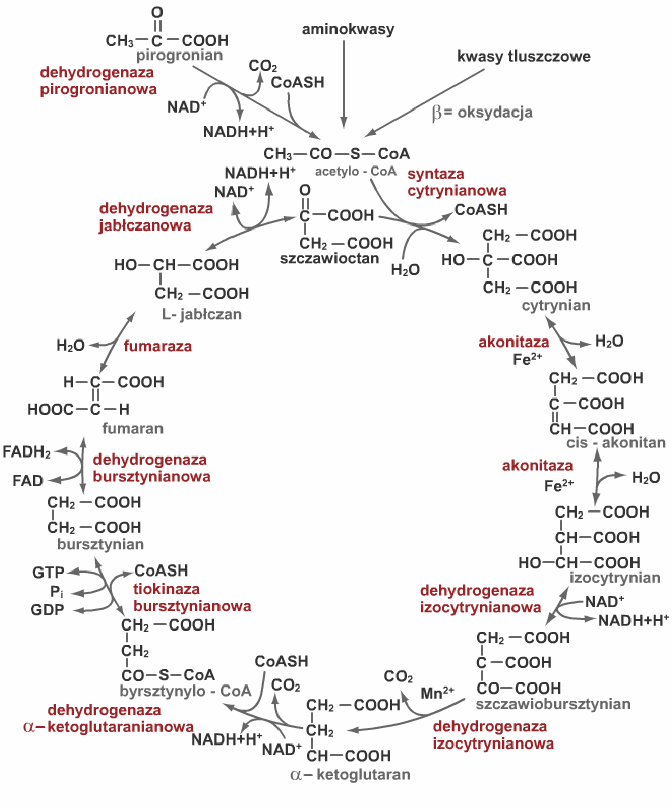
Sa to nastepujace reakcje:
-Acetylo-CoA ->(syntaza cytrynianowa) cytrynian
-Izocytrynian ->(NAD+, dehydrogenaza izocytrynianowa, wydzielany CO2) alfa- ketoglutaran
-Alfa-ketoglutaran ->(NAD+, wydzielany CO2, dehydrogenaza alfa-ketoglutaranowa) bursztynylo-CoA
-Syntaza cytrynianowa hamowana przez ATP i cytrynian; dehydrogenaza izocytrynianowa hamowana przez ATP i NADH, a stymulowana przez ADP; dehydrogenaza alfa-ketoglutaranowa hamowana przez bursztynylo-CoA i NADH.
-Pirogronian ->(wydzielenie NADH i CO2) acetylo-CoA
Ta reakcja hamowana przez ATP, acetylo-CoA i NADH.
Znaczenie tych reakcji. Produkty i substraty wykorzystywane sa w wielu szlakach biosyntez, np.:
- synteza kw tluszcz z cytrynianu
- synteza aminokwasow nastepujaca po transaminacji alfa-ketoglutaranu
- synteza nukleotydow purynowych i pirymidynowych z alfa-ketoglutaranu
8. Podaj sumaryczna reakcje CKTK oraz dwie funkcje tej przemiany i nazwy dehydrogenaz. Napisz jedna z reakcji. Podaj nazwy dwoch produktow posrednich, które mogą bezposrednio przejsc w aminokwasy i w jakiego typu reakcjach?
Glowna funkcja cyklu kw cytrynowego jest utlenianie pirogronianu (wytwarzanego podczas glikolizy) do CO2 i H2O z jednoczesnym uzyskiwaniem energii. Cykl ten również odgrywa role w wytwarzaniu prekursorow dla szlakow biosyntez.
Dehydrogenazy: izocytrynianowa, alfa-ketoglutaranowa, bursztynianowa, jablczanowa.
Bezposrednio w aminokwasy mogą przejsc szczawiooctan i alfa-ketoglutaran. Odbywa się to na drodze transaminacji glutaminianu.
Szczawiooctan + glutaminian asparaginian + alfa-ketoglutaran
Na drodze kondensacji:
Bursztynylo CoA + glicyna -> parafiny
9.Napisz reakcje prowadzace do wydalania nadmiaru grup NH4 z organizmu kregowcow ladowych.
Kregowce ladowe nadmiar azotu przeksztalcaja w amoniak, który w cyklu mocznikowym przeksztalcany w mocznik i w tej postaci wydalany z organizmu.
2ATP + HCO3 + amoniak ->(syntetaza karbamoilofosforanowa) karbamoilofosforan
...ornityna ->(+karbamoilofosforan, karbamoilotransferaza ornitynowa, wydzielenie Pi) cytrulina ->(+asparaginian, ATP do ADP =Ppi, syntetaza argininobursztynianowa) argininobursztynian ->(wydzielenie fumaranu, liaza argininobursztynianowa) arginina ->(+H2O co powoduje wydzielenie mocznika, arginaza) ornityna... i tak do usranej śmierci
9'.W jakich przedzialach kom zachodza poszczegolne reakcje wydalania nadmiaru grup NH4? W jakim organie przebiega synteza mocznika?
Synteza mocznika przebiega w watrobie na drodze cyklu mocznikowego. Poszczegolne reakcje tego cyklu zachodza w mitochondrium (ornityna + karbamoilofosforan -> cytrulina) i cytozolu (reszta reakcji - sa wczesniej)
10. Wymień alfa-ketokwasy powstałe w wyniku transaminacji alaniny, glutaminy i asparaginianu. Odpowiedź poprzyj wzorami.
Asparaginian - szczawiooctan. Alanina - pirogronian. Glutamina - alfa-ketoglutaran.
10'.W jaki sposób można wyrażać aktywność enzymów:
- jednostka standardowa (uniwersalna) - za taką jednostkę przyjęto tę ilość enzymu, która katalizuje przemianę 1 umola substratu w ciągu 1 minuty, w temperaturze 30 C i optymalnych warunkach pH oraz stężenia substratu,
- katal - jest to taka ilość enzymu, która w ciągu 1 sekundy w tem. 30 C i optymalnych warunkach pH oraz stężenia substratu powoduje przemianę 1 mola substratu. Ponieważ jest to bardzo duża jednostka więc zwykle używa się jej podwielokrotności, np. .mikro- lub nanokatala.
- aktywność molekularna - jest to ilość mmoli substratu przekształcona w ciągu 1 minuty w standardowych warunkach przez 1 umol enzymu (w odniesieniu do jednego centrum aktywnego, jeżeli enzym zawiera ich więcej).Ten sposób wyrażania aktywności można jednak stosować tylko wtedy, gdy znana jest masa cząsteczkowa enzymu i liczba centrów aktywnych.
- aktywność właściwa - oznacza się nią ilość białka w badanym materiale i jego aktywność, określa ona liczbe jednostek enzymu na 1 mg białka.
10. Scharakteryzuj zasadnicze różnice pomiędzy metabolizmem mózgu, mięsni i wątroby. Jakie będą konsekwencje zahamowania aktywności jednego z enzymów:
heksokinazy w tkance tłuszczowej (nie bedzie mogła przebiegać glikoliza)
- acetylotransferazy karnitynowej w mięśniach szkieletowych (nie będzie syntezy lipidow)
- glukokinazy w wątrobie (nie będzie mogła przebiegać synteza glukozy)
a) MÓZG - wyłącznym substratem energetycznym jest glukoza;
- brak zapasów energetycznych, wymaga więc stałego dopływu glukozy (zużycie ok. 120g/dobę)
- podczas okresów długotrwałego głodowania substratami energetycznymi moga być ciała ketonowe wytwarzane przez wątrobę
b) MIĘŚNIE - substratami energetycznymi są glukoza, kwasy tłuszczowe oraz ciała ketonowe (w mięśniu sercowym)
- duże zapasy glikogenu
- nie zawiera glukozo-6-fosfatazy, więc nie możliwy eksport glukozy
- w mięśniu pracującym aktywnie szybkość glikolizy znacznie przekracza szybkość cyklu Krebsa (redukcja pirogronianu do mleczanu, który po przejściu do wątroby może przekształcać się w glukozę lub transaminacji do alaniny)
c) WĄTROBA - dostarcza substraty energetyczne do mózgu, mięśni i innych organów peryferyjnych
- może pobierać duże ilości glukozy i przekształcać w glikogen
- rozkładając zapasy glikogenu i wykorzystując szlak glukoneogenezy może uwalniać glukozę do krwi (prekursorami glukozy są mleczan i alanina, glicerol i aminokwasy glukogenne)
- paliwem dla wątroby są ketokwasy pochodzące z rozkładu aminokwasów, a gdy ich brak, wykorzystywana jest glukoza
- nie może wykorzystać acetooctanu jako paliwa, gdyż nie zawiera transferazy przekształcającej ten związek w jego aktywną formę - acetylo-CoA)
- 9 -
Wyszukiwarka