R6-R7
Jakie są różnice między ogniwem galwanicznym a elektrolizerem?
Ogniwo galwaniczne wytwarza energię elektryczną w wyniku przebiegającej w nim samorzutnej reakcji chemicznej. W elektrolizerze przebieg niesamorzutnej reakcji zostaje wymuszony przez przyłączenie elektrod do zewnętrznego źródła prądu stałego.
W reakcji siarczku miedzi(II) z tlenem wskazać, które substancje uległy utlenieniu, a które redukcji?
CuS (s) + O2 (g) → Cu (s) + SO2 (g)
redukcji : Cu (II), O
utlenieniu : S2- do S (IV)
Jaka jest umowa dotycząca zapisu reakcji cząstkowych utleniania i redukcji?
Przyjęto umowę, by wszystkie reakcje cząstkowe zapisywać jako reakcje redukcji, a więc reakcję utleniania zapisujemy jako odwrotną reakcję cząstkową redukcji. Pełna reakcja redoks jest zatem różnicą dwóch cząstkowych reakcji redukcji.
Podać symboliczny schemat półogniwa wodorowego, cząstkową reakcję półogniwa i iloraz reakcji
Pt | H2 (g) | H+ (aq)
H+ (aq) + e- → ½ H2 (g)
gdzie:
Podać równanie redukcji tlenu w kwaśnym roztworze i iloraz tej reakcji
O2 (g) + 4 H+ (aq) + 4e-→ 2H2O (c)
Jaki jest schemat zapisu półogniwa drugiego rodzaju?
M | MX | X -
Wyprowadzić wzór na iloraz reakcji dla półogniwa drugiego rodzaju ołów- siarczan(VI) ołowiu(II), w którym w roztworze jonów wodorosiarczanowych zachodzi redukcja do metalicznego ołowiu
Pb (s) | PbSO4 (s) | HSO4 - (aq)
PbSO4 (s) + H+ (aq) + 2e - → Pb (s) + HSO4 - (aq)
Czym się różnią elektrolityczne ogniwo stężeniowe i elektrodowe ogniwo stężeniowe?
W elektrolitycznym ogniwie stężeniowym oba półogniwa różnią się jedynie stężeniem elektrolitu. W elektrodowym ogniwie stężeniowym same elektrody mają różne stężenia.
W jakich ogniwach stężeniowych występuje potencjał dyfuzyjny, a w jakich ogniwach stężeniowych nie występuje?
Potencjał dyfuzyjny występuje zawsze w elektrolitycznych ogniwach stężeniowych natomiast nie ma go w ogniwach stężeniowych elektrodowych.
Napisać schemat ogniwa złożonego z półogniwa wodorowego i półogniwa chlorosrebrowego
Pt | H2 (g) | HCl (aq) | AgCl (s) | Ag
Wymienić dwie funkcje klucza elektrolitycznego
Zapewnia przepływ prądu elektrycznego między półogniwami i jednocześnie uniemożliwia mieszanie się elektrolitów wchodzących w skład półogniw.
W jaki sposób można osiągnąć odwracalność procesu zachodzącego w ogniwie?
Przyłączając do jego elektrod zewnętrzne źródło napięcia (inne ogniwo lub źródło prądu stałego) o napięciu skierowanym przeciwnie i dokładnie równym napięciu wytwarzanemu przez ogniwo. Wówczas zmniejszając o nieskończenie małą wartość napięcie przyłożone z zewnątrz, wywołamy samorzutny przebieg reakcji ogniwa, zwiększając zaś infinitezymalnie napięcie zewnętrzne spowodujemy przebieg reakcji w kierunku przeciwnym.
W jaki sposób można wyznaczyć entalpię swobodną reakcji przebiegającej w ogniwie?
∆rG = -vFE
Wychodząc z równania wiążącego entalpię swobodną reakcji ze składem mieszaniny reakcyjnej, wyprowadzić równanie Nernsta
∆rG = -vFE
∆rG = ∆rG ⃚ + RTlnQ
E ⃚ = - ∆rG ⃚ / vF
E = E ⃚ - (RT/vF) * lnQ
Jak się zmieni SEM ogniwa, w którym zachodzi reakcja i ν =1, gdy iloraz reakcji wzrośnie 100 razy?
25°C → RT/F ≈ 25,7 mV
E' - E = (25,7mV)* (lnQ' - lnQ) = -(25,7mV)* ln (Q'/Q) = - (25,7mV)* ln100 =
= - (25,7mV)*4,6 = -118,22mV
Wyprowadzić z równania Nernsta równanie pozwalające przewidywać wartość stałej równowagi
Q = K
E = 0
Standardowa SEM ogniwa Daniella wynosi +1.10V. Jaka jest wartość stałej równowagi reakcji zachodzącej w ogniwie?
K = 1,5 · 1037
Wykazać, że w roztworze zawierającym jony miedzi(II) i miedzi(I) tych drugich jest zdecydowanie mniej. Eθ(Cu+, Cu)=+ 0.52V, Eθ(Cu2+, Cu)=+ 0.16V
Wyprowadzić zależność pozwalającą zmierzyć pH roztworu poprzez pomiar SEM ogniwa złożonego z półogniwa wodorowego i półogniwa kalomelowego

Standardowe potencjały par Cu2+/Cu i Cu+/Cu wynoszą odpowiednio +0.340V i +0.522V. Obliczyć potencjał standardowy pary Cu2+/Cu+.
Jakie wielkości termodynamiczne można wyznaczyć poprzez pomiar współczynnika temperaturowego SEM?
Entalpia swobodna
Entropia
Entalpia reakcji ogniwa
Wyprowadź wyrażenie opisujące potencjał półogniwa, w którym reakcją cząstkową jest redukcja jonów Cr2O72- do Cr3+ w kwaśnym roztworze
Napisać wyrażenie na potencjał pary redox MnO4-,H+/Mn2+ przy pH=6, gdy aktywności pozostałych jonów są równe1
Czy stała równowagi reakcji wypierania miedzi z roztworu cynkiem jest większa, czy też mniejsza od 1?
k>1
Jak zmienia się ciśnienie podczas przebiegu reakcji rozkładu N2O5 w fazie gazowej?
2N2O5(g)→4NO2(g) + O2(g)
Ciśnienie całkowite w stałej objętości i temperaturze w modelu gazu doskonałego jest proporcjonalne do liczby cząsteczek w fazie gazowej, zatem ponieważ z każdego mola N2O5 otrzymujemy 5/2 mola cząsteczek gazu, możemy oczekiwać, że wzrost ciśnienia wyniesie 5/2 wartości początkowej. W tym celu postęp reakcji wyrazimy jako funkcję ułamka α cząsteczek N2O5, które uległy rozpadowi.
Niech początkowe ciśnienie wynosi p0, a początkowa liczba cząsteczek N2O5 niech będzie równa n. Gdy rozkładowi ulegnie ułamek α cząsteczekN2O5 w mieszaninie reakcyjnej pozostają następujące ilości reagentów:
N2O5 NO2 O2 łącznie
Ilość n(1 - α) 2αn 1/2αn n(1+3/2α)
Gdy α - 0, ciśnienie wynosi p0, zatem na dowolnym etapie reakcji ciśnienie całkowite układu wyraża się wzorem
p= (1+3/2α)p0
Po zakończeniu reakcji ciśnienie wzrośnie do 5/2 swej wartości początkowej.
Za pomocą jakich metod można obserwować przebieg reakcji?
- metoda zamrażania
- metoda przepływowa
- zatrzymanego przepływu
- fotolizy błyskowej
Na czym polega analiza w czasie realnym?
Jest to analiza składu badanego układu w trakcie przebiegu reakcji. Pomiary można prowadzić, pobierając niewielkie ilości próbki lub też śledząc skład całego roztworu.
Na czym polega zamrożenie reakcji?
-W metodzie zamrażania reakcję prowadzi się przez pewien określony czas, a następnie gwałtownie zatrzymuje, przez nagłe ochłodzenie, wprowadzenie mieszaniny do dużej objętości rozpuszczalnika albo przez szybkie zobojętnienie kwaśnego reagenta.
Co jest niedogodnością metody przepływu?
Wadą tej techniki jest duże zużycie roztworów reakcyjnych, co nabiera szczególnego znaczenia w przypadku szybkich reakcji ponieważ aby rozciągnąć reakcję wzdłuż rury przepływowej, przepływ musi być odpowiednio szybki.
Jakie wielkości wyznacza się w metodzie zatrzymanego przepływu?
-W metodzie zatrzymanego przepływu reagenty za pomocą strzykawek wprowadza się z dużą szybkością do komory mieszania, a następnie śledzi się zmianę stężenia w czasie.
Co to jest femtosekunda?
Femtosekunda - to jednostka ułamkowa jednostki czasu
1fs =
s
Jaki jest graficzny obraz chwilowej szybkości reakcji?
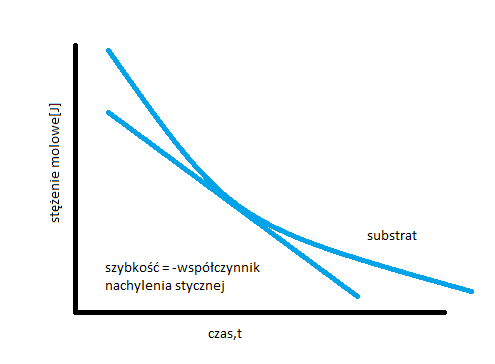
Chwilową szybkość reakcji określa styczna do krzywej wyznaczającej zmianę szybkości reakcji w czasie.
Kiedy szybkość reakcji jest równa szybkości zaniku substratu?
-spadek stężenia każdego z substratów musi skutkować proporcjonalnym spowolnieniem reakcji nawet jeśli pozostałe substraty występują w nadmiarze do niego.
Od czego zależy, a od czego nie zależy stała szybkości reakcji?
Stała szybkości reakcji jest niezależna od stężeń, a zależy od temperatury.
Co to jest równanie kinetyczne? W jaki sposób określa się wykładniki potęg w równaniu kinetycznym?
-Równanie kinetyczne jest równaniem, które wyraża szybkość reakcji chemicznej jako funkcję stężenia wszystkich reagentów występujących w stechiometrycznym zapisie reakcji chemicznej. Wykładniki potęg w równaniu kinetycznym określają stężenia reagentów reakcji.
Jaki jest wymiar stałej k w równaniu: szybkość reakcji = k[A][B]?
Jednostki stałej k wynikają bezpośrednio z równania i maja taki wymiar aby zmienić wymiar iloczynu stężeń na stężenie na jednostkę czasu (dla k=[A][B]=
)
Co to jest rząd reakcji?
-Wykładnik potęgi, do której podniesione jest w równaniu kinetycznym stężenie reagenta
W jaki sposób zapisujemy w równaniu kinetycznym niezależność szybkości reakcji od stężenia reagenta?
- w postaci stałej szybkości k, który nie jest zależny od stężeń lecz od T
Jaki jest całkowity rząd reakcji tworzenia bromowodoru w fazie gazowej?
H2+Br2=2HBr Teoretycznie 2 rzędu
Podać sposoby wyznaczania równania kinetycznego
Metoda izolacyjna w której wszystkie substraty podaje się w dużym nadmiarze z wyjątkiem 1 co upraszcza nam równanie kinetyczne reakcji
Metoda szybkości początkowych, gdzie mierzy się chwilową szybkość reakcji dla różnych stężeń początkowych substratu.
Kiedy równanie określa się równaniem reakcji pseudopierwszego rzędu?
-Kiedy rzeczywiste równanie kinetycznie sprowadzamy do postaci równania pierwszego rzędu
Jakie są oznaczenia osi na wykresie pozwalającym wyznaczyć rząd reakcji metodą szybkości początkowych, gdy izolowanym substratem jest A. Przedstawić zależności dla reakcji rzędu 1 i 2
Oś X oznaczamy:log k + a log
oś Y oznaczamy : log (
).
Zależność miedzy reakcja rzędu 1 i 2 wyznacza nachylenie linii wykresu.
Podać dwa zastosowania postaci całkowej równania kinetycznego
- Obliczanie reakcji I rzędu
-Obliczanie reakcji II rzędu
Wykazać, że dla reakcji pierwszego rzędu następuje wykładniczy zanik substratu
Wyprowadzić postać całkową równania kinetycznego reakcji drugiego rzędu
Vg
Jaką trzeba wykreślić zależność, aby wykazać, że reakcja jest drugiego rzędu?
1/[A] od t. Jeżeli otrzymany wykres będzie przedstawiał linię prostą to rząd reakcji będzie drugi, a nachylenie linii podaje wartość stałej szybkości reakcji.
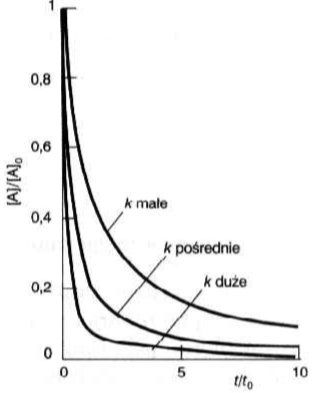
Czy czas połowicznego zaniku reakcji pierwszego rzędu zależy od stężenia początkowego substratu? Wykazać
Nie.
Wyprowadź związek między czasem połowicznej przemiany w reakcji drugiego rzędu a stałą szybkości reakcji
W chwili t = 0 stężenie A wynosi [A]0, a po czasie t wynosi [A], zatem wyrażenie to można scałkować w następujący sposób:
Ponieważ całka 1/x2 jest równa -1/x, podstawiając odpowiednie granice całkowania otrzymujemy równanie
Podstawiając w tym równaniu t = t1/2 i [A] -1/2[A]0 na czas połowicznej przemiany substratu A zanikającego w reakcji drugiego rzedu otrzymujemy wyrażenie t1/2 =
Zatem czas połowicznej przemiany zmienia się ze stężeniem początkowym.
Podać dwie postaci równania Arrheniusa. Co to są parametry Arrheniusa?
-parametry Arrheniusa:
Czynnik przedwykładniczy lub czynnik częstości
Energia aktywacji
Parametry te można uważać za wielkości empiryczne, umożliwiające analizę zmian stałej szybkości z temperaturą.
Równania Arrheniusa:
Jak się zmienia stromość (nachylenie) linii na wykresie Arrheniusa gdy Ea rośnie, a jak, gdy Ea maleje?
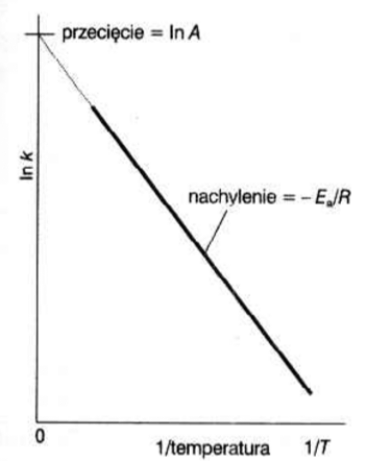
stromo kiedy energia aktywacji jest duża
przy niskiej energii aktywacji wykres jest bardziej płaski.
Podać przykład reakcji, której szybkość nie zależy od temperatury. Jaka jest energia aktywacji tej reakcji?
Przykładem jest reakcja rekombinacji rodników w fazie gazowej. Energia aktywacji natomiast jest równa zeru.
Energia aktywacji reakcji wynosi 87 kJ/mol. Jak zmieni się stała szybkości reakcji, gdy temperaturę obniży się z 37°C do 15°C?
Jaki jest ułamek zderzeń o energii wystarczającej, aby zaszła reakcja o energii aktywacji równej 50kJ/mol, gdy temperatura reakcji wynosi: a) 25°C b)500°C?
Jaki jest sens fizyczny czynnika sterycznego P w reakcjach, w których: a) P=0 b) P=10-6 c) P=5?
a)P=0 oznacza że żadna z możliwych orientacji nie pozwala na zajście reakcji
b)reakcja stawia bardzo duże wymagania co do wzajemnej orientacji czasteczek
c)oznacza że cząsteczki reagują częściej niż następuje ich kolizja
W czym tkwi wyższość teorii kompleksu aktywnego nad teorią zderzeniowa?
Wyższość polega na tym, iż teoria kompleksu aktywnego zakłada że kompleks aktywny jest tworem o określonym składzie i luźnej strukturze. Można go przedstawić jako zespół atomów z którego mogą utworzyć się produkty jak i odtworzyć substraty, nie ma przy tym charakteru produktu przejściowego który można wyizolować i badać jak inne cząsteczki.
Przedstawić profile reakcji: niekatalizowanej i katalizowanej. Opisać osie
Jakiego typu jest elementarna reakcja izomeryzacji cykloheksanu na propen? Napisać reakcję
Jest to reakcja jednocząsteczkowa (monomolekularna),pojedyncza cząsteczka rozpada się na fragmenty lub przegrupowuje tworzące ją atomy
Jaka jest różnica między rzędem reakcji a cząsteczkowością reakcji?
Rząd reakcji jest wielkością doświadczalną .Określa się ją na podstawie doświadczalnie wyznaczanego równania kinetycznego reakcji.
Cząsteczkowość reakcji można odnieść tylko do określonego typu reakcji elementarnej , która jest etapem pewnego mechanizmu reakcji.
Które stwierdzenie jest zawsze słuszne: a) jeżeli reakcja jest reakcją dwuczasteczkową, to jest reakcją drugiego rzędu, b) jeżeli reakcja jest drugiego rzędu, to jest reakcją dwucząsteczkową?
Słuszne jest stwierdzenie, że jeżeli reakcja jest reakcją dwucząsteczkową , to jest również reakcją drugiego rzędu
Na czym polega koncepcja przybliżenia stanu stacjonarnego?
Stężenia wszystkich produktów przejściowych pozostają niezmienne i małe przez cały czas przebiegu reakcji (z wyjątkiem jej stadiów początkowych i końcowych).
Dlaczego szybkość reakcji utleniania NO do NO2 maleje ze wzrostem temperatury?
2NO+O2=2NO2 reakcją przejściową jest powstanie dimeru N2O2=2NO Ka[NO]2 , reakcja jest odwracalna i szybkość reakcji odwrotnej Ka'[N2O2] określa szybkość rozpadu dimeru, dimer łączy się z tlenem i określa ją równanie Kb[N2O2][O2] sumarycznie Kpowstania NO2=2KaKb/K'a wraz ze wzrostem temperatury znaczenie szybciej rośnie K'a aniżeli iloczyn 2KaKb
Co to jest etap limitujący szybkość reakcji?
Najpowolniejszy etap w mechanizmie reakcji.
Wyszukiwarka