Termodynamika
Podejście mikroskopowe (~1023) → termodynamika statystyczna
Podejście makroskopowe → termodynamika fenomenologiczna
Układ zamknięty (nie ma wymiany materii z otoczeniem) → układ otwarty (układy biologiczne)
Zmiana stanu układu → na sposób kwazistatyczny → przez ciąg stanów równowagi
Przykład rozpuszczanie kostki lodu w szklance soku
(sok + lód)→(sok)
(sok + lód)→→→→→→→......→→→→→→→→→→→→→ →→→→→→→→→→→......→→→→→→→→→→(sok)
Gaz doskonały (1 mol): 3 parametry do opisu - p, V, T
Układ zamknięty
![]()
pV = R*T - równanie stanu gazu doskonałego
Zmienne intensywne → T, p
Zmienna ekstensywna → V
Stała - R = 8.31 J/(mol*K)
Załóżmy, że T = const
Przejście między 2 stanami „A” i „B” (pA > pB)
pAVA = pBVB
Przejście od „A” do „B” w sposób kwazistatyczny
Zmieniam wartości parametrów (p, V) o bardzo niewielka ale skończoną wartość → (dp, dV)
Symbol dx → oznacza bardzo niewielką zmianę wartości x
Rzeczywistą zmianę funkcji przybliżam przez ciąg zmian liniowych → od stanu „A” do stanu „B” przechodzę przez wiele stanów pośrednich
dp = tgα dV = (![]()
)dV
Stosunek ![]()
nazywamy pochodną funkcji p względem V → znając zależność p = f(V) mogę obliczyć pochodną (matematyka → rachunek różniczkowy) i dalej dla dowolnego dV obliczyć dp
Uogólnienie:
Dowolna funkcja y = f(x, z) → mogę obliczyć pochodną funkcji f względem x przy założeniu z = const → często stosowane oznaczenie 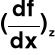
→ znając pochodną mogę dla każdego dx obliczyć dy jako
dy = 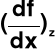
dx
Niewielka zmiana funkcji f = iloczynowi 2 wielkości f = pV
d(pV) = 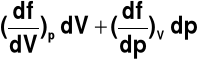
= pdV + Vdp
Funkcja f = sumie 2 wielkości
d(p + V) = dp + dV
Funkcja f = stałej
f = const → df = 0
Wielkości fizyczne wykorzystywane w termodynamice do opisu stanu układu → p, V, T
Praca → L
Praca objętościowa → L0
dLO = F*dx = 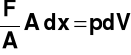
Praca przy skracaniu mięśnia o dl → dLS
dLS = F*dl
Praca dla przeniesienia ładunku dq przeciw różnicy potencjałów ψ → dLQ
dLQ = ψdq
Praca dostarczenie do układu dn moli substancji przeciw spadkowi stężenia → dLC
dLC = μdn
μ - potencjał chemiczny
Uwaga:
Interpretacja μ → gdy dn = 1 mol wtedy praca dLC = μ
Można pokazać
μi = ![]()
+ RT ln(ci)
![]()
→ standardowy potencjał chemiczny
ci → stężenie substancji „i” w roztworze
Uogólnienie → dn1, dn2, ...,dnN
dLC = 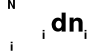
Ciepło → Q
Przykład:
Bilans cieplny
Kostka lodu (mL, TL < 273 K) umieszczam w naczyniu o temperaturze otoczenia TO > 273 K. Ile ciepła (Q) zostanie pobranego z otoczenia ?
![]()
Uwaga:
Różnica między ciepłem i praca → pojęcie energii wewnętrznej
Energia wewnętrzna → U
Mikroskopowe ruchy cząsteczek (![]()
kT dla gazu doskonałego) → wszystkie możliwe ruchy cząsteczek (drgania, rotacje, wzbudzenia)
I zasada termodynamiki
dU = dQ + dL
I zasada termodynamiki to zasada zachowania energii z uwzględnieniem równoważności ciepła i pracy
Ten sam efekt (dU) mogę wywołać dostarczając ciepło (dQ przy dL = 0) jak i wykonując pracę (dL przy dQ = 0)
Przejścia Q → L jak i L → Q zawsze odbywają się z udziałem energii wewnętrznej
Konwencja znaków
Q, L dostarczone do układu > 0
Q, L dostarczone do otoczenia < 0
Przykład:
Praca wykonana przy sprężaniu gazu
dLO = - pdV = -p*(Vkon - Vpoc)
Entropia - S
Procesy w przyrodzie są ukierunkowane i są nieodwracalne
przepływ ciepła → od cieplejszego do chłodniejszego
ruch klocka przesuwanego po stole → zamiana L → Q jest możliwa ale odwrotny proces nie jest obserwowany (Q → L)
Powstaje problem jak sprawdzić czy dany proces w przyrodzie będzie przebiegać samorzutnie
Wprowadzam nową wielkość fizyczną, której zmiany pozwolą określić możliwość samorzutnego przebiegu procesu
Rozważmy 2 naczynia zawierające 6 cząsteczek (mikroskopowo)
Na ile sposobów mogę zrealizować określony stan układu
A = 6, B = 0 W = 1
A = 5, B = 1 W = 6
A = 4, B = 2 W = 15
A = 3, B = 3 W = 20
A = 2, B = 4 W = 15
A = 1, B = 5 W = 6
A = 0, B = 6 W = 1
W sumie istnieją 64 możliwe stany
Zgodnie z naszą intuicją równy rozkład jest najbardziej prawdopodobny
Prawdopodobieństwo określonego stanu
Moneta → p = ½
Kostka → p = 1/6
![]()
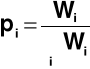
Stan 6 cząstek w naczyniu A
1 stan → p = ![]()
Podział 3 + 3
20 stanów → p = ![]()
Uwaga:
Układy makroskopowe składają się z bardzo dużej liczby cząstek (~1023) → bardzo duża liczba możliwych stanów → dla 20 cząstek stan 10+10 mogę zrealizować na 184756 sposobów a stan 20+0 tylko na jeden → niektóre W mogą być bardzo dużymi liczbami inne bardzo małymi → bardzo duże różnice w wartościach p
Definiuje entropię
S = k ln(W)
k = 1.38*10-23 J/K → stała Boltzmanna
Dwa stany → W1 (początkowy) i W2 (końcowy)
dS = S2 - S1 = 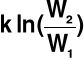
→ > 0, 0, <0
II zasada termodynamiki
Procesy w przyrodzie są ukierunkowane. Układ dąży od stanów mniej prawdopodobnych do bardziej prawdopodobnych. Procesy zachodzą w przyrodzie samorzutnie gdy towarzysząca im zmiana entropii (dS) jest dodatnia
dS > 0
Dla rozważanego układu → dążenie do stanu 3 cząstki w A i 3 cząstki w B
Definicja makroskopowa entropii
Można pokazać, że dla zamkniętego układu z kwazistatycznym przepływem ciepła dQ w procesie odwracalnym związana jest zmiana entropii dS
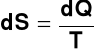
Idealizacja:
1) pojęcie procesu odwracalnego
2) kwazistatyczne przeniesienie dQ przy T1 = T2
Proces rzeczywisty
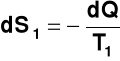
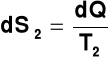
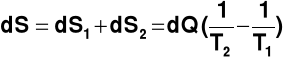
T1 > T2 → dS > 0 → proces samorzutny
Uwzględnieniu procesów odwracalnych i nieodwracalnych
![]()
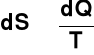
Ze względów praktycznych w termodynamice stosowane są także inne parametry do opisu układu
Entalpia → H
H = U + pV
Energia swobodna → F
F = U - TS
Entalpia swobodna (funkcja Gibbsa) → G
G = H - TS = U + pV - TS
Przykład:
Wykorzystanie entalpii swobodnej
Rozpatrzmy gaz w naczyniu z tłokiem w warunkach izobaryczno-izotermicznych
Warunki izobaryczne p = const (dp = 0)
Warunki izotermiczne T = const (dT = 0)
II zasada termodynamiki
TdS ≥ dQ → 0 ≥ dQ - TdS
≥ dQ - TdS = dU - dL - TdS = dU + pdV - TdS =
= dU + pdV + Vdp - TdS - SdT = dU + d(pV) - d(TS) =
= d(U + pV -TS) = dG
W samorzutnej przemianie izobaryczno-izotermicznej
≥ dG
Uwaga:
W żywych organizmach procesy przebiegają w warunkach izobaryczno-izotermicznych
Połączenie I i II zasady termodynamiki dla kwazistatycznego procesu odwracalnego (stanu równowagi)
I Zasada dU = dQ + dL
II Zasada TdS = dQ
Równanie Gibbsa
dU = TdS + dL = TdS + dLO + dLS + dLQ + dLC =
= TdS - pdV + Fdl + ψdq + ![]()
Uwaga:
Równanie Gibbsa jest spełnione w stanie równowagi
Przykład:
Opis termodynamiczny reakcji chemicznej w warunkach izobaryczno-izotermicznych → stosuje równanie Gibbsa (Dodatek 1)
αA + βB → γC + δD
dG = 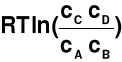
- RTln(K)
K = const → stała równowagi reakcji
Możemy obliczyć zmianę entalpii swobodnej przy dowolnym stężeniu składników → zastosowanie do opisu reakcji biochemicznych → reakcja powstawania kwasu mlekowego z glukozy
Glukoza → 2*(kwas mlekowy)
RTln(K) = 33 kcal/mol → wartość odczytana z tablic
Komórka
Glukoza → c = 0.005 mol/l
Kwas mlekowy → c = 0.001 mol/l
dG = [RT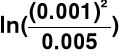
- 33 ] kcal/mol ≈ - 38 kcal/mol
Badana reakcja przebiega samorzutnie
Powstająca entalpia swobodna może być wykorzystana w innych reakcjach których samorzutny przebieg jest niemożliwy (glukoza + fruktoza → sacharozy + H2O, dG = 5 kcal/mol)
Ciśnienie osmotyczne
Osmometr Pfeffera
Błona półprzepuszczalna → przepuszcza rozpuszczalnik a nie przepuszcza substancji rozpuszczonej
Rurkę wypełniam roztworem i zanurzam w naczyniu z czystym rozpuszczalniku → rozpuszczalnik wnika do rurki
Ciśnienie hydrostatyczne wewnątrz rurki będzie rosło aż do osiągnięcia stanu równowagi (Δp)
Przy podanych założeniach Δp = ciśnieniu osmotycznemu
Opis termodynamiczny w stanie równowagi
W opisanym zjawisku mam do czynienia z przepływem substancji elektrycznie obojętnej (dq = 0) w stałej temperaturze (dT = 0) i bez pracy skracania mięśnia (dl = 0)
Stosując rozważania jak dla reakcji chemicznej (Dodatek 1)
dG = ![]()
μi = ![]()
+ RT ln(ci)
wyrażam ci jako ułamek molowy xi
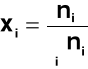
Dla czystego rozpuszczalnika xi = 1
I → oznacza czysty rozpuszczalnik w naczyniu
II → oznacza roztwór rurce
Potencjały chemiczne rozpuszczalnika w „I” i „II”
μI = ![]()
+ RTln(xI) = μ0
μII = ![]()
+ RTln(xII) = μ0 + RT 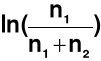
n1 → liczba moli rozpuszczalnika
n2 → liczba moli substancji
n1 >> n2
Przybliżenie matematyczne → 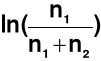
≈ - ![]()
μII = μ0 - RT ![]()
Przepływ rozpuszczalnika z I do II
dG = ![]()
= (Zmiana w I) + (Zmiana w II) =
= - μ0 dn + μ0 dn - RT ![]()
dn < 0
Taki proces zachodzi samorzutnie
Uwaga:
dn < 0 (wypływ z I) i dn > 0 (napływ do II)
Przepływ rozpuszczalnika z II do I
dG = μ0 dn - μ0 dn + RT ![]()
dn > 0
Taki proces NIE zachodzi samorzutnie
W wyniku napływu rozpuszczalnika μII wzrasta do momentu osiągnięcia stanu równowagi termodynamicznej gdy osiąga wartość ![]()
równą μI
Aby obliczyć zmianę μ korzystam z definicji potencjału chemicznego → praca na przeniesienie 1 mola substancji przeciw spadkowi stężenia równa się zmianie potencjału chemicznego
Praca objętościowa = pdV
p = Δp = π → ciśnienie w stanie równowagi (ciśnienie
osmotyczne)
dV = objętość 1 mola oznaczam Vm
W stanie równowagi
μI = ![]()
= μII + π*Vm
π = 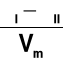
= 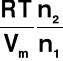
= 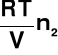
= cRT
c → stężenie molowe [mol/l]
Prawo van't Hoffa
π = cRT
Przykład:
1) c = 1 mol/l, T = 310 K, R = 8.31 J/mol*K
π ≈ 2.6*106 Pa = 26 atm
2) 0.9% NaCl, c = 0.154 mol/l
π ≈ 4*105 Pa = 4 atm
Uwaga:
NaCl 1 cząsteczka brak dysocjacji
Roztwory hiper-, izo- i hipo-toniczne → znaczenie fizjologiczne
Z reguły ciśnienie osmotyczne wyrażamy osmolach
Osmol jest to ciśnienie osmotyczne jakie wywiera w temperaturze 273 K idealny roztwór 1 molowy substancji niedysocjującej
Osmolarność → ciśnienie osmotyczne jednostki objętości
Osmolarność [osm/l] = 
NaCl (0.9%) → 9 g/l
MCZ = 23 + 35.5 = 58.5
Liczba jonów = 2
Osmolarność = 0.308 osm/l
Pomiar ciśnienia osmotycznego
metoda klasyczna → osmometr Pfeffera
krioskopowa
Temperatura krzepnięcia roztworu obniża się w stosunku do temperatury krzepnięcia czystego rozpuszczalnika proporcjonalnie do liczby osmotycznie czynnych cząsteczek
Stała krioskopowa H20 = 1.860 C → 1 mol substancji rozpuszczony w H20 → roztwór zamarza w temperaturze
-1.860 C
Stała krioskopowa surowicy = 0.5470 C
Termodynamicznie rozważam równowagę jonową - przepływ jonów
![]()
![]()
Błona półprzepuszczalna przepuszcza tylko jony A
Zaniedbuje zjawisko osmozy (wiele innych związków których stężenia nie zmieniają się)
T= const, p = const
Transport jonów A zgodnie z spadkiem stężenia będzie powodował powstanie różnicy potencjałów, która będzie przeciwdziałać przepływowi jonów
Badam stan równowagi (dG = 0) → nie występuje przepływ jonów
Przekształcam równanie Gibbsa
dU = TdS - pdV + Fdl + ψdq + ![]()
dq = Z*F*dn
F → stałą Faradaya (ładunek jednego mola jonów jednowartościowych) = 96500 C
Gdy mam wiele różnych jonów
dq = ![]()
dU = TdS - pdV + Fdl + ψF![]()
+ ![]()
=
= TdS - pdV + Fdl + ![]()
=
= TdS - pdV + Fdl + ![]()
Potencjał elektrochemiczny ![]()
![]()
= μi + ψFZi = ![]()
+ RT ln(ci) + ψFZi
Uwaga:
ψ jest identyczne ponieważ zakładam, że wszystkie jony w jednym układzie
W stanie równowagi (dG = 0) dostaje zależność (Dodatek 2)
![]()
Uwaga:
Układ składa się z 2 podukładów charakteryzujących się różnymi wartościami ψ → ψI i ψII
![]()
+ RT ln(![]()
) + Z F ψI = ![]()
+ RT ln(![]()
) + Z F ψII
![]()
→ identyczne w obu podukładach
Równania Nernsta
Δψ = ψI - ψII = 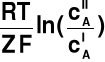
T = 310 K i Z = 1 oraz zmiana ln(x) = 2.303log(x)
Δψ = 0.061 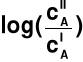
[Δψ] = V
![]()
= 10, Δψ = 61 mV
Przykład:
Zastosowanie równania Nernsta dla komórek mięśnia szkieletowego
Jon |
Zewnątrz-komórkowe (mM) |
Wewnątrz-komórkowe (mM) |
Potencjał Nernsta (mV) |
K+ |
~5 |
140 |
-95 |
Na+ |
145 |
~10 |
70 |
Cl- |
115 |
~5 |
-90 |
Uwaga:
Tabela podaje wartości orientacyjne stężeń
Δψ = ψI - ψII = 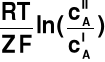
= ψW - ψZ = 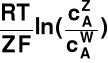
I → wewnątrz-komórkowy = „W”
II → zewnątrz-komórkowy = „Z”
Uwaga:
Równanie Nernsta nie ma zastosowania do żywych komórek
Uwaga:
Z reguły potencjał zewnątrz komórki przyjmuje jako zerowy
Dodatek 1
Reakcja chemiczna w warunkach izobaryczno-izotermicznych stosuje równanie Gibbsa bez zmian ładunku (dq = 0) i bez pracy na skracanie mięśnia (dl = 0)
αA + βB → γC + δD
dG = Gkońcowe - Gwyjściowych = d(U + pV -TS) =
= dU+ pdV - TdS =
= TdS - pdV + Fdl + ψdq + ![]()
+ pdV - TdS =
= ![]()
= (γμC + δμD) - (αμA + βμB)
Korzystam z wyrażenia na potencjał chemiczny
μA = ![]()
+ RTln(cA) i analogicznie dla B, C i D
dG = γ![]()
+ δ![]()
- α![]()
- β![]()
+
+ RT(γln(cC)+ δln(cD) - αln(cA) - βln(cB))
Wprowadzam oznaczenie
dG0 = γ![]()
+ δ![]()
- α![]()
- β![]()
Matematyka → własności funkcji ln
xln(y) = ln(yx)
ln(x) + ln(y) = ln(xy)
ln(x) - ln(y) = ln![]()
dG = dG0 + 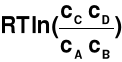
W stanie równowagi termodynamicznej dG = 0
dG0 = - 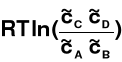
= const
![]()
→ stężenie w stanie równowagi sunctancji C i
odpowiednio dla A, B i D
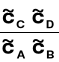
= K = const → stała równowagi reakcji
dG = 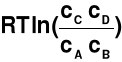
- RTln(K)
Dodatek 2
Równowaga jonowa przy przepływie jonów
Stosuje równanie Gibbsa bez pracy na skracanie mięśnia (dl = 0)
dG = Gkońcowe - Gpoczątkowe = d(U + pV -TS) =
= dU+ pdV - TdS =
= TdS - pdV + ![]()
+ pdV - TdS =
= ![]()
= ![]()
= 0
W rozważanej sytuacji ![]()
![]()
Otrzymujemy ostatecznie
![]()
1
14
W9
Wyszukiwarka