Międzywidziałowa Szkoła Inżynierii Biomedycznej 2007/2008
Zagadnienia do egzaminu z chemii organicznej
Klasy związków organicznych. Grupy funkcyjne charakterystyczne dla poszczególnych klas związkow.
Klasy związków :
Węglowodory |
C, H |
Halogenopochodne |
C, H,X ( Br, Cl, I) |
Estry, alkohole, aldehydy, ketony |
C, H, O |
Aminy, iminy, nitryle, zw.azotowe |
C, H, N |
Amidy, związki nitrowe |
C, H, O, N |
Chlorki kwasowe |
C, H, O, Cl |
Hybrydyzacja orbitali elektronowych atomów węgla w cząsteczkach związków organicznych. Rodzaje wiązań i geometria cząsteczek wynikające z hybrydyzacji orbitali.
Alkany - hybrydyzacja sp3, same wiązania typu sigma, kształt tetraedru
Alkeny - hybrydyzacja sp2, jedno wiązanie sigma, jedno pi, kształt piramidy trygonalnej
Al.kiny - hybrydyzacja sp, jedno wiązanie sigma, dwa wiązania pi, kształt liniowy
Izomeria konstytucyjna i przestrzenna związków organicznych.
Izomeria konstytucyjna - izomery konstytucyjne posiadają różne wiązania chemiczne, (tzw. konstytucję)
Izomeria konfiguracyjna - występowanie dwóch lub więcej cząsteczek o tej samej liczbie i rodzaju atomów, między którymi występują dokładnie te same wiązania chemiczne, różniących się mimo to układem atomów w przestrzeni.
konformacyjne - w których różnice w układzie atomów w przestrzeni wynikają z faktu częściowego lub zupełnego zablokowania rotacji grup atomów wokół pojedynczych wiązań chemicznych
izomeria geometryczna - wynika z faktu różnego układu atomów i podstawników przy wiązaniach wielokrotnych lub w układach cyklicznych. (formy cis i trans)
izomeria optyczna - ma miejsce gdy mogą istnieć dwie lub więcej form chiralnych (w uproszczeniu prawo- i lewoskrętnych) cząsteczek.
Substancja jest czynna optycznie jeżeli skręca płaszczyznę polaryzacji światła.
Enancjomery - izomery będące wzajemnymi odbiciami lustrzanymi
Chiralność - zachodzi, kiedy przedmioty nie pokrywają się ze swoimi odbiciami lustrzanymi, nie wykazują żadnych elementów symetrii.
Centrum chiralności - atom węgla połączony z 4 różnymi podstawnikami (ilość chiralnych atomów węgla decyduje o ilości enancjomerów)
Diastereoizomery - różnią się konfiguracją przy co najmniej jednym centrum chiralności
Epimery - różnią się konfiguracją przy tylko jednym centrum chiralności
Forma Mezo - dwa enancjomery mające wspólną płaszczyznę symetrii, uznaje się je za jedną odmianę
Rodzaje reakcji organicznych i reagenty biorące w nich udział. Heterolityczny
i homolityczny rozpad wiązania kowalencyjnego.
Reakcje organiczne :
Substytucja elektrofilowa - chemiczna reakcja wymiany, zachodzi przy wytworzeniu się wolnych rodników (np. halogenowanie, sulfonowanie, nitrowanie, alkilowanie) :
Etapy reakcji halogenowania :
Inicjowanie: chlor, najczęściej pod wpływem promieniowania UV, ulega rozpadowi na wolne rodniki, inicjujące łańcuch reakcji.
Cl2 → Cl· + Cl·
Propagacja: wolne rodniki chloru reagują z metanem, tworząc rodnik metylowy, który następnie w reakcji z wolnym chlorem tworzy produkt (jeden z wielu) chlorowania i kolejny wolny rodnik zdolny do dalszych reakcji:
CH4 + Cl· → CH3· + HCl
CH3· + Cl2 → CH3Cl + Cl·
CH3Cl + Cl· → CH2Cl· + HCl
CH2Cl· + Cl2 → CH2Cl2 + HCl
itd..
Chlorowanie przebiega do mono- i wielopodstawionych chloropochodnych metanu CH3Cl, CH2Cl2, CHCl3 oraz CCl4.
Zakończenie łańcucha reakcji - może zajść na wiele sposobów. Najczęściej jest to spowodowane rekombinacją się dwóch wolnych rodników, która prowadzi do powstania niereaktywnych cząsteczek:
CH3· + Cl· → CH3Cl
Cl· + Cl· → Cl2
CH3· + CH3· → C2H6
Substytucja nukleofilowa - reakcja chemiczna podstawienia, w której czynnikiem atakującym jest nukleofil (jon). Wyróżnia się jej dwa typy : jednocząsteczkową (Sn1) i dwucząsteczkową (Sn2)
Typ reakcji |
Sn1 |
Sn2 |
Ilość etapów |
Reakcja 2-etapowa. 1 etapem jest wytworzenie karbokationu, który w drugim etapie jest atakowany przez nukleofil |
Reakcja 1-etapowa. W jednym etapie do cząsteczki następuje zbliżenie się nukleofila, który się podstawia i odejście nukleofila odchodzącego. Tworzy się pośredni etap, w którym powstaje częściowe wiązanie z nukleofilem atakującym a wiązanie z nukleofilem odchodzącym zanika. Nukleofil atakujący zawsze atakuje ze strony przeciwnej do nukleofila odchodzącego. Warunkuje to najczęściej zmianę konfiguracji formalnej atomu, przy którym następuje podstawienie (substytucja). |
Rząd reakcji |
Reakcja I rzędu, jej szybkość zależy wyłącznie od stężenia R-X w środowisku reakcji.
|
Reakcja II rzędu, jej szybkość zależy od stężenia R-X i Nu w środowisku reakcji |
Czynność optyczna |
Z czynnego optycznie substratu powstaje nieczynna optycznie mieszanina racemiczna |
Z czynnego optycznie substratu powstaje czynny optycznie produkt |
Co jej ulega? |
Najłatwiej ulegają jej III rzędowe halogenki alkilowe |
Najłatwiej ulegają jej I rzędowe halogenki alkilowe |
Addycja- reakcja, w której dwa substraty łączą się, dając jeden, nowy produkt. Przykładem może być przyłączanie HBr do wiązania wielokrotnego w alkenach i alkilach.
Elektrofilowa : CH3CH2=CH2 + HBr = CH3CH2(+)CH3 +Br(-) = CH3CH2BrCH3
Wolnorodnikowa: CH3CH2=CH2 + Br- = CH3CH2(-)CH2Br + H(+) = CH3CH3CH2Br
Eliminacja- czyli inaczej reakcja oderwania - w wyniku tej reakcji od cząsteczki odrywa się atom lub grupa atomów i nic innego się w to miejsce nie przyłącza. (typowa reakcja powstawania alkenów i alkilów)
Rozpad wiązana kowalencyjnego :
Heterolityczny - niesymetryczne rozerwanie, powstają dwa jony o przeciwnych ładunkach :
C2H5-C2H3 = C2H5(+) + O-C2H3 (-)
Homolityczny - symetryczne rozerwanie wiązania, powstają wolne rodniki - rozpad samoistny
CH3CH2OH = CH3· + CH2OH·
Alkany: budowa, nazewnictwo, izomeria konstytucyjna, izomeria przestrzenna (konformery), rzędowość atomów węgla, charakterystyczne reakcje (spalanie, podstawienie wolnorodnikowe). Mechanizm wolnorodnikowego halogenowania alkanów. Łatwość tworzenia wolnych rodników i produkty monohalogenowania wyższych alkanow.
Alkany to nasycone związki organiczne mające w swojej cząsteczce wyłącznie atomy wodoru i węgla, brak grup funkcyjnych.
Izomeria konstytucyjna alkanów :
- izomery łańcuchowe
- izomery podstawników
- metameria - izomeria grup funkcyjnych
Izomeria przestrzenna (konformery):
(grube kreski do wiązania wysunięte „do nas”, kreski przerywane to wiązania wchodzące pod płaszczyznę rysunku)
Rzędowość atomów węgla w cząsteczce alkanu - określa się przez ilość przyłączonych do niego innych atomów węgla (3 atomy - 3-rzędowy)
Rzędowość atomów wodoru - atomy wodoru mają tą samą rzędowość, co węgle do których są przyłączone.
Spalanie :
Całkowite - 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Półspalanie - 2 C2H6 + 5 O2 → 4 CO + 6 H2O
Niecałkowite - CH4 + O2 → C + 2 H2O
Substytucja wolnorodnikowa - patrz punkt 4
Łatwość zajścia reakcji - reaktywność atomów H (3º>2º>1º>CH4), reaktywność chlorków J2>Br2>Cl2
O ilości powstających monochlorowco-pochodnych decyduje rzędowość atomów wodoru i ilość atomów wodoru o danej rzędowości
Cykloalkany: trwałość, konformacje cykloheksanu, reakcje z zachowaniem
i z rozerwaniem pierścienia.
CnH2n
Trwałość - cykloalkany są stosunkowo trwałe, z wyjątkiem cyklopropanu i cyklobutanu, które ze względu na silne naprężenia kątowe wiązań chemicznych węgiel-węgiel łatwo ulegają rozkładowi z wytworzeniem odpowiednich rodników.
Reakcje z zachowaniem pierścienia :
Cykloalkan + X2 pod wpływem światła
Reakcje z rozerwaniem pierścienia :
Cyklopropan (cyklobutan) + H2 = CH3CH2CH3
Cyklopropan (cyklobutan) + Cl2 = CH2ClCH2CH2Cl
Konformery Cykloheskanu
Konformacja krzesłowa atomu cykloheksanu
Rodzaje konformerów cykloheksanu :
krzesłowa, 2- pół-krzesło, 3-skręcona łódka, 4- łódka, 5- skręcona łódka
Alkeny: budowa, nazewnictwo, izomeria konstytucyjna, izomeria geometryczna (cis-trans, Z-E), charakterystyczne reakcje addycji. Addycja elektrofilowa cząsteczek typu HZ do alkenów - reguła Markownikowa, mechanizm reakcji. Addycja wolnorodnikowa HBr w obecności nadtlenków - produkty i mechanizm reakcji. Ozonoliza jako sposób na wykrywanie położenia wiązania podwójnego w cząstecze alkenu.
Izomeria geometryczna :
Forma cis forma trans
Warunek na izomerię geometryczną - atom węgla musi mieć dwa różne podstawniki
Reakcje addycji :
H2
CH3=CH3 + H2 (Ni lub Pt) = CH4CH4
HX
CH2=CH2+ HCl = CH3CH2Cl
Reguła Markownikowa - addycja HX do wiązania podwójnego przebiega tak, że atom wodoru przyłącza się przede wszystkim do tego atomu węgla, przy którym jest już więcej atomów wodoru
Addycja wolnorodnikowa HBr w obecności nadtlenków
Ozonoliza - reakcja chemiczna rozkładu związków chemicznych pod wpływem działania ozonu. Służy do określania położenia wiązania podwójnego w alkenach.
Alkadieny: rodzaje, reakcje buta-1,3-dienu.
Skumulowane - nietrwałe, przechodzą w alkiny
-CH=C=CH-... → ...-CH2-C≡C-...
Sprzężone - bardziej reaktywne
CH2=CH-CH=CH2
reakcje buta-1,3-dienu
CH2=CH-CH=CH2 (Na/Δ)→ CH3-CH2-CH≡CH
CH2=CH-CH=CH2 + H2O → CH3 - CH(OH)-CH=CH2 → CH3COCH2CH3
CH2=CH-CHBr-CH2Br + Zn →ZnBr2 + CH2=CH-CH=CH2
Reakcja Dielsa-Adlera :
Alkiny: budowa, izomeria, addycja do wiązania potrójnego jako reakcja charakterystyczna alkinów. Kwasowość alkinów terminalnych - tworzenie acetylenków.
Reakcja charakterystyczna alkilów:
CH≡CH + Cl2 → CHCl=CHCl + Cl2 → CHCl2- CHCl2
Dobierając odpowiednie proporcje możemy rozróżnić alkeny od alkilów w reakcji z wodą bromową :
Np. 5g Br2 odbarwi się po dodaniu 0.5dm3 acetylenu, ale nie odbarwi się po dodaniu takiej samej ilości etylenu
Kwasowość alkilów terminalnych - kwasowość atomu H rośnie wraz ze wzrostem udziału orbitali s w hybrydyzacji (największa dla orbitali sp - alkilów)
2R - C≡C-H + 2Na → 2R-C≡C-Na (acetylenek) + H2
Związki aromatyczne: budowa benzenu, reguła Hückla jako sposób określania aromatyczności związków organicznych. Nazewnictwo i izomeria związków organicznych. Reakcje podstawienia elektrofilowego jako reakcje charakterystyczne węglowodorów aromatycznych (halogenowanie, sulfonowanie, nitrowanie, alkilowanie Friedla-Craftsa, acylowanie Friedla-Craftsa). Ogólny mechanizm reakcji SE, mechanizmy reakcji nitrowania i sulfonowania za pomocą H2SO4. Rodzaje podstawników w pierścieniu aromatycznym i ich wpływ na reakcje SE.
Benzen C6H6
3 zdelokalizowane wiązania typu pi
Reguła Hückla - związek jest aromatyczny, jeśli występuje w nim 4n+2 elektronów zdelokalizwoanych na wiązaniach pi, gdzie n - liczba pierścieni
Reakcje Se
Sulfonowanie
Nitrowanie
Halogenowanie
Alkilowanie metodą Fiedla - Craftsa
Acylowanie metodą Fiedla - Craftsa
Wpływ kierujący podstawników
I rodzaju - Orto i para |
II rodzaju - meta |
Grupy alkilowe Fluorowce Grupa hydroksylowa (OH) Grupa aminowa (NH2) |
Grupa nitrowa (NO2) Grupa sulfonowa (HSO3) Grupa nitrylowa (CN) Grupa karboksylowa (COOH) |
Halogenopochodne węglowodorów. Halogenki alkilów: budowa, rzędowość, reakcje podstawienia nukleofilowego. Reakcje SN1 i SN2 - mechanizm, stereochemia, zależności kinetyczne, produkty. Eliminacja jako reakcja konkurencyjna w stosunku do SN - reguła Zajcewa. Halogenki arylów - budowa i reaktywność.
Halogenki Alkilów |
Halogenki Arylów |
Atom halogenu związany z tetraedrycznym atomem węgla |
Atom halogenu związany bezpośrednia z atomem węgla w pierścieniu aromatycznym |
Łatwo ulegają reakcjom Sn i eliminacji (po wpływem np. KOH) |
Nie ulegają reakcjom Sn ani eliminacji. W szczególnych przypadkach możliwa reakcja SnAr |
Tworzą związki metaloorganiczne |
|
Reakcje SN1 i SN2 - mechanizm, stereochemia, zależności kinetyczne, produkty
SN1
CH3CH2Cl (H2O i KOH)→ CH3CH2 (+) + Cl (-)
CH3CH2(+) + OH(-) → CH3CH2OH
SN2
CH3CH2Cl + NaOH → CH3OH + NaCl
Zależności kinetyczne - patrz punkt 4
Eliminacja
E1
CH3CH2Cl → CH3CH2(+) +Cl(-)
CH3CH2(+) + OH(-) (śr.-alkohol)→ CH2=CH2 + H20
E2
CH3CH2Cl +OH (-)→ CH2=CH2 + Cl(-) + H2O
Eliminacja w konkurencji do Sn
Reguła Zajcewa - w eliminacji, w wyniku której powstaje wiązanie podwójne C=C powstają głównie jak najbardziej rozgałęzione izomery. W przypadku reakcji eliminacji halogenowodorów (HX) z halogenków alkilowych z reguły tej wynika, że jako produkt główny powstaje alken zawierający maksymalną liczbę grup alkilowych przy atomach węgla posiadających wiązanie podwójne.
Alkohole i fenole: budowa, nazewnictwo, izomeria. Wiązania wodorowe i ich wpływ na właściwości fizyczne. Właściwości kwasowe alkoholi i fenoli. Rzędowość alkoholi. Reakcje podstawienia nukleofilowego w alkoholach - mechanizm, stereochemia i zależności kinetyczne. Dehydratacja alkoholi - reguła Zajcewa. Utlenianie alkoholi. Reaktywność fenoli.
protonowanie alkoholu CH3CH2OH + H(+) → CH3CH2O(+)[H]H
wytwarzanie karbokationu CH3CH2O(+)[H]H → CH3CH2 (+) + H2O
reakcja karbokationu z nukleofilem CH3CH2 (+) + Cl(-) → CH3CH2Cl
protonowanie alkoholu CH3OH + H(+) → CH3O(+)[H]H
reakcja kationu etylooksoniowego z nukleofilem
Aldehydy i ketony - budowa, nazewnictwo. Reakcje addycji nukleofilowej do grupy karbonylowej jako reakcje charakterystyczne aldehydów i ketonów. Inne reakcje aldehydów i ketonów (utlenianie i redukcja).
Kwasy karboksylowe - budowa nazewnictwo, wiązania wodorowe i ich wpływ na właściwości fizyczne kwasów. Reakcje kwasów karboksylowych: tworzenie soli, tworzenie pochodnych, reakcje z udziałem atomów wodoru przy atomie węgla α.
Aminy - rzędowość, nazewnictwo, wiązania wodorowe i ich wpływ na właściwości fizyczne, zasadowość amin.
rzędowe
i 3- rzędowe
symetrycznie podstawione :
niesymetrycznie podstawione
Biocząsteczki: lipidy (tłuszcze, woski, fosfolipidy, steroidy), sacharydy, aminokwasy, peptydy i białka.
|
Monohydroksylowe |
Polihydroksylowe |
Fenole |
Budowa |
Grupa OH połączona z at. C o hybrydyzacji Sp3 |
Grupa OH przy at. C o hybrydyzacji Sp2 |
|
Najprostszy przedstawiciel |
Metanol CH3OH |
Glikol etylenowy CH2OHCH2OH |
fenol |
Dysocjacja |
Nie |
Nie |
Tak (słabo) |
Reakcja z NaOH |
Nie |
Nie |
Tak |
Reakcja z Na |
Tak |
Tak |
Tak |
Charakter kwasowy |
Tylko w reakcji z metalami aktywnymi (bardzo słaby) |
Bardzo słaby, choć trochę mocniejszy od monohydroksylowych |
Słaby, ale wyraźny |
Reakcja z HX |
Tak, choć zależy od rzędowości i rodzaju HX) - najlepiej 3 rzędowe z HI |
Tak, choć słabiej niż monohydroksylowe |
Nie |
Reakcje charakterystyczne |
|
Reakcja z Cu(OH)2 - daje szafirowy roztwór |
Reakcja z FeCl3 - powstają barwne kompleksy |
Reakcja z X2 |
Tylko gdy jest wiązanie podwójne |
tak |
|
Wiązania wodorowe w alkoholach - Ze względu na obecność silnie elektroujemnego atomu tlenu i związanego z nim atomu wodoru alkohole tworzą wiązania wodorowe, ulegając asocjacji w większe struktury. Niższe alkohole takie jak metanol, etanol i propanol mają niskie temperatury wrzenia i dużą lotność. Wiązania wodorowe zwiększają t.t i t.w. , obniżają lotność.
Rzędowość alkoholi
Rzędowość alkoholu jest równa rzędowości atomu węgla, z którym połączona jest grupa hydroksylowa.
Sn w alkoholach
Sn1
Sn2
CH3O(+)[H]H + Br(-) → Br- CH3O(+)[H]H → BrCH3 + H2O
stan przejściowy
Dehydratacja alkoholi
CH3CH2OH ( śr. H2SO4 lub Al2O3, T)→ CH2=CH2
CH3 - CH(OH) - CH2CH3 → CH3-CH=CH- CH3 (produkt główny)
CH2=CH-CH2-CH3
Reguła Zajcewa - patrz eliminacja w halogenopochodnych
Utlenianie alkoholi - otrzymywanie aldehydów i ketonów
CH3CH2OH + CuO (pod wpływem T)→ CH3COH + Cu + H20 z alk. 1º powstają aldehydy
CH3C(OH)CH3 + CuO (pod wpływem T)→ CH3C(O)CH3 + Cu + H2O z alk. 2º- ketony
Alkohole 3º praktycznie nie ulegają reakcji utleniania, potrzebny byłby b. silny utleniacz, który rozerwałby b. silne wiązanie C-C
Aldehydy - końcówka - al., ketony - końcówka - on
Addycja nukleofilowa do gr. Karbonylowej
1.możliwość - HCN, ROH, RMgX ( odczynnik Grigranda)
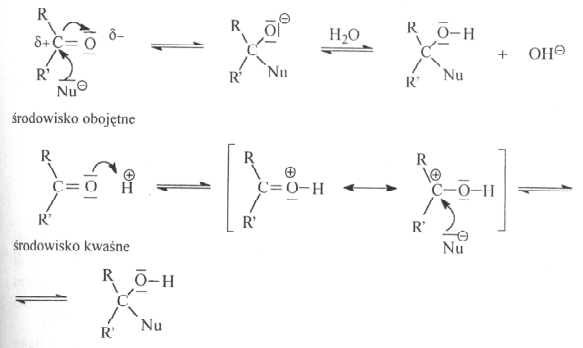
2.możliwość - NH3, RNH2 (aminy), NH2OH ( hydroksyloamina)
Tworzenie hemiacetali i acetali
CH3CHO + CH3OH (śr. Kwasowe)→ CH3CH (OH)- O- CH3 - hemiacetal (półacetal)
CH3CH (OH)- O- CH3 + CH3OH (śr.kwasowe) → CH3CH(OCH3)OCH3 + H2O - acetal
Utlenianie aldehydów i ketonów :
Próba Trommera - odróżnianie aldehydów od ketonów
CH3CH2CHO + Cu(OH)2 →Cu2) + CH3CH2COOH + 2H2O
Zmiana zabarwienia z niebieskiego na ceglastoczerwony osad
Próba Toulensa - odróżnianie aldehydów i ketonów
CH3COH + Ag2O (pod wpływem NH3)→ 2Ag + CH3COOH
na ściankach próbówki powstaje lustro srebrne
Utlenianie ketonów - tzw. Ultra utleniacz
5CH3C(O)CH3 + 6KMnO4 + 9H2SO4 → 5CH3COOH + 5HCOOH + 6MnSO4 + 3K2SO4 + 9H20
Redukcja:
Aldehydy - R- CHO [H] → RCH2OH
Ketony R1 - C(O)-R2 →R1- C(OH) - R2
Otrzymywanie - utlenianie ketonów i aldehydów
Moc - maleje ze wzrostem długości łańcucha węglowodorowego
Reakcje z metalami - tylko tymi, które stoją wyżej w szeregu napięciowym metali, niż wodór (K, Na, Ca, Mg, Al. Zn, Ni, Fe, Sn, Pb)
Powstawanie soli :
CH3COOH + NaOH → CH3COONa + H2O
Tworzenie pochodnych - estry :
HCOOH + CH3(stęż. H2SO4)→ HCOOCH3 + H2O
Estry gliceryny i wyższych kwasów tłuszczowych - tłuszcze - nasycone(twarde, zwierzęce) i nienasycone - (płynne , roślinne)
Przykłady :
Utwardzanie:
Zmydlanie - hydroliza tłuszczy w śr.zasadowym (nieodwracalna)
Hydroliza kwasowa - odwracalna ( w śr. Kwasowym)
Tworzenie pochodnych - amidy
CH3COOH + NH3 → CH3COONH4 [T]→ CH3CONH2 - występuje wiązanie peptydowe
Aminy - związki, które można potraktować jako pochodne amoniaku (NH3), w którym 1 atom wodoru (aminu 1 rzędowe), lub więcej atomów wodoru (2 i 3 rzędowe) zostały zastąpione grupą alkilową, lub arylową.
Nazewnictwo
CH3NH2 - metyloamina, CH3CH2NH2 - etyloamina
CH3- NH2- CH3 - dimetyloamina
CH3- NH2(CH3)-CH3 - trimetyloamina
CH3-CH2-NH-CH3 - N-metyloetyloamina
CH3- CH2 - CH(CH3)- CH3 N-etylo - N- dimetyloamina
Zasadowość amin - aminy alifatyczne mają silniejszy charakter zasadowy niż amoniak, aromatyczne zaś - słabszy
Dysocjacja amin
CH3NH2 + H2O → CH3NH3 (+) + OH(-)
Aromatyczne - praktycznie nie zachodzi!
Lipidy:
ESTRY
Tłuszcze - patrz punkt 14
Woski- mieszaniny estrów kwasów tłuszczowych i alkoholi o długich łańcuchach węglowych
Fosfolipidy - zawierają ugrupowania estrowe kwasu fosforowego i alkoholi
Nie-estry :
Steroidy : - układ czteropierścieniowy (3 pierścienie 6-członowe, 1 5- członowy)
Wyszukiwarka