Procesy dyfuzyjne
Wiele procesów inżynierii chemicznej, w których zachodzi międzyfazowa wymiana substancji, najczęściej określa się jako procesy wymiany masy. Należą do nich absorpcja, desorpcja, adsorpcja, ekstrakcja, nawilżanie gazów, destylacja i rektyfikacja oraz wiele podobnych. Teoretyczny opis tych procesów czy inaczej mówiąc operacji jest trudniejszy od opisu procesów wymiany ciepła. Już sama ich systematyka jest bogatsza i można ją sformułować według różnych kryteriów. Można mówić o procesach wymiany masy, które przebiegają: jednokierunkowo, przeciwkierunkowo, z wymianą jednego składnika, z wymiana wielu składników, z równoczesną reakcja chemiczną, z równoczesną wymianą ciepła, izotermicznie, z efektem cieplnym, a to i tak nie wypełnia całej ich różnorodności. W różnych operacjach przemysłowych można przecież spotkać przypadki o charakterze mieszanym. Oprócz różnorodności układów dwufazowych, jak na przykład faza gazowa i ciekła, faza ciekła i faza stała czy dwie różne fazy ciekłe, może występować także różnorodność substancji, które podlegają wymianie masy. Jako przykład można wymienić dwa procesy, w których z tego samego surowca jakim jest gaz koksowniczy raz można usuwać benzen, a innym razem amoniak. Jeśli dodatkowo uwzględni się fakt, że w procesach wymiany ciepła najczęstszym elementem aparatury jest rura, a w procesach wymiany masy, gdzie chodzi o zapewnienie jak największego pola powierzchni międzyfazowej i jak najdłuższego czasu kontaktu faz, stosuje się aparaty o różnorodnych wypełnieniach, o czym szczegółowo będzie mowa w dalszej części, to twierdzenie o bardziej skomplikowanym opisie procesów wymiany masy staje się w pełni uzasadnione.
Procesy wymiany masy najczęściej wiążą się z dyfuzyjnym ruchem molekuł, stąd teoretyczny opis tych operacji opiera się na prawach dyfuzyjnego ruchu masy, a procesy zyskały nazwę procesów dyfuzyjnych. Matematyczny opis wszystkich operacji dyfuzyjnych pojawiających się w inżynierii chemicznej i procesowej ma zatem wspólne podstawy teoretyczne.
Mechanizmy dyfuzyjnego ruchu masy
Mechanizmy ruchu masy wykazują pewne podobieństwa do mechanizmów ruchu ciepła. Przy wymianie ciepła można wyróżnić przewodzenie, konwekcję i promieniowanie. W przypadku wymiany masy rozróżnia się tylko dwa mechanizmy, tj. dyfuzję i konwekcję.
Aby w procesach wymiany masy zachodził transport substancji (przepływ określonego rodzaju molekuł) konieczny jest pewien gradient stężenia transportowanego składnika wzdłuż drogi poruszania się tych molekuł, czyli ruch masy odbywa się zawsze od ośrodka (miejsca) o stężeniu wyższym do ośrodka (miejsca) o stężeniu niższym.
Dyfuzja jest zjawiskiem molekularnym i podobnie jak przewodzenie ciepła przebiega w warstwach nieruchomych lub poruszających się ruchem laminarnym. Dyfuzja najłatwiej zachodzi w fazie gazowej, trudniej w fazie ciekłej, a najtrudniej w fazie stałej. Szybkość dyfuzji rośnie ze wzrostem temperatury, maleje ze spadkiem ciśnienia i jest mniejsza dla molekuł o większej masie molowej.
Dyfuzyjny ruch masy może występować, jeśli w dwóch różnych punktach przestrzeni występuje różnica stężeń, różnica temperatur lub różnica ciśnień. Mówimy wówczas o dyfuzji stężeniowej, termodyfuzji lub dyfuzji ciśnieniowej. Znany jest także dyfuzyjny ruch masy pod wpływem różnicy natężenia pola elektrycznego, taki przypadek w przyrodzie obserwuje się w komórkach organizmów żywych i wówczas mówi się o elektrodyfuzyjnym ruchu masy.
Konwekcja lub ruch masy przez konwekcję odbywa się w ten sposób, że dana faza znajdująca się w ruchu burzliwym przenosi pewne porcje płynu z miejsc o stężeniu wyższym do miejsc o stężeniu niższym, zupełnie podobnie jak w procesach wymiany ciepła. Jednakże w procesach międzyfazowej wymiany masy tak opisana konwekcja nie zachodzi. W obecności drugiej fazy na ich granicy następuje spowolnienie ruchu płynu aż do ruchu laminarnego. Zatem wymiana masy do drugiej fazy następuje poprzez laminarne warstwy graniczne istniejące pomiędzy dwiema fazami. W tych warstewkach granicznych zanika konwekcja, a pojawia się dyfuzja. Zatem transport składnika z głębi burzliwej fazy do granicy międzyfazowej, to najpierw konwekcja a potem dyfuzja. Taki ruch składnika odbywający się w obrębie jednej fazy nazywa się wnikaniem masy. Jeśli połączy się dwa procesy wnikania masy w sąsiadujących fazach, to mamy do czynienia z przenikaniem masy. Zatem przenikanie masy odbywa się następująco najpierw składnik z głębi (z rdzenia) jednej fazy wskutek wnikania dociera do granicy międzyfazowej, przechodzi do drugiej fazy na granicy i w końcu wnika do głębi drugiej fazy. Schematyczny opis tego zjawiska można przedstawić graficznie za pomocą wykresu stężenia (np. ułamków molowych) od drogi.
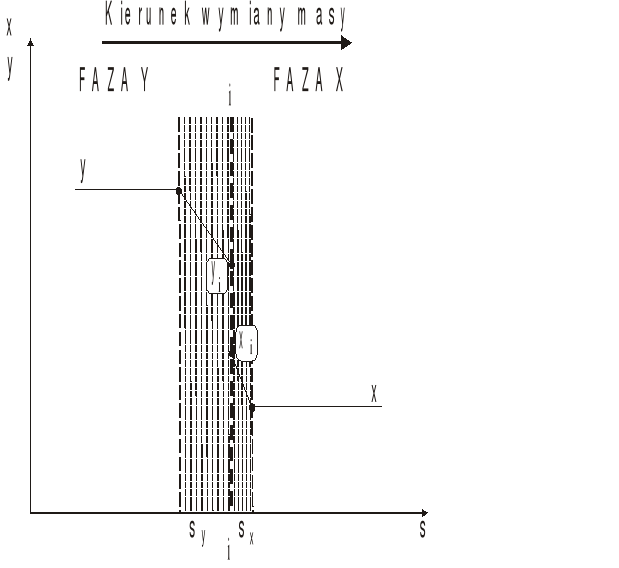
Rys. 1. Rozkład stężeń przy przenikaniu masy z fazy y do fazy x
Dwie fazy są rozdzielone granicą międzyfazową „i”. W pobliżu granicy każda z faz wytwarza warstewkę laminarną o grubości sy lub sx. Daleko od granicy międzyfazowej stężenia w każdej z faz są stałe, a w warstewkach granicznych zmieniają się wskutek dyfuzji.
Dyfuzja w fazie gazowej
Teoria dyfuzji gazów rozwinęła się wraz z teorią kinetyczną gazów. Wymienić tu należy takich badaczy jak Maxwell, Stefan, Mayer, Sutherland i inni).
Dyfuzja może być procesem ustalonym bądź nieustalonym. W pierwszym przypadku stężenie transportowanego składnika jest wyłącznie funkcją miejsca:
![]()
,
a w przypadku dyfuzji nieustalonej jest dodatkowo funkcją czasu:
![]()
,
Weźmy pod uwagę warstwę gazu znajdującą się w spoczynku, ograniczoną dwiema płaszczyznami I i II. Przez warstwę tę dyfunduje składnik mieszaniny gazowej A. Ruch składnika występuje na skutek istniejącej różnicy stężeń. Do wyrażenia stężeń można wykorzystać koncentrację (stężenie) oznaczaną symbolem cA [kmol/m3]. Rozpatrzmy dyfuzję ustaloną. Zatem stężenia w przekrojach I i II są niezmienne w czasie, tzn.:
cAI = const, cAII = const, a ponadto cAI > cAII.
Przemieszczanie się cząsteczek A w kierunku dyfuzji (w kierunku malejącego stężenia) wynika z różnicy stężeń składnika A w przekrojach I i II, można zatem mówić o gradiencie stężenia składnika A wzdłuż drogi. Stężenie składnika można wyrazić jako jego prężność pA, a więc można mówić o gradiencie prężności dpA/ds, który ze względu na spadek prężności wzdłuż drogi ma wartość mniejszą od zera. Gradient prężności składnika A należy traktować jako miarę oporu na jaki napotykają cząsteczki substancji A podczas dyfuzji wśród innych cząsteczek. Dla mieszaniny dwuskładnikowej Maxwell i Stefan opór dyfuzji w kierunku s opisali zależnością:
![]()
(1)
gdzie:
dpA - strata prężności składnika A w kierunku zgodnym z drogą s na drodze o długości ds, Pa
cA, cB - stężenie składnika A lub B, kmol/m3,
uA, uB - prędkość (ruchliwość) cząsteczek A lub B, m/s,
λAB - współczynnik proporcjonalności charakterystyczny dla układu A i B, [kg⋅m3/(kmol2⋅s)]
Natomiast dla przypadku, w którym cząsteczki A dyfundują przez mieszaninę składników B, C, ..., N, odpowiednie równanie opisujące gradient prężności składnika A ma postać:
![]()
(2)
Oba powyższe równania wynikają z teorii kinetycznej gazów.
Aby za pomocą równań opisać ile cząsteczek substancji A przemieszcza się wzdłuż drogi s w jednostce czasu dokonajmy przekształceń powyższego równania.
Zdefiniujmy:
Gęstość strumienia składnika A: ![]()
[kmol/(m2⋅s)]
Gęstość strumienia składnika B: ![]()
[kmol/(m2⋅s)]
Gęstość strumienia składnika N: ![]()
[kmol/(m2⋅s)]
Prężność składnika A: ![]()
oraz ![]()
![]()
(3)
Kinematyczny współczynnik dyfuzji:
![]()
[m2/s]
![]()
, ..., ![]()
![]()
stężenie ogólne mieszaniny A, B, ..., N [kmol/m3]
![]()
Dynamiczny współczynnik dyfuzji:
![]()
[kmol/(m⋅s)]
![]()
, ..., ![]()
![]()
(4)
Oznaczmy stosunki strumieni (stosunki gęstości strumieni) odniesione do gęstości strumienia IA:
![]()
, ![]()
, ..., ![]()
Jeśli kierunek dyfuzji wybranego składnika będzie zgodny z kierunkiem dyfuzji składnika A, to strumień dyfuzji tego składnika jest dodatni, a w przypadku dyfuzji w kierunku odwrotnym do składnika A - znak ujemny. Stosunki strumieni oczywiście też będą podlegały tej regule. Zatem po przekształceniach uzyskuje się zależność:
![]()
(5)
Stąd:
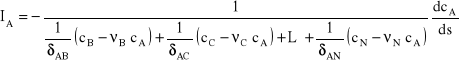
(6)
Wstawmy:
![]()
, ![]()
, ..., ![]()
![]()
Zatem po wprowadzeniu ułamków molowych uzyskuje się równanie:
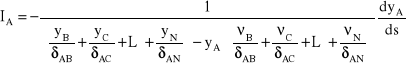
(*7)
Analizując powyższe równanie widać, że strumień dyfundującego składnika A jest proporcjonalny do jego gradientu, a ponadto zależy od stężeń pozostałych składników obecnych w mieszaninie, od ich współczynników dyfuzji, ich kierunku dyfuzji oraz od stosunków strumieni. Gdyby współczynniki dyfuzji wszystkich składników mieszaniny gazowej były jednakowe i równe ![]()
, to równanie przekształca się do postaci:
![]()
(8)
Zdefiniujmy sumę względnych strumieni wszystkich składników:
![]()
![]()
(9)
Wyrażenie w nawiasie ulega zmianie na skutek zmienności ułamka ![]()
.Gdyby wyrażenie w nawiasie pomnożyć przez ![]()
, a jednocześnie gradient ułamka podzielić przez ten sam wyraz, to uzyskalibyśmy zależność:
![]()
(10)
Powyższa zależność, co prawda oparta na dość dużym uproszczeniu (równości współczynników dyfuzji), pozwala zaproponować jak uzyskać stałość pierwszego członu w równaniu oznaczonym (*) w przypadku, gdy nie czynimy już uproszczeń, tj dla nierównych współczynników dyfuzji. Na tej podstawie równanie (*) można zapisać w postaci:
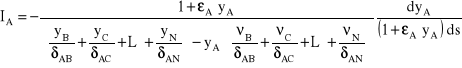
(11)
Przez analogię do wcześniejszych stwierdzeń można przyjąć, że pierwszy ułamkowy człon równania jest wielkością prawie stałą i nazywa się go zastępczym współczynnikiem dyfuzji, zaś drugi ułamek wyraża „siłę” napędową procesu, w której wielkość ![]()
znajdująca się w mianowniku wskazuje, że strumień składnika ![]()
jest tym mniejszy im większy jest mianownik yf lub inaczej wyrażenie w mianowniku działa hamująco na proces dyfuzji składnika A. Ostatecznie otrzymamy zależność na gęstość strumienia dyfuzji składnika A przez nieruchomą warstwę gazu w postaci:
![]()
(12)
Jeśli zachodzi potrzeba wyznaczenia gęstości strumienia dyfuzji składnika A pomiędzy przekrojami I i II, to powyższe równanie należy scałkować. W procesie ustalonym ![]()
, zatem strumień pomiędzy przekrojami I i II odległymi o drogę s wynosi:
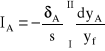
(13)
dla: 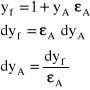
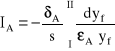
(14)
![]()
(15)
Średnia logarytmiczna definiowana jest następująco:
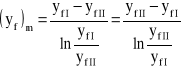
![]()
(16)
![]()
![]()
Ostatecznie otrzymamy zależność:
![]()
(17)
Możliwych jest wiele przypadków dyfuzji, które zostaną teraz omówione szczegółowo. Rozpatrzmy kolejno wybrane mechanizmy procesu dyfuzji i wyprowadźmy ostateczne wzory, z których można obliczyć gęstość strumienia dyfuzji składnika.
Przypadek I:
dyfuzja składnika A przez składnik inertny B
![]()
, ![]()
, ![]()
, ![]()
![]()
,![]()
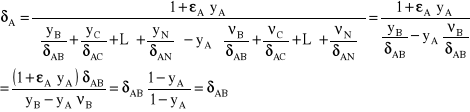
![]()
(18)
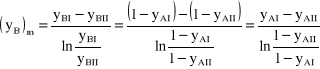
![]()
![]()
Otrzymuje się kilka równoważnych zależności dla różnych sposobów wyrażania stężeń składnika A:
![]()
(19)
![]()
(20)
![]()
(21)
![]()
(22)
Określmy równanie, według którego zmienia się stężenie w funkcji drogi:
Przekształćmy równanie:
![]()
(23)
![]()
(24)
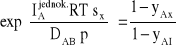
(25)
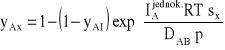
(26)
Zmiana stężenia w procesie jednokierunkowej dyfuzji składnika A przez inert B odbywa się po krzywej exponencjalnej.
Przykład 1:
W pionowej rurze o długości 2 m znajduje się nieruchomy strumień powietrza. Dolny koniec rury zanurzony jest w wodzie, a górny jest otwarty do atmosfery. Średnica wewnętrzna rury wynosi 50 mm. Zakładając, że temperatura układu wynosi 298 K, a ciśnienie 1000 hPa należy obliczyć: a) gęstość strumienia dyfuzji pary wodnej, b) po jakim czasie przez rurę przepłynie 1 kg pary wodnej. Założyć, że kinematyczny współczynnik dyfuzji pary wodnej w powietrzu wynosi 2,58⋅10-5 m2/s, ciśnienie nasyconej pary wodnej w warunkach procesu wynosi 3167 Pa, a powietrze omywające górny koniec rury jest suche. Rozwiązanie: Dane: Długość drogi dyfuzji s = 2 m, średnica wewnętrzna rury d = 0,05 m, warunki procesu T = 298 K, p = 1⋅105 Pa, współczynnik dyfuzji pary wodnej w powietrzu DAB = 2,58⋅10-5 m2/s prężność nasyconej pary wodnej w warunkach procesu pAI = 3167 Pa, prężność pary wodnej na końcu drogi dyfuzji pAII = 0 masa odparowanej wody mA = 1 kg. Przypadek opisany w zadaniu można potraktować jako proces dyfuzji jednokierunkowej przez inert.
|
|
Na rysunku zaznaczono kierunek dyfuzji oraz prężności pary wodnej panujące w przekroju I i II. Korzystając ze wzoru (22) opisującego gęstość strumienia dyfuzji można napisać, że:
![]()
Strumień pary wodnej wynosi:
![]()
Aby wyliczyć czas odparowania i odtransportowania 1 kg wody w sposób dyfuzyjny skorzystajmy z definicji strumienia substancji:
![]()
Stąd czas odparowania po wstawieniu masy molowej wody MA = 18 kg/kmol wynosi:
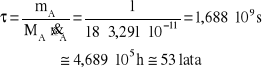
Przykład 2:
W próbówce o średnicy 10 mm znajduje się toluen. Początkowy poziom toluenu
w probówce jest poniżej 45 mm poniżej krawędzi. Należy obliczyć, po jakim czasie poziom obniży się o 60 mm, jeśli w pomieszczeniu odbywa się powolny ruch czystego powietrza. Temperatura procesu wynosi 295 K, ciśnienie 1010 hPa, a współczynnik dyfuzji acetonu w powietrzu w tych warunkach jest równy 9,4⋅10-6 m2/s. Gęstość ciekłego toluenu wynosi 867 kg/m3, a prężność nasyconej pary toluenu w temperaturze procesu jest równa 3212 Pa.
Rozwiązanie:
Dane: Średnica próbówki: d = 1⋅10-3 m,
początkowa droga dyfuzji: s0 = 45⋅10-3 m,
końcowa droga dyfuzji sk = 105⋅10-3 m,
warunki procesu T = 295 K, p = 1,01⋅105 Pa,
gęstość ciekłego toluenu ρA = 867 kg/m3
współczynnik dyfuzji toluenu w powietrzu DAB = 8,09⋅10-6 m2/s
prężność nasyconej pary toluenu w warunkach procesu pAI = 3212 Pa,
prężność par toluenu na końcu drogi dyfuzji pAII = 0
Można założyć, że proces odpowiada ustalonej dyfuzji jednokierunkowej przez inert, wówczas strumień dyfuzji toluenu w próbówce można opisać równaniem:
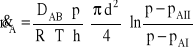
Z drugiej strony, korzystając z definicji strumienia, można napisać:
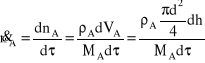
Porównując oba równania otrzymuje się zależność:
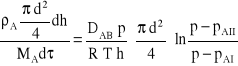
,
która po przekształceniu i rozdzieleniu zmiennych przyjmuje postać:
![]()
Dla całego procesu dyfuzji równanie to należy scałkować w granicach s0 - sk i 0 - τ
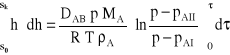
Ostatecznie otrzymuje się zależność, z której można policzyć czas odparowania toluenu:
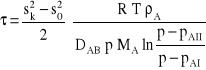
Po wstawieniu liczb otrzymuje się:
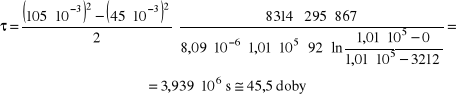
Przypadek II:
dyfuzja równomolowa przeciwkierunkowa w mieszaninie dwuskładnikowej
![]()
, ![]()
, ![]()
, ![]()
![]()
, ![]()
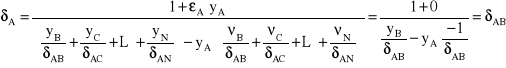
po uwzględnieniu powyższego:
![]()
(27)
lub
![]()
(28)
![]()
(29)
![]()
(30)
![]()
(31)
Równanie (31) jest identyczne z I prawem Ficka, które zostało przez niego sformułowane w 1855 r. na podstawie badań eksperymentalnych dyfuzji soli w wodzie.
Określmy równanie, według którego zmienia się stężenie w funkcji drogi s:
Przekształćmy równanie:
![]()
, (32)
w którym za drogę s wstawimy dowolny odcinek drogi sx, a za stężenie yAII dowolne stężenie na tym właśnie odcinku, czyli yAx:
![]()
(33)
Po przekształceniu:
![]()
(34)
Jest to równanie linii prostej, zatem stężenie obniża się wzdłuż drogi po linii prostej.
Porównując przypadek dyfuzji jednokierunkowej i przeciwkierunkowej w mieszaninie dwuskładnikowej można stwierdzić, że dyfuzja przeciwkierunkowa jest trudniejsza, tj, przebiega wolniej, bowiem wyrażenie:
![]()
(35)
Można powiedzieć, że ruch cząsteczek substancji B skierowany przeciwnie do ruchu cząsteczek A wytwarza dodatkowy opór dla cząsteczek A.
Przypadek III (najczęściej występujący w praktyce przemysłowej):
Dyfuzja jednego składnika przez mieszaninę wielu składników inertnych
![]()
, ![]()
, ![]()
, ![]()
, ..., ![]()
,![]()
![]()
, ![]()
Wprowadźmy pojęcie zastępczego składnika inertnego, zatem:
![]()
![]()
,![]()
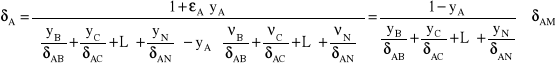
Wielkość ![]()
jest zastępczym współczynnikiem dyfuzji składnika A w mieszaninie wieloskładnikowej
![]()
(36)
gdzie mianownik jest równy:
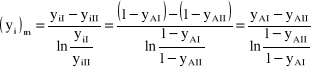
![]()
(37)
![]()
(38)
![]()
(39)
Zatem równanie przekształca się do postaci analogicznych jak dla dyfuzji składnika A przez jeden składnik inertny B, z tym że zastępczy współczynnik dyfuzji musi być obliczany z uwzględnieniem wszystkich współczynników binarnych (![]()
) oraz udziałów poszczególnych składników inertnych (![]()
).
Określmy równanie, według którego zmienia się stężenie w funkcji drogi s:
Przekształćmy równanie:
![]()
(40)
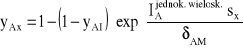
(41)
Zmiana stężenia w procesie dyfuzji jednokierunkowej przez mieszaninę inertów, podobnie jak przez jeden inert, ma charakter krzywej exponencjalnej.
Przykład 3:
Warstwa nieruchomego powietrza o grubości 1,2 m znajduje się pod ciśnieniem
1013 hPa w temperaturze 25°C. Przez tę warstwę dyfunduje dwutlenek węgla. W przekroju oznaczonym symbolem I stężenie CO2 w powietrzu wynosi 0,25% obj., a w przekroju II 0,05% obj. Współczynnik dyfuzji CO2 w powietrzu w temperaturze 0°C wynosi 1,03⋅10-5 m2/s. Proszę obliczyć gęstość strumienia dyfundującego dwutlenku węgla w procesie ustalonej dyfuzji przeciwkierunkowej i jednokierunkowej oraz profil zmian stężenia CO2 w powietrzu wzdłuż drogi dyfuzji dla obu przypadków.
Rozwiązanie:
Dane:
P = 1,013⋅105 Pa,
T = 298 K,
Droga dyfuzji s = 1,2 m
Ułamki objętościowe liczbowo równe są ułamkom molowym i wynoszą:
yAI = 0,0025
yAII = 0,0005.
Powietrze można traktować jako pseudoskładnik i zamiast dyfuzji przez mieszaninę inertów można rozpatrywać proces dyfuzji w układzie dwuskładnikowym.
Współczynnik dyfuzji w temperaturze T0 = 273 K wynosi DAB = 1,03⋅10-5 m2/s należy przeliczyć na warunki procesu. Korzystając z zależności Gillilanda określającej wpływ temperatury na współczynnik dyfuzji można napisać, że:
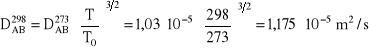
Obliczmy gęstości strumieni dwutlenku węgla:
a) Dyfuzja równomolowa przeciwkierunkowa:
Gęstość strumienia wynosi:
![]()
b) Dyfuzja jednokierunkowa przez inert:
Aby obliczyć gęstość strumienia skorzystajmy z zależność:
![]()
Obliczmy stężenie ![]()
:
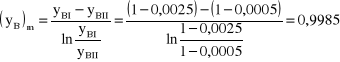
Zatem gęstość strumienia wynosi:
![]()
.
Obliczmy równania, według których zmienia się stężenie w funkcji drogi:
a) Dyfuzja równomolowa przeciwkierunkowa:
Korzystając z zależności (34) opisującej zależność stężenia składnika dyfundującego od drogi dyfuzji w procesie dyfuzji równomolowej przeciwkierunkowej można napisać, że:
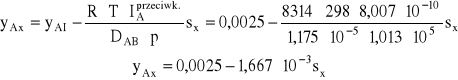
Jest to równanie linii prostej.
b) Dyfuzja jednokierunkowa przez inert:
Wykorzystując równanie (26) opisujące zmianę stężenia składnika dyfundującego od drogi w dyfuzji jednokierunkowej przez inert można po wstawieniu liczb otrzymujemy:
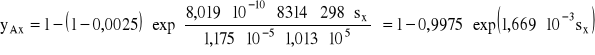
Zmiana stężenia w procesie dyfuzji jednokierunkowej przez inert odbywa się po krzywej exponencjalnej.
Schematyczne porównanie przebiegu obu zależności przedstawiono na poniższym rysunku.
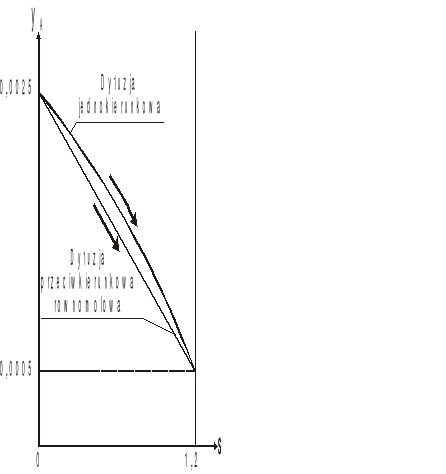
Rys. 2. Porównanie przebiegu zmian stężenia składnika dyfundującego wzdłuż drogi dyfuzji
w procesach dyfuzji jednokierunkowej przez inert
i w dyfuzji równomolowej przeciwkierunkowej.
Dyfuzja w fazie ciekłej
Precyzyjny opis dyfuzji w fazie ciekłej nie jest możliwy ze względu na to, że nie znamy tak dobrego narzędzia jakim jest teoria kinetyczna cieczy analogiczna do teorii kinetycznej gazów. Jeśli mimo braku podstaw teoretycznych spróbujemy opisać dyfuzję w cieczy za pomocą równań analogicznych do równań opisujących dyfuzję w gazach, to opis ten będzie tylko intuicyjny, a jego przydatność powinna być zweryfikowana doświadczalnie.
Jeśli zatem dla dyfuzji jednego składnika gazowego przez drugi gazowy składnik inertny wyprowadzone zostało równanie:
![]()
, (18)
to dla dyfuzji jednego składnika ciekłego przez drugi ciekły składnik inertny powinno być spełnione równanie:
![]()
, (42)
Można też, jak postępuje wielu badaczy, do opisu mechanizmu dyfuzji w fazie ciekłej stosować I prawo Ficka.
Doświadczalna weryfikacja równań tego typu odniesionych do fazy ciekłej pozwala na przyjęcie ich do praktyki obliczeniowej.
Wykłady z inżynierii chemicznej - Dyfuzja
Maksymilian Pająk i Wojciech Skrzypiński
13
Wyszukiwarka
Podobne podstrony:
Wnikanie masy, Radioizotopy i ochrona przed promieniowaniem, wyklady z podstaw inzynierii chemicznej
Filtracja, Radioizotopy i ochrona przed promieniowaniem, wyklady z podstaw inzynierii chemicznej
Rośliny jako potencjalne źródło filtrów UV w ochronie przed promieniowaniem słonecznym
Sposoby ochrony przed promieniowaniem komórkowym
Prawo ochrony przed promieniowaniem
Ochrona przed promieniowaniem jonizującym
OCHRONA PRZED PROMIENIOWANIEM JONIZUJĄCYM 2 ppt
obowiązki lek kierującego, obowiązki lek radiologa w zakresie ochrony przed promieniowaniem jonizują
Ochrona przed promieniowaniem laserowm
BHP w sprawie szczegółowych zasad ochrony przed promieniowaniem szkodliwym dla ludzi i środowiska, d
OCHRONA PRZED PROMIENIOWANIEM NADFIOLETOWYM, OCHRONA PRZED PROMIENIOWANIEM NADFIOLETOWYM
Ochrona przed promieniowaniem jonizującym ppt
więcej podobnych podstron
