Elementy kinetyczno - molekularnej teorii gazów. Ciśnienie gazu w zbiorniku zamkniętym.
Teoria kinetyczna gazów stanowi część ogólniejszej od niej teorii kinetyczno - molekularnej budowy ciał, zgodnie z którą wszystkie ciała są zbudowane z atomów i cząsteczek, pozostających w bezustannym ruchu. Zgodnie z tym poglądem teoria ta stara się wytłumaczyć jak największą liczbę zjawisk mających jakikolwiek związek z budową materii. Z mikroskopowego punktu widzenia wprowadzamy następujący model gazu doskonałego:
gaz składa się z cząsteczek, które można traktować jako punktu materialne;
cząsteczki poruszają się chaotycznie i podlegają zasadom dynamiki Newtona;
całkowita liczba cząstek jest bardzo duża
objętość cząsteczek jest małą częścią objętości zajmowanej przez gaz, więc można ją pominąć;
poza momentem zderzenia na cząsteczki nie działają żadne siły;
zderzenia są sprężyste, a czas ich trwania jest tak krótki, że można go pominąć.
Biorąc pod uwagę te wszystkie założenia otrzymano zależność, która informuje, że ciśnienie p, wywierane przez cząsteczki gazu na ścianki naczynia w wyniku zderzeń ze ścianką, zależy od liczby cząsteczek n przypadających na jednostkę objętości gazu i od średniej energii kinetycznej ruchu postępowego cząsteczek gazu ![]()
: ![]()
. Jest to podstawowy wzór kinetycznej teorii gazów.
Teorię kinetyczną gazów z równaniem stanu gazu doskonałego wiąże następujące równanie: ![]()
- równanie to możemy uważać za definicję temperatury na gruncie teorii kinetycznej. Oznacza ono, że: Całkowita energia kinetyczna ruchu postępowego jednego mola cząsteczki gazu doskonałego jest proporcjonalna do temperatury. Kinetyczno - molekularna teoria gazów została stworzona zanim zaistniały możliwości badawcze, pozwalające na obserwację pojedynczych cząsteczek. Jednym z pierwszych bezpośrednich dowodów istnienia cząsteczek i słuszności założeń tej teorii były ruchy Browna. Ruchami Browna nazywamy chaotyczne ruchy wykonywane przez bardzo małe, widoczne jedynie pod mikroskopem optycznym, cząstki zawiesin w gazie i cieczy. Przyczyną ruchów Browna jest ruch cząsteczek i ich zderzenia z cząstkami zawiesiny. Ruchy Browna stanowią najbardziej bezpośrednie potwierdzenie statystycznego charakteru praw makroskopowych. Dla tak małych cząstek przestaje obowiązywać prawo Pascala. Liczba cząsteczek gazu bombardujących z różnych stron cząsteczkę zawiesiny podlega wahaniom.
Kinetyczną teorią gazów nazywamy naukę o budowie i własnościach fizycznych gazów opartą na statystycznych modelach badania ( Własności makroskopowe układów składających się z bardzo dużej liczby cząstek badane są metodą statystyczną. Metoda statystyczna oparta jest na wykorzystaniu teorii prawdopodobieństwa oraz określonych modeli budowy badanych układów. Układy złożone z dużej liczby cząstek charakteryzują pewne wartości średnie wielkości fizycznych, opisujące zbiór cząstek jako całość. W gazie np. są określone średnie wartości prędkości ruchu cieplnego cząsteczek i ich energii.) Ciśnienie gazu w naczyniu stanowi rezultat zderzeń cząsteczek gazu ze ściankami naczynia. Ciśnienie gazu jest makroskopowym przejawem ruchu cieplnego cząsteczek. Podczas zderzeń ze ściankami naczynia cząsteczki zmieniają swoje pędy, a przekaz ściankom odpowiednich pędów prowadzi pojawienia się ciśnienia gazu. W przypadku gazu doskonałego wzajemne zderzenia cząsteczek w objętości naczynia nie wpływają na wartość ciśnienia gazu na ścianki. Ze względu na chaotyczność ruchu cieplnego cząsteczek ciśnienie gazu na wszystkie ścianki naczynia jest jednakowe i, zgodnie z definicja ( ciśnieniem p nazywamy wielkość fizyczną liczbowo równą sile działającej na jednostkę powierzchni ciała wzdłuż normalnej do tej powierzchni: p= dF / ds. - gdzie dF jest wartością składowej normalnej siły działającej na mały element powierzchni ciała ds.), równe wartości średniej siły działającej na jednostkę powierzchni ścianki wzdłuż normalnej do tej ścianki. Podstawowe równanie kinetycznej teorii gazów: ![]()
, gdzie ![]()
jest ciśnieniem gazu, ![]()
jego objętością, a ![]()
- sumaryczną energią kinetyczną ruchu postępowego N znajdujących się w naczyniu cząsteczek. CD.
Pojęcie temperatury; skale temperatur.
Temperatura jest to wielkość fizyczna, której równość zapewnia równowagę termiczną ciał będących ze sobą w kontakcie. Jak to prościej wyjaśnić - Weźmy dwa ciała: A, które wydaje nam się zimne i B, które odczuwamy jako gorące. Jeżeli ciała te zetkniemy ze sobą, to po pewnym czasie odczujemy, że ich „ciepłota” wyrównała się. Stan, który oba ciała osiągną, nie będzie ulegał dalszym zmianom. Taki stan nazywamy równowagą termiczną. Ciała A i B uzyskują równowagę termiczną wtedy, gdy ich temperatury staną się jednakowe. Aby określić czy dwa ciała, nie będące ze sobą przez wystarczająco długi czas w kontakcie, są w równowadze termicznej, należy użyć trzeciego ciała, zwykle bywa to termometr. Tu należy wspomnieć o zerowej zasadzie termodynamiki: Jeżeli ciało A jest w równowadze termicznej z ciałem C i ciało B jest także w równowadze z tym samym ciałem C, to oba ciała A i B są w równowadze termicznej. To prawo daje nam logiczne podstawy wykorzystania termometrów. ( Aby zbudować termometr musimy znaleźć pewne mierzalne cechy fizyczne, które zmieniają się wraz ze zmianą temperatury. Nazywamy je cechami termometrycznymi. Są to między innymi takie wielkości jak, jak objętość cieczy, długość ciał stałych, opór elektryczny lub ciśnienie gazu w zamkniętym naczyniu. Każda z tych cech może być użyta do pomiaru temperatury. W najczęściej spotykanych termometrach, z przyczyn praktycznych, wykorzystujemy rozszerzalność termiczną rtęci. Oczywiście musimy zdawać sobie z tego sprawę, że wybranie pewnego ciała termometrycznego prowadzi do powstania jakiejś szczególnej skali temperatur. Może się zdarzyć, że różne skale nie będą nie będą dawały jednakowych wyników. Dlatego też zawarto porozumienie i przyjęto jako wzorcowy tzw. termometr gazowy. W urządzeniu tym cechą termometryczną jest ciśnienie zamkniętej masy gazu( najlepiej pod obniżonym ciśnieniem) w stałej objętości. W międzynarodowej skali Celsjusza ( skali stustopniowej) temperaturę oznacza się przez t i mierzy w ![]()
( stopień Celsjusza). Przyjmuje się, że pod ciśnieniem normalnym ![]()
temperatury topnienia lodu i wrzenia wody są odpowiednio równe ![]()
i ![]()
. W termodynamicznej ( bezwzględnej) skali temperatur temperaturę mierzy się w kelwinach (K) i oznacza T. Związek między temperaturą bezwzględną T i temperaturą w skali Celsjusza jest następujący ![]()
. Temperaturę T = 0 (t = -273,15°C) nazywamy temperaturą zera bezwzględnego. W niektórych krajach anglosaskich jest w życiu codziennym stosowana skala Fahrenheita, której jeden stopień jest 5/9 razy mniejsza niż stopień Celsjusza, a zero bezwzględne przypada na -459,67°F.
Równanie stanu gazu doskonałego; równanie Clapeyrona.
Gazem doskonałym( idealnym) nazywamy gaz, którego cząsteczki nie oddziałują ze sobą „na odległość” oraz mają znikomo małe rozmiary własne. Podczas zderzeń wzajemnych oraz zderzeń ze ściankami naczynia cząsteczki gazu doskonałego zachowują się jak doskonale sprężyste kuleczki (o średnicy d - efektywna średnica cząsteczki - zależnej od chemicznej natury gazu. Występowanie średnicy efektywnej d( d ∼ 10 - 10m) oznacza, że między cząsteczkami działają wzajemnego odpychania. Międzycząsteczkowe siły przyciągania szybko maleją wraz ze wzrostem odległości r między cząsteczkami. Wodór, hel, tle, azot przyjmuje się za gazy doskonałe przy gęstościach odpowiadających warunkom normalnym. Dla danej masy gazu doskonałego stosunek iloczynu wartości liczbowych ciśnienia i objętości do temperatury bezwzględnej jest wielkością stałą (równanie Clapeyrona): ![]()
. Wartość liczbowa stałej gazowej C zależy od masy gazu i jego składu chemicznego. Jeśli ![]()
jest objętością właściwą gazu( objętością właściwą gazu nazywamy wielkość, która jest odwrotnością gęstości![]()
ciała: ![]()
. W przypadku ciała jednorodnego objętość właściwa jest równa objętości ciała o masie jednostkowej), a M jego masą, to ![]()
i wtedy równanie Clapeyrona przybiera postać ![]()
, gdzie ![]()
jest właściwą stałą gazową, przypadającą na jednostkę masy.
Z definicji mola wynika, że mol dowolnego gazu zawiera jednakową liczbę cząsteczek - liczbę (stałą) Avogarda ![]()
( ![]()
). Masą molową ![]()
gazu lub dowolnego ciała nazywamy wielkość fizyczną równą stosunkowi masy M gazu ( lub dowolnego ciała) do liczby N moli w nim zawartych: ![]()
. Masa molowa jest wprost proporcjonalna do względnej masy cząsteczek gazu: μ =10 -3 m/m0, gdzie m jest masą cząsteczki danego gazu, m0 - jednostką masy atomowej w skali węglowej. Współczynnik 10 -3 pojawia się dlatego, ponieważ w układzie SI masę molową mierzymy w kg / mol. Objętością molową Vμ nazywamy wielkość fizyczną równą stosunkowi objętości V gazu do liczby N moli zawartych w gazie: Vμ = V / N. Masa mola jest liczbowo równa μ, dlatego Vμ = μv, gdzie v jest objętością właściwą.
Równanie stanu dla jednego mola gazu doskonałego jest następujące: ![]()
lub ![]()
. We wzorze tym R jest uniwersalną stałą gazową, tzn. stałą gazowa odniesioną do jednego mola gazu. Uniwersalność stałej R wynika z prawa Avogarda, zgodnie z którym mole wszystkich gazów doskonałych w jednakowych ciśnieniach i temperaturach zajmują jednakowe objętości. W warunkach normalnych ( T = 273,15 K, p=1,0132⋅105 Pa = 1atm = 760 mm Hg) mol dowolnego gazu zajmuje objętość Vμ = 22,415⋅10 -3m. Stąd można obliczyć wartości liczbowe R w różnych układach jednostek. Jeśli w objętości V gazu zawarta jest masa M kg, czyli M / μ moli, to V = (M / μ)⋅ Vμ i równanie stanu gazu przybiera postać: ![]()
, nazywamy równaniem stanu gazu doskonałego. Stałą Bolzmanna k nazywamy wielkość fizyczną równą stosunkowi uniwersalnej stałej gazowej R do liczby Avogarda NA, tzn. k = R / NA. Równanie stanu gazu, wyrażone za pomocą stałej Bolzmanna, ma postać: ![]()
, gdzie n0 = NA / Vμ jest liczbą cząsteczek gazu w jednostce objętości ( koncentracja cząsteczek). W stałej temperaturze ciśnienie gazu jest wprost proporcjonalne do koncentracji jego cząsteczek (lub gęstości gazu). ![]()
.
Przemiany gazowe: izotermiczna, izobaryczna i izochoryczna. Badanie przemiany izotermicznej gazu - ćwiczenia.
Parametry stanu gazu są ze sobą powiązane równaniem zwanym równaniem stanu. Podstawą do sformułowania równania stanu gazu są odkryte doświadczalnie prawa przemian gazowych. Prawa te opisują zmianę właściwości ustalonej porcji gazu w procesach: izotermicznym, izobarycznym i izochorycznym.
Przemianę izotermiczną, tzn. taki proces, w którym ![]()
, p
Opisuje prawo Boyle'a i Mariotte'a: Dla ustalonej liczby moli gazu i temperatury iloczyn
ciśnienia i objętości jest w ustalonej temperaturze wielkością stałą. T=const
![]()
.
V
Przemianę izobaryczną, czyli taką, w której ![]()
opisuje prawo Gay - Lussaca:
v0 p =const Dla ustalonej liczby moli gazu pod stałym ciśnieniem 0 V
wzrost temperatury powoduje wzrost objętości gazu
proporcjonalny do różnicy temperatur:
![]()
, gdzie: V - objętość w temperaturze t°C, V0-objętość w
0 273K T temp. 0°C, α - współczynnik termicznej rozszerzalności gazu.
Współczynnik ten dla każdego gazu jest nieco inny, a liczbowo równy względnemu przyrostowi objętości, przypadającemu na jednostkowy przyrost temperatury: ![]()
. W przemianie izobarycznej ![]()
.
Przemianę izchoryczną, tzn. taki proces, w którym ![]()
, opisuje prawo Charlesa: p
Dla ustalonej liczby moli gazu w stałej objętości wzrost temperatury powoduje wzrost v=const
ciśnienia gazu proporcjonalny do różnicy temperatur: ![]()
gdzie: p - ciśnienie w temperaturze t°C, p0 - ciśnienie w temperaturze 0°C p0
β - współczynnik prężności termicznej gazu.
0
273K T
Współczynniki α, β mają różne wartości dla różnych gazów. Jednak przy małym ciśnieniu i wysokiej temperaturze dążą one do wartości ![]()
. Dla gazu doskonałego przyjmujemy ![]()
. Przy użyciu skali Kelvina ( T = t + 273) prawa Gay - Lussaca i Charlesa przyjmują postać: ![]()
(G - L), oraz ![]()
; gdzie: T - odpowiada temperaturze t, T0 - temperaturze 0°C.
Energia wewnętrzna ciała. Pojęcie ciepła. I zasada termodynamiki.-praca wykonana
przez gaz.
Do swoich rozważań weźmy pod uwagę bardzo prosty układ fizyczny: porcję gazu w poziomo leżącym cylindrze, zamkniętym ruchomym tłokiem o powierzchni S. Podstawowy stan układu charakteryzujemy podają wielkości parametrów podstawowych - objętości V0 i ciśnienia p0. W stanie równowagi siły parcia gazu na ścianki naczynia muszą być zrównoważone przez siły sprężystości ścianek; dla zrównoważenia siły parcia gazu na powierzchnię tłoka (F0 = p0S), na tłok musi działać specjalnie przyłożona siła zewnętrzna F = - F0. Nawet minimalne zmniejszenie siły zewnętrznej powoduje, że na tłok zaczyna działać niezrównoważona siła i tłok zacznie się przesuwać w kierunku przeciwnym niż przyłożona siła zewnętrzna. Objętość gazu zacznie wzrastać, a ciśnienie stopniowo maleć. Przesunięciu tłoka towarzyszy wykonanie pracy. Ponieważ zwroty przesunięcia i siły zewnętrznej są przeciwne, wiec praca L siły zewnętrznej jest ujemna. Dodatnia jest natomiast praca L0 = - L, jaką wykonuje siła parcia gazu F0. Zdolność do wykonania (dodatniej) pracy świadczy o tym, że układ posiada pewien zasób energii. Energię tą nazywamy energią wewnętrzną. Energię wewnętrzną można wyrazić przez podstawowe parametry stanu, używane do makroskopowego opisu naszego układu, a więc przez ciśnienie i objętość. Wyrażamy to krótko stwierdzeniem, że energia wewnętrzna jest funkcja stanu układu. (Jest to suma wszystkich rodzajów energii wszystkich cząsteczek danego ciała lub układu ciał, które zależą od stanu wewnętrznego, a nie zewnętrznego, jak np. energia kinetyczna). Przy zmianach stanu układu energia wewnętrzna zmienia się. W rozważanej przez nas zmianie stanu gazu w cylindrze towarzyszyło wykonanie pracy przez układ, a więc zmniejszenie energii wewnętrznej. Jeżeli zaś zamiast zmniejszyć siłę zewnętrzną zwiększymy ja ponad wartość niezbędną w stanie równowagi, to tłok zacznie przesuwać się w kierunku przeciwnym niż poprzednio, objętość gazu zmaleje, ciśnienie wzrośnie. Tym razem przesunięcie tłoka ma ten sam zwrot co siła zewnętrzna, więc siła zewnętrzna wykonuj dodatnią pracę L. Dodatni znak pracy siły zewnętrznej świadczy o tym, że energia układu wzrasta. Wnioski, do których doszliśmy analizując bardzo prosty układ fizyczny, obowiązują dla dowolnie skomplikowanych układów. Każdy makroskopowy układ fizyczny posiada pewien zasób energii wewnętrznej. Energia wewnętrzna jest funkcja stałą układu. Każdej pracy wykonanej przez układ lub nad układem przez siły zewnętrzne towarzyszy zmiana stanu układu i odpowiednia zmiana energii układu. (dowolny układ termodynamiczny znajdujący się w dowolnym stanie termodynamicznym ma określoną energię całkowitą W, w której skład wchodzą:
energia kinetyczna
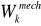
ruchu mechanicznego układu jako całości( lub jego makroskopowych części)Energia potencjalna
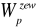
, układu umieszczonego w zewnętrznych polach sił( na przykład elektromagnetycznym, grawitacyjnym;Energia wewnętrzna
![]()
. Energią wewnętrzną ciała lub układu termodynamicznego nazywamy energię zależną tylko od stanu termodynamicznego ciała (układu). W przypadku układu nieruchomego, nie umieszczonego w zewnętrznych polach sił, energia wewnętrzna jest równa energii całkowitej. Energia wewnętrzna jest również równa energii spoczynkowej ciała (układu) i zawiera w sobie energię wszystkich postaci ruchów wewnętrznych w ciele (układzie) oraz energię oddziaływania wzajemnego wszystkich cząstek( atomów, cząsteczek, jonów itp.), z których składa się ciało( układ). Energia wewnętrzna - gazu doskonałego U jest proporcjonalna do średniej energii kinetycznej jego cząsteczek( i tym samym do temperatury gazu): ![]()
, gdzie: ![]()
- liczba cząsteczek gazu, ![]()
- liczba moli, ![]()
-liczba Avogarda, ![]()
- średnia energia kinetyczna cząsteczek - gazu jest proporcjonalna do temperatury gazu i zależy od liczby stopni swobody cząsteczki: ![]()
, ![]()
, gdzie: ![]()
- stała Bolzmanna, ![]()
- stała gazowa, oraz ![]()
- liczba stopni swobody ![]()
=3, 4, 5 odpowiednio dla gazu jedno-, dwu-, i trójatomowego, jeśli więzy między atomowe można traktować jako sztywne, przy czym trzy stopnie swobody związane są z ruchem postępowym, pozostałe - z obrotowym w przestrzeni. W warunkach normalnych cząsteczki gazów wieloatomowych zachowują się zgodnie z powyższym założeniem.
Ciepło jest to wielkość opisująca przepływ energii wewnętrznej wywołany różnicą temperatur. Ciepła nie należy utożsamiać z energią wewnętrzną układu. Jest ono wielkością analogiczną do pracy. Ciepło (podobnie jak praca) nie charakteryzuje ani stanu początkowego, ani końcowego układu, a tylko sam proces zmiany energii. Energia wewnętrzna natomiast jest jednoznacznie określona prze parametry stanu układu. Każdy makroskopowy układ fizyczny posiada pewien zasób energii wewnętrznej. Energia wewnętrzna jest funkcją stanu układu Energie wewnętrzną układu można zmienić w sposób mechaniczny, wykonując nad układem pracę, oraz w sposób mechaniczny - drogą wymiany cieplnej. Jest to jedno z możliwych sformułowań pierwszej zasady termodynamiki.
I zasadę termodynamiki możemy zapisać następująco: ![]()
, co oznacza: W dowolnej przemianie termodynamicznej układu zamkniętego zmiana![]()
energii wewnętrznej jest równa ciepłu ![]()
dostarczonemu do układu i pracy ![]()
wykonanej nad układem. We wzorze obowiązują prawa umowne dotyczące znaków. Rozpatrzmy kilka przypadków zastosowania tej zasady.
I) ![]()
gdy ![]()
- ta postać pierwszej zasady termodynamiki oznacza zwykłe nagrzewanie ciała. Temperatura ciała ulega zwiększeniu, czyli wzrasta jego energia wewnętrzna. Wartość dostarczonej energii obliczamy ze wzoru: ![]()
( m - masa ciała ogrzewanego, c - ciepło właściwe). W przypadku, gdy wym11111iana ciepła z otoczeniem na odprowadzaniu ciepła do otoczenia będzie miało znak ujemny ![]()
. Energia ciała maleje a więc ![]()
.
II) ![]()
gdy ![]()
. Gdy![]()
, to zapis ten oznacza, że nad ciałem wykonano pracę. Ciepła nie doprowadzono. Przykładem może być wielokrotne wyginanie drutu - po wykonaniu kilku ruchów drut rozgrzeje się zanim pęknie( skutek podobny jak w I) ale bez użycia ciała o wyższej temperaturze)Wzrost energii wewnętrznej sygnalizowany jest przyrostem temperatury (![]()
).
III) ![]()
- oznaczać to może nagrzewanie drutu nad palnikiem z równoczesnym wyginaniem. Przyrost energii wewnętrznej będzie w tym przypadku będzie większy niż poprzednio.
IV) ![]()
gdy ![]()
. Ten przypadek może występować podczas wyginania drutu połączonego z intensywnym chłodzeniem.( Rozgrzany wyginaniem drut polewamy zimną wodą - ![]()
i ![]()
). Stosując w zapisie bezwzględne wartości ciepła i pracy, można ten przypadek wyrazić w innej postaci, a mianowicie: ![]()
. Popularnie nosi on skrótową, choć nie w pełni poprawną nazwę: „Zamiana pracy na ciepło” (![]()
.
VI) Przypadek odwrotny, „zamiana ciepła na pracę”, ma miejsce w silnikach cieplnych. Spalane paliwo dostarcza ciepła ![]()
, a silnik wykonuje ( oddaje otoczeniu) pracę, co zapisujemy, że ![]()
. I zasada termodynamiki dla tego przypadku przyjmuje następującą postać: ![]()
(![]()
, ![]()
, ![]()
) lub ![]()
. „Pracę na ciepło” możemy zamienić w każdych warunkach, natomiast do procesu odwrotnego potrzeba skomplikowanych urządzeń, tzw. silników cieplnych.
Pierwszą zasadę termodynamiki możemy sformułować jako możliwość realizowania perpetuum mobile I rodzaju, tzn. urządzenia, które dokonywałoby pracę bez pobierania energii z jakiegokolwiek źródła. Doświadczenie wykazuje, że ilość ciepła Q, jaką trzeba dostarczyć układowi jednorodnemu, aby temperatura wzrosła od t0 do t1 ≥ t0, jest proporcjonalna do masy układu i różnic temperatur: Q = cm(t1 - t0). Współczynnik proporcjonalności c we wzorze zależy od rodzaju substancji oraz warunków, w jakich zachodzi wymiana cieplna ( p = const lub V = const). Współczynnik ten nazywamy ciepłem właściwym, jest on liczbowo równy ilości ciepła potrzebnej do ogrzania jednostki masy danej substancji o 1°C (1 K). Dokładne pomiary wykazują, że ciepło właściwe nie jest w rzeczywistości stałe, lecz jest funkcją temperatury( liniowe związki między ciepłem a różnicą temperatur są przybliżone, można je stosować tylko przy niezbyt dużych różnicach temperatur). Ciepło mierzymy w tych samych jednostkach co pracę i energię. Podstawową jednostką ciepła jest dżul [Q] = J, zaś jednostką ciepła właściwego ![]()
.
Praca wykonywana przez gaz. Przemiany gazowe w świetle I zasady term.
Jeśli układ termodynamiczny jest nieruchomy, to do wykonania pracy niezbędne jest przemieszczenie oddziałujących z nim ciał zewnętrznych, tzn. konieczna jest zmiana parametrów zewnętrznych stanu układu (ciśnienie, objętość). W przypadku braku pól zewnętrznych wymiana energii między nieruchomym układem i ośrodkiem zewnętrznym za pomocą pracy może nastąpić tylko przy zmianie objętości i kształtu układu. Zgodnie z zasadą zachowania energii praca A′ wykonana nad układem przez siły zewnętrzne jest liczbowo równa i przeciwna, co do znaku pracy A, jaką sam układ wykonuje nad ośrodkiem zewnętrznym, tzn. przeciw siłom zewnętrznym: A′ = -A.
Pracą ekspansji( rozszerzenia) nazywamy pracę, jaką układ wykonuje przeciwko siłom ciśnienia zewnętrznego. Elementarna praca ekspansji jest równa ![]()
, gdzie ![]()
jest równomiernie rozłożonym ciśnieniem zewnętrznym, a ![]()
elementarną zmianą objętości układu.
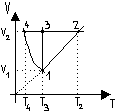
W przypadku izoprocesów równowagowych w gazach pierwsza zasada termodynamiki przybiera postać:
Do przemiany izobarycznej: (1) ![]()
, (2)![]()
, (2)′ ![]()
, (2)′′ ![]()
; (2)′ i (2)′′⇒(2) ![]()
ale (3) ![]()
zatem (2)i(3)⇒(1) ![]()
bo ![]()
.
Do przemiany izochorycznej: (1) ![]()
, (2) ![]()
czyli (2)⇒(1) ![]()
.
Do przemiany izotermicznej: ![]()
- w przemianie izotermicznej zmiana energi wewnętrznej wynosi 0; ![]()
- w przemianie izotermicznej mamy równoważność pracy i ciepła. 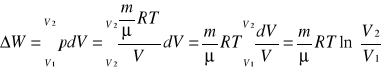
, ![]()
;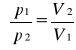
![]()
, ![]()
czyli 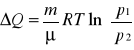
.
Gdzie: ![]()
- ciepło molowe przy stałym ciśnieniu,![]()
- ciepło molowe przy stałej objętości, ![]()
- liczba moli, ![]()
na podstawie prawa Meyera, ![]()
- wykładnik adiabaty(![]()
, ![]()
).
Adiabatyczna przemiana gazu.
Przemiana adiabatyczna gazu polega na sprężaniu i rozprężaniu gazu w zbiorniku, którego ścianki uniemożliwiają przepływ ciepła. W praktyce każda ścianka w mniejszym lub większym stopniu przewodzi ciepło. Jeżeli jednak przepływ ciepła jest powolny w porównaniu z czasem przemiany, możemy go zaniedbać. Przykładem przemiany adiabatycznej jest sprężanie mieszanki w cylindrach silników spalinowych. Ilość ciepła, które w czasie sprężania wymienia mieszanka z otoczeniem, jest bardzo mała w porównaniu z pracą włożoną w sprężanie gazu.
Dla gazu doskonałego energia wewnętrzna jest proporcjonalna do temperatury i nie zależy od innych parametrów stanu. Z pierwszej zasady termodynamiki dla procesu adiabatycznego wynika, że sprężaniu gazu doskonałego, a więc dodatniej pracy sił zewnętrznych, towarzyszy wzrost temperatury gazu. Rozprężeniu, a zatem ujemnej pracy sił zewnętrznych, towarzyszy spadek temperatury gazu. Oba te zjawiska znalazły zastosowanie w praktyczne. (W wysokoprężnych silnikach spalinowych - silnikach Diesla - silne sprężanie mieszanki powietrza z paliwem w cylindrze powoduje tak znaczny wzrost temperatury, że zapłon następuje bez pomocy elektrycznych aparatów zapłonowych i świec zapłonowych stosowanych w zwykłych silnikach spalinowych. Adiabatyczne rozprężanie wykorzystuje się w chłodnictwie. Stanowi ono podstawę działania lodówek sprężarkowych. Rozprężony gaz ochładza się, a następnie pobiera ciepło od ścianek zamrażalnika, przez które przepływa. W przemianie adiabatycznej: ![]()
.
![]()
- równanie Poissona. ![]()
. (1) ![]()
;
(2)![]()
gdzie (2)′ ![]()
ponieważ nie ma wymiany ciepła z otoczeniem; (2)′′ ![]()
. (2)′′⇒(1) ![]()
wynika z tego, że ![]()
czyli ![]()
. Przyrost energii wewnętrznej w procesach adiabatycznych: ![]()
.
Ciepło molowe gazu; sens fizyczny uniwersalnej stałej gazowej. Ciepło właściwe
cieczy i ciał stałych.
Ciepło molowe ![]()
jest stosunkiem ilości ciepła ![]()
pobranego przez ciało do iloczynu ilości materii (wyrażanej przez liczbę moli) ![]()
ciała i przyrostu temperatury![]()
wywołanego jego pobieraniem: ![]()
. Ciepło molowe informuje nas o ilości ciepła potrzebnego do ogrzania 1 mola danej substancji o 1 kelwin. Między ciepłem molowym a właściwym zachodzi związek: ![]()
. Stała gazowa inaczej - uniwersalna stała gazowa, jest miarą pracy wykonanej przez rozrzedzający się 1 mol gazu przy ogrzaniu go jeden stopień Celsjusza; występuje w równaniu stanu gazu doskonałego.
Jak wiemy, dostarczenie ciału ciepła prowadzi do wzrostu jego energii wewnętrznej, a co za tym idzie do wzrostu jego temperatury o ![]()
. Możemy zapisać: ![]()
∼ ![]()
, ![]()
- masa ciała. Zamiast pisać znak proporcjonalności możemy wstawić współczynnik proporcjonalności, noszący nazwę ciepła właściwego. Jest to pewien parametr charakteryzujący cieplne właściwości ciała: ![]()
, stąd ![]()
, ![]()
. Możemy powiedzieć: Ciepło właściwe jest liczbowo równe ilości ciepła potrzebnego do ogrzania 1 kg danej substancji o 1K. Ciepło właściwe jest wielkością makroskopową, dostępną naszym pomiarom. Ciepło właściwe przy stałej objętości i ciśnieniu również jest wiązane równaniem Mayera i ma postać: ![]()
gdzie ![]()
jest masą molową.
Cykl kołowy prosty i odwrotny. Procesy odwracalne i nieodwracalne; II zasada
termodynamiki.
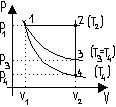
Procesem kołowym lub cyklem (procesem cyklicznym) nazywamy taki zbiór procesów termodynamicznych, w wyniku którego układ powraca do stanu wyjściowego. Na wykresach stanu p(V), p(T) i innych równowagowe procesy cykliczne przedstawione są za pomocą krzywych zamkniętych, gdyż dwóm tożsamościowym stanom - początkowi i końcowi procesu cyklicznego - z wykresie odpowiada ten sam punkt. Układ termodynamiczny, w którym przebiega proces cykliczny oraz w którym możliwa jest wymiana energii z innymi ciałami( otoczeniem), nazywamy ciałem roboczym. W maszynach cieplnych zwykle tym ciałem jest gaz. Graficznie można przedstawić tylko procesy równowagowe - w przypadku procesów nierównowagowych nie można mówić o parametrach stanu dla całego ciała( lub układu). Dlatego podobne wykresy dla procesów nierównowagowych są niemożliwe.
Dowolny równowagowy proces cykliczny C1aC2b C1, któremu poddany jest gaz doskonały, można rozbić na proces rozprężania gazu ze stanu C1 do stanu C2 (krzywa C1aC2) i proces sprężania gazu ze stanu C2 do stanu C1 (krzywa C2b C1). Podczas rozprężania gazu wykonuje on dodatnią pracę A1 mierzoną polem powierzchni figury V1 C1aC2 V2. Sprężanie gazu zachodzi w wyniku działania sił zewnętrznych, które wykonują dodatnią pracę A′ = -A2, mierzoną polem powierzchni figury V1 C1bC2 V2. Ponieważ A1 >A2′, więc w czasie cyklu gaz wykonuje dodatnią pracę A = A1 + A2 = A1 - A2′ mierzoną polem obszaru ograniczonego krzywą tego procesu C1aC2b C1. Obszar ten został zakreskowany.
Cyklem prostym nazywamy proces kołowy, w którym układ wykonuje pracę ujemną ![]()
. Na wykresie p(V) cykl prosty reprezentuje krzywa zamknięta, którą ciało robocze w czasie procesu obiega zgodnie z ruchem wskazówek zegara. Przykładem cyklu prostego jest cykl, jaki wykonuje ciało robocze w silniku cieplnym. W takim silniku ciało robocze otrzymuje energię w postaci ciepła ze źródeł zewnętrznych i jej część oddaje w postaci pracy*(ciepło i praca nie są postaciami energii, lecz formami jej zmian. W rozpatrywanym silniku ciepło jest formą pobierania energii wewnętrznej, praca zaś formą jej oddania w postaci mechanicznej).
Cyklem odwrotnym nazywamy proces kołowy, w którym układ wykonuje pracę ujemną ![]()
. Na wykresie p(V) cykl odwrotny reprezentuje krzywa zamknięta, którą ciało robocze w czasie procesu obiega przeciwnie do kierunku ruchu wskazówek zegara. Przykładem cyklu odwrotnego jest cykl, jaki wykonuje ciało robocze w urządzeniu chłodniczym. W urządzeniu takim ciało robocze pobiera ciepło od ciała o niższej temperaturze i przekazuje je ciału o temperaturze wyższej kosztem wykonanej nad nim pracy.
Proces termodynamiczny nazywamy procesem odwracalnym, jeśli po przejściu go przez układ termodynamiczny najpierw w normalnym, a następnie w przeciwnym kierunku, zarówno układ, jak i wszystkie ciała zewnętrzne, z którymi układ oddziaływał, wracają do stanu wyjściowego. Inaczej mówiąc, w procesie odwracalnym układ termodynamiczny może wrócić do stanu wyjściowego w taki sposób, że w otaczającym ośrodku nie pozostawi to żadnych zmian. Warunkiem koniecznym odwracalności procesu termodynamicznego jest aby wszystkie stany pośrednie w tym procesie były stanami równowagowymi. Jednakże fakt, iż proces jest procesem równowagowym, nie oznacza jego odwracalności. (Przykład 1. Procesem odwracalnym jest mechaniczny ruch ciała w próżni przy całkowitym braku sił tarcia. Niech, np. w tych warunkach ciało zostanie wyrzucone z pewną prędkością początkową w polu sił ciężkości (własność pola polegająca na tym, że na umieszczony w nim punkt materialny działa siła proporcjonalna do jego masy) pod pewnym kontem względem poziomu. Poruszając się po torze parabolicznym upadnie ono na Ziemie w pewnym miejscu. Jeśli następnie wyrzucimy to ciało z miejsca upadku, pod tym samym kontem i z tą samą prędkością początkową, lecz przeciwnie skierowaną, to ciało poruszając się w kierunku przeciwnym, zakreśli ten sam tor i upadnie w punkcie początkowym. Dowolne stany przejściowe poruszającego się ciała czy to w kierunku pierwotnym, czy też w przeciwnym są całkowicie tożsame. Odwracalność ruchów mechanicznych oznacza ich symetryczność względem zmiany przyszłości na przeszłość, tzn. względem zmiany znaku czasu. Odwracalność ruchów mechanicznych wynika z różniczkowych równań ruchu. Przy zmianie znaku czasu zmienia się również znak prędkości ciała, natomiast wchodzące do równań przyśpieszenie zachowuje swój znak)
Przykład 2. Procesem odwracalnym są drgania niegasnące, które wykonuje w próżni ciało zawieszone na sprężystej sprężynie. Układ „ciało - sprężyna” jest układem zachowawczym. Jego drgania mechaniczne nie powodują zmian energii chaotycznego ruchu cieplnego cząstek układu. Do zmiany jego stanu prowadzą tylko zmiany konfiguracji i prędkości. Lecz zmiany te całkowicie powtarzają się po upływie czasu równego okresowi drgań T, zatem warunki odwracalności procesu są spełnione. Proces odwracalny jest przemianą termodynamiczną, dla której możliwe jest przeprowadzenie układu i otoczenia z ich stanów końcowych do stanów początkowych dokładnie po tej samej „drodze” - przez takie same stany pośrednie. Proces taki jest idealizacją procesów realnych i może zachodzić tylko wtedy, gdy w układzie działają siły pola zachowawczego.
Procesy nieodwracalne są to dowolne procesy nie spełniające warunków odwracalności, czyli np. proces, który powoduje zmiany w otoczeniu - dyssypacja energii. Przykład: Procesem nieodwracalnym jest zwykły proces hamowania ciała pod wpływem siły tarcia. Jeśli są to jedyne działające na ciało siły, to prędkość maleje i w końcu ciało zatrzymuje się. Energia ruchu mechanicznego ciała jako całość maleje, zamieniając się w energię ruchu chaotycznego cząstek ciała i otaczającego środowiska. Rośnie energia wewnętrzna ciała i otoczenia, które w wyniku działania sił tarcia ogrzewają się. Rozpatrzony prosty proces przebiega samorzutnie: następuje on bez jakichkolwiek procesów zachodzących w otoczeniu. Zaistnienie procesu odwrotnego i powrót układu do stanu początkowego oznaczałoby, że zatrzymane ciało zaczęłoby poruszać się ponownie w wyniku ochłodzenia ciała i otoczenia. Jak wynika z doświadczeń, nie jest możliwe, aby chaotyczny ruch cieplny cząsteczek ciała mógł w sposób samorzutny doprowadzić do uporządkowanego ruchu wszystkich cząsteczek ciała jako całość. Do urzeczywistnienia takiego ruchu konieczny jest dodatkowy proces kompensacyjny ochłodzenia ciała i otoczenia do temperatury początkowej. W procesie takim chłodnicy zostanie przekazana ilość ciepła Q, a nad ciałem zostanie wykonana praca A′ = Q. Jak widać, kolejne przeprowadzenie takich procesów ( zwykłego i odwrotnego) doprowadza układ „ciała - otoczenie” do stanu początkowego, lecz stan ciał zewnętrznych ulegnie zmianie. Dlatego wszystkie procesy, którym towarzyszy tarcie, są procesami nieodwracalnymi.
Pierwsza zasada termodynamiki głosi, że w procesach termodynamicznych( tj. przy uwzględnieniu zamiany energii na ciepło) jest zachowana całkowita energia. Nie wprowadza ona jednak żadnych ograniczeń w możliwości zmiany pracy na ciepło lub ciepło na pracę. Wiadomo z praktyki, że możemy dowolną, określoną ilość pracy zamienić całkowicie na ciepło, ale nigdy nie będziemy w stanie wynaleźć urządzenia, które określoną ilość ciepła pozwoliłoby zamienić całkowicie na pracę.
Druga zasada termodynamiki, która jest rezultatem wielu doświadczeń, orzeka, że nie istnieją takie urządzenia, które przenosiłyby ciepło z ciała zimnego do gorącego bez dodatkowej pracy zewnętrznej. W sformułowaniu R. E. Clausiusa brzmi: Niemożliwy jest taki proces termodynamiczny, którego jedynym rezultatem byłoby przekazanie ciepła przez ciało chłodniejsze ciału bardziej nagrzanemu. Sformułowanie drugiej zasady termodynamiki podane przez T. W. Kelvina brzmi następująco: Niemożliwy jest taki proces termodynamiczny, którego jedynym rezultatem byłoby pobrane pewnej ilości ciepła przez układ i wykonanie przez układ pracy. Druga zasada termodynamiki wyklucza możliwość przepływu ciepła od ciała zimniejszego do cieplejszego bez innych zmian, a więc określa kierunek przenoszenia ciepła. Sformułowanie drugiej zasady termodynamiki wyklucza możliwość zbudowania „doskonałego” silnika cieplnego, ponieważ nie możemy wytwarzać pracy mechanicznej pobierając wyłącznie ciepło z pojedynczego zbiornika, bez zwracania pewnej ilości tego ciepła do innego zbiornika o niższej temperaturze. Druga zasada termodynamiki sprowadza się więc do stwierdzenia, że nie możliwe jest pobieranie ciepła z jednego, termicznie jednorodnego ciała o zamiana go na pracę bez wprowadzania zmian w otoczeniu, czyli niemożliwe jest zrealizowanie perpetuum mobile II rodzaju.
Z drugiej zasady termodynamiki wynika między innymi istnieje funkcji stanu, zwanej entropią, wprowadzoną przez L. Boltzmanna. Entropia jest funkcją stanu, którą oznaczamy literą S, i której zmiana w izotermicznym procesie odwracalnym jest równa stosunkowi ciepła Q, dostarczonego układowi, do temperatury T układu: ![]()
. Wykorzystując pojęcie entropii możemy dla procesów nieodwracalnych zapisać nierówność: ![]()
. Łącznie dla procesów odwracalnych i nieodwracalnych w układach izolowanych( układ ciał, na który nie działają siły zewnętrzne) zachodzi zależność: ![]()
. Jest to nierówność Clausiusa, stanowiąca matematyczny wyraz drugiej zasady termodynamiki. II zasada termodynamiki można teraz zapisać następująco: We wszystkich układach izolowanych( odosobnionych) całkowita entropia układu nie może maleć. (ENTROPIA - miara nieuporządkowania układu. Zdefiniowana jest dla makrostanu układu osłoniętego adiabatyczne( czyli o ustalonej energii), za pomocą wzoru: ![]()
, gdzie: ![]()
- liczba mikrostanów wchodzących w skład danego makrostanu, ![]()
- stała Boltzmanna. Własności entropii: a) S ≥ 0 ( entropia jest nieujemna - nieujemność); b) S = S1 + S2 ( entropia układu jest równa sumie entropii podukładów - addytywność, ekstensywność); c) ΔS ≥ 0 (entropia układu izolowanego nigdy nie maleje - jedno z równoważnych sformułowań II zasady termodynamiki; d) ΔS = Q/T (przyrost entropii układu, który pobrał w temperaturze T ciepło Q)
Przemiany fazowe pierwszego rodzaju; ciepło przemiany fazowej.
Pochłanianie lub wydzielanie ciepła przez układ jest związane z jego przejściem z jednej fazy w inną. Faza to jednolita część układu różniąca się od pozostałych właściwościami termodynamicznymi. Różne stany substancji, takie jak ciecz, gaz czy ciało stałe, nazywamy fazą substancji. Przemiany fazowe następują wtedy, gdy pod wpływem zmieniających się warunków zewnętrznych dochodzi do przebudowy struktury wewnętrznej ciała. Przykładami przemian fazowych jest topnienie i krzepnięcie, parowanie, wrzenie, skraplanie, sublimacja, resublimacja. Mówimy, że przemiana fazowa jest pierwszego rodzaju, jeżeli z przemianą tą związane jest wydzielanie lub pochłanianie ciepła i występuje też różnica gęstości między fazami. Przemian fazowa nazywa się przemianą drugiego rodzaju, jeżeli nie jest z nią związany efekt cieplny i zmiana gęstości, ale występuje skokowa zmiana takich wielkości, jak: ciepło właściwe, współczynnik rozszerzalności objętościowej. Przykładem takiej przemiany jest przejście ciekłego helu ze stanu normalnego w stan nadciekły oraz przemiana ferromagnetyka w paramagnetyk w punkcie Curie. Ciepło przemiany fazowej - ciepło utajone; ciepło przepływające między układem a otoczeniem podczas przejścia określonej ilości substancji z jednej fazy do drugiej przy stałym ciśnieniu i temperaturze; przykładami takiego ciepła są: ciepło parowania, topnienia, skraplania.( Ciepłem przemiany fazowej - nazywamy ilość energii pochłoniętej lub uwolnionej w trakcie przemiany fazowej 1 kg substancji).
Ciepło topnienia jest ciepłem pobranym(ilość energii) przez jednostkową masę substancji przy przejściu z fazy stałej do fazy ciekłej przy stałym ciśnieniu i w stałej temperaturze: ![]()
, ![]()
. Ciepło topnienia mierzymy w J/kg.
Ciepło parowania jest to ilość ciepła pobierana przez jednostkowa masę substancji przy przejściu z fazy cieczy do fazy pary w temperaturze wrzenia. ![]()
, ![]()
- ciepło parowania danej substancji w określonej temperaturze. Ciepło parowania zależy od rodzaju cieczy i temperatury. Szczególny przypadkiem parowania jest cieczy jest wrzenie. Zachodzi ono w odróżnieniu od „zwykłego” parowania, w całej objętości cieczy. Temp. wrzenia zależy od ciśnienia panującego w cieczy.
Krzywe równowagi termodynamicznej układów dwufazowych. Wykres stanu( dla
wody);punkt potrójny.
Krzywe równowagi faz są to krzywe na wykresie fazowym oddzielające od siebie obszary odpowiadające występowaniu różnych faz. Dla parametrów odpowiadających tym krzywym fazy współistnieją w równowadze, nie przechodzą w siebie. (Równowaga fazowa makroskopowo polega na tym, że tyle samo cząsteczek przechodzi z fazy ciekłej do stałej ile odwrotnie).
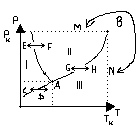
I - ciało stałe(lód) pk - ciśnienie krytyczne
II - ciecz(woda) Tk - temperatura krytyczna
III - para
IV - gaz
A - punkt potrójny M→N - nie ma przejścia fazowego
B - punkt krytyczny E→F - topnienie H→G -skraplanie
C →D - sublimacja F→E - krzepnięcie
D→C - resublimacja G→H - parowanie
Punkt krytyczny to punkt, w którym identyczne masy cieczy i gazu mają identyczne objętości i różnica między fazami zanika. Temperatura krytyczna dla wody wynosi 374°C. Temperaturze tej odpowiada ciśnienie krytyczne. Dla temperatur po wyżej temperatury krytycznej nie stosujemy określenia „para” tylko „gaz”, między parą a gazem nie zachodzi przemiana fazowa.
Punkt potrójny - opisuje warunki, w których ciało może istnieć równocześnie w stanie ciekłym, stałym i gazowym, zachowując równowagę termodynamiczną. Parametry punktu potrójnego są ściśle określone - pp = 611 Pa, Tp = 273,16 K- tak że mogą służyć za wzorzec. Wartość temperatury punktu potrójnego wody służy właśnie za wzorzec bezwzględnej skali temperatury Kelvina.
Izotermy pary i gazów; stan krytyczny materii.
22
1 - 2 przemiana izobaryczna
![]()
; ![]()
.
- prawo Gay - Lussaca
![]()
![]()
![]()
![]()
2 - 3 - 4 przemiana izochoryczna
![]()
;![]()
.
- prawo Charlesa
![]()
![]()
![]()
3 - 1 przemiana izotermiczna
![]()
;![]()
.
- prawo Boyle'a - Mariotte'a
![]()
![]()
![]()
1 - 4 przemiana adiabatyczna
![]()
- równanie Poissona
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Ferromagntyki odznaczają się bardzo silnymi właściwościami m, Szkoła, penek, Przedmioty, Fizyka, Teo
fizyka do nauki, Szkoła, penek, Przedmioty, Fizyka, Teoria
1-Fizyka jako nauka, Szkoła, penek, Przedmioty, Fizyka, Teoria
3-Astronomia i grawitacja, Szkoła, penek, Przedmioty, Fizyka, Teoria
SPR YNKA I, Szkoła, penek, Przedmioty, Nawigacja, Teoria, Materiały do nauki na I egzamin Nawigacyj
program zajęc aud I sem 10-11, Szkoła, penek, Przedmioty, Nawigacja, Teoria, Materiały do nauki na I
Dewiacja, Szkoła, penek, Przedmioty, Nawigacja, Teoria, Materiały do nauki na I egzamin Nawigacyjny
LAB3, Szkoła, penek, Przedmioty, Fizyka, Laborki
Galwanometr, Szkoła, penek, Przedmioty, Fizyka, Laborki
ekonomia 5, Szkoła, penek, Przedmioty, Ekonomia, Teoria
Skrajnik dziobowy, Szkoła, penek, Przedmioty, BISS, Teoria
wyznaczenie optycznych widm emisyjnych i absorpcyjnych2, Szkoła, penek, Przedmioty, Fizyka, Laborki
Pomiary Rezystancji, Szkoła, penek, Przedmioty, Fizyka, Laborki
materiały niebezpieczne, Szkoła, penek, Przedmioty, Ładunkoznawstwo
Charakterystyki Tyrystora, Szkoła, penek, Przedmioty, Fizyka, Laborki
więcej podobnych podstron