Słabe kwasy i zasady Prawo rozcieńczeń Ostwalda |
Rozpatrzmy dysocjację słabego kwasu w roztworze wodnym:
CH3COOH + H2O H3O+ + CH3COO-
Tę równowagę opisuje stała dysocjacji Ka=1.8.10-5:
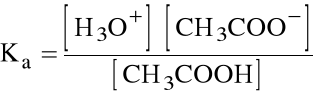
Jeśli pominąć jony H3O+ pochodzące z autodysocjacji wody (jest ich na pewno 10-7 M), to
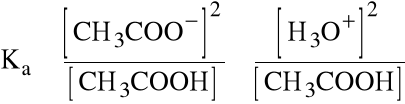
Jeśli zaś pamiętamy, że słaby kwas jest zdysocjowany w niewielkim stopniu ([CH3COOH]=ca):
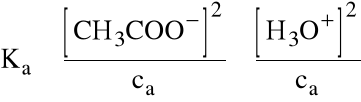
Stąd łatwo policzyć pH roztworu słabego kwasu o znanym stężeniu i stałej pKa:
![]()
|
Przykład 1: obliczyć pH 0.01 M roztworu CH3COOH (pKa=4.8).
Korzystamy ze wzoru Ostwalda:
![]()
Zatem (z definicji) pH=3.4. Zauważmy, że oba założenia Ostwalda są spełnione.
Przykład 2: obliczyć pH 0.0001 M roztworu kwasu cyjanowodorowego (pKa=10).
Próba powtórzenia poprzedniej procedury daje pH=7. Odczyn nie może być obojętny (jest to przecież roztwór kwasu), więc jedno z założeń Ostwalda nie stosuje się.
Dla bardzo słabych i/lub rozcieńczonych elektrolitów trzeba uwzględniać jony H+ lub OH- pochodzące z autodysocjacji wody:
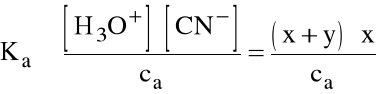
gdzie x - stężenie jonów H+ pochodzących z dysocjacji kwasu (=[CN-]), y - stężenie jonów H+ pochodzących z autodysocjacji wody (=[OH-]).
Odpowiednio przedstawiamy wyrażenie na iloczyn jonowy wody:
Kw=10-14=(x+y).y
Rozwiązanie tego układu dwóch równań prowadzi do następujących wyników:
x = 0.707.10-7 ; y = 0.707.10-7 ; [H+] = x+y = 1.41.10-7 ; pH = 6.85
Słabe kwasy i zasady Prawo rozcieńczeń Ostwalda |
Prawo Ostwalda pozwala też obliczyć pH roztworów soli słabych elektrolitów. Pamiętajmy, że zgodnie z teorią Brnsteda każdy kwas ma sprzężoną z nim zasadę.
Przykład: obliczyć pH 0.01 M roztworu NH4Cl. Z tablic znajdujemy, że pKa,NH4+=9.2.
Jon amonowy jest kwasem, zaś amoniak zasadą:
kwas zasada + H+ |
|
Sole są silnymi elektrolitami, dysocjują całkowicie, więc [NH4+]=csoli. Ze wzoru Ostwalda zatem wynika, że
![]()
a więc pH=5.6.
|
Prawo Ostwalda pozwala też w łatwy sposób obliczyć stopień dysocjacji kwasu lub zasady.
Weźmy znów jako przykład kwas octowy rozpuszczony w wodzie (stała dysocjacji Ka=1.8.10-5):
CH3COOH + H2O H3O+ + CH3COO-
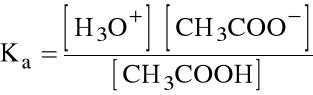
Zdefiniujmy stopień dysocjacji kwasu jako ułamek liczby moli, które zdysocjowały, do całkowitej ilości kwasu:
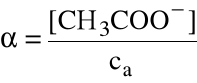
Jeśli pominąć jony H+ pochodzące z autodysocjacji wody (jest ich na pewno 10-7 M), to [H+]/ca. Ponadto [CH3COOH]=ca[CH3COO-]ca-ca.ca. Stąd
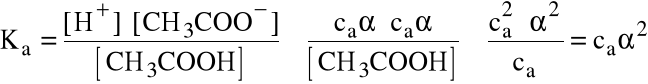
Słabe kwasy i zasady Prawo rozcieńczeń Ostwalda |
Przykład: obliczyć stopień dysocjacji CH3COOH w jego
a/ 0.01 M;
b/ 0.001M roztworze
(pKa=4.8).
Skoro pKa=4.8, to Ka=104.81.8.105 .
Z prawa Ostwalda Ka=ca.2, czyli
a/
=![]()
=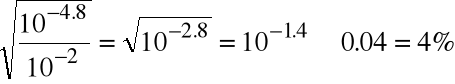
b/
=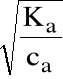
=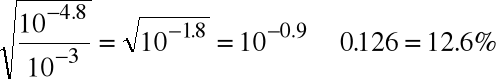
Zwróćmy uwagę, że moc kwasu rośnie z jego rozcieńczeniem.
© J. Gliñski, w. 7, p. 3
Wyszukiwarka