skanuj0071

iliul®.........................................................................
Przewodnictwo elektryczne elektrolitów polega na ruchu jonów dodatnich (kationów) ku elektrodzie ujemnej (katodzie), a jonów ujemnych (anionów) ku elektrodzie dodatniej (anodzie). Ładunki jonów po dojściu do anody i katody ulegają zobojętnieniu i na elektrodach wydzielają się pierwiastki w czystej chemicznie postaci, bądź wchodzą w reakcje z atomami elektrod lub innymi atomami otoczenia. Przewodnictwo elektryczne elektrolitów rośnie ze wzrostem temperatury (przeciwnie niż w metalach), ponieważ rośnie stopień dyso-cjiicji i ruchliwości jonów.
Przepływ prądu przez elektrolity i towarzyszące mu reakcje chemiczne określa sięmianem elektrolizy.
Wspomniane już wydzielanie się substancji chemicznych na elektrodach podlega prawom Faraday’a. Pierwsze z nich mówi, że masa substancji wydzielonej na każdej z elektrod jest proporcjonalna do wartości ładunku przeniesionego przez elektrolit:
m=k-Q~ k-I- x
(4)
gdzie: k to równoważnik elektrochemiczny, Q - ładunek elektryczny (Q-Iv), I - natężenie stałego prądu, v- czas elektrolizy. Równoważnik elektrochemiczny A: jest równy liczbowo masie substancji wydzielonej przy przepływie przez elektrolit ładunku 1 C.
Drugie prawo elektrolizy Faraday’a podaje, że masy substancji wydzielonych na różnych elektrodach przy przepływie tego samego ładunku, są proporcjonalne do odpowiednich gramorównoważników chemicznych tych substancji:
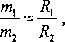
(5)
gdzie: R = MJz to gramorównoważnik chemiczny substancji, M - masa atomowa (molowa) substancji, z - wartościowość jonów.
Z równań (4) i (5) wynika, że stosunek gramorównoważnika chemicznego do elektrochemicznego jest wielkością stałą:
k. kn k z ■ k
gdzie: F jest stałą Faraday'a. Przepływ takiego ładunku przez elektrolit powoduje wydzielenie 1 gramorównoważnika chemicznego substancji.
Można obliczyć, że stała Faraday’a jest równa iloczynowi ładunku elementarnego e i liczby Avogadra N/.
F = e-NA = 96 484 C mol'1 - 96 500 C moF1 (7)
2. Metoda pomiaru

Rys. 1. Schemat układu pomiarowego z aparatem Hofmanna
2.1. Wyznaczania równoważnika elektrochemicznego wodoru
Do tego celu często używamy aparatu Hofmanna. Są to trzy szklane naczynia połączone ze sobą (rys.l). W dwóch biuretach, zaopatrzonych w szczelne korki, zbierają się gazowe produkty elektrolizy. Platynowe płytki, zamocowane w gumowych korkach zamykających od dołu biurety, służą jako elektrody. Środkowa rurka, zakończona otwartą bańką, służy do zbierania wypieranej cieczy i daje możliwość pomiaru ciśnienia hydrostatycznego wywieranego przez elektrolit na gazy.
Aparat zasilany jest z zasilacza prądu stałego (12 V) poprzez regulowany opornik R, służący do ustalania stałej wartości prądu (0,2+1,0 A). Aparat wypełniony jest 10% roztworem kwasu siarkowego (H2SO4). Podczas elektrolizy na elektrodzie dodatniej wydziela się tlen, a na ujemnej wodór. Możemy jednak wyznaczyć tylko równoważnik elektrochemiczny wodoru, ponieważ tlen w znacznym stopniu rozpuszcza się w roztworze.
Wyszukiwarka
Podobne podstrony:
skanuj0010 (311) !. Przewozy kontenerowe lądowo-morskie wozy multimodalne powinny się odbywać na pod
skanuj0011 (290) 4.2.2. Przewozy lądowo-promowe W przewozach lądowo-promowych jedn
skanuj0018 (277) przewód omoczni Rys. 167. Błony płodowe. ■ &8&sr. pęcherzyk żółtkowy jama
skanuj0008 5, Osłuchiwanie przewodzenia głosu - klatkę piersiową osłuchujemy wtedy
skanuj0011 miernik był podłączony za pomocą przewodów miedzianych, zbudowane ogniwo możemy zapisać:
skanuj0019 (131) stwa”. 2. „Dziecko w wieku do lat 7 może być przewożone na rowerze, pod warunkiem ż
więcej podobnych podstron