P1100077
i redukcja substancji elektroaktywmych, jest określony przez własności rozpust czalnika om z elektrody pracującej. Wyidealizowaną krzywił prąd-nn pięcie, odpo. władającą roztworowi wodnemu, przedstawiono na rys. 1.2.
|
j5p |
8 |
•l|
Rys. li Krzywi prąd-aapiędc i granicząc włości napięcia dla elektrolizy rortwuiów wodnych
•I
W przedziale AB prąd praktycznie nie płynie; w przedziale lym elektroda jest idealnie polaryzowałoś. Zmiany potencjału w tym obszarze zmieniają ładunek po obydwu stronach granicy faz w taki sposób, jakby to były okładki idealnego kondensatora. Warstwa podwójna zachowuje się tak, jak kondensator bez strat Idealnie polaryzowana elektroda może zatem przyjmować dowolny potencjał względem roztworu, w zależności od napięcia źródła zewnętrznego (w przedziale AB) i utrzy. mywać go po odłączeniu źródła. Przykładem elektrod idealnie polaryzowanych mogą być elektrody: Hg, Pt, C i podobne, zanurzone w roztworze KG lub KNO,. Zanieczyszczenia znajdujące się w układach rzeczywistych powodują krótkotrwałe utrzymywanie się potencjału elektrodowego.
Reakcje elektrochemiczne substancji clektiouktywnych mogą przebiegać w przedziale potencjałów od A do B. W celu zorientowania się, czy dana reakcja będzie przebiegać, można wykorzystywać dane termodynamiczne. Krzywe prąd-napięcie, odpowiadające zarówno powolnej jak i bardzo szybkiej reakcji elektrochemicznej, przedstawione są na rys. 1.3.
Jak widać w pierwszym przypadku (układ powolny) nie ma wartości potencjału, przy której utlenianie i redukcja przebiegałyby równocześnie z dostatecznie dużą
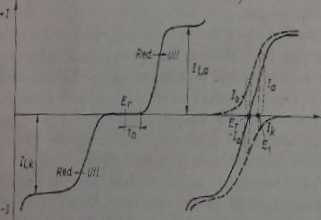
Rys. 1.3. Krzywe prąd-napięcie dla prostej reakcji elektrochemicznej: a) dla porofnera układa elektrochemicznego, b) dla szybkiego układu elektrochemicznego
szybkością. Przy potencjale równowagi E, (l - 0) prądy katodowy i anodowy są jerowe lub bardzo małe. Jeśli konieczne jest, żeby utlenianie lab redukcja przebiegały wystarczająco szybko, nałeży zapewnić warunki, w których E > E, lub E 4 Er W omawianym przypadku potencjał równowagowy nie jest dokładnie określony, ten wzrost potencjału nazywany jest nadnaplędem aktywacyjnym rj, (przy założeniu, fis na powierzchni elektrody nie występuje zmiana stężenia substancji cłcktrotktyw-nej> Nadnapięcie aktywacyjne jest wynikiem przepływu prądu o określonej gęstości. Ogólnie. jeśli przez elektrodę przepływa prąd, przyjmuje ona potencjał pracy, który lóini się od równowogowego - elektroda się polaryzuje. Miarą polaryzacji Jest nadnapięcie. a przyczyną mała szybkość jednego ze zjawisk cząstkowych. Na przykład powolny proces przeniesienia ładunku jest przyczyną nadnapięóa aktywacyjnego i;,, powolny transport substancji - przyczyną nadnaplącia stężeniowego *jc. powolna reakcja chemiczna - przyczyną nudnapięda chemicznego itd. W ogólnym przypadku zatem potencjał pracy elektrody
E = - Ej+ij (1.5)
W drugim przypadku (szybki układ) widać, żc istnieje przedział potencjałów, w którym utlenianie I redukcja przebiegają równocześnie i to z dostatecznie dużą szybkością. Na przykład przy potencjale E = prąd I, jest miarą szybkości procesu utleniania, a prąd /k — miarą szybkości procesu redukcji. Sumaryczny prąd
f I | B
Przy potencjale równowagowym E, szybkość procesu utleniania jest równa szybkości procesu redukcji
Ift-IU-f* (l.t)
Dla szybkich reakcji prąd wymiany f0 ma dużą wartość i potencjał równowagowy jest ściśle określony (rys. 1.4). Z krzywej prąd-napięcie dla szybkiego układu
Rys. %Ą. Kierunek przeniesienia ładunku oraz wielkość przeniesionego ładunku w zależności od potencjału elektrody

E>Er
widać, żc nadnapięcie aktywacyjne jest bardzo małe. Ze względu na to, żc w przypadku o którym mowa utlenianie i redukcja są procesami zbliżonymi do odwracalnych, szybki układ określany jest mianem układu odwracalnego, a układ powolny -mianem układu nieodwracalnego. Określenia te nic są całkowicie adekwatne, ponieważ nie chodzi tu o termodynamiczną odwracalność lub nieodwracalność.
Kinetyka reakcji elektrochemicznych jest zbliżona do kinetyki reakcji chemicznych. Co najwyżej uwzględnia się zależność od potencjału elektrody. Z uwagi na
27
Wyszukiwarka