P1050445
L KONDI KTOMKTR1 \ 5
q>
6,mS
§,mS
I
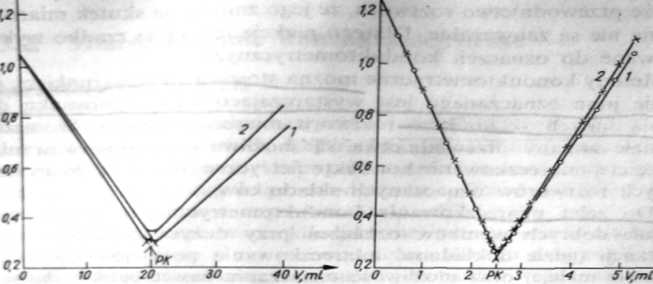
Rys. 2.7. Krzywa miareczkowania konduktometryczncgo mocnego kwasu mocną zasadą: a) roztwór 0.0008 mol/1 HO miareczkowano roztworem 0,01 mol/1 NaOH; I — bez poprawki na rozcieńczenie. 2 — z poprawką na rozcieńczenie; b) roztwór (LOOl mol/1 HO miareczkowano roztworem 0,1 mol/1 NaOH (punkty wyznaczone z poprawką na rozcieńczenie oznaczono x, a punkty bez poprawki o)
Krzywą miareczkowania ok. 0,001 mol/1 HC1 roztworem 0,01 mol/1 NaOH przedstawiono na rys. 2.7a.W pobliżu punktu równoważności występuje niewielkie zaokrąglenie krzywej. Spowodowane jest ono głównie rozcieńczeniem roztworu. Wprowadzenie poprawki na roz-
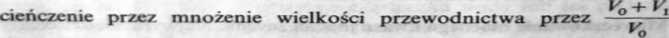
<*'«, — objętość pierwotna roztworu miareczkowanego, — objętość dodanego titrantu) zmniejsza zaokrąglenie krzywej (rys. 2.7a krzywa 2), ale go nie likwiduje, ponieważ przewodnictwo nie jest ściśle proporcjonalne do rozcieńczenia — jak to zakłada stosowanie poprawki. Poprawka taka uchodzi za wystarczającą, jeżeli stężenie titrantu jest co najmniej lO-krotnie większe od stężenia roztworu miareczkowanego [1.3]. W miareczkowaniach przeprowadzonych w Politechnice Łódzkiej dopiero zastosowanie titrantu o stężeniu 100-krotnie większym (0,1 mol/1) od stężenia roztworu miareczkowanego mocnego kwasu doprowadziło do otrzymania dwóch przecinających się prostych (rys. 2.7b). Zastosowanie poprawki na rozcieńczenie nie ma w przypadku tych stężeń wyraźnego wpływu na przebieg krzywej
Wyszukiwarka