ANG234562345678
p
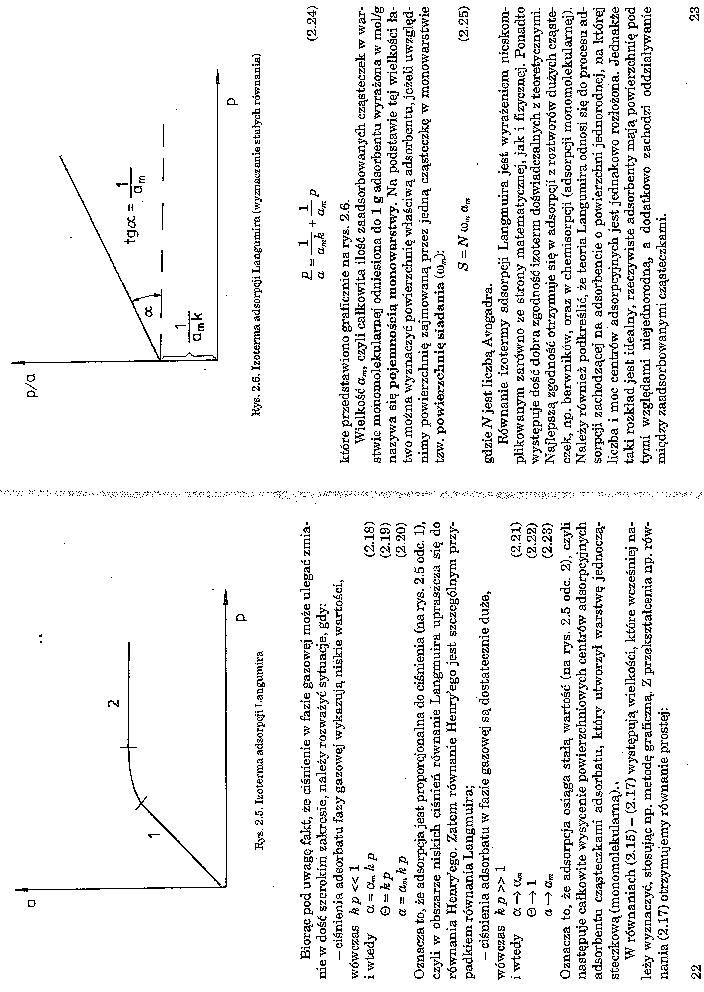
Rys. 2.5. Izoterma adsorpcji T.anguwira
Biorąc pod uwagę fakt, że ciśnienie w fazie gazowej może ulegać zmianie w dość szerokim zakresie, należy rozważyć sytuacje, gdy:
-ciśnienia adeorbatu fazy gazowej wykazują niskie wartości, wówczas k p « 1
i wtedy a - cl kp (2.18)
ę>~kp (2.i9>
cr=aa,kp . (2.20)
Oznacza to, że adsorpcja jeat. proporcjonalna do ciśnienia (na rys. 2.5 ode. 1), czyli w obszarze niskich ciśnień równanie Langmuira upraszcza się do równania Henr/cgo. Zatem równanie Herrryego jest szczególnym przypadkiem równania Langmuira;
- ciśnienia adsorbatu w fazie gazowej sa. dostatecznie duże, wówczas k p » 1
i wtedy c< —> (2.21)
© -> 1 (2.22)
a —> Cr, (2.23)
Oznacza to, że adsorpcja osiąga stalą wartość (na rys. 2.5 ode. 2), czyli następuje całkowite wysycenie powierzchniowych centrów adaorpcyjnych adsorbentu cząsteczkami adsorbatu, który utworzył warstwę jednoczą-steczkową (monomolekularną). *
W równaniach (2.15) — (2.17) występują wielkości, które wcześniej należy wyznaczyć, stosując np. metodę graficzną. Z przekształcenia np. równania (2.17) otrzymujemy równanie prostej:
p/a
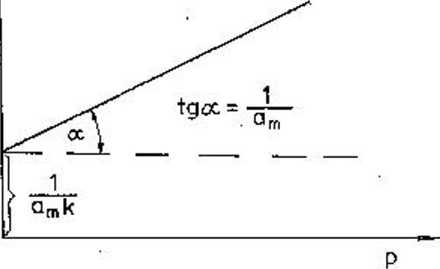
Kye. 2.6. Izoterma adsorpcji Lao^iimlra (wyznaczanie stałych równania)
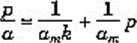
które przedstawiona graficznie na rys. 2.6.
Wielkość amt czyli całkowita ilość zaadsorbowanyćh cząsteczek w warstwie monomolekularnej odniesiona do 1 g adsorbentu wyrażona w moL/g nazywa się pojemnością monownrstwy. Na podstawie tąj wielkości łatwo można wyznaczyć powierzchnię właściwą adsorbentu, jeżeli uwzględnimy powierzchnię zajmowaną przez jedną cząsteczkę w monowarstwie tzw. powierzchnię siadania (cO:
S-N <o^am (2.25)
gdzie N jest. liczbą Avogadra.
Równanie izotermy adsorpcji Langmuira jest wyrażeniem nieskomplikowanym zarówno ze strony matematycznej, jak i fizycznej. Ponadto występuje dość dobra zgodność izoterm doświadczalnych z teoretycznymi. Najlepszą zgodność otrzymuje się w adsorpcji z roztworów dużych cząsteczek, np. barwników, oraz w ćhemisorpcji (adsorpcji monomolekularnej). Należy również podkreślić, że teoria Langmuira odnosi się do procesu adsorpcji zachodzącej na adsorbencie o powierzchni jednorodnej, na której liczba i moc centrów* adsorpcyjnych jest jednakowo rozłożona. Jednakże taki rozkład jest idealny, rzeczywiste adsorbenty mają powierzchnię pod tymi względami niejednorodną, a dodatkowe zachodzi oddziaływanie między zaadsorbowanymi cząsteczkami.
23
Wyszukiwarka
Podobne podstrony:
ANG234562345678 p Rys. 2.5. Izoterma adsorpcji T.angumira Biorąc pod uwagę fakt, że ciśnienie w fazi
Scan0059 SHY^t B OY ruszyłem dalej, by wybrać dwa konie zapasowe i zapisać ich numery. Biorąc pod uw
DSC00067 Prawo włączonego środka łyda. Biorąc pod uwagę fakt, że na operacje togo ty. pu decydują si
przeglad�3 116 Agnieszka Zaremba nictwie1 2. Biorąc pod uwagę fakt, że przemysł okrętowy traktowany
Biorąc pod uwagę fakt, że na pojedynczej, 80-kolumnowej karcie kodowano do osiemdziesięciu
Okres Królestwa Polskiego (1864—1914) 69 dokładny69. Niemniej biorąc pod uwagę fakt, że szybko
arcz 93 Rys. 6.2. Wykres trakcyjny ulepszony Biorąc pod uwagę, że dla danego samochodu opór powietrz
ANG23456234567 p Rys. 2.3. Izoterma adsorpcji Henry ego2.4. Równanie izotermy Langmulra Teoria Langm
bywało w innych formatach wzorowanych na MARC - 12 znaków. Biorąc pod uwagę fakt, iż oznaczenie pozi
75481 P1050584 (2) Biorąc pod uwagę to, że długość wyrobiska jest znacznie większa w porównaniu z wy
więcej podobnych podstron