s che 1F

Zaobserwować zmianę barwy warstwy organiczny i nieorganicznej.
Napisać równanie reakcji Wskazać utleniacz i reduktor.
i 1.Ł4. Redukujące właściwości wodoru
Doświadczenie l.
Do probówki zawierający 15-20 kropli roztworu kwasu siarkowego(VI) dodać 1-2 krople roztworu mangani&nii(Vll) potasu. Otrzymany roztwór powinien mieć barwę bladoróżową. Następnie wrzucić do probówki kawałek cynku.
W pierwszym etapie reaguje cynk z H2S04 i powstaje atomowy wodór, który w dnjgim etapie reakcji redukuje KMnQ* do MnSO<
Obserwować zachodzącą zmianę barwy roztworu.
Napisać równania zachodzących reakcji
Co wskazuje na przebiegającą redukcję mangaruanu( VU)?
11.3. PYTANIA 1 ZADANIA
1. Które z wymienionych reakcji przedstawiają układy redox?
a) HNOj 4 NaNOi = NaNOj h H2O
b) Mg + 2HC1 = MgCIi + H2
c) Cu(NQ02 + 2NaOH - Cu(OH); + 2NaNO,
d) CaCOj = CaO 4 c<h
e) 2ZnS + 302 = 2ZnO 4 2SOi
2. Dobrać współczynniki w następujących równaniach reakcji utleniania i redukcji oraz określić, który z pierwiastków pełni funkcję utleniacza, a który reduktora:
a) HNOa + Ag » AgNO, NO + 1^0
b) MnOj + KC10-, 4 KOH - K^MnOi i KCI 4 HjO
c) FeCli h HjOj 4 HC1 = FeCI, 4 h20
rf) KNOj 4 KI + HiS04 = KjS04 + h + NO + H20
e) KMn04 + FeS04 4 H2S04 = MnSO, 4 Fej(S04)3 + KiSO< K IfeO
0 SnCb + KiCr,Ot + HCl = SnCL* 4 CrCI3 4 KCI 4 H20
Odpowiedzi:
Ib, le.
2a) 4HNOa 4 3 Ag = 3AgNO, 4 NO 4 2H20
2b) 3Mn02 + KO03 4 6KOH = 3K2Mn04 4 KCI 4 3H*0
2o) 2FeCk 4 Hz02 4 2HCI = 2FeCh + 2HiO
2d) 2KNOz 4 2KI 4 2H2S04 = 2K2S04 + h + 2NO 4 2H20
2e) 2KMn04 4 IOFeSO« + SthSO* * 2MnS04 4 Sfe^SO^ + K2SO* 4 8H20
20 3SnC1z + K2Cr207 + 14HCJ = 3SnCU 4 2CtCI3 4 2KCI 4 7H&
12. OGNIWA GALWANICZNE
12.1. WSTĘP TEORETYCZNY
12.1.1. POTENCJAŁ NORMALNY
Na granicy faz między metalem zanurzonym w roztworze zawierającym jego kationy mogą zachodzić następujące procesy:
1) przechodzenie kationów metalu do roztworu, utlenianie metalu:
Me —-Mę* + ne,
2) redukowanie się kationów metalu do metalu:
Me“' + ne "—• Me
W wyniku tych procesów na granicy faz tworzy się podwójna warstwa elektryczna (rys. 12. IX składająca się z ujemnych ładunków na powierzchni metalu zanurzonego w roztworze i bezpośrednio przylegającej warstwy dodatnich kationów znajdujących aię w roztworze. W zależności od rodzaju metalu wypadkowy ładunek ujemny jest większy' lub mniejszy od wypadkowego ładunku dodatniego. Na granicy zetknięcia metalu z roztworem powstaje zatem różnica potencjałów elektrycznych, którą nazywamy potencjałem elektrody. Układ utworzony przez fazę metaliczną graniczącą z elektrolitem nazywa się pól ogniwem. Dwa połączone ze sobą półogniwa tworzą ogniwo galwaniczne, a różnica potencjałów elektrod ogniwa otwartego jest jego siłą elektromotoryczną (SiiM).
Ufltfll Rtwnór
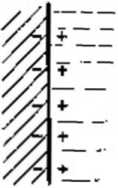
Rys. 12.1. Schemat podwójnej warstwy elektrycznej
Ponieważ doświadczalnie nie można zmierzyć bezwzględną wartości potencjału jednej elektrody a tylko różnicę potencjałów dwóch elektrod, potencjał elektrody określa się przez pomiar siły elektromotorycznej ogniwa złożonego z elektrody daną i elektrody porównawczej. Jako elektrodę porównawczą przyjęto tzw. normalną elektrodę wodorową o umownej wartości zerowej potencjału. Elektrodę wodorową przedstawia rysunek 12.2.
Wyszukiwarka
Podobne podstrony:
intensywniejsza. Zaobserwowano zmianę barwy od jasno żółtego aż do jasno pomarańczowego. Następnie p
img341 208 - Zaobserwować zmianę barwy spasywowanego fragmentu drutu stalowego w p
s che 1U zaobserwować zmiany barwy zachodzące podczas miareczkowania, kolbkę z oznaczonym roztworem
s che 1U zaobserwować zmiany barwy zachodzące podczas miareczkowania, kolbkę z oznaczonym roztworem
Rozdz(0002 28. Systematyka związków nieorganicznych 1 7. Napisz równania reakcji pozwalających zreal
Chemia organiczna 2 lO.Dokończyć równania reakcji. Czy produkty będą wykazy wały czynność optyczną?
SSL24883 beztlenowe Źródło elektronów: związki organiczne i nieorganiczne Akceptor elektronów: związ
Zanieczyszczenia komunalne AqH Zanieczyszczenie chemiczne, organiczne i nieorganiczne Znajomość skła
IMAG0063 (4) Główną rolę odgrywa tu woda, a szczególnie rozpuszczone w niej zwitki organiczne i nieo
42967 skanuj0007 (103) 6. Mając do dyspozycji benzen i inne odczynniki organiczne i nieorganiczne za
organicznej i nieorganicznej katalizatory spotykamy ha rdzo często i od dawna umiemy się nimi posług
7 (192) Stałe składniki AGH Pyty popiołowe Pyły popiołowe to organiczne i nieorganiczne substancje c
19372 Zdjęcie063 (7) Podziały Wg rodzaju anałitu: * organiczny *
więcej podobnych podstron