80785 skanuj0001

1/1 -tf W Aii A M( VI
()hlicz i porównaj stopnie utlenienia atomów w następujących cząsteczkach i jonach'! U) H2S04j Na2S04, SOf; </■ b),H2S03,K2S03,S0|-; W 0) IIC104, NH4C104, CIO;
MA
cl) IIN03, Ba(N03)2, NO;. V Ob 1
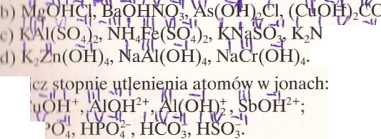
a2P207; Hg2Cl2;
»! -4
Kt-H
(,bh b) FI21
. ()blicz stopnie utlenienia atomów w cząsteczkach: Fe304, Pb304, Na2S203, FeS2<j Uwaga: Na2S203 ma następującą strukturę elektronową:
b-
/
Na+
1 H-U H/f-f? '
(>hlicz stopnie utlenienia atomów w cząsteczkach kwasów: H2S20&, H2S2Q7, H2S(), Uwaga: Cząsteczki te mają następujące struktury elektronowe:
H inf'1
101
IQI
O'
-(|
ii
I
II
a 1vi__a ;!
11 — 0^" $ *0 o*—
Bilansowanie równań redoks
3.12. Ustal, które z podanych reakcji są reakcjami redoks. W równaniach redoks wskaż
utleniaj i reduktor
■Pi + O,
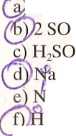
Sd?
2 + O2 —| 2 SO3 , , — Ił
H20 + S02 - r^JL.
+ (S2 — iHlfl
aÓk + HC1 -p NaCl + H20 Sju + & -r. 2HCr‘ ,
as/r-
g) 2 NaCl + H2S04 — 2 HC1 + Na2S04 \ W
Ir 3.13. Ustal, które z podanych reakcji są reakcjami redoks. W równaniach redoks wskaż utleniacz i reduktor. o , j n _ .
@Mg + H2S04 — MgS04 + H2t ^6 ~
hlMg(N03)2 + Na2C03 — MgC03l + 2 NaN03 •«-—.
/Sfcu + 4 HN03 — Cu(N03)2 + 2 N02 + 2 H20 <3) Cu(OH)2 — CuO + H20 . j
e}K2Cr207 + 2 KOH — 2 K2Cr04 + H20 ^ ^
M.
(S3t2Cr207 + 6 KI + 7 H2S04 — C/2(S04)3 + 312 + 7 H20 + 4 K2S04
3.14. W podanych równaniach redoks dobierz współczynniki metodą bilansu elektronowej). Wskaż utleniacz i reduktor, reakcję utlenienia i redukcji.
a) Fe + AgN03 — Fe(N03)2 + Ag
b) KI + Cl2 — KC1 + I2
c) Co + HC1 — CoCl2 + H2
d) NH3 + 02 — N2 + H20
e) F2 + H20 HF + 02
f) CO + N02£p C02 + NO
g) Si02 + Mg —► Si + MgO
3.15. W podanych równaniach redoks dobierz współczynniki metodą bilansu elektronowego. Wskaż utleniacz i reduktor, reakcję utlenienia i redukcji.
a) NH3 + Oz ^ NO + H20
b) H2S + 02 —* S02 + H20
c) ZnS + 02 —► ZnO + S02 (I) Na + HzO —* NaOH + H2
o) Co(OH)2 + 02 + H20 — Co(OH)3
i 3,16, W podanych równaniach redoks dobierz współczynniki metodą bilansu elektronowego. Wskaż utleniacz i reduktor, reakcję utlenienia i redukcji, u) C + 1 INO, — CO, + N02 + H20
b) S -l- HNOj • II2S04 + N02 + H20 C) P + HNO, • I I;,PO,, + N02 + I*I20
d) C + H2SO,| — COa + SOj + HaO
c) P + I IjSOi • I IiPQ4+ SOj + I li()
Wyszukiwarka
Podobne podstrony:
44552 skanuj0014 Vl<Ł ^0 CR-lfU<W
skanuj0005 (502) Jppfp •: jpMt f V(4€*gCi. ?JlJQ/n£l_. OróZ^S i tf^/jiljpśtf j t
68580 skanuj0001 (546) 2ad- iObr^sWc IUc^Tf betowa u). ecuo7c/ 2e ac *AX(X A (YV 3 SUMĆsZClAstfcl t
skanuj0002 * « “ r* ru V » *ff></ ^ ^4«-y cŁ ffllp#
Skanuj10001 * VfT]p^Vł ^O^oww (y$ X) ^irrT2>V)TpyW
więcej podobnych podstron