( 8.11 ) KRZYWA TEMPERATURY WRZENIA UKŁADU CHLOROFORM - ACETON
Prawo Raoulta - prężność pary nad roztworem równa jest prężności pary nad czystym rozpuszczalnikiem pomnożonej przez ułamek molowy rozpuszczalnika. Ułamek molowy jest liczbą zawsze mniejszą od jedności, wynika z tego, że prężność pary nasyconej nad roztworem jest zawsze niższa, niż prężność pary nasyconej czystym rozpuszczalnikiem. Obniżenie prężności pary nad roztworem doskonałym nie zależy od rodzaju substancji rozpuszczonej, lecz jedynie od stężenia roztworu. ![]()
Stwierdzono doświadczalnie, że dla roztworów rozcieńczonych prężność pary rozpuszczalnika przebiega w sposób niemal doskonały. Prawidłowość ta ma charakter ogólny. Można więc stwierdzić, że nawet w przypadku roztworów niedoskonałych prężność pary rozpuszczalnika nad roztworami rozcieńczonymi stosuje się do prawa Raoulta, przy zbliżaniu się do rozcieńczenia nieskończenie wielkiego.
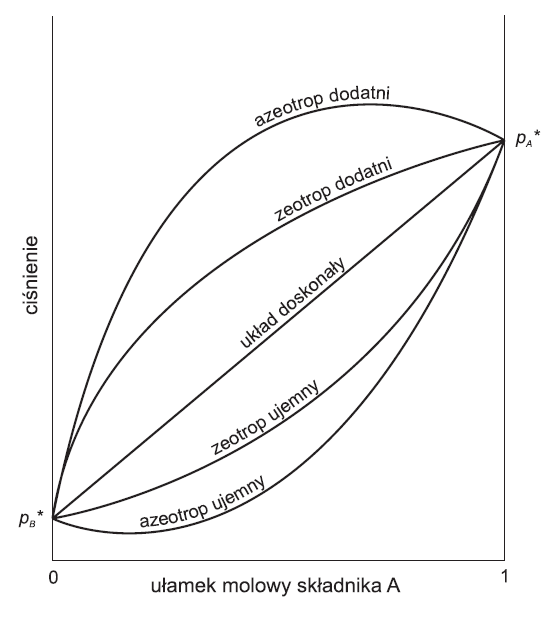
Występują dwa rodzaje odchyleń od prawa Raoulta :
- dodatnie - w roztworze takim lotność składników w roztworze jest większa, niż lotność poszczególnych czystych składników roztworu. Widoczne siły przyciągania między cząsteczkami czystych substancji w takim roztworze są mniejsze, niż odpowiednie siły przyciągania między cząsteczkami czystych substancji przed ich zmieszaniem w celu utworzenia roztworu.
- ujemne - np.: roztwór aceton/chloroform. W tym przypadku siły przyciągania między cząsteczkami w roztworze są większe, niż odpowiednie siły przyciągania między cząsteczkami czystych składników roztworu. Powoduje to mniejszą lotność składników w roztworze i obniżenie ich prężności par. Obserwuje się tu również kontrakcję objętości i wydzielanie się ciepła podczas mieszania składników roztworu.
Prawo Henry' ego - dla roztworów rozcieńczonych prężność pary substancji rozpuszczonej zmienia się liniowo ze składem roztworu. Prawo to jest spełniane przez lotne substancje rozpuszczone w rozcieńczonych roztworach, co można wyrazić wzorem: ![]()
Azeotrop jest to mieszanina cieczy wrząca w stałej temperaturze aż do wyczerpania jednego ze składników; ponieważ skład pary pozostającej w równowadze z cieczą jest identyczny ze składem cieczy, azeotropu nie można rozdzielić metodą destylacji.
Molowy potencjał termodynamiczny równowagowych par cieczy, które mieszają się tworząc roztwór, jest równy molowemu potencjałowi termodynamicznemu samych cieczy. Molowy potencjał termodynamiczny równowagowej pary roztworu jest równy molowemu potencjałowi termodynamicznemu roztworu. ![]()
Układ chloroform aceton jest typowym przykładem roztworu, w którym oddziaływania między cząsteczkami różnych składników są odmienne od oddziaływań między cząsteczkami jednego składnika. Roztwory takie stanowią mieszaniny cząsteczek kwasowych i zasadowych. Podczas mieszania cząsteczki takie oddziaływają ze sobą: w układzie chloroform/aceton przejawia się to w postaci wiązania wodorowego.
Wyszukiwarka