Sprawozdanie z ćwiczenia nr C-6
Temat: Badanie widm absorpcji i fluorescencji
Podstawy teoretyczne
Atomy i cząsteczki mogą pochłaniać (absorbować) i wysyłać (emitować) kwanty promieniowania elektromagnetycznego czyli fotony. Rozdzielając względem długości fal promieniowanie które przeszło przez substancję absorbującą otrzymujemy widmo absorpcyjne, natomiast analiza promieniowania wysyłanego przez substancję emitującą pozwala na uzyskanie widma emisyjnego.
Izolowane atomy (np. jednoatomowe gazy pod niskim ciśnieniem, pary metali) dają widma liniowe, natomiast cząsteczki wieloatomowe - widma pasmowe. W przypadku ciał stałych możemy obserwować widma ciągłe (np. takie jak emituje wolframowe włókno żarówki).
Promieniowanie elektromagnetyczne rozciąga się od długich fal radiowych o
częstotliwości 103 Hz do promieniowania gamma wytwarzanego w jądrach atomowych - 1022 Hz. Odpowiada to długościom fal od 106 m do 10-13 m.
Promieniowanie elektromagnetyczne ma dwoistą naturę tzn. zachowuje się jednocześnie jak fala i jak strumień cząstek (korpuskuł). Zakres promieniowania wysyłanego lub pochłanianego przez atomy i cząsteczki rozciąga się od miękkiego promieniowania X do zakresu mikrofalowego.
Równanie Schrödingera.
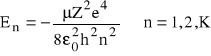
gdzie: - zredukowana masa układu jądro-elektron ( -1=m-1+M-1) bliska masie elektronu,
Z - liczba atomowa pierwiastka
e - ładunek elektronu
0 - stała dielektryczna próżni; h - stała Plancka.
Przejście atomu wodoropodobnego z jednego stanu energetycznego do drugiego wiąże się z pochłonięciem lub emisją kwantów promieniowania elektromagnetycznego o wielkości równej różnicy energii między tymi stanami:
![]()
gdzie: E=h - energia fotonu
Ważna w tych rozważaniach jest stała Rydberga opisana wzorem:
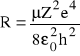
Znając stałą Rydberga wartości energii przejść można opisać wzorem:
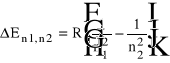
Absorpcja i fluorescencja.
Wykonując obliczenia kwantomechaniczne dla stanu podstawowego ( tj. wszystkie elektrony na najniższych możliwych poziomach energetycznych) i dla elektronowego stanu wzbudzonego (co najmniej jeden elektron przeniesiony na wyższy poziom energetyczny) otrzymuje się różne krzywe zależności energii potencjalnej od położeń jąder (rys. niżej).
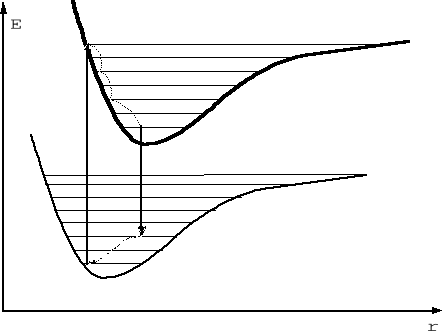
Rys. Krzywe potencjalne cząsteczki dwuatomowej w stanie podstawowym i wzbudzonym - linie poziome oznaczają poziomy oscylacyjne. Pionowe strzałki odpowiadają przejściom elektronowym związanym z absorpcją i emisją fotonu. Linie kropkowane symbolizują przejścia bezpromieniste, powodujące zanik oscylacji tj. przejście od podstawowego stanu oscylacyjnego zarówno w podstawowym jak i wzbudzonym stanie elektronowym.
Różnice w długościach pionowych strzałek odpowiadają różnicy energii między fotonem absorbowanym i emitowanym.
Średnia odległość między jądrami atomowymi r0 (odpowiada jej minimum krzywej energii potencjalnej obliczonej dla podstawowego lub wzbudzonego stanu elektronowego) jest na ogół większa w stanie wzbudzonym. Z różnego przebiegu krzywej energii potencjalnej wynika też inna anharmoniczna stała siłowa i co za tym idzie - inna odległość między poziomami oscylacyjnymi.
Odległości (czyli różnice energii) między poziomami oscylacyjnymi są dużo (przynajmniej rząd wielkości) mniejsze niż różnice energii między podstawowym a wzbudzonymi stanami elektronowymi - "czyste" widma oscylacyjne, odpowiadające absorpcji lub emisji fotonów o energii równej odległościom między poziomami oscylacyjnymi obserwujemy w podczerwieni. Jeszcze mniejsze są odległości między poziomami rotacyjnymi. w stanie gazowym zachodzą w cząsteczkach jednocześnie przejścia elektronowo-oscylacyjno-rotacyjne, prowadzące do skomplikowanej struktury pasmowej.
W roztworach, wskutek przekazania energii cząsteczkom rozpuszczalnika, wzbudzone oscylacje zanikają w czasie krótszym niż średni czas życia wzbudzonego stanu elektronowego.
Oznacza to, że zarówno podczas absorpcji, jak i emisji kwantów promieniowania o wielkości odpowiadającej przejściom elektronowym układ znajduje się w najniższym stanie oscylacyjnym.
Absorpcja fotonu prowadzi do bardzo szybkiego przejścia układu do wzbudzonego stanu elektronowego. To przejście elektronowe jest o kilka rzędów wielkości szybsze od okresu jednej oscylacji.
Zasada Francka-Condona mówi, że podczas przejścia elektronowego nie zdąży zmienić się odległość między jądrami. Zgodnie z tym po absorpcji fotonu (przejście elektronowe) z dużym prawdopodobieństwem znajdziemy na krzywej energii potencjalnej dla stanu wzbudzonego bardzo blisko najbardziej prawdopodobnej długości wiązania w podstawowym stanie elektronowym. Wyrażają to pionowe strzałki na powyższym rysunku. Taka długość wiązania w elektronowym stanie wzbudzonym odpowiada zwykle wzbudzonemu stanowi oscylacyjnemu. Teraz następują przejścia oscylacyjne, podczas których energia zostaje przekazana innym wiązaniom lub (w roztworze) cząsteczkom rozpuszczalnika. Zanim foton zostanie wyemitowany wiązanie wraca do oscylacyjnego stanu podstawowego.
Zwykle dopiero teraz następuje przejście do elektronowego stanu podstawowego.
Może być to :
1 Przejście bezpromieniste - gdy energia przekazana jest otoczeniu
2 Przejście z emisją fotonu, czyli fluorescencja.
Przejście jest bardzo szybkie, więc zgodnie z zasadą Francka-Condona odpowiada mu znów strzałka pionowa z wcześniejszego rysunku. to przejście prowadzi znów do wyższego niż zerowy poziomu oscylacyjnego w elektronowym stanie podstawowym cząsteczki, która wkrótce powraca (oddając bezpromieniście nadmiar energii) do najniższego stanu oscylacyjnego.
Widać więc, że zjawisko relaksacji do najniższego poziomu oscylacyjnego powoduje wystąpienie różnicy energii między fotonem absorbowanym i emitowanym.
Różnice między wartościami energii absorbowanej prowadzą do pojawienia się zamiast pojedynczej linii widmowej pasma absorpcji, natomiast różnice w wartościach energii emitowanej powodują pojawienie się pasma fluorescencji. Niekiedy w niskich temperaturach możemy zaobserwować na tle pasma elektronowego strukturę oscylacyjną (drobne "ząbki" modyfikujące nieco kształt pasma).
Reguła Stokes'a:
Pasmo fluorescencji jest przesunięte w kierunku dłuższych fal w porównaniu z pasmem absorpcji - pochłonięty kwant promieniowania elektromagnetycznego stanowił większą porcję energii tj. odpowiadał mniejszej długości fali - niż kwant emitowany.
Bardzo rzadko obserwuje się także pasma antystokesowskie co może świadczyć o elektronowym przejściu absorpcyjnym ze wzbudzonego stanu oscylacyjnego, albo o dopływie energii do cząsteczki, gdy była ona w elektronowym stanie wzbudzonym.
Wykonanie ćwiczenia.
1. Ustawienie spektrometru :
- nastawienie krzyża lunety na ostrość
- nastawienie lunety na nieskończoność tzn. na ostrość obrazu dalekiego przedmiotu
- nastawienie kolimatora na ostry obraz oświetlonej szczeliny (wtedy szczelina jest w ognisku soczewki kolimatora).
- wypoziomowanie stolika spektrometru
2. Ustawimy pryzmat na stoliku spektrometru w takim położeniu aby występował tzw. kąt najmniejszego odchylenia, czyli tak aby całkowite odchylenie promieni światła przez pryzmat osiągało minimum.
3. Oświetlamy szczelinę kolimatora światłem neonu. Następnie mierzymy położenie kątowe lunetki dla kilku najwyraźniejszych prążków w widmie neonu. Wyniki pomiarów notujemy w protokóle pomiarów.
4. Na podstawie wyników z poprzedniego punktu sporządzamy krzywą dyspersji.
5. Badamy widma absorpcji dla dwóch roztworów ( w naszym przypadku rodaminy i fluoresceiny), ustawiając kuwety z tymi roztworami między szczeliną kolimatora a źródłem światła białego. Notujemy położenia lunetki odpowiadające granicom pasm absorpcyjnych. Znając te granice nanosimy je na wykres krzywej dyspersji.
6. Badamy widma fluorescencji dla tych samych co poprzednio roztworów w ten sposób, że kuwety z badanymi roztworami ustawiamy blisko szczeliny kolimatora i oświetlamy je wiązką światła białego skierowaną prostopadle do osi kolimatora. Notujemy położenia lunetki odpowiadające granicom widm fluorescencji. Granice te również nanosimy na wykres krzywej dyspersji.
W poniższej tabeli umieszczone są wyniki z punktów 5. i 6.
Absorpcja |
|
|
|
Fluorescencja |
|
|
|
|
Granice |
|
Środek |
|
Granice |
|
Środek |
Roztwór |
Lewa |
Prawa |
przedziału |
Roztwór |
Lewa |
Prawa |
przedziału |
|
[nm] |
[nm] |
[nm] |
|
[nm] |
[nm] |
[nm] |
Rodamina |
536 |
572 |
554 |
Rodamina |
570 |
658 |
614 |
Fluoresceina |
440 |
528 |
484 |
Fluoresceina |
526 |
580 |
553 |
7. Obliczamy średnią wewnętrzną stratę energii dla fluoresceiny dla jednego fotonu pomiędzy procesem absorpcji i emisji.
Po podstawieniu do wzoru danych i obliczeniu otrzymaliśmy:
- dla fluorescencji Ef =3173,2410-22 J
- dla absorpcji Ea=3585,6510-22 J
Czyli średnia strata energii dla jednego fotonu wynosi:
E=Ef - Ea=-412,4110-22 J
Dyskusja błędów.
Pomiary nasze są obarczone głównie błędami odczytu kątów. Dlatego też należy wyznaczyć ten błąd.
![]()
gdzie: 2' - dokładność odczytu kąta z noniuszy.
sz - szerokość kątowa obrazu szczeliny sz=4'
Po podstawieniu otrzymujemy:
![]()
- jest błąd bezwzględny każdego pomiaru
Wnioski.
Jak widać na wykresie pasmo fluorescencji przesunięte jest w kierunku dłuższych fal w porównaniu z pasmem absorpcji.
Widać z tego dla obydwóch roztworów zgodność z regułą Stokes'a
Poznane widma:
ciągłe - dają je rozżarzone ciała stałe i ciecze, oraz gazy pod dużym ciśnieniem
liniowe - dają atomy rozżarzonych gazów i par metali
pasmowe - dają rozbudzone cząsteczki.
Laboratorium z Fizyki.
Strona nr 5
Wyszukiwarka
Podobne podstrony:
FIZLAB, SPRW A23, Tabela do sprawozdań
FIZLAB, SPRW A23, Tabela do sprawozdań
FIZLAB, SPRW A10, Tabela do sprawozdań
FIZLAB, SPRW C11, Tabela do sprawozdań
FIZLAB, SPRAW E1, Tabela do sprawozdań
FIZLAB, SPR B12, Tabela do sprawozdań
Tabela do sprawozdania 1
Dyspersja optyczna, Tabela do sprawozdań
tabela do sprawozdania, Inzynieria Bezpieczenstwa, Logistyka
Bragg, Tabela do sprawozdań
Badanie właściwości statystycznych elektronów emitoawany 02, Tabela do sprawozdań
Badanie widma promieniowania termicznego na przykładzie 03, Tabela do sprawozdań
Tabela do sprawozdania 2
Badanie efektu Halla2, Tabela do sprawozdań
TABELA DO SPRAWOZDANIA Z REALIZACJI PROGRAMU PROFILAKTYKI PROMOCJI ZDROWIA DZIECI I MŁODZIEŻY SZKOLN
tabela do 41 sprawozdania
więcej podobnych podstron