G. Uzgadnianie równań reakcji redukcji utlenienia (redox)
Pod pojęciem reakcji redox rozumie się reakcje, które przebiegają ze zmianą wartościowości pierwiastków. Jako, że procesy te polegają na wymianie elektronów, uzgadnianie ich jest specyficzne i wymaga oddzielnego omówienia i przećwiczenia. Podstawą bilansowania takich równań reakcji jest uzgadnianie bilansu elektronowego procesu redukcji i biegnącego jednocześnie procesu utleniania. Bilans ten stanowi podstawę uzgodnienia równania reakcji. Z tego względu reakcje te określa się również jako procesy, które biegną ze zmianą wartościowości pierwiastków uczestniczących w nich. Procesy takie mogą mieć przebieg łatwy do zanotowania np. równanie reakcji spalania węgla czy synteza siarczku miedzi(II). W wielu wypadkach jednak w reakcjach tego typu uczestniczą substancje złożone oraz kilka różnych substratów i produktów. W takich sytuacjach uzgodnienie równania reakcji staje się trudniejsze i w wówczas należy się posłużyć sposobem specyficznym dla tego typu równań reakcji. Celem poniższego postępowania programowanego jest przybliżenie metody uzgadniania równań reakcji redox.
Program nauczania reakcje redoks
1.
Program poniższy umożliwi Wam opanowanie umiejętności w zakresie ustalania liczby utlenienia (elektrowartościowości) pierwiastków lub jonów i jej wykorzystania w bilansowaniu równań reakcji redoks zwanych również reakcjami redukcji - utlenienia.
W jaki sposób można ustalić stopień utlenienia pierwiastków?
Można w tym celu wyróżnić cztery zasady ustalania stopnia utlenienia, które należy sobie przyswoić
Oto one:
Pierwiastki w formie niezwiązanej posiadają stopień utlenienia równy 0 (zero)
Stopień utlenienia jonów prostych (złożonych z jednego atomu) jest równy ich ładunkowi elektrycznemu czyli ich elektrowartościowości
Oto przykłady:
Sód Na posiada stopień utlenienia równy 0
Jon sodu Na+ stopień utlenienia +1
Jon siarczkowy S2- stopień utlenienia -2
Teraz proszę określić stopień utlenienia następujących pierwiastków i jonów- żelazo, jon chlorkowy, jon wodorowy, siarka
Zanotuj:
Stopień utlenienia 0 posiada........................................
Stopień utlenienia -1 posiada......................................
Stopień utlenienia +1 posiada......................................
Swoje notatki porównaj z 17
2.
Obok azotanu(V) srebra powstaje NO2 i H2O. W reakcji tej nie wydziela się typowy dla reakcji kwasów z metalami wodór
Ag + 2HNO3 → AgNO3 + NO2 + H2O
Takie produkty są typowe dla reakcji kwasu utleniającego z metalem szlachetnym. Jony wodorowe nie ulegają redukcji. Przykładowo zbilansujemy równanie reakcji roztwarzania srebra w kwasie azotowym(V). Pierwsze pytanie: jaki jest stopień utlenienia azotu w tlenku azotu o wzorze NO2 ?
Zanotuj ustaloną wartość i przejdź do 74
3.
Odpowiedź jest błędna. Szczegółowe wyjaśnienia zawiera 34
4.
Słusznie, 1 mol KMnO4 reaguje z 5 molami FeSO4, wynika to z zapisy reakcji połówkowych
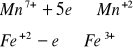
Stosunek molowy KMnO4 do FeSO4 wynosi 1:5. Uwzględniając wyprowadzoną zależność w równaniu reakcji otrzymamy:
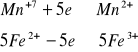
dlatego stosunek molowy KMnO4 do FeSO4 wynosi 1:5
Uwzględniając powyższą zależność w równaniu reakcji otrzymamy:
KMnO4 + 5FeSO4 + H2SO4 ![]()
Prowadząc w dalszym ciągu uzgadnianie ilości atomów żelaza po prawej stronie równania otrzymamy współczynnik ![]()
, aby zlikwidować współczynnik ułamkowy całe równanie mnożymy przez dwa otrzymując:
![]()
ustaliliśmy w ten sposób ilość atomów manganu po prawej stronie równania reakcji. Proszę odpowiednim współczynnikiem uzupełnić ilość atomów manganu po prawej stronie.
Sprawdź pozycję 31
5.
Prawidłowy zapis :
![]()
Pozostaje wreszcie etap trzeci polegający na ustaleniu ilości pozostałych składników równania reakcji. Najpierw ustalamy ilość atomów sodu. Jest ona równa po obu stronach równania reakcji. Z kolei obliczmy ile jonów siarczanowych(VI) ![]()
znajduje się z prawej strony równania, odejmujemy od niej ilość jonów siarczanowych w siarczanie(VI) żelaza(II) FeSO4 i otrzymujemy w ten sposób ilość moli kwasu siarkowego. Oblicz ile moli kwasu siarkowego weźmie udział w powyższym równaniu reakcji ?
Sprawdź wynik z pozycją 75
6.
Istnieje możliwość obliczenia stopnia utlenienia jonów siarczkowych - równa się 2-. Suma ładunków jonów tworzących cząsteczkę jest równa zero. Oblicz więc z kolei wartość stopnia utlenienia żelaza w związku o wzorze FeS
Wartość zanotuj i sprawdź z pozycją 28
7.
W równaniu reakcji po stronie lewej znajduje się 2KMnO4 a po prawej 5Cl2, ta ilość chloru powstaje z 10 moli HCl. W równaniu reakcji zapisano jednak 16HCl. Co się dzieje z 6 molami chlorowodoru? Spójrz na równanie reakcji , zanotuj swoje sugestie i porównaj je z pozycją 20
8.
Odpowiedź błędna proszę ponownie policzyć ilość jonów siarczanowych w równaniu 31 jeżeli masz wątpliwości to zapoznaj się z wyjaśnieniem 51
9.
Miedź utlenia się zaś siarka ulega redukcji. Do utlenienia mola miedzi potrzebny jest mol kwasu siarkowego(VI)Zestawiając cząstkowe równania reakcji redukcji i utlenienia w jedno równanie otrzymujemy:
![]()
Równanie to nie jest jednak jeszcze uzgodnione. Jako produkt reakcji tworzy się również woda. Mając to na uwadze proszę do końca uzgodnić równanie reakcji i porównać z zapisem pod numerem 54
10.
Odpowiedź jest błędna. Wyjaśnienie znajdziesz pod pozycją 32
11.
![]()
Reakcje połówkowe będą przebiegały następująco:
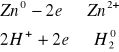
Obecnie przejdziemy do uzgadniania trudniejszych przykładów równań reakcji. W tym celu przeanalizujemy uzgadnianie równanie reakcji srebra z kwasem azotowym:
Ag + 2HNO3 ![]()
AgNO3 + NO2 + H2O
Typowa reakcja metalu z kwasem polega na otrzymaniu soli i wydzieleniu wodoru. Reakcja srebra z kwasem azotowym(V) ma nieco inny przebieg. Jakimi produktami reakcji różni się przytoczone równanie reakcji od typowej reakcji kwasów z metalami. Co powstaje oprócz soli - azotanu(V) srebra? Proszę uzupełnić odpowiedź:
Oprócz azotanu(V) srebra powstaje............................... oraz ................................... 2
12.
Odpowiedź jest błędna. Tylko pierwiastki w stanie wolnym (nie związane) posiadają stopień utlenienia równy zero. W związku chemicznym pierwiastki mają stopnie utlenienia większe (dodatnie) lub mniejsze (ujemne) od zera. Proszę powtórzyć zasady określania stopnia utlenienia pierwiastków pozycja 1
13.
Odpowiedź jest błędna. Proszę ponownie policzyć ilość w równaniu reakcji 31 lub przeczytać materiał pomocniczy zawarty w 51
14.
Odpowiedź jest błędna. Wyjaśnienia znajdują się pod numerem 32
15.
Odpowiedź jest błędna zaś wyjaśnienia znajdują się pod pozycją 34
16.
1 mol KMnO4 utlenia 5 moli HCl do gazowego chloru Cl2
Zmiana wartościowości opisana równaniami połówkowymi przedstawia się następująco:
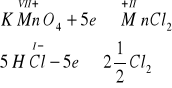
proszę przejść do 23
17.
Proszę porównać:
Stopień utlenienia równy 0 posiada żelazo i siarka
Stopień utlenienia -1 posiada jon chlorkowy
Stopień utlenienia +1 posiada jon wodorowy czyli proton
Obydwa pierwiastki w stanie niezwiązanym czyli żelazo i siarka posiadają stopień utlenienia równy zero. Chlor w postaci jonu chlorkowego Cl- posiada stopień utlenienia -1 zaś wodór w postaci jonu wodorowego składającego się wyłącznie z protonu H+ stopień utlenienia +1:
Teraz wprowadzamy trzecią zasadę, która brzmi suma stopni utlenienia atomów w cząsteczce związku chemicznego jest równa zero 0. Przykład:
![]()
Korzystając z podanej zasady można obliczyć stopień utlenienia pierwiastków w cząsteczkach dowolnych związków chemicznych. Wyliczyliśmy w ten sposób elektrowartościowość jonów chlorkowych. Oblicz jaka jest elektrowartościowość, czyli stopień utlenienia, złota w soli o wzorze AuCl3 ?
W molu soli o wzorze AuCl3 znajdują się trzy jony chlorkowe 3 (-1) = -3. Zgodnie z przytoczoną zasadą suma stopni utlenienia pierwiastków w cząsteczce związku jest równa 0, więc złoto w tym związku posiada elektrowartościowość równą 3+ gdyż:
3(-1) +3 = 0
Teraz spróbuj policzyć elektrowartościowość żelaza w związku o wzorze FeS
Zanotuj wartość i porównaj z 28
Jeżeli potrzebujesz pomocy przejdź do 6
18.
Odpowiedź zła. Współczynnik przy wzorze soli jest błędnie zapisany
Proszę przyjąć wariant odpowiedzi 31
lub zapoznać się z informacją pomocniczą 51
19.
Obliczono niewłaściwą wartość stopnia utlenienia (elektrowartościowości) manganu w połączeniach występujących w równaniu reakcji.
Proszę przeczytać wyjaśnienie 43
20.
Proszę porównać: dodatkowych 6 moli chloru wynika z faktu, że 4 molu jonów chlorkowych wchodzą w dwa mole chlorku manganu(II) MnCl2 zaś pozostałe dwa mole jonów chlorkowych tworzą dwa mole chlorku potasu KCl. Wodór występujący we wszystkich 16 molach chlorowodoru tworzy z tlenem zawartym w nadmanganianie potasu (KMnO4) 8 moli wody. Uzgodnienie tak złożonego równania reakcji można zamknąć w trzech etapach:
Obliczenie stopnia utlenienia substancji, które uległy utlenieniu i redukcji
Ustalenie stechiometrii reakcji redukcji i utlenienia
Ustalenie stechiometrii pozostałych substratów i produktów równania reakcji
Przyswojenie podanego toku postępowania ułatwi uzgodnienie dowolnego równania reakcji redoks. Istnieje cały szereg reakcji w których mangan przechodzi ze stopnia utlenienia +VII na +II. Wszystkie te reakcje przebiegają w środowisku kwaśnym. W celu doskonalenia umiejętności bilansowania równań reakcji zajmijmy się utlenianiem żelaza ze stopnia utlenienia +II do +III.
Jakościowo proces ten można zapisać takimi substratami i produktami reakcji:
![]()
Proszę zanotować równanie w powyższej formie. Przystąpimy teraz do właściwego dobrania współczynników równania reakcji. W tym celu proszę ułożyć równania połówkowe czyli równanie redukcji dla manganu oraz utlenienia dla żelaza. Ile moli siarczanu(VI) żelaza(II) jest utlenianych przez jeden mol nadmanganianu potasu?
1 mol FeSO4 sprawdź pod 10
3 mole FeSO4 sprawdź pod 14
5 moli FeSO4 sprawdź pod 4
potrzebuję pomocy w tym celu przejdź do 32
21.
![]()
Przy uzgadnianiu równania reakcji redoks istotne są tylko te pierwiastki, których stopnie utleniania w wyniku reakcji uległy zmianie. Tak więc siarki w reszcie kwasowej, która w reakcji nie uległa przemianie w bilansowaniu równania nie uwzględnia się. Istotne pozostają więc następujące elektrowartościowości:
![]()
Żelazo metaliczne o stopniu utlenienia równym zero przechodzi w wyniku reakcji polegającej na oddaniu dwóch elektronów w jon żelaza o stopniu utlenienia 2+. Elektrony te przejmują dwa jony wodorowe (protony) o stopniu utlenienia 1+ przechodząc w gazowy wodór H2, którego stopień utlenienia jest oczywiście równy zero. Można więc zapisać następujące równania reakcji połówkowych:
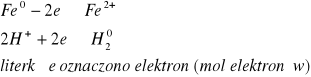
Suma elektronów uczestniczących w procesach połówkowych reakcji redoks zawsze musi być równa zero ! (liczba elektronów oddanych musi być równa ilości elektronów przyjętych)
Proszę teraz zapisać równanie reakcji cynku z kwasem solnym uwzględniając zmieniające się stopnie utlenienia. Zapis porównaj z 11
22.
Poprawny zapis równania reakcji ma postać:
Cu + 4HNO3 ![]()
Cu(NO3)2 + 2NO2 + 2H2O
Uzyskanie zapisu zgodnego z powyższym świadczy o dobrej pracy i zrozumieniu istoty reakcji redoks. Reakcje redoks nie odnoszą się jednak tylko do działania kwasów na metale. Ilość substancji, które w wyniku reakcji chemicznych ulegają utlenianiu lub redukcji jest bowiem znacznie większa.
Obecnie rozważmy przykład reakcji redoks substancji o takich właściwościach. Do powszechniej stosowanych w procesach chemicznych należy manganian potasu(VII) o wzorze KMnO4 Oblicz stopień utlenienia manganu w tym związku:
+III sprawdź pod pozycją 15
+V sprawdź pod pozycją 3
+VII sprawdź pod pozycją 66
+IX sprawdź pod pozycją 48
23.
1 mol KMnO4 utlenia 5 moli chlorowodoru do chloru. Jeżeli podałeś inną odpowiedź proszę zapoznać się z wyjaśnieniem zawartym pod numerem 16
Wyznaczono w ten sposób stosunek molowy utleniacza do reduktora. Można więc przejść do ustalenia stechiometrii pozostałych reagentów tej reakcji redoks:
5 moli HCl daje ![]()
mola Cl2
postępując zgodnie z zasadą stosowania całkowitych współczynników reakcji otrzymane wartości współczynników należy pomnożyć przez dwa. Ile moli KMnO4 znajduje się teraz po lewej stronie równania reakcji oraz ile moli chloru Cl2 po prawej ? Uzyskany rezultat sprawdź pod 7
24.
Odpowiedź jest częściowo poprawna. Oprócz siarki i azotu jeszcze jeden pierwiastek zmienia wartościowość. Proszę ponownie zastanowić się nad równaniem reakcji lub skorzystać z wyjaśnień pomocniczych znajdujących się pod numerem 45
25.
po prawej stronie równania reakcji musi być 8H2O Zgadza się bowiem w ten sposób również ilość atomów tlenu. W dwóch molach KMnO4 podobnie jak w 8 molach H2O znajduje się osiem atomów tlenu. Tak więc równanie reakcji ma ostatecznie postać:
2KMnO4 + 10FeSO4 + 8H2SO4 ![]()
2MnSO4 + 5Fe2(SO4)3 + 8H2O + K2SO4
Z nadmanganianem można porównać inny bardzo silny utleniacz jakim jest dwuchromian potasu o wzorze K2Cr2O7. Oblicz stopień utlenienia chromu w tym związku chemicznym. Uzyskany wynik porównaj z 52
Jeżeli nie potrafisz sobie poradzić przejdź do 35
26.
Będziemy to równanie krok po kroku uzgadniali
Przebieg reakcji wiąże się z następującymi zmianami wartościowości:
CrVI+ + 3e → CrIII+
3FeII+ - 3e→ 3FeIII+
Stosunek molowy chromu(VI) do soli żelaza(II) ma się jak 1:3. W molu dwuchromianu sodu znajdują się jednak dwa mole chromu(VI), więc 1 mol Na2Cr2O7 utleni ............... moli FeSO4. Wyliczoną wartość porównaj z pozycją 64
27.
Odpowiedź jest jedynie częściowo poprawna. Siarka i azot zmieniają wartościowość. Wodór zarówno w kwasie azotowym(V) jak i w wodzie posiada wartościowość 1+. Oprócz wymienionych jeszcze jeden pierwiastek zmienia wartościowość. Proszę ponownie przeanalizować równanie 78 lub skorzystać z wyjaśnienia pomocniczego zawartego pod numerem 49
28.
Żelazo w związku o wzorze FeS posiada stopień utlenienia 2+
![]()
Proszę teraz obliczyć stopnie utlenienia bromu w bromowodorze HBr oraz tytanu w chlorku o wzorze TiCl4. Zanotuj uzyskane wartości i przejdź do 40
29.
Tak słusznie, węgiel posiada stopień utlenienia czyli elektrowartościowość IV+
Elektrowartościowość wodoru wynosi I+ co daje łącznie ![]()
Elektrowartościowość tlenu wynosi II- co daje łącznie ![]()
Jako, że suma elektrowartościowości wynosi zero węgiel w tym związku posiada elektrowartościowość równą IV+. W reakcjach redoks uczestniczą również związki organiczne, w których węgiel może przyjmować elektrowartościowości, wynikające z bilansowania ładunków jonów, praktycznie od IV- (w metanie) do IV+ (w dwutlenku węgla). Do bardziej znanych połączeń tego typu należy kwas szczawiowy o wzorze sumarycznym H2C2O4, który w reakcjach redoks utlenia się do dwutlenku węgla.
Proszę obliczyć stopień utlenienia węgla w kwasie szczawiowym i porównać z 49
30.
Obliczona wartość stopnia utlenienia manganu jest błędna.
Proszę zapoznać się z informacją zawartą w 43
31.
Zbilansować:
2KMnO4 + 10FeSO4 + H2SO4 ![]()
2MnSO4 + 5Fe2(SO4)3 + H2O + K2SO4
w ten sposób w zapisie uwzględniono stechiometrię czynników, które zmieniły wartościowość. W dalszym ciągu należy zbilansować pozostałe składniki równania reakcji. Ilość atomów potasu po obydwu stronach równania jest identyczna. Przystępujemy z kolei do ustalenia liczby jonów siarczanowych ![]()
po prawej stronie równania reakcji.
Po prawej stronie równania reakcji znajduje się:
5 moli jonów siarczanowych (sprawdź z18)
9 moli jonów siarczanowych (sprawdź z 13)
17 moli jonów siarczanowych (sprawdź z 8)
18 moli jonów siarczanowych (sprawdź z 42)
nie potrafię tego policzyć (wyjaśnienie pod numerem 51)
32.
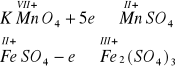
Mangan zmienia stopień utlenienia z VII+ na II+. Pobiera przy tym pięć moli elektronów. Donorem elektronów są jony żelaza utleniające się z II+ do III+. Utleniając się każdy jon żelaza oddaje jeden elektron.
1 mol KMnO4 utlenia zatem ............... moli siarczanu(VI)żelaza(II) (FeSO4) zapis proszę porównać z informacją 4
33.
Tak, poprawny zapis równania reakcji ma postać:
Na2Cr2O7 + 6FeSO4 + 7H2SO4 ![]()
Cr2(SO4)3 + 3Fe2(SO4)3 7H2O + Na2SO4
Czy ustaliłeś identyczne wartości współczynników reakcji? Jeżeli tak, to przejdziemy do omówienia dalszych zagadnień związanych z reakcjami redoks. W tym celu proszę przejść do 78
34.
Obliczymy teraz stopień utlenienia (elektrowartościowość) manganu w KMnO4 nadmanganianie potasu
Potas jako metal pierwszej grupy układu okresowego posiada elektrowartościowość I+, łączny ładunek czterech atomów tlenu wynosi VIII- ![]()
. Zgodnie z zasadą elektroobojętności cząsteczek związków chemicznych mangan będzie miał ładunek elektrowartościowość równą ...............wynik proszę porównać z 66
35.
Musimy ustalić elektrowartościowość (stopień utlenienia) chromu w dwuchromianie sodu Na2Cr2O7. Stopnie utlenienia sodu i tlenu wynoszą odpowiednio, sód I+, tlen II- Bilans ładunków dla tych dwóch pierwiastków wynosi więc: 2(+1) + 7(-2)= -12
Uwzględniając fakt elektroobojętności cząsteczek oraz ilość atomów chromu w cząsteczce tego związku można wyliczyć stopień utlenienia chromu wynoszący ............ Wyliczoną wartość proszę porównać z informacją zawartą pod numerem 52
36.
Obliczona wartość stopnia utlenienia manganu jest błędna. Proszę zapoznać się z wyjaśnieniem 43
37.
Tak jest, wartościowość zmieniają trzy pierwiastki: siarka, azot i miedź. Reakcja redoks, w której uczestniczy więcej niż dwa pierwiastki nosi nazwę podwójnej reakcji redoks. W takiej sytuacji pierwiastki zmieniające wartościowość wchodzące w skład jednego związku chemicznego rozpatruje się łącznie. Proszę ułożyć łączny bilans uwzględniający zmianę wartościowości miedzi i siarki tworzących jeden związek. Rezultat porównaj z informacją 53
38.
Odpowiedź jest błędna. Nie uwzględniono faktu, że w cząsteczce H2SO4 znajdują się dwa atomy wodoru. Proszę przejść do 72
39.
Nie uwzględniono faktu, że w cząsteczce Na2Cr2O7 znajdują się dwa atomy chromu. Dlatego do utlenienia 6 moli FeSO4 zużyje się tylko połowę tej ilości Na2Cr2O7. Podano również błędną ilość moli kwasu siarkowego(VI)
Proszę poprawić błąd w zapisie i przejść do 52
Potrzebuję pomocy, która znajduje się w pozycji 26
40.
Proszę porównać elektrowartościowości: Br 1- oraz Ti 4+, ponieważ
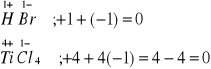
Przejdźmy obecnie do czwartej zasady uzgadniani reakcji redoks, która brzmi:
4.Stopień utlenienia tlenu w związkach chemicznych jest zawsze równy 2- (Istnieje tylko jeden wyjątek: w nadtlenku wodoru H2O2 tlen posiada stopień utlenienia równy 1-). Czy pamiętasz jeszcze treść podanych wcześniej trzech reguł stosowanych przy uzgadnianiu reakcji redoks ? W tym celu odpowiedz na trzy pytania:
Jaka jest wartość stopnia utlenienia pierwiastków w stanie wolnym (nie związanym)?
Jak ustala się wartość stopnia utlenienia jonów prostych ?
Jaka jest wartość sumy stopni utlenienia pierwiastków w cząsteczkach związków chemicznych?
W celu sprawdzenia poprawności udzielonych odpowiedzi proszę przejść do 54
41.
Podane równanie reakcji jest zapisane błędnie. Ustaliliśmy w bilansie redoks, że do utlenienia jednego mola miedzi zużywa się 2 mole kwasu azotowego(V). Musimy więc zapisać po prawej stronie równania reakcji dwa mole tlenku azotu(IV) NO2
Proszę jeszcze raz przeanalizować to zagadnienie i przejść do pozycji 71
42.
Po prawej stronie równania reakcji znajduje się łącznie 18 moli jonów siarczanowych(VI) ![]()
. Po lewej stronie równania znajduje się 10 moli jonów siarczanowych(VI) w siarczanie(VI) żelaza(II) FeSO4. W celu zbilansowania ilości moli tych jonów trzeba z lewej strony równania uwzględnić 8 moli kwasu siarkowego(VI) H2SO4
2KMnO4 + 10FeSO4 + 8H2SO4 ![]()
2MnSO4 + 5Fe2(SO4)3 + H2O + K2SO4
Obecnie ustalimy ilości atomów wodoru występujących po stronie lewej dobierając odpowiednia ilość moli wody po stronie produktów (prawej).
Ile moli wody powstanie w wyniku reakcji ? Proszę zanotować wyliczoną ilość i porównać z pozycją 25
43.
W wyniku reakcji mangan przechodzi w chlorek o wzorze MnCl2. W celu ustalenia stopnia utlenienia manganu w soli o wzorze MnCl2 musimy znać stopień utlenienia jonów chlorkowych, który wynosi -1, ponieważ jony te stanowią resztę kwasową kwasu chlorowodorowego ![]()
. Uwzględniając zasadę zerowej wartości sumy elektrowartościowości atomów pierwiastków tworzących cząsteczkę można obliczyć elektrowartościowość manganu w tej soli, która wynosi sprawdź pod pozycją 66
44.
Przeanalizujmy jeszcze raz zmianę stopni utlenienia pierwiastków biorących udział w procesie redoks
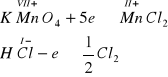
Mangan zmieniając elektrowartościowość z VII+ na II+ przyjmuje pięć elektronów, które są oddane przez jony chlorkowe, powodując ich utlenienie do chloru gazowego. Ile moli chloru gazowego powstaje w wyniku redukcji jednego mola nadmanganianu potasu KMnO4 ?
Odpowiedź sprawdź z pozycją 16
45.
Porównajmy wartościowości poszczególnych pierwiastków przed i po reakcji
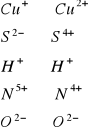
Widzimy więc, że wartościowość zmieniają następujące pierwiastki................ Porównaj z 37
46.
Stopień utlenienia został źle obliczony lub przyjęty jak dla siarki w jonach siarczkowych czyli 2-. Proszę powtórzyć zasady obliczania stopnia utleniania pierwiastków zawarte w pozycji 1
47.
Równanie reakcji jest zapisane błędnie. Jeżeli po lewej stronie znajdują się cztery mole kwasu azotowego(V) HNO3 zawierające łącznie cztery mole wodoru atomowego to muszą one wystąpić również po prawej stronie równania. Proszę ponownie uzgodnić równanie reakcji i wynik sprawdzić pod numerem 71
48.
Odpowiedź jest błędna. Wyjaśnienie zawiera 34
49.
Tak, istotnie w związku tym węgiel posiada stopień utlenienia równy 3+. Spróbujmy powtórzyć obliczenia: wzór sumaryczny związku H2C2O4
Stopnie utlenienia dla wodoru: 2(+1) = +2
Stopnie utlenienia dla tlenu: 4(-2) = -8
Zgodnie z zasadą elektroobojętności cząsteczek związków chemicznych na dwa atomy węgla w cząsteczce przypada więc ładunek +6, czyli po +3 na każdy z atomów węgla. Rozpatrując dalsze przykłady połączeń organicznych można wykazać, że węgiel może w nich występować na różnych stopniach utlenienia, może nawet przyjmować wartość równa zero. Tak jest przykładowo w glukozie C6H12O6 lub aldehydzie mrówkowym HCHO.
Proszę teraz obliczyć elektrowartościowość azotu w kwasie azotowym(V) a wynik sprawdzić pod numerem 68
50.
Proszę porównać: ![]()
Spróbujmy teraz proste równanie reakcji kwasu z metalem uzgodnić z uwzględnieniem zmiany elektrowartościowości pierwiastków. Żelazo roztwarza się w rozcieńczonym kwasie siarkowym
Fe + H2SO4 ![]()
FeSO4 + H2
Proszę przepisać powyższe równanie reakcji i nad symbolami pierwiastków zapisać ich stopnie utlenienia (elektrowartościowości). Wynik sprawdź z 21
51.
Pytanie dotyczyło określenia ilości moli jonów siarczanowych po prawej stronie równania reakcji. Znajdują się tam:
2 MnSO4 czyli 2 mole ![]()
5 Fe2(SO4)3 czyli 15 moli ![]()
1 K2SO4 czyli 1 mol ![]()
Proszę obliczyć łączną ilość moli jonów siarczanowych i przejść do 42
52.
W dwuchromianie sodu chrom posiada stopień utlenienia równy VI+. Zapis cyframi rzymskimi stosuje się wówczas, gdy dany atom nie tworzy jonu prostego, lecz jak to jest w przypadku dwuchromianu, jon złożony. Dwuchromian utlenia również jony żelaza(II) do żelaza(III). Jakościowy zapis równania takiej przemiany będzie miał postać:
![]()
Proszę dobrać współczynniki powyższego równania reakcji postępując podobnie jak to było w przypadku nadmanganianu potasu. Czyli:
Ustalić stosunek ilościowy moli dwuchromianu sodu do siarczanu(VI) żelaza(II) na podstawie zmiany ich stopni utlenienia
Ustalić stechiometrię substancji, które zmieniły w wyniku reakcji wartościowość
Ustalić stechiometrię pozostałych substancji uczestniczących w reakcji
W zależności od dobranych współczynników:
Na2Cr2O7 FeSO4 H2SO4
1 6 7 [33]
2 6 9 [77]
1 3 5 [67]
1 3 7 [70]
2 6 8 [39]
potrzebuję wyjaśnień pomocniczych [26]
53.
W cząsteczce Cu2S elektrowartościowość zmieniają obydwa składniki, ponadto związek ten jest praktycznie nierozpuszczalny. Tak więc bilans elektronowy rozpatruje się łącznie dla całej cząsteczki czyli
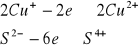
czyli jeden mol siarczku miedzi(I) oddaje łącznie osiem elektronów dają w wyniku przemiany dwa mole jonów miedzi(II) oraz jeden mol tlenku siarki(IV) czyli SO2.
Ile moli kwasu azotowego(V) HNO3 zostanie zredukowanych przez jeden mol siarczku miedzi(I) ? Proszę zapisać wyliczoną wartość i przejść do 80
54.
Proszę porównać odpowiedzi:
Stopień utlenienia pierwiastków w stanie wolnym wynosi zawsze zero
Stopień utlenienia jonów prostych (złożonych z jednego pierwiastka) jest równy ich wartościowości
Suma stopni utlenienia atomów w cząsteczce związku chemicznego jest zawsze równa zero
Teraz proszę powiedzieć jaka jest stała wartość elektrowartościowości tlenu w związkach chemicznych? Odpowiedź porównaj z 72
55.
Ostateczna postać równania reakcji:
![]()
W utlenieniu mola srebra uczestniczą dwa mole kwasu azotowego(V):
jeden mol utlenia srebro, przy tym azot zmienia stopień utlenienia z V+ na IV+
kolejny mol tego kwasu tworzy cząsteczkę soli [azotanu(V)]
Podobnie przebiega reakcja utlenienia miedzi gorącym stężonym kwasem siarkowym(VI) H2SO4. Miedź przechodzi do roztworu w postaci soli siarczanu(VI) miedzi(II) CuSO4 przy jednoczesnym wydzieleniu tlenku siarki(IV) SO2
Proszę przedstawić w postaci odpowiednich równań reakcji jak zmieniają się stopnie utlenienia siarki i miedzi i zbilansować ilości elektronów oddanych i przyjętych.
Cu0 - .....→Cu2+
H2SO4 +........ →H2O + SO2
Uzyskany wynik porównaj z informacją 9
56.
Zgadza się, mangan przed reakcją w KMnO4 posiada stopień utlenienia VII+ (jon złożony) zaś po reakcji w soli MnCl2 2+ (jon prosty). Jednocześnie mangan powoduje utlenienie jonów chlorkowych z -1 do wolnego chloru, którego stopień utlenienia jest równy zero.
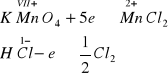
W tak zapisanych równaniach połówkowych nie uwzględniono właściwego stosunku molowego utleniacza do reduktora. Ile moli chlorowodoru HCl utleni jeden mol nadmanganianu potasu?
Proszę zanotować odpowiednią wartość i przejść do 23
Potrzebujesz pomocy i dodatkowych wyjaśnień, proszę przejść do 44
57.
Odpowiedź poprawna. Siarka w kwasie siarkowym posiada stopień utlenienia równy VI+. Stopień utlenienia wodoru wynosi oczywiście 1+ zaś tlenu 2- zatem w H2SO4
[2 atomy wodoru] 2(+1) [4 atomy tlenu] 4(-2) aby cząsteczka była elektroobojętna 1 atom siarki musi mieć elektrowartościowość równą VI+
![]()
Teraz proszę obliczyć elektrowartościowość węgla w kwasie węglowym H2CO3. Wynik sprawdź w pozycji 29
58.
Przytoczmy ponownie bilans reakcji redoks
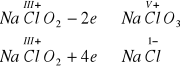
Redukująca się do chlorowodoru cząsteczka chloranu(III) sodu musi przyłączyć 4 elektrony, które są emitowane przez utleniające się cząsteczki chloranu(III) sodu, przy czym jeden mol tego związku emituje dwa elektrony. Potrzebne do redukcji 4 elektrony będą więc uzyskane przez utlenieni dwóch moli chloranu(III) sodu. Łącznie w reakcji redoks uczestniczą więc................ mole chloranu(III) sodu. Proszę teraz wrócić do 73 i wybrać poprawną odpowiedź. 73
59.
Miedź można również utlenić kwasem azotowym(V), przy czym tworzy się odpowiednia sól [azotan(V)] oraz wydziela się brunatny gaz, tlenek azotu(IV) NO2
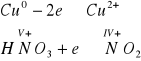
Bilansując biegnące w czasie reakcji procesy redoks suma elektronów oddanych i przyjętych musi być równa zero. Z tego względu ilość redukujących się cząsteczek kwasu azotowego(V) trzeba podwoić. Proszę podstawić do bilansu odpowiednie wartości i sprawdzić, czy suma elektronów oddanych i przyjętych jest równa zero. Przejdź do 71
60.
Obliczono niewłaściwą wartość stopnia utlenienia manganu w podanym równaniu reakcji. Proszę przeczytać wyjaśnienie 43
61.
Odpowiedź jest błędna. Nie uwzględniono prawdopodobnie faktu, że w cząsteczce kwasu siarkowego znajdują się cztery atomy tlenu i dwa atomy wodoru. Jeżeli teraz uwzględnimy stopnie utlenienia wodoru +1 i tlenu -2 to w 72 znajdziemy prawidłową odpowiedź. 72
62.
Potrzebna jest jeszcze jedna cząsteczka kwasu azotowego(V) po lewej stronie równania reakcji. Dzięki tej dodatkowej cząsteczce otrzymujemy cząsteczkę wody oraz jon azotanowy(V) niezbędny do utworzenia cząsteczki azotanu(V) srebra.
Proszę zapisać pełne równanie reakcji i przejść do 55
63.
Równanie reakcji zapisano błędnie. Jeżeli po prawej stronie mamy dwa mole wody 2H2O a po lewej tylko trzy mole kwasu azotowego(V) to ilość atomów wodoru po lewej stronie równania jest za mała. Proszę porównać również ilości atomów innych pierwiastków i poprawić zapis równania reakcji. Wynik porównać z 71
64.
1 mol Na2Cr2O7 utlenia 6 moli FeSO4. Do równania reakcji wpisujemy więc:
Na2Cr2O7 + 6FeSO4 + H2SO4 → Cr2(SO4)3 + Fe2(SO4)3 + H2O + Na2SO4
Po lewej stronie równania wprowadzono współczynniki wynikające ze stosunku molowego w jakim reagują czynniki redoksowe, fakt ten należy również uwzględnić po stronie produktów. Proszę wprowadzić odpowiednie współczynniki dla siarczanów(VI) chromu (III) oraz żelaza(III). Wynik porównać z zapisem 5
65.
Popełniłeś błąd! Nie uwzględniono prawdopodobnie faktu, że po lewej stronie równania są dwa mole miedzi, więc i po prawej muszą być dwa. Również ilość kwasu azotowego(V) po stronie produktów (prawej) będzie sumą moli kwasu, który uległ redukcji oraz utworzył sól. Proszę ponownie uzgodnić równanie reakcji znajdujące się pod numerem 80 lub skorzystaj z dodatkowych informacji 79
66.
Słusznie mangan w nadmanganianie potasu posiada stopień utlenienia VII+. Wynika to z wyliczenia: 4 mole tlenu posiadają łączna elektrowartościowość -8, potas +1 tak więc mangan do wyzerowania całkowitego ładunku musi posiadać elektrowartościowość właśnie VII+. Nadmanganian potasu jest bardzo silnym utleniaczem, może przykładowo utlenić jony chlorkowe do wolnego chloru. Proces ten biegnie zgodnie z równaniem reakcji:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Teraz przeanalizujemy powyższe równanie reakcji. Proszę zanotować równanie na karteczce i odpowiedzieć na pytanie. Oblicz stopień utlenienia manganu przed i po reakcji
przed po sprawdź
+VII +VI 19
+VII +V 30
+VII +IV 60
+VII +III 36
+VII +II 56
potrzebuję pomocy 43
67.
Nie uwzględniono faktu, że w cząsteczce Na2Cr2O7 znajdują się dwa atomy chromu. Utlenia się więc dwukrotnie większa ilość żelaza a tym samym cząsteczek FeSO4. Błędnie ustalono również ilość moli kwasu siarkowego(VI).
uzgodnij ponownie równanie reakcji 52
potrzebuję dalszych wyjaśnień 26
68.
Stopień utlenienia azotu w kwasie azotowym(V) HNO3 jest oczywiście równy V+. Proszę zapisać wzór sumaryczny kwasu azotowego(V) a nad symbolami za pomocą cyfr rzymskich, z uwzględnieniem odpowiedniego znaku zapisz stopnie utlenienia poszczególnych pierwiastków, wchodzących w skład cząsteczki tego kwasu. Zapis porównaj z 50
69.
Uzgodniłeś poprawnie równanie reakcji, którego zapis ma postać
Cu2S + 12HNO3 ![]()
2Cu(NO3)2 +SO2 + 8NO2 + 6H2O
Z lewej strony sumuje się ilość moli kwasu azotowego(V), ulegających redukcji z tworzącymi sól azotan(V) miedzi(II). W tej ilości moli kwasu azotowego(V) znajduje się łącznie dwanaście atomów wodoru, które utworzą 6 moli wody.
Teraz spróbujmy uzgodnić równanie reakcji redoks nieco inne od rozpatrywanych dotychczas:
NaClO2 ![]()
NaCl + NaClO3
W reakcji tej jeden substrat chloran(III) sodu NaClO2 daje dwa produkty chlorek sodu NaCl oraz chloran(V) sodu. W każdym z tych związków chlor posiada różne elektrowartościowości (stopnie utlenienia), spróbuj je ustalić i zapisać.
Chlor posiada następujące stopnie utlenienia:
w NaClO2 =
w NaCl =
w NaClO3 = wynik sprawdź z 79
70.
Nie uwzględniono faktu, że w cząsteczce Na2Cr2O7 znajdują się dwa atomy chromu. Utlenia się więc dwukrotnie większa ilość moli FeSO4 Błędna jest również wyliczona ilość moli kwasu siarkowego(VI)
Popraw równanie reakcji i porównaj z 52
Potrzebuję pomocy 26
71.
Proszę porównać z prawidłowym zapisem:
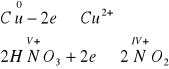
Ustalono więc stosunek molowy substancji ulegających procesowi redoks. Do utlenienia jednego mola miedzi potrzeba dwóch moli kwasu azotowego(V).
Uzupełnione równanie reakcji ma więc zapis:
Cu + 2HNO3 ![]()
Cu2+ + 2NO2 + H2O
Proszę samodzielnie uzgodnić do końca powyższe równanie reakcji redoks. W tym celu trzeba uwzględnić kwas azotowy(V) niezbędny do utworzenia odpowiedniej ilości moli azotanu(V) miedzi(II).
W efekcie uzgadniania zastosowano następujące współczynniki:
HNO3 NO2 H2O informacja
2 1 1 41
3 2 2 63
4 2 1 47
4 2 2 22
72.
Stopień utlenienia tlenu w związkach chemicznych wynosi zawsze 2-. Za pomocą tych czterech reguł można obliczyć stopień utlenienia lub inaczej elektrowartościowość atomów pierwiastków w cząsteczkach dowolnych związkach chemicznych.
Jako przykład obliczmy elektrowartościowość fosforu w kwasie w wzorze H3PO4:
łączna elektrowartościowość trzech atomów wodoru 3(1+) = 3+
łączna elektrowartościowość czterech atomów tlenu 4(2-) = 8-
jako, że suma elektrowartościowości w cząsteczce zawsze jest równa zero, tak więc fosfor będzie miał elektrowartościowość równą 5+.
Dla sprawdzenia właściwego zrozumienia sposobu obliczania elektrowartościowości pierwiastków w cząsteczkach związków chemicznych proszę obliczyć elektrowartościowość siarki w cząsteczce kwasu o wzorze H2SO4 a następnie przejdź do dalszych etapów programu
Siarka posiada elektrowartościowość:
II- sprawdź 46
zero sprawdź 12
I+ sprawdź 61
VI+ sprawdź 57
VII+ sprawdź 38
73.
Bilans tzw. reakcji połówkowych redoks przedstawia się następująco:
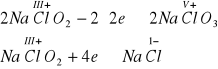
wynika z niego, że 1 mol redukującego się chloranu(III) sodu utlenia dwa mole tegoż chloranu(III) do chloranu(V). W związku z tym współczynniki równania tej reakcji przedstawiają się następująco:
przy NaClO2 przy NaCl przy NaClO3 sprawdź
2 1 3 76
3 1 2 81
potrzebuję dodatkowych wyjaśnień 58
74.
Azot w tlenku NO2 posiada stopień utlenienia równy IV+
![]()
Jako, że azot w kwasie azotowym HNO3 jest na stopniu utlenienia V+, w wyniku reakcji przechodzi na stopień IV+. Srebro w wyniku reakcji zmienia stopień utlenienia z 0 na I+. Oto zapis połówkowych reakcji redoks:
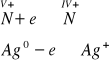
Z bilansu reakcji połówkowych wynika, że utleniacz i reduktor reagują w stosunku molowym 1:1, co można zapisać równaniem:
![]()
W powyższym zapisie brak uzgodnienia równania, po lewej stronie jest więcej atomów wodoru i tlenu. Proszę uzgodnić równanie uwzględniając fakt powstania w trakcie reakcji soli - azotanu(V) srebra AgNO3
Uzupełnione równanie porównaj z 62
75.
7H2SO4
Równanie reakcji przyjmuje teraz postać:
Na2Cr2O7 + 6FeSO4 + 7H2SO4 ![]()
Cr2(SO4)3 + 3Fe2(SO4)3 + H2O + Na2SO4
W tak zapisanym równaniu nie uzgodniono jeszcze ilości moli powstałej wody. Proszę dobrać odpowiedni współczynnik i porównać z 33
76.
Odpowiedź jest częściowo poprawna. Nie uwzględniono bowiem wszystkich cząsteczek chloranu(III) sodu NaClO2 biorących udział w reakcji. Proszę wrócić do 73 i ponownie zastanowić się nad uzgodnieniem równania reakcji lub skorzystać z informacji pomocniczej 58
77.
Nie uwzględniono faktu, że w cząsteczce Na2Cr2O7 znajdują się dwa atomy chromu. Do utlenienia 6 moli FeSO4 trzeba więc o połowę mniej moli dwuchromianu. Zaproponowana w zapisie ilość moli kwasu siarkowego(VI) jest również błędna
popraw zapis równania i porównaj z 52
jeżeli potrzebujesz dodatkowych informacji przejdź do 26
78.
Skoro doszedłeś do prawidłowego zbilansowania równania reakcji zastanów się nad nowym przykładem:
Cu2S + HNO3 ![]()
Cu(NO3)2 + SO2 + NO2 + H2O
Proszę wymienić pierwiastki, które w tej reakcji zmieniły wartościowość
siarka i azot sprawdź w 24
siarka, azot i wodór sprawdź w 27
siarka, azot i miedź sprawdź w 37
potrzebuję pomocy przejdź do 45
79.
Stopnie utlenienia chloru w wymienionych związkach są następujące:
w NaClO2 III+(jon złożony)
w NaCl 1- (jon prosty)
w NaClO3 V+ (jon złożony)
W rozpatrywanej przemianie ten sam związek redukuje się i utlenia. Tego typu reakcje redoks noszą nazwę reakcji dysproporcjonowania
Proszę dokonać bilansu zachodzących reakcji połówkowych redoks:
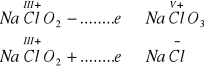
Z powyższego bilansu reakcji połówkowych wynika, że jeden mol redukującego się chloranu(III) sodu NaClO2 utlenia ............ moli NaClO2 do NaClO3.
Po wpisaniu odpowiednich liczb przejdź do 73
80.
Tak, zredukuje się 8 moli kwasu azotowego(V) HNO3
![]()
Cząsteczki kwasu azotowego(V) redukując się przyjmują jeden elektron, więc 8 elektronów emitowanych przez 1 mol Cu2S zredukuje 8 moli kwasu azotowego(V)
W ten sposób ustalono stosunek molowy substancji uczestniczących bezpośrednio w procesie redoks, czyli inaczej współczynniki substratów równania reakcji
Cu2S + 8HNO3 ![]()
Cu(NO3)2 + SO2 + NO2 + H2O
Proszę dobrać pozostałe współczynniki równania reakcji:
Cu2S HNO3 Cu(NO3)2 SO2 NO2 H2O Sprawdź
1 8 1 1 8 4 65
1 12 2 1 8 6 69
potrzebuję pomocy 70
81.
Dobrze, odpowiedź poprawna:
3NaClO2 ![]()
NaCl + 2NaClO3
z bilansu wynika, że jeden mol redukującego się chloranu(III) sodu utleni dwa mole chloranu(III) sodu. Łącznie w reakcji redoks wezmą więc udział trzy mole chloranu(III) sodu. Po stronie produktów otrzymuje się jeden mol chlorku sodu oraz dwa mole chloranu(V) sodu.
Na tym kończy się program szkolący w zakresie umiejętności uzgadniania reakcji redoks. Przypadków szczególnych w uzgadnianiu tak reakcji jest bardzo dużo, tak więc rzeczywiste opanowanie techniki uzgadniania tego typu reakcji wymaga dalszych ćwiczeń. W celu ułatwienia tego zadania, w dalszej części zamieszczono przykłady reakcji redoks do samodzielnego zbilansowania. Każdy z podanych przykładów jest rozwiązany z zachowaniem podstawowych zasad postępowania przy uzgadnianiu równań reakcji redoks. Ćwiczenia doskonalące będą również uwzględniały uzgadnianie równań w zapisie jonowym co stwarza między innymi możliwość przewidywania środowiska kwasowo-zasadowego, w którym dana reakcja może przebiegać.
ĆWICZENIA DOSKONALĄCE
Obliczyć stopnie utlenienia siarki w następujących związkach chemicznych; a/SF6 b/SCl4, c/S2Cl2, d/H2S, e/H2S2, f/Na2S2O3, g/Na2S4O6 h/SO2Cl2
Obliczyć stopień utlenienia chloru w jego połączeniach tlenowych: a/ NaClO; b/ NaClO2 c/NaClO3 d/NaClO4
Obliczyć stopnie utlenienia pierwiastków w ich związkach chemicznych: a/ manganu w H2MnO4 b/ fosforu w H4P2O7 c/ węgla w C2H5OH d/ azotu w HNO2
Napisać równania reakcji utlenienia za pomocą K2Cr2O7 w środowisku kwasu siarkowego(VI): A/ CH3OH do HCHO B/ KI do I2 C/ SO2 do Cr2(SO4)3 D/N2H4 do N2
Uzgodnij następujące równania reakcji redoks:
A/ Zn + H2SO4 ![]()
ZnSO4 + S + H2O
B/ Mg + HNO3 ![]()
Mg(NO3)2 + N2O + H2O
C/ KI + KMnO4 + H2SO4 ![]()
MnSO4 + I2 + K2SO4 + H2O
D/ Cl2 + S + H2O ![]()
H2SO4 + HCl
E/ Na2SO3 + KMnO4 + H2SO4 ![]()
MnSO4 +K2SO4 + Na2SO4 + H2O
F/ Cl2 + Na2SO3 + H2O ![]()
HCl + Na2SO4
G/ HClO3 + HCl ![]()
Cl2 + H2O
H/ Ca3P2 + Br2 + H2O ![]()
Ca3(PO4)2 + HBr
I/ KI + PbO2 + HNO3 ![]()
Pb(NO3)2 + I2
J/ Al + NaOH + H2O ![]()
NaAlO2 + H2
K/ PH3 + NaClO ![]()
H3PO4 + NaCl
L/ As2S3 + HNO3 + H2O ![]()
H3AsO4 + H2SO4 + NO
Dobrać współczynniki w poniższych reakcjach redoks w zapisie jonowym
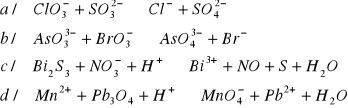
Dobrać współczynniki reakcji redoks biegnących z udziałem związków organicznych
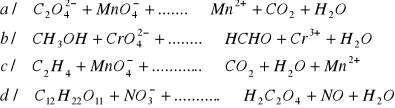
ODPOWIEDZI
Obliczyć stopnie utlenienia siarki w następujących związkach chemicznych; a/ S(VI+); b/ S(IV+), c/ S(I+), d/ S(II-), e/ S(I-), f/ S(II+), g/ S(2,5+) h/ S(VI+)
Obliczyć stopień utlenienia chloru w jego połączeniach tlenowych: a/ Cl(I+); b/ Cl(III+) c/ Cl(V+) d/ Cl(VII+)
Obliczyć stopnie utlenienia pierwiastków w ich związkach chemicznych: a/ manganu w H2MnO4 -Mn(VI+) b/ fosforu w H4P2O7 -P(V+) c/ węgla w C2H5OH -C(II-) d/ azotu w HNO2 -N(III+)
Napisać równania reakcji utlenienia za pomocą K2Cr2O7 w środowisku kwasu siarkowego(VI):
A/ 3CH3OH + K2Cr2O7 + 4H2SO4 ![]()
3HCHO + Cr2(SO4)3 + K2SO4 + 7H2O
B/ 6KI + K2Cr2O7 + 7H2O ![]()
3I2 + 4K2SO4 + Cr2(SO4)3 + 7H2O
C/ 3SO2 + K2Cr2O7 + H2SO4 ![]()
Cr2(SO4)3 + K2SO4 + 14H2O
D/ 3N2H4 + 2K2Cr2O7 + 8H2SO4 ![]()
3N2 + 2K2SO4 + 2Cr2(SO4)3 + 14H2O
Uzgodnione równania reakcji redoks:
A/ 3Zn + 4H2SO4 ![]()
3ZnSO4 + S + 4H2O
B/ 4Mg + 10HNO3 ![]()
4Mg(NO3)2 + N2O + 5H2O
C/ 10KI + 2KMnO4 + 8H2SO4 ![]()
2MnSO4 + 5I2 + 6K2SO4 + 8H2O
D/ 3Cl2 + S + 3H2O ![]()
H2SO4 + 6HCl
E/ 5Na2SO3 + 2KMnO4 + 3H2SO4 ![]()
2MnSO4 +K2SO4 + 5Na2SO4 + 3H2O
F/ Cl2 + Na2SO3 + H2O ![]()
2HCl + Na2SO4
G/ 2HClO3 + 10HCl ![]()
3Cl2 + 6H2O
H/ Ca3P2 + 8Br2 + 8H2O ![]()
Ca3(PO4)2 + 16HBr
I/ 2KI + PbO2 + 4HNO3 ![]()
Pb(NO3)2 + I2 + 2KNO3 +2H2O
J/ 2Al. + 2NaOH + 2H2O ![]()
2NaAlO2 + 3H2
K/ PH3 + 4NaClO ![]()
H3PO4 + 4NaCl
L/ 3As2S3 + 28HNO3 + 4H2O ![]()
6H3AsO4 + 9H2SO4 + 28NO
Dobrać współczynniki w poniższych reakcjach redoks w zapisie jonowym
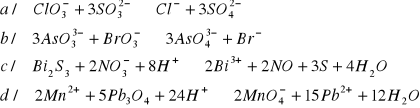
Dobrać współczynniki reakcji redoks biegnących z udziałem związków organicznych
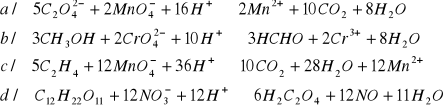
ROZWIĄZANIE PODANYCH PRZYKŁADÓW
Na wstępie przypomnijmy zasady obliczania elektrowartościowości zwanej również stopniem utlenienia:
Dla jonów prostych elektrowartościowość jest równa wartościowości danego jonu
Tlen posiada elektrowartościowość równą II-, zaś wodór +1 - jon wodorowy zwany jest również czasami protonem, gdyż istotnie składa się jedynie z protonu.
Suma elektrowartościowości atomów w cząsteczce jest równa zero zaś w jonach złożonych ładunkowi danego jonu.
Elektrowartościowość w jonach złożonych zapisuje się nad symbolem za pomocą cyfry rzymskiej i znaku ładunku, w jonach prostych zaś cyfrą arabską i odpowiednim znakiem
Mając na uwadze powyższe uwagi można przystąpić do obliczania stopni utlenienia w zadaniach 1 i 2
Zad 1.Oblicznie stopnia utlenienia siarki w różnych połączeniach:
SF6 - fluor, jak wynika z układu okresowego przyjmuje wyłącznie elektrowartościowość -1, łącznu ładunek wszystkich atomów fluoru wynosi więc -6. Mając na uwadze fakt, że suma ładunków w cząsteczce musi być równa zero, siarka w tym połączeniu posiada stopień utlenienia 6+. Jednak w tej postaci związek nie ulega dysocjacji tak więc stopień utlenienia zapiszemy za pomocą cyfry rzymskiej czyli ![]()
SCl4 - chlor, podobnie jak fluor posiada elektrowartościowość róną 1-, co stanowi łącznie ładunek 4-,aby suma ładunków była równa 0 siarka w tej cząsteczce będzie miała stopień utlenienia 4+, który również zapiszemy cyfrą rzymską ponieważ związek ten nie ulega dysocjacji to znaczy siarka w tym połączeniu nie tworzy jonów prostych. ![]()
S2Cl2 - chlor, jak wspomniano wyżej posiada elektrowartościowość 1- co daje łączny ładunek chloru 2-. Na dwa atomy siarki przypada więc ładunek 2+, czyli każdy z atomów siarki w tym połączeniu posiada elektrowartościowość wynoszącą 1+. Jako, że związek ten nie ulega dysocjacji czyli siarka nie tworzy w tej postaci jonów prostych elektrowartościowość zaznaczymy w postaci cyfr rzymskich. ![]()
H2S - wodór posiada elektrowartościowość 1+, co daje łącznie ładunek 2+ neutralizowany przez jeden atom siarki, którego ładunek (elektrowartościowość) będzie wynosiła 2-. Zastosowano cyfry arabskie, gdyż siarkowodór ulega dysocjacji. ![]()
.
H2S2 - rozumowanie podobne jak w przykładzie poprzednim, jednak łączny ładunek jonów wodorowych 2+ będzie tym razem zobojętniany przez dwa atomy siatki a więc każdy z nich ma ładunek 1-, co można zapisać ![]()
Na2S2O3 - łączny ładunek tlenu wynosi VI- co po uwzględnieniu ładunku dodatniego dwóch jonów sodowych daje IV-, który zobojętniają dwa atomy siarki, tak więc każdy z nich ma ładunek II+. Stosuje się zapis cyframi rzymskimi, gdyż siarka występuje w jonie złożonym ![]()
Na2S4O6 - dokonajmy na wstępie bilansu ładunków pierwiastków, których elektrowartościowości są znane. Tak więc łączny ładunek atomów tlenu wynosi XII-, sodu 2+ a więc na cztery atomy siarki pozostaje ładunek X+, co oznacza że każdy atom siarki ma elektrowartościowość równą +2,5. Warto przy tej okazji zauważyć, że ilość elektronów wymienianych przez całą cząsteczkę będzie liczba całkowitą bowiem w cząsteczce znajdują się cztery atomy siarki a to oznacza wymianę właśnie dziesięciu elektronów. ![]()
SO2Cl2 - łączny ładunek dwóch atomów tlenu i dwóch atomów chloru wynosi VI- a więc siarka w tym związku posiada elektrowartościowość równą VI+ (taki zapis gdyż związek ten nie ulega dysocjacji.). ![]()
Zad. 2. Obliczanie stopnia utlenienia chloru:
NaClO - stopień utlenia sodu wynosi 1+, zaś tlenu jak zwykle II- tak więc dla zbilansowania ładunków do zera atom chloru w tej cząsteczce ma ładunek I+ (cyfra rzymska bowiem chlor występuje w jonie złożonym) ![]()
NaClO2 - postępujemy podobnie jak w przykładzie poprzednim. Tym razem do zobojętnienia łącznego ładunku sodu i tlenu potrzebny jest ładunek III+, który podobnie jak w poprzednim przykładzie zapisujemy cyframi rzymskimi. ![]()
NaClO3 - sposób obliczenia jak wyżej. Dodatkowy atom tlenu o stopniu utlenienia II- powoduje, że również o dwa wzrasta elektrowartościowość dodatnia chloru, który w tej sytuacji ma stopień utlenienia równy V+. Można to zapisać ![]()
NaClO4 - zwiększenie ilości atomów tlenu o jeden powoduje, że elektrowartościowość chloru będzie większa o dalsze dwie jednostki i wyniesie VII+. ![]()
Zad. 3
Zasada obliczenia analogiczna jak w przykładach poprzednich
a/ mangan w H2MnO4 - przyjmując stałe elektrowartościowości wodoru i tlenu bilansujemy wartością elektrowartościowości manganu do zera ![]()
. Elektrowartościowość manganu wynosi więc VI+
b/ fosfor w H4P2O7 czyli ![]()
elektrowartościowość fosforu wynosi V+
c/ węgla w C2H5OH czyli ![]()
elektrowartościowość węgla jest równa II-
d/ azotu w HNO2 czyli ![]()
elektrowartościowość azotu wynosi III+
Zad. 4
Korzystając z informacji o warunkach przebiegu reakcji zapisujemy wzory substratów i produktów, pamiętając, że prawie zawsze produktem tego typu reakcji jest również woda. Przykład A można zapisać:
CH3OH + K2Cr2O7 + H2SO4 ![]()
HCHO + K2SO4 + Cr2(SO4)3 + H2O
Jeżeli wzory substratów i produktów są zapisane poprawnie przystępujemy do drugiego etapy, którym jest obliczenie elektrowartościowości pierwiastków tworzących substraty i produkty reakcji
![]()
w obliczeniach pominięto wodór, tlen oraz siarkę, która tak po stronie produktów jak i substratów występuje w formie jonów siarczanowych a więc nie może zmieniać wartościowości. Obliczenia wykazały, że elektrowartościowość zmienia węgiel i chrom co można zapisać w formie tzw. reakcji połówkowych a następnie uzgodnić współczynniki tych reakcji tak aby ilość elektronów oddanych była równa ilości elektronów przyjętych (bilans elektronowy).
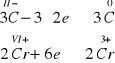
3CH3OH + K2Cr2O7 + H2SO4 ![]()
3HCHO + K2SO4 + Cr2(SO4)3 + H2O
następny etap to uzgodnienie ilości atomów metali po stronie produktów, w powyższym przykładzie występuje zgodność. Z kolei na podstawie liczby reszt kwasowych kwasu siarkowego(VI) dobieramy współczynnik przy kwasie siarkowym(VI). W powyższym wypadku będzie to liczba 4
3CH3OH + K2Cr2O7 + 4H2SO4 ![]()
3HCHO + K2SO4 + Cr2(SO4)3 + H2O
ilość moli wody po stronie produktów ustalamy na podstawie ilości atomów tlenu po stronie substratów (w obliczeniach można pominąć tlen w resztach kwasu siarkowego(VI) ponieważ, jak stwierdzono, nie biorą one udziału w reakcji redoks. Po lewej stronie jest dziesięć takich atomów tlenu, tak więc po stronie produktów powstanie siedem moli wody. Ostateczny zapis równania ma postać
3CH3OH + K2Cr2O7 + 4H2SO4 ![]()
3HCHO + K2SO4 + Cr2(SO4)3 + 7H2O
ostatecznym kryterium poprawności zapisu będzie porównanie ilości atomów wodoru po lewej i prawej stronie równania. Liczba ta jest zgodna, tak więc poprawnie uzgodniono równanie reakcji redoks.
Przykład B.
Zapis substratów i produktów:
KI + K2Cr2O7 + H2SO4 → I2 + K2SO4 + Cr2(SO4)3 + H2O
Obliczenie stopni utlenienia:
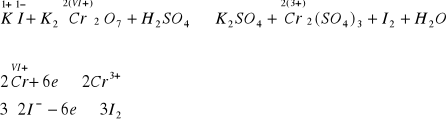
Po uwzględnieniu współczynników wynikających z bilansu reakcji połówkowych
6KI + K2Cr2O7 + H2SO4 → 3I2 + K2SO4 + Cr2(SO4)3 + H2O
Po uzgodnieniu ilości jonów metali (potasu i chromu)
6KI + K2Cr2O7 + H2SO4 → 3I2 + 4K2SO4 + Cr2(SO4)3 + H2O
Ilość moli kwasu siarkowego na podstawie ilości reszt kwasowych po stronie prawej:
6KI + K2Cr2O7 + 7H2SO4 → 3I2 + 4K2SO4 + Cr2(SO4)3 + H2O
Na koniec ustalamy na podstawie ilości atomów tlenu liczbę moli powstałej wody
6KI + K2Cr2O7 + 7H2SO4 → 3I2 + 4K2SO4 + Cr2(SO4)3 + 7H2O
Przykład C
SO2 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
Ustalenie elektrowartościowości
![]()
Bilans elektronowy przedstawia się następująco:
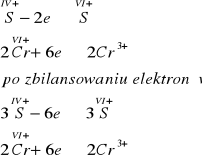
Wyliczone w bilansie współczynniki wprowadźmy do równania:
3SO2 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
ilość powstałych z utlenienia tlenku siarki(IV) reszt kwasowych zbilansujemy łącznie po uzgodnieniu ilości moli metali. Z ilości atomów wodoru po stronie produktów wynika również, że powstanie jeden mol wody. Tak więc powyżej zapisane równanie jest już ostatecznie uzgodnione.
Przykład D
Ustalenie elektrowartościowości po uwzględnieniu odpowiednich substratów i produktów reakcji:
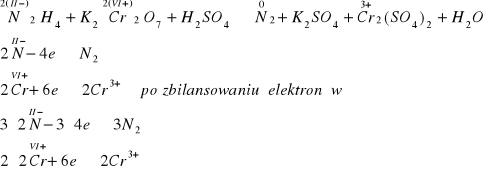
Ustalone współczynniki wprowadzamy do równania reakcji:
3N2H4 + 2K2Cr2O7 + H2SO4 → 3N2 + K2SO4 + 2Cr2(SO4)3 + H2O
Następnie uzgadniamy ilości atomów metali a konkretnie potasu, po prawej stronie należy więc podwoić ilość moli siarczanu(VI) potasu
3N2H4 + 2K2Cr2O7 + H2SO4 → 3N2 + 2K2SO4 + 2Cr2(SO4)3 + H2O
z kolei na podstawie ilości reszt kwasowych po stronie prawej obliczamy ilość moli kwasu siarkowego(VI) po stronie substratów
3N2H4 + 2K2Cr2O7 + 8H2SO4 → 3N2 + 2K2SO4 + 2Cr2(SO4)3 + H2O
ilość atomów wodoru po stronie lewej [wodór występuje w dwóch związkach (!)] pozwala na ustalenie ilości moli wody po stronie produktów:
3N2H4 + 2K2Cr2O7 + 8H2SO4 → 3N2 + 2K2SO4 + 2Cr2(SO4)3 + 14H2O
Zad. 5 Każdy przykład będzie rozwiązany według schematu: ustalenie elektrowartościowości, bilans elektronowy, ustalenie pozostałych współczynników reakcji
Przykład A
Zn + H2SO4 → ZnSO4 + S + H2O
Ustalenie elektrowartościowości oraz bilans elektronowy

Po wstawieniu do równania reakcji:
3Zn + H2SO4 → 3ZnSO4 + S + H2O
po prawej stronie znajdują się cztery atomy siarki, czyli w reakcji wezmą udział cztery mole kwasu siarkowego co da po stronie produktów cztery mole wody. Ostateczna postać równania:
3Zn + 4H2SO4 → 3ZnSO4 + S + 4H2O
Przykład B
Mg + HNO3 → Mg(NO3)2 + N2O + H2O
Ustalenie elektrowartościowości i bilans elektronowy:
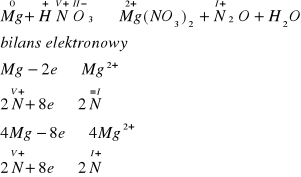
Wprowadzamy wynikające z bilansu współczynniki lecz na razie nie zapisujemy wynikających z ustalonego stosunku ilości moli kwasu azotowego(V) ponieważ po stronie lewej trzeba również uwzględnić ilość kwasu niezbędną do utworzenia soli.
4Mg + HNO3 → 4Mg(NO3)2 + 1N2O + H2O
Po prawej stronie jest łącznie 10 atomów azotu i tyle moli kwasu azotowego wejdzie w trakcie, zapisujemy więc po lewej stronie 10 moli kwasu azotowego(V)
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + H2O
Dziesięć atomów wodoru z lewej strony oznacza, że powstanie 5 moli wody, czyli ostatecznie:
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O
Przykład C
KI + KMnO4 + H2SO4 ![]()
MnSO4 + K2SO4 + I2 + H2O
Obliczenie elektrowartościowości i bilans elektronowy

Ustalone w bilansie współczynniki wprowadzamy do równania reakcji:
10KI + 2KMnO4 + H2SO4 ![]()
2MnSO4 + K2SO4 + 5I2 + H2O
Uzgadniamy ilości metali a konkretnie ilość atomów potasu, których z lewej strony jest 12, czyli z prawej strony należy wpisać współczynnik 6
10KI + 2KMnO4 + H2SO4 ![]()
2MnSO4 + 6K2SO4 + 5I2 + H2O
z prawej strony znajduje się 8 moli reszt kwasowych kwasu siarkowego(VI) co odnotujemy odpowiednim współczynnikiem przed wzorem kwasu po stronie lewej i na końcu z ilości atomów wodoru po stronie lewej wyprowadzamy ilość moli wody
10KI + 2KMnO4 + 8H2SO4 ![]()
2MnSO4 + 6K2SO4 + 5I2 + 8H2O
równe ilości atomów tlenu po obu stronach równania są dowodem prawidłowego uzgodnienia równania reakcji.
Przykład D
Cl2 + S + H2O ![]()
H2SO4 + HCl
Obliczenie elektrowartościowości i bilans elektronowy
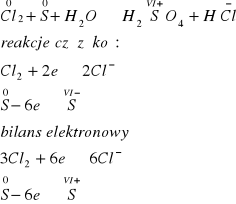
Wyprowadzone w bilansie współczynniki wprowadzamy do równania:
3Cl2 + S + H2O ![]()
H2SO4 + 6HCl
do ustalenia pozostaje ilość cząsteczek wody po stronie lewej. Wobec ośmiu atomów wodoru z strony prawej po lewej zapisujemy cztery mole wody:
3Cl2 + S + 4H2O ![]()
H2SO4 + 6HCl
Przykład E
Na2SO3 + KMnO4 + H2SO4 ![]()
Na2SO4 + K2SO4 + MnSO4 + H2O
Obliczenie elektrowartościowości i bilans elektronowy:
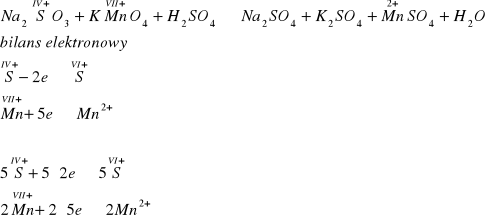
Ustalone współczynniki wprowadzamy do równania reakcji
5Na2SO3 + 2KMnO4 + H2SO4 ![]()
5Na2SO4 + K2SO4 + 2MnSO4 + H2O
wobec uzgodnienia przy okazji ilości atomów metali sumujemy ilość reszt kwasowych kwasu siarkowego(VI) po stronie prawej, która wynosi 8 i tyle moli musi być po stronie lewej. Uwzględniamy tu fakt, że 5 moli reszt kwasu siarkowego(IV) utleni się do reszt kwasu siarkowego(VI) tak więc uzupełniamy trzy brakujące mole kwasu siarkowego(VI) po stronie prawej.
5Na2SO3 + 2KMnO4 + 3H2SO4 ![]()
5Na2SO4 + K2SO4 + 2MnSO4 + H2O
ilość moli wody wyprowadzamy na podstawie ilości atomów wodoru po stronie lewej - powstają więc trzy mole wody. Ostatecznie równanie ma postać:
5Na2SO3 + 2KMnO4 + 3H2SO4 ![]()
5Na2SO4 + K2SO4 + 2MnSO4 + 3H2O
Przykład F
Cl2 +Na2SO3 + H2O → HCl + Na2SO4
Obliczanie elektrowartościowości i bilans elektronowy:
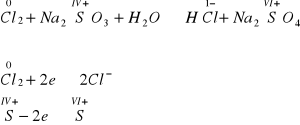
Wobec wymiany tej samej ilości elektronów w reakcjach połówkowych ich przebieg jednocześnie określa współczynniki reakcji, które wpisuje się do równania:
Cl2+ Na2SO3 + H2O → 2HCl + Na2SO4
Wpisane współczynniki bez poprawek określają również ilość moli wody tak, że powyższy zapis jest zapisem ostatecznym.
Przykład G
HClO3 + HCl → Cl2O + H2O
Obliczenie elektrowartościowości i bilans reakcji połówkowych
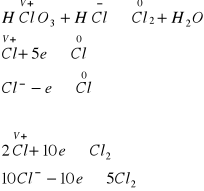
Ustalone w bilansie współczynniki wprowadzamy do równania reakcji:
2HClO3 + 10HCl → 6Cl2 + 6H2O
uzyskane współczynniki nie stanowią najmniejszej wielokrotności dlatego całe równanie dzielimy przez dwa i otrzymujemy:
5HCl + HClO3 → 3H2O + 3Cl2
Przykład H
Ca3P2 + Br2 + H2O → Ca3(PO4)2 + HBr
Ustalamy elektrowartościowości i bilansujemy połówkowe procesy redukcji i utlenienia
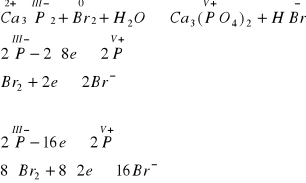
Po wstawieniu ustalonych współczynników:
Ca3P2 + 8Br2 + H2O → Ca3(PO4)2 + 16HBr
Z prawej strony znajduje się szesnaście atomów wodoru tak więc po stronie lewej musi się znaleźć 8 moli wody. Ostateczny zapis równania reakcji:
Ca3P2 + 8Br2 + 8H2O → Ca3(PO4)2 + 16HBr
Przykład I
KI + PbO2 + HNO3 → Pb(NO3)2 +I2 + KNO3 + H2O
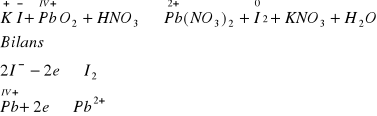
![]()
Ustalone współczynniki przy utleniaczu i reduktorze wprowadzamy do równania reakcji:
2KI + PbO2 + HNO3 → Pb(NO3)2 +I2 + KNO3 + H2O
ustalamy ilość atomów potasu po stronie prawej a następnie z sumy reszt kwasowych po stronie produktów ilość moli kwasu azotowego(V), które weszły w reakcję:
2KI + PbO2 + 4HNO3 → Pb(NO3)2 +I2 + 2KNO3 + H2O
na koniec ustalamy ilość moli wody. Porównanie ilości atomów tlenu z lewej i prawej strony równania stanowi ostateczne kryterium poprawności zapisanego równania reakcji.
2KI + PbO2 + 4HNO3 → Pb(NO3)2 +I2 + 2KNO3 + 2H2O
Przykład J
Al + NaOH + H2O → NaAlO2 + H2
Obliczamy elektrowartościowości pierwiastków i na podstawie tzw. reakcji połówkowych wyprowadzamy współczynniki przy substancji utlenianej i redukowanej
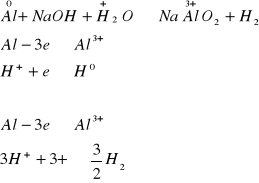
Po wprowadzeniu współczynników stechiometrycznych do równania:
Al + NaOH + H2O → NaAlO2 + ![]()
H2
Chcąc zlikwidować współczynnik ułamkowy, równanie należy pomnożyć przez dwa:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Przykład K
PH3 + NaClO → H3PO4 + NaCl
Obliczamy elektrowartościowość pierwiastków oraz ustalamy współczynniki przy utleniaczu i reduktorze:
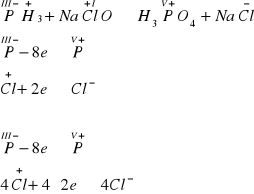
wyznaczone współczynniki wprowadzamy do równania reakcji:
PH3 + 4NaClO → H3PO4 + 4NaCl
Wprowadzenie współczynników spowodowało jednocześnie ostateczne uzgodnienie równania reakcji
Przykład L
As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO
Obliczmy elektrowartościowości pierwiastków i ustalamy współczynniki przy utleniaczu i reduktorze
![]()
jako, że w tym równaniu trzy pierwiastki zmieniają wartościowość więc zgodnie z przyjętą zasadą rozpatrujemy łącznie siarczek arsenu(III)
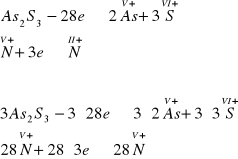
ustalone współczynniki wprowadzamy do równania reakcji
3As2S3 + 28HNO3 + H2O → 6H3AsO4 + 9H2SO4 + 28NO
porównując ilości atomów wodoru stwierdzamy, że po lewej stronie równania muszą być 4 mole wody, co ostatecznie pozwala uzgodnić równanie:
3As2S3 + 28HNO3 + 4H2O → 6H3AsO4 + 9H2SO4 + 28NO
Zadanie 6
Przykład A
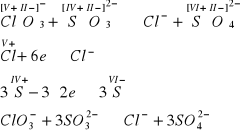
Przykład B
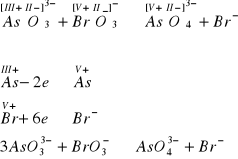
Przykład C
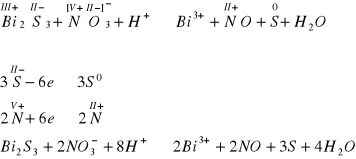
na podstawie bilansu reakcji połówkowych ustalono ilości jonów, oprócz wodorowych. Ilość tych jonów dobiera się korzystając z właściwości równań jonowych, polegającej na równości sum ładunków jonów po obu stronach równania i tak po prawej stronie równania suma ładunku jonów wynosi +6 ( dwa jony bizmutowe o ładunku 3+). Aby suma ładunków strony lewej również wynosiła +6 musimy przed jonem wodorowym zapisać współczynnik 8, co daje w efekcie cztery mole wody po stronie produktów. Porównanie ilości atomów tlenu po obu stronach równania stanowi ostateczne kryterium poprawności zapisu równania reakcji.
Przykład D
W poniższym przykładzie niemożliwe jest ustalenie elektrowartościowości manganu, gdyż otrzymuje się liczbę ułamkową. W związku z powyższym bilansujemy ładunek całej cząsteczki równy zero (po stronie lewej z sumą ładunków ołowiu[3(+2)] i tlenu[4(-2)] po stronie prawej co daje wartość -2, czyli oznacza przyjęcie przez cząsteczkę tego tlenku dwóch elektronów.
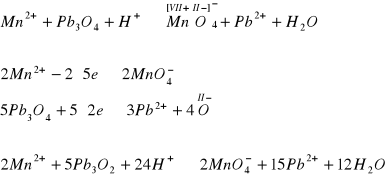
Zadanie 7
Przykład A
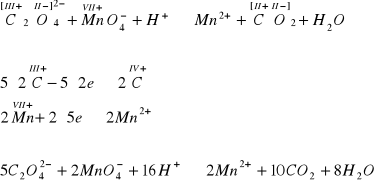
ilość jonów wodorowych można dobrać z uzgodnienia ładunków jonów po stronie prawej i lewej lub z ilości powstałej z bilansu ilości moli wody.
Przykład B
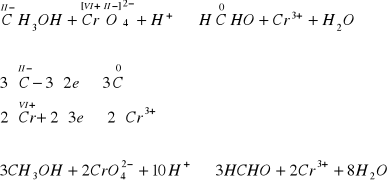
Przykład C
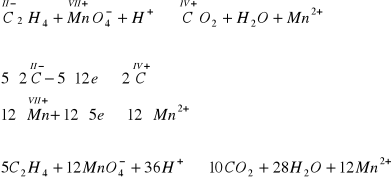
Przykład D
produktem utlenienia sacharozy C12H22O11 kwasem azotowym(V) jest kwas szczawiowy, najprostszy z kwasów dwukarboksylowych. Cząsteczka tego kwasu składa się z dwóch połączonych z sobą grup karboksylowych COOH. Kwas ten należy do jednych z najsilniejszych reduktorów organicznych
40
Wyszukiwarka